서 론
동맥 내 산소 분압이 40 mmHg 이하로 감소하는 저산소증 상태에서 관상동맥을 포함한 대부분의 혈관에서는 혈관 이완이 발생되나, 폐동맥에서는 혈관 수축이 발생된다. 체순환의 혈관 이완은 허혈 또는 증가된 대사의 요구에 반응하기 위한 혈류량 증가에 따른 생리학적 조절 과정이며, 이는 저산소증에 노출된 조직으로부터 유리되는 혈관 이완 인자에 의해 주로 조절된다. 그러나 이와는 달리 폐동맥에서는 저산소증 때 혈관 수축이 발생되는데, 이러한 현상을 저산소성 폐혈관 수축(hypoxic pulmonary vasconstriction)이라고 한다. 이는 저산소증 때 혈관수축이 일어남으로써 폐내 환기가 되지 않는 부위의 혈액 관류를 감소시키는 동시에 환기가 잘되는 부위로 혈액 관류를 전환시켜 환기와 혈액 관류량의 평형을 적절히 유지하기 위해서이다. 이 과정은 가스 교환을 적절히 하여 저산소혈증을 방지하기 위한 생리학적 반응이다[1,2].
저산소성 폐혈관수축은 직경이 작은 폐동맥(직경 < 200 μm)과 폐정맥(직경 < 900 μm)에서는 유발되나 직경이 큰 혈관에서는 유발되지 않는다고 보고되고 있다. 또한 저산소성 폐혈관수축은 폐포 저산소증 시 수 초 내에 시작되고, 정상 산소 분압상태가 되면 폐혈관은 정상화된다[3]. 그러나 급성 호흡 부전 증후군, 간-폐 증후군, 전신 마취 상태와 같은 급성 병태생리학적 상태에서는 저산소성 폐혈관수축 기전에 장애가 생겨 동맥혈 내 산소 분압이 유지되지 않는다. 고산지대나 만성 폐쇄성 폐질환, 폐렴과 같은 폐기능 장애 상태에서는 폐포 저산소증이 전폐에 걸쳐 전반적이고, 지속적으로 나타난다. 이와 같이 만성적인 저산소증 상태가 되면 작은 폐동맥의 평활근이 두꺼워지는데 이것을 저산소성 폐혈관 재형성(hypoxic pulmonary vascular remodelling)이라고 한다. 저산소성 폐혈관 재형성으로 인해 폐혈관 저항이 증가하여 폐고혈압이 유발되고, 우심실 부하를 증가시키게 된다[2,4].
본 증례에서는 급성 골수성 백혈병 환자가 기저 폐질환이 없는 상태에서 폐렴과 빈혈에 의해 발생한 급성 저산소증으로 인해 가역적인 저산소성 폐혈관수축이 발생하여 폐고혈압이 발생하였다가 2주만에 급격히 호전된 예를 보고하고자 한다.
증 례
18세 남자 환자가 내원 7일 전부터 시작된 운동 시 호흡곤란, 12시간 전부터 시작된 발열, 오한으로 응급실에 내원하였다. 환자는 2008년 1월 급성 골수성 백혈병(M1형)을 진단 받은 후 항암요법 및 자가 조혈모세포 이식술을 시행하였으나 재발한 자이다. 내원 당시 활력 징후는 혈압 130/80 mmHg, 맥박수 분당 90회, 호흡수 분당 26회, 체온 38.3℃, 맥박 산소 포화도 80%였고, 동맥혈 가스 검사 결과 pH 7.36 PaO2 43 mmHg, PaCO2 30 mmHg, SaO2 79%로 저산소증 소견을 보였다. 말초 혈액 검사에서 혈색소 5.7 g/dL, 헤마토크리트 16.2%, 백혈구 870/mm3 (다핵구 39.1%, 임파구 54%), 혈소판 7,000/mm3으로 심한 빈혈과 혈소판 감소증 소견을 보였다. 혈청 생화학 검사에서 BUN 13.5 mg/dL, 크레아티닌 0.80 mg/dL, 총 단백 5.4 g/dL, 알부민 3.9 g/dL, AST 24 IU/L, ALT 28 IU/L이었다. 혈청 전해질은 나트륨 139 mEq/L, 칼륨 3.1 mEq/L이었으며 D-dimer는 0.76 μg/mL로 정상소견을 보였다.
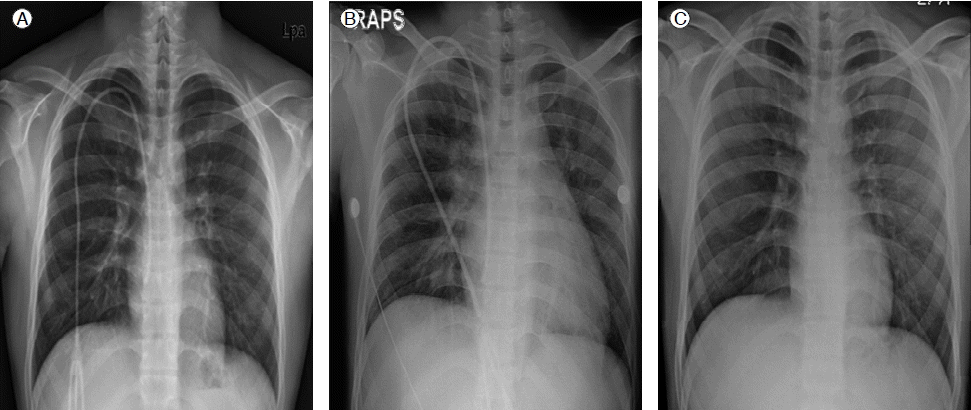
내원 당시 흉부 X-선 사진에서 심비대와 함께 기관지 주변 폐렴성 침윤이 관찰되었고, 양 폐 하엽에 삼출액 소견이 있었다(Fig. 1B). 1주일 전에 검사한 흉부 사진과(Fig. 1A) 비교하여 심비대가 급격히 진행한 소견을 관찰할 수 있었고, 이에 대한 평가를 위하여 심초음파를 시행하였다.
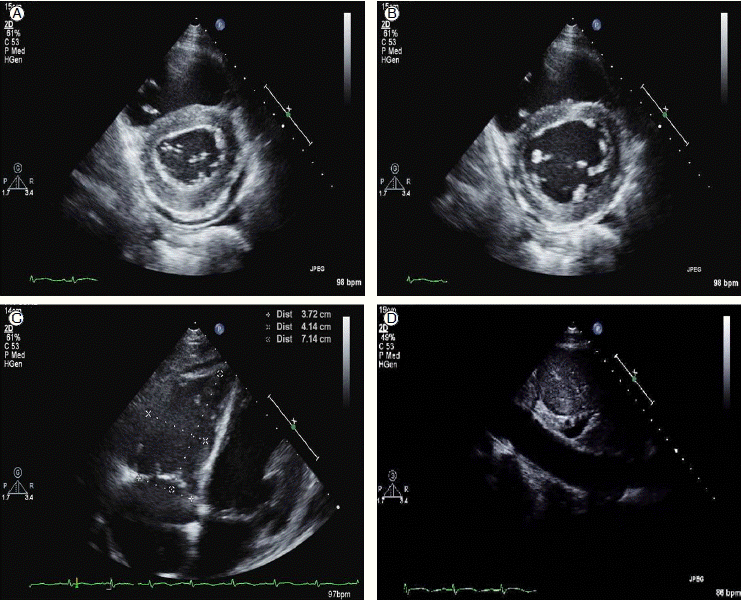
흉골 좌측연 단축 심초음파도에서 좌심실이 D형으로 변형된 소견을 관찰할 수 있었고, 수축기 말기(Fig. 2A)와 이완기 말기(Fig. 2B) 모두에서 변형이 나타나 우심실의 압력이 상승되어 있음을 알 수 있었다. 좌심실 구혈률은 61%로 수축기능 저하는 없었으며, 대동맥판막 및 승모판의 기능 이상도 관찰되지 않았다. 우심실 내경이 3.72 cm, 4.14 cm, 7.14 cm로 확장되어 있어, 우심실 기능 이상을 시사하는 소견을 보였다(Fig. 2C). 삼첨판 최대 역류 속도가 3.4 m/s이고, 하대정맥이 3 cm으로 확장되어 있었고(Fig. 2D), 심호흡을 시켜도 수축되지 않는 소견으로 우심실 수축기 압력은 60-66 mmHg로 평가되었다.
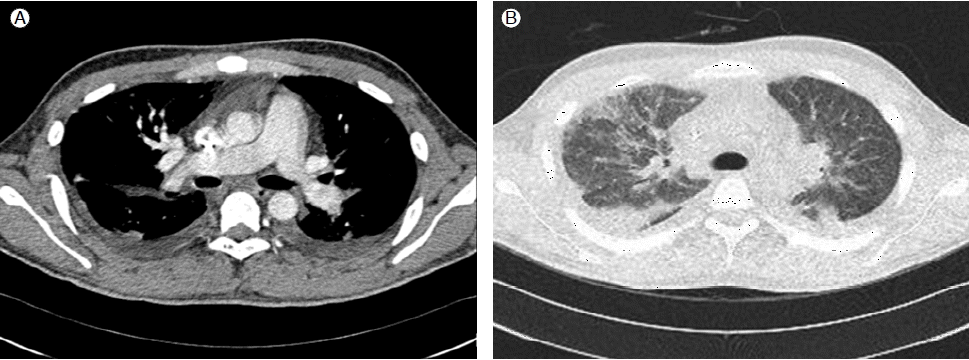
이상의 소견으로 급성 폐색전증을 감별하기 위하여 전산화 폐 단층 촬영 시행하였으나, 폐동맥 내에 혈전은 관찰되지 않았고(Fig. 3A), 양측 폐 실질의 침윤 및 흉막 삼출액 소견이 있었다(Fig. 3B).
환자는 중환자실에 입원하여 활력 징후 및 산소 포화도를 관찰하면서 산소 요법과 항생제 투여를 시행하였고, 빈혈 교정을 위하여 수혈을 시행하였다. 환자는 호흡 주머니로 산소를 7 L 투여하면서 시행한 동맥혈 가스 검사 결과 pH 7.36, PaO2 148 mmHg, PaCO2 38.8 mmHg, SaO2 99%로 나타나 이후 동맥혈 가스 검사 결과 추적검사하면서 산소 양을 조절하였다. 내원 10병일째 산소 투여량을 3 L로 감량하였고, 내원 12병일째 산소 투여를 중단하였다. 추적검사 결과, 일반 혈액 검사에서 혈색소 9.1 g/dL, 헤마토크리트 25.5%, 백혈구 3,070/mm3, 혈소판 20,000/mm3으로 수혈 후에 빈혈이 교정되는 양상을 보였고, 흉부 X-선 검사에서 심비대가 호전된 양상을 보였다(Fig. 1C). 또한 심초음파 소견에서도 좌심실 D형 변형이 사라지고, 우심실 확장 소견도 호전되었으며 우심실 수축기 압력도 34 mmHg로 감소되었다(Fig. 4).
환자는 내원 시 폐고혈압 및 우심실 부전 소견이 발견되었는데, 이는 폐색전증 및 기저 폐 질환 없는 상태에서 생긴 것으로, 급성 골수성 백혈병이 재발하면서 발생한 심한 빈혈 상태에 폐렴이 합병되면서 저산소증이 진행되어 저산소성 폐혈관수축이 발생하였고, 이에 의해 폐고혈압(group III)이 생긴 것으로 생각해 볼 수 있다. 환자의 치료로 빈혈 교정 위해 수혈을 시행하였고, 폐렴 치료를 위하여 항생제 투여를 하였으며 산소 요법으로 저산소증을 교정하였고, 우심실 부전을 치료하기 위하여 이뇨제 투여하였다. 이후 산소 포화도가 산소 투여 없이 정상 범위로 유지되면서 추적관찰한 흉부 X-선 사진에서 심비대 및 폐침윤이 호전되는 소견과 심초음파에서 폐고혈압 및 우심실 부전이 호전되는 소견도 같이 관찰할 수 있었다. 이후 환자는 호흡 곤란 및 발열 증상 없어 일반 병실로 이실하였고, 재발한 급성 골수성 백혈병에 대해서 항암 치료 후 특이 합병증 없이 퇴원하였다.
고 찰
폐고혈압이란 호흡곤란의 임상 증상과 함께 폐동맥압의 상승 및 우심실 기능부전을 공통적 임상 특징으로 가진 여러 질환들을 총칭하는 것으로[5] 2008년 다나 포인트에 의하면 평균 폐동맥압이 25 mmHg 이상일 경우로 정의한다[6].
저산소증이란 산소 운반과 활용 과정의 장애로, 동맥혈 산소함량이 감소하여 신체 내 조직세포의 산소 분압이 비정상적으로 낮은 경우를 말하며 저산소성 저산소증, 빈혈 저산소증, 울혈 저산소증, 조직 독성 저산소증, 수용성 저산소증으로 분류할 수 있다. 이 중 저산소성 저산소증은 동맥혈의 산소 분압이 감소되어 초래된 저산소증으로, 흡입 공기 중의 산소 농도가 감소하거나, 호흡중추억제, 기도 폐쇄, 폐부종 등으로 인한 폐포 환기 감소, 무기폐, 폐렴, 폐부종 등으로 인한 폐포의 가스 교환 장애, 고열, 신진대사항진과 같은 조직 내 산소 소모 증가로 인하여 발생하며, 드물게 이산화질소를 이용한 전신마취 후 발생하는 확산성 저산소증에 의해 발생할 수 있다.
빈혈은 WHO 기준으로 남자에서 혈색소 수치가 13 g/dL 미만이고, 여자에서 12 g/dL 미만으로 정의한다. 적혈구는 폐에서 여러 장기로 산소를 운반하는 역할을 하기 때문에 빈혈이 발생하면 장기로 산소 이동이 되지 않아, 신체 내 여러 장기에 저산소증이 발생할 수 있다. 이것을 빈혈 저산소증이라고 하는데, 이는 산소 분압은 정상 범위 내에 있으나 동맥혈의 산소 함량이 크게 감소되어 있는 경우를 말한다[7].
일반적으로 급성기 저산소성 폐혈관수축은 급격한 혈관수축을 일시적으로 약 10-15분간 일으키고, 정상 산소 분압상태가 되면 혈관상태가 정상화 되나, 전 폐야를 침범한 폐질환이나 만성적으로 저산소증이 지속되면 저산소성 폐혈관수축은 혈관 재형성을 통해 폐고혈압을 유발한다고 알려져 있다[8]. 그러나 본 증례는 임상경과를 고려할 때, 급성 저산소성 폐혈관수축 상태에서 혈관 재형성 없이 폐고혈압이 유발되면서 우심실 기능 상실까지 초래한 예로 보인다. 본 증례에서 저산소증의 원인으로 먼저 폐렴을 생각할 수 있고, 혈관 재형성에 의한 만성 폐고혈압의 경우, 2주 정도의 짧은 기간에 회복되지 않을 것으로 예상할 수 있어, 일시적인 저산소증에 의한 가역적인 급성 폐동맥수축으로 인하여 폐고혈압이 발생한 것으로 추정할 수 있다. 그러나 전 폐야에 걸친 전반적인 폐렴성 침윤이 없는 상태에서 우심실 부전을 유발할 정도로 심한 폐고혈압이 발생한 점은 폐렴으로 인한 저산소증 외에 다른 유발요인이 작용하였을 가능성을 유추하게 한다. 입원 당시 환자가 심한 빈혈 상태였던 것을 고려하면, 빈혈 저산소증과 폐렴에 의한 저산소증이 합병되면서 전 폐야의 폐혈관 수축을 유발한 것으로 생각해 볼 수 있다.
저산소성 폐혈관수축이 혈관 재형성을 통해 폐고혈압을 유발하는 과정은 전사 인자 중 hypoxia-inducible factor (HIF)를 통해서 조절되는데, 인체 내 세포는 저산소 상태에 반응해서 HIF를 활성화시키고, 활성화된 HIF는 수 백 개의 유전자 촉진자(promotor)에 있는 hypoxia-responsive elements (HREs)에 결합하여 저산소 상태에서 적응하고 살아남는 데에 필요한 유전자들을 발현시킨다[9]. HIF를 조절하는 철분 의존성 효소(oxygen-sensing iron-dependent dioxygenase enzymes)는 철 성분에 매우 민감하다. 철이 HIF의 하이드록실화반응에 관여하여 급, 만성 저산소증 상태에서 폐혈관수축 반응에 관여한다고 보고되었다. 만약, 저산소증 상태에서 철분 가용성(iron availability)이 급격히 감소할 경우, 폐동맥압은 급격히 증가한다. 이것은 철분 결핍이 폐 성심과 같은 저산소증에 의한 폐고혈압의 악화 가능성을 시사하는 것이다. Smith의 Iron protocol과 DFO protocol 연구 결과를 통해 저산소증에 대한 폐동맥 반응에서 철분의 중요성을 알 수 있고, 이러한 측면에서 철분 균형이 중요하다는 것과 폐순환에서 HIF 하이드록실화 반응에 철분 가용성이 중요하다는 것을 알 수 있다[10]. 따라서 본 증례에서 적혈구 수혈은 빈혈 개선과 저산소증의 개선 외에도 철분을 공급하는 효과를 나타냄으로써 폐동맥 수축 상태를 호전시키는 효과가 있었을 것으로 판단된다.
급성 골수성 백혈병 환자는 치료 경과 중에 심한 빈혈이 드물지 않으며, 면역 능력이 떨어져 있기 때문에 폐렴의 발병 위험이 높다. 따라서 치료 경과 중에 심한 빈혈이 동반된 경우, 전 폐야를 침범하지 않는 폐렴으로도 심한 저산소증이 발생할 수 있으며 이로 인한 폐고혈압이 발생할 수 있다는 것을 고려해야 할 것이다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






