심낭 삼출액 환자에서 Adenosine Deaminase를 근거로 한 항결핵 치료 결정의 적합성
Appropriateness of Adenosine Deaminase-Guided Management for Patients with Pericardial Effusion
Article information
Abstract
목적:
심낭 삼출액에서 결핵균 검출의 양성률이 낮은 것으로 알려져 있어 결핵 유병률이 높은 지역에서는 ADA를 이용한 간접적인 진단이 필요하다. 심낭 삼출 환자의 ADA 수치에 따른 치료 경과를 살펴보고 특발성 심낭염 환자에 있어 항결핵제의 경험적 사용의 유용성을 평가하고자 연구를 시행하였다.
방법:
2001년 1월부터 2010년 12월까지 경상대학교병원에서 심낭 삼출 또는 심낭 압전으로 심낭 천자술 또는 심낭 조루술을 시행 받은 환자 중 TbP, 특발성 심낭염을 진단받은 47명을 연구대상으로 하였다. Definite TbP는 심낭 삼출액에서 결핵균이 직접 증명된 경우나 심낭 조직검사상 건락괴사를 동반한 육아종이 있는 경우로 정의하였고, probable TbP의 경우 ADA 활성도 ≥ 40 IU/L으로 측정되거나 Tb interferon 양성 또는 심낭 외 결핵이 있는 경우로 정의하였다. 특발성 심낭염의 경우 definite 또는 probable TbP를 비롯한 다른 질환의 진단 기준에 합당하지 않은 경우로 정의하였다.
결과:
전체 환자 47명의 추적기간은 중앙값 12.1개월(0.17-100개월)이었으며 definite TbP, probable TbP, 특발성 심낭염 환자는 각각 12명, 17명, 18명이었다. Definite TbP 환자와 특발성 심낭염 환자의 심낭 삼출액을 비교하였을 때 definite TbP 환자에서 ADA 활성도가 유의하게 증가되어 있었다(74.97 ± 36.79 vs. 20.14 ± 7.39, p < 0.001). 심낭 삼출액의 ADA 활성도를 ROC 곡선으로 분석하였을 때 결핵성 심낭염의 진단을 위한 ADA의 절단값은 64 IU/L였고, 민감도 75.8%, 특이도 77.1%, 양성예측도 52.9%, 음성예측도 90.0%였다. 통상적으로 결핵 진단에 사용된 ADA 활성도 40 IU/L를 기준으로 두 군으로 47명의 환자를 나누었을 때 ADA < 40 IU/L, ADA ≥ 40 IU/L인 경우가 각각 22명, 25명이었다. ADA < 40 IU/L인 22명의 환자 중 10명이 항결핵제 치료를 받았고 항결핵제 사용 여부에 따라 다시 두 군으로 나누어 사망과 재발을 비교하였을 때 차이는 없었다.
결론:
결핵성 심낭염의 신속한진단을 위해 심낭 삼출액의 ADA 활성도가 유용하며 심낭삼출액에서 결핵균이 증명되지 않고 ADA 활성도가 40 IU/L 미만인 경우에 있어서 경험적 항결핵제를 사용하지 않더라도 양호한 예후를 보이는 환자가 있다는 것을 알 수 있었다. (Korean J Med 2012;82:441-448)
Trans Abstract
Background/Aims:
The prognostic impact of empirical anti-tuberculous management according to adenosine deaminase (ADA) levels in patients exhibiting pericardial effusion (PE) has not been established. We evaluated the appropriateness of ADA-guided anti-tuberculous medication for patients with PE.
Methods:
From 2001 to 2010, 47 patients with PE and who were diagnosed with either tuberculous pericarditis (TbP) or idiopathic pericarditis (IP) were enrolled. The diagnosis of definite TbP was made by the presence of Tb bacilli or caseous granuloma in pericardial tissue or effusion. The diagnosis of probable TbP was made by the presence of one or more of the following: (1) elevated ADA (≥ 40 IU/L) in pericardial fluid, (2) positive Tb interferon test, or (3) extracardiac presence of Tb. All clinical information was collected by medical record review and telephone contact.
Results:
Among the 47 patients with PE, 12 were diagnosed with definite TbP; 17, with probable TbP; and 18, with IP. The mean ADA level was significantly higher in patients with definite TbP than in patients with IP (74.97 ± 36.79 vs. 20.14 ± 7.39 IU/L; p< 0.001). The optimal ADA cutoff value for diagnosis of definite TbP was 64 IU/L. The median follow-up time was 12.1 months (range, 0.17-100 months). In patients with low levels of ADA (< 40 IU/L), the incidence of death or recurrence did not different between patients who were prescribed anti-tuberculous medication and those who were not.
Conclusions:
The ADA level in pericardial fluid was useful for making a rapid diagnosis of tuberculous pericarditis. Even in tuberculosis-endemic areas, patients with ADA < 40 IU/L may have a good prognosis without empirical anti-tuberculous treatment. (Korean J Med 2012;82:441-448)
서 론
심낭 삼출의 원인으로는 악성 종양, 감염, 약물, 외상, 교원성 질환 등이 있다[1,2]. 서구에서는 특발성 심낭 삼출이 가장 흔한 원인으로[3], 국내에서는 결핵성 심낭염, 악성 종양, 요독증의 순으로 보고되고 있다[2]. 특히 결핵성 심낭염은 치료를 하지 않으면 압축성 심낭염 및 사망 등 심각한 합병증을 유발하므로 심낭염 환자에 있어 결핵의 신속한 진단과 치료가 요구된다[4].
결핵성 심낭염을 확진하기 위해서는 심낭 삼출액에서 Mycobacterium tuberculosis 균의 도말 검사나 배양 검사, 심낭 생검에 의한 조직 검사 등이 필요하다. 그러나 심낭 삼출액에서 결핵균을 발견하는 것은 감수성이 10% 이하로 낮게 보고되고 있으며[4,5], 심낭 생검의 경우 심낭 천자술로는 검사할 수 없는 한계가 있어서 ADA 활성도, interferon 상승 등을 통한 간접적이고 신속한 진단 방법이 많이 사용되고 있다[4,6-8].
ADA는 핵산 대사에 관여하는 효소로서 주로 T 임파구에서 검출되며 세포성 면역 반응을 반영한다. 결핵성 늑막저류, 복수, 뇌척수액, 심낭 삼출액에서 현저히 ADA 활성도가 증가하여 결핵의 진단에 도움을 줄 수 있으며, 높은 진단적 감수성과 특이성을 가지고 있어 폐외 결핵의 진단에 유용한 표지자로 알려져 있다[6,9,10]. 따라서 결핵의 높은 유병률을 보이는 지역에서는 ADA 상승을 근거로 폐외 결핵의 치료를 시행하고 있는 실정이다. 심낭 삼출에 대한 유럽 가이드라인에서도 ADA 상승을 보이는 경우 “진단 가능한 결핵성 심낭염”(probable TbP)으로 분류하고 항결핵제 사용을 권고하고 있으며, 이 가이드라인에서는 ADA 30 IU/L 이상을 기준으로 제시하고 있다[11]. 또한 결핵 유행지역에서는 뚜렷한 원인을 발견하지 못한 경우 경험적인 항결핵제의 사용도 권고되고 있다[5]. 우리나라도 결핵의 유병률이 높은 국가에 속하여 경험적 항결핵제 치료가 시행되기도 한다. 그러나 저자들이 아는 바로는 경험적 항결핵제 치료 후 추적관찰 및 치료성적에 대한 국내의 보고는 없었다.
이에 저자는 10년간 경상대학병원에서 진단받은 심낭염 환자를 조사하여 특발성 심낭염과 결핵성 심낭염 진단에 있어 심낭 삼출액의 ADA 활성도의 진단적 가치를 분석하고 ADA 활성도에 따른 항결핵제의 사용에 따른 임상적 경과를 관찰하여 그 적합성을 평가하고자 하였다.
대상 및 방법
대상
2001년 1월부터 2010년 12월까지 경상대학교병원에서 심낭 삼출 또는 심낭압전으로 심낭천자술 또는 심낭조루술을 받은 130명의 환자의 원인을 조사하였을 때 악성종양(30.1%), 결핵성(22.8%), 특발성(17.3%), 개심술 후(6.8%), 심근경색과 관련된 Dressler’s syndrome (5.3%), 경피적관동맥성형술의 합병증으로 발생한 경우(3.8%), 화농성 심낭염(3.0%), 대동맥박리(2.3%), 요독증(2.3%), 갑상선기능저하증(1.5%), 유미성 삼출액(0.8%), 유육종증(0.8%) 등의 순이었다. 이들 환자 중 심장조루술을 시행하여 심낭 조직 검사를 포함한 모든 심낭액 검사가 이루어진 환자로서 의무 기록이 확인 가능한 결핵성 및 특발성 심낭염 환자 47명을 대상으로 검사 결과 및 예후를 분석하였다.
방법
결핵성 및 특발성 심낭염으로 진단된 47명의 환자에서 의무 기록을 통해 기저 질환 및 기본 검사, 심낭 삼출액 검사 결과를 확인하였다. 심낭 삼출액 검사는 육안 소견, 세포 수, 포도당 수치, 총 단백질 수치(total protein), 유산 탈수소 효소(lactate dehydrogenase, LDH), 세포학적 검사(cytology), 세균과 결핵균 도말 검사와 배양, 심낭 삼출액/혈청 단백질 비율(pericardial fluid/serum total protein), 심낭 삼출액/혈청 LDH 비율(pericardial fluid/serum LDH), 태아성암항원(carcinoembryonic antigen, CEA), ADA를 조사하였다. 심낭 삼출액의 ADA 활성도는 비색법으로 측정되었다.
심낭 삼출액에서 결핵균 도말 검사 양성 또는 배양 검사 양성 또는 PCR을 통하여 증명되거나 조직 검사에서 건락괴사를 동반한 육아종으로 결핵이 확진된 경우를 “확진된 결핵성 심낭염” (이하, definite TbP)으로 정의하였고, 심낭 삼출액 또는 심낭 조직에서 균은 증명되지 않았으나 폐를 비롯한 심낭 외에서 결핵이 확진 되거나 interferon 검사 양성 또는 심낭 삼출액의 ADA ≥ 40 IU/L인 기준 중 1개 이상을 만족한 경우를 probable TbP로 정의하였다. 다른 원인 질환이 없으면서 definite TbP 또는 probable TbP의 진단 기준에 만족하지 않는 심낭 삼출액 환자의 경우를 특발성 심낭염으로 정의하였다. Definite TbP 환자 12명, probable TbP 환자 17명, 특발성 심낭염 환자 18명의 총 47명의 환자의 심낭 삼출액의 특성을 살펴보고, 심낭 삼출액의 ADA 활성도에 따라 환자를 분류하여 이를 토대로 ADA의 결핵성 심낭염의 진단능을 알아보았고, ADA 활성도에 따른 항결핵제 치료 여부, 사망률 및 재발 여부를 조사하였다. 환자의 사망률과 재발 유무는 의무 기록 조회 및 전화설문을 통하여 조사되었다.
통계적 분석
본 연구에서 자료의 통계 분석은 Statistical Package for Social Science (SPSS, Version 12.0)을 이용하여 분석하였다. 특발성과 결핵성 심낭염의 임상 특징에 대해서는 카이제곱 검정을 이용하였고, 혈액검사 및 삼출액 비교는 Mann-Whitney test를 사용하여 비교 분석하였다. Receiver operating characteristic (ROC) 곡선 분석을 이용하여 결핵성 심낭염 예측을 위한 ADA 활성도의 가장 좋은 절단값(cut-off value)을 찾았고, 민감도, 특이도, 양성예측도 및 음성예측도 값을 계산하였다. p 값이 0.05 미만일 경우 통계적으로 유의한 것으로 판정하였다.
결 과
결핵성 심낭염과 특발성 심낭염에서의 임상양상 및 검사소견의 비교
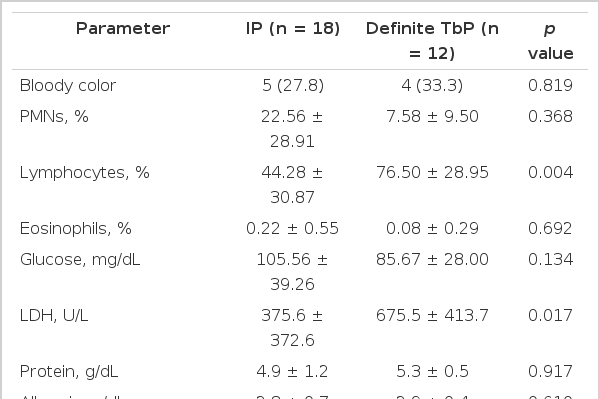
Definite TbP 환자 12명과 특발성 심낭염 환자 18명의 임상양상 및 혈액검사, 심낭 삼출액 검사소견을 비교하였다. Definite TbP의 경우 남성이 50.0%, 특발성 심낭염 환자에서는 남성이 33.3%였고, 평균 연령은 definite TbP 환자에서 58세, 특발성 심낭염에서 64세였다. 양 군의 혈액검사를 비교하였을 때 통계적으로 유의한 차이는 없었다(Table 1). 심낭 삼출액 소견을 비교했을 때(Table 2) definite TbP인 경우 100%에서 exudate 소견이었고, 특발성인 경우 93.8%에서 exudate로 양 군의 유의한 차이는 없었다. Definite TbP에서 특발성에 비해 유의하게 lymphocyte의 비율이 높았고(76.50 ± 28.95% vs. 44.28 ± 30.87%, p= 0.004), lymphocyte-dominant exudate를 보인 환자도 definite TbP에서 의미 있게 많았다(100% vs. 58.6%, p= 0.012). 심낭 삼출액의 ADA를 비교하면 definite TbP에서 특발성에 비해 유의하게 높은 수치를 나타내었다(74.97 ± 36.79 IU/L vs. 20.14 ± 7.39 IU/L, p < 0.001). Definite TbP 환자 12명 중 9명이 ADA 40 IU/L 이상이었고 3명에서 40 IU/L 미만의 수치를 보였다. ADA 40 IU/L 미만의 환자의 특징을 살펴보면 다음과 같다. 한 환자는 심낭액 검사를 통하여 결핵균 배양 검사 양성이 확인되었다. ADA 39 IU/L이었으며 폐결핵이 진단된 환자였다. 다른 환자는 모든 검사에서 음성으로 나왔으며 ADA 6 IU/L으로 낮은 수치를 보였으나 PCR 검사에서 양성으로 나와 확진되었고 마지막 한 환자는 ADA 19 IU/L로 나타났으며 조직검사에서 육아종이 확인되어 definite TbP로 진단되었다.

Clinical characteristics and laboratory findings of patients with idiopathic pericarditis and definite tuberculous pericarditis
ADA 활성도의 분포 및 결핵성 심낭염 진단을 위한 ADA 활성도
Definite TbP 환자 12명, probable TbP 환자 17명, 특발성 심낭염 환자 18명의 총 47명의 환자를 항결핵제 치료를 받은 군과 받지 않은 군으로 나누고 이에 따른 ADA 활성도의 분포를 살펴보았다(Fig. 1). 항결핵제 치료를 받지 않은 군(n = 13)에서는 1명을 제외한 나머지 환자 모두 ADA 활성도가 40 IU/L 미만이었다. ADA 51 IU/L로 측정되었으나 항결핵제 치료를 받지 않은 환자는 심낭 삼출액에서 결핵균이 증명되지 않고 조직 검사상에서도 결핵소견이 없으면서 ADA만 40 IU/L 이상으로 증가되어 있었던 경우로 환자 본인이 항결핵제 치료에 동의하지 않은 경우였다. 항결핵제 치료를 받은 군은 34명으로 거의 대부분이 ADA 활성도가 높았고, ADA 40 IU/L 미만의 경우에서도 항결핵제 치료를 받은 환자가 10명이었다.
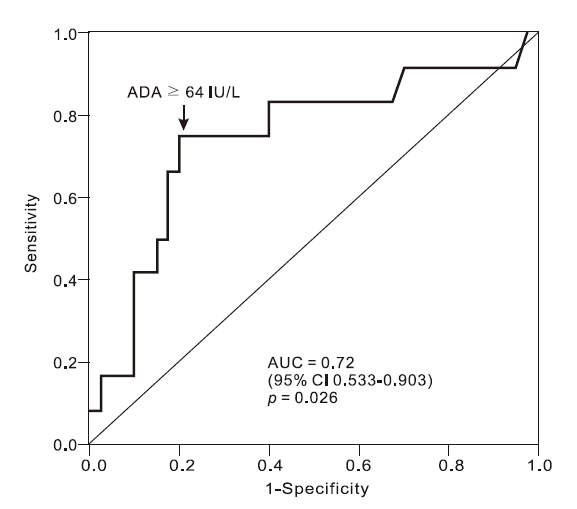
ADA의 결핵성 심낭염에 대한 진단능을 알아보기 위해 47명의 환자에서 ROC 곡선 분석을 시행하였다(Fig. 2). 가장 민감도와 특이도가 좋은 ADA 64 IU/L을 절단값으로 정하였을 때, 민감도는 75.8%, 특이도 77.1%, 양성예측도 52.9%, 음성예측도 90.0%였다. 본 연구 대상자들에서 통상적으로 사용되고 있던 ADA 40 IU/L의 진단능은 민감도 75.0%, 특이도 54.3%, 양성예측도 36.0%, 음성예측도 86.4%였다.
활성도에 따른 항결핵제 치료 및 임상경과 분석
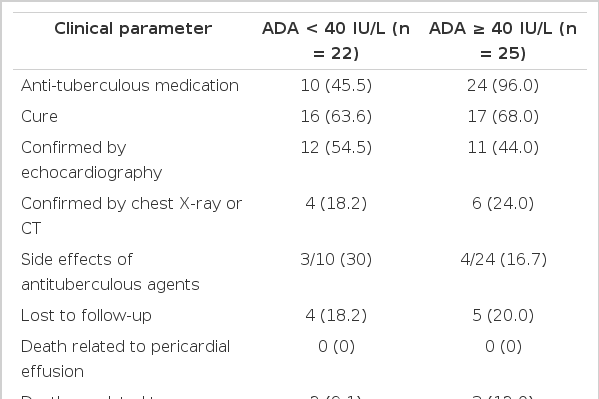
특발성 및 결핵성 심낭염으로 진단된 47명의 환자에서 ADA 활성도에 따른 항결핵제 치료 양상 및 예후를 분석하였다(Table 3). 통상적으로 결핵 진단의 기준으로 사용하였던 ADA 40 IU/L를 기준으로 하여 두 군으로 나누고 각 군의 항결핵제 처방률, 부작용 발생률, 사망 및 재발 여부를 조사하였다. 전체 환자 47명의 추적기간은 중앙값 12.1개월(0.17-100개월)이었다. ADA 활성도가 40 IU/L 미만인 경우가 22명, ADA ≥ 40 IU/L인 경우 25명이었고 각 군에서 항결핵제 처방률은 각각 10명(10/22, 45.5%), 24명(24/25, 96.0%)이었다. 항결핵제를 처방받은 환자 중 부작용의 발생은 각각3명(3/10, 30%), 4명(4/24, 16.7%)이었다. 구토가 심하여 입원치료가 필요하였던 경우가 2명이었고 이 중 한 명은 이후 외래에 방문하지 않았고 한 명은 가려움증이 심하게 동반되는 등 부작용 정도가 심하여 이차 약제로 변경 투여하였다. 그러나 1개월 후 뇌경색의 발병으로 사망하였다. 가려움증을 호소한 경우는 3명, 간기능 악화로 입원치료한 경우가 1명, 위막성대장염으로 치료한 경우가 2명이었다. 약물치료를 요할 정도의 심한 요산치 상승이 1명에서 발생하였다. 외래 경과관찰이 가능했던 환자 각 16명과 17명에서 재발은 없었으며 심낭 삼출과 관계된 사망은 없었다. ADA 활성도가 40 IU/L 미만인 군으로 경과관찰이 가능했던 16명 중 12명은 심장초음파 검사를 통하여 심낭삼출이 없음이 증명되었고 2명은 흉부 X-선 검사를 통하여 심장의 크기에 변화가 없음을 확인하였고 나머지 2명은 흉부 CT 검사에서 심낭삼출이 재발하지 않았다는 것을 확인하였다. ADA 활성도 40 IU/L 이상인 군에서는 17명 중 11명이 심초음파 검사를 받았고 5명이 흉부 X-선 검사, 1명이 흉부 CT 검사를 받았다. ADA 활성도가 40 IU/L 미만인 군에서는 심낭삼출과 관련된 사망은 없었으나 경과관찰 기간 중 뇌출혈로 인한 사망과 세균성 폐렴에 의한 사망이 있었다. ADA 40 IU/L 이상인 군에서는 각각 뇌출혈, 뇌경색, 세균성 폐렴과 관련된 패혈증으로 3명의 사망이 있었다(Table 3). Definite TbP로서 ADA 40 IU/L 이상인 환자 한 명에서 일시적인 압축성 심낭염 소견이 관찰되었으나 치료 종료 시점에서는 호전된 결과를 보였다.
특발성 심낭염 환자의 항결핵제 치료에 따른 임상경과 분석
특발성 심낭염 환자는 18명으로 모든 환자가 ADA 활성도는 40 IU/L 미만이었다. 그중 6명에서 항결핵제 치료가 이루어졌으며 이 중 재발이나 사망은 없었다. 항결핵제 치료를 받지 않은 환자 12명은 추적관찰이 되지 않은 2명과 심낭 삼출과 관계없는 사망 환자 2명이 발생하였다. 추적관찰이 가능하였던 8명은 중앙 추적기간 19개월 동안 재발 및 심낭 삼출과 관련된 사망은 없었다(Fig. 3).
고 찰
본 연구에서 definite TbP를 진단할 수 있는 가장 적합한 심낭 삼출액의 ADA 수치는 64 IU/L 이상이었다. 통상적으로 TbP를 진단하는 ADA 기준치인 40 IU/L 미만인 환자에서 항결핵제는 10명(45.5%)에서 처방되었으며 항결핵제 사용여부와 관계없이 심낭 삼출이 원인이 된 사망은 없었다. 재발이나 심낭 삼출의 악화도 관찰되지 않았다. 항결핵제의 부작용은 전체 사용 환자 34명 중 7명(20.6%)이었고 40 IU/L 미만인 환자 10명 중 3명(30%)이었다.
ADA는 퓨린 대사에 관여하는 효소로 T-임파구에 높은 농도로 존재하며 결핵성 삼출액에 높은 농도로 존재하여 여러 연구에서 ADA가 결핵성 질환의 감별 진단에 유용함이 알려져 있다[6-10,12,13]. 그러나 임상적으로 사용되는 기준은 30에서 60 IU/L로 다양하여 30 IU/L를 절단값으로 했을 때 결핵 진단의 민감도는 94%, 특이도는 68% 정도로 보고되며[6], Ocaña 등[12]은 늑막 삼출액 ADA 기준을 45 IU/L로 하였을 때 민감도는 100%, 특이도는 97%로 보고하였다. 본 연구에서 definite TbP와 특발성 심낭염의 심낭 삼출액을 비교하였고 삼출액의 림프구 수와 ADA 활성도가 결핵성에서 의미 있게 높은 것으로 나타났으며 결핵성 심낭염을 확진할 수 있는 ADA 수치를 구하였을 때 ADA 64 IU/L에서 민감도 75.8%, 특이도 77.1%, 양성예측도 52.9%, 음성예측도 90.0%로 중등도의 진단능을 보여주었다. 본 연구에서 제시한 ADA 64 IU/L는 낮은 검출률을 보이는 조직검사나 결핵균의 증명을 기준으로 정한 수치이기 때문에 양성예측도는 낮고 음성예측도는 높게 나온 것으로 생각된다. 또한 전체 환자 수가 적기 때문에 보다 정확한 절단값을 결정하는 데 한계가 있었던 것으로 생각한다.
결핵 유병률이 높은 국내에서는 신속 검사에서 결핵의 진단을 놓치는 경우에 대비하여 특발성 심낭염 환자에게 경험적으로 항결핵제를 처방하는 것이 고려되며 실제로 국내에서도 임상의의 판단에 근거하여 경험적 항결핵제 처방이 시행되고 있는 실정이다. 본 연구에서 결핵성 심낭염 및 특발성 심낭염 환자 47명을 결핵 치료 여부에 따라 양 군으로 나누고 ADA 분포를 살펴보았을 때 항결핵제를 사용한 군에서 ADA 활성도가 높은 경향을 보였고, 항결핵제를 사용하지 않은 군은 ADA 활성도가 낮았으나 ADA 활성도가 낮은 경우에 있어서는 TbP를 완전히 배제할 수 없어 경험적 항결핵제를 사용한 예가 45.5%에서 있었다. 결핵성 및 특발성 심낭염으로 진단된 47명을 대상으로 기존의 다른 연구들에서 알려진 ADA 기준 40 IU/L [13]을 토대로 환자를 심낭 삼출액의 ADA 수치에 따라 두 군으로 나누어 임상경과를 비교한 결과 ADA < 40 IU/L에 포함되는 환자군에서 항결핵제를사용한 환자와 사용하지 않은 환자의 사망 및 재발이 없어 양 군의 차이가 없음을 확인할 수 있었다. 특발성 심낭염 환자 18명 중 항결핵제 치료를 받지 않은 환자 군에서도 좋은 예후를 가지는 것을 확인할 수 있었다. 부작용의 발생은 전체환자 20.6%, ADA 40 IU/L 미만 환자 30%로 나타났으며 특히 ADA 40 IU/L 미만 환자 중 부작용이 있었던 3명 중 2명이 입원치료가 필요할 정도였다.
실제 임상에서는 심낭 삼출의 진단 및 치료로서 심낭 조루술보다는 심낭 천자술이 덜 침습적이며 안전한 검사로서 심낭 천자술이 더 흔히 시행되고 있으나 심낭 천자술로는 심낭 생검을 얻을 수 없다는 한계가 있다. 그러나 본 연구에서 육아종이 발견되어 확진된 한 명을 제외하고 모든 definite TbP 환자에서 심낭 천자술로 얻을 수 있는 ADA 수치, PCR 검사 및 결핵균 배양 검사에서 치료 결정이 가능함을 확인하였다. 그리고 본 연구에서 나타난 임상경과와 항결핵제의 부작용 등을 고려할 때, 저자들은 결핵균이 증명되지 않고 PCR이 음성이면서 ADA < 40 IU/L라면 항결핵제 치료가 반드시 필요한 것은 아니며 추적관찰하는 것도 정당한 방안이 될 수 있다고 생각하였다.
본 연구는 후향적 연구로 단일기관의 결과이며, 심장조루술을 시행한 환자를 대상으로 하고 진단이 확실한 환자를 대상으로 한 연구로 환자의 수가 많지 않았다. 특히 적은 환자 수로 인하여 본 연구에서 얻은 ADA 절단값 64 IU/L에 대한 검증을 할 수 없었다. 비록 심초음파와 흉부 방사선 검사로 더 이상의 심낭삼출이 없음을 확인하고 치료를 종료하였고 연구를 시행하는 시점에서 환자와의 전화상담을 시행하였지만, 장기간의 예후에 대한 객관적인 검사 및 평가가 이루어질 수 없었다는 제한점이 있었다.
결론적으로 결핵성 심낭염의 빈도가 높은 우리나라에서는 결핵의 신속한 진단과 적절한 항결핵제 사용 여부의 기준으로서 심낭 삼출액의 ADA 활성도가 유용하겠다. ADA 64 IU/L에서 결핵성 심낭염 진단의 가장 높은 예측도를 보여주었다. 그리고 비록 우리나라는 결핵의 유행지역이기는 하지만, 결핵균이나 건락괴사의 증거 없이 심낭 삼출액의 ADA 활성도가 40 IU/L 미만인 경우에 있어서 경험적 항결핵제를 사용하지 않더라도 양호한 예후를 보이는 환자가 있다는 것을 알 수 있었다. 향후 항결핵제 사용 결정에 대한 방향 제시를 위해 ADA 64 IU/L를 기준으로 하여, 많은 수의 환자를 대상으로 한 전향적 연구가 필요할 것으로 생각한다.