ņä£ ļĪĀ
ĒÅÉĒżļŗ©ļ░▒ņ”ØņØĆ ņØĖņ¦Ćņ¦łņØ┤ ĒÆŹļČĆĒĢ£ ļŗ©ļ░▒ņ¦ł ņ¢æ ļ¼╝ņ¦łņØ┤ ĒÅÉĒż ļé┤ņŚÉ ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ ņČĢņĀüļÉśņ¢┤ ņĀĆņé░ņåīņ”ØĻ│╝ ņĀ£ĒĢ£ņä▒ ĒÖśĻĖ░ņןņĢĀļź╝ ņ£Āļ░£ĒĢśļŖö ļō£ļ¼Ė ĒÅÉņ¦łĒÖśņ£╝ļĪ£ 1958ļģä Rosen ļō▒ņŚÉ ņØśĒĢ┤ ņ▓śņØīņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[1]. ĒÅÉĒżļŗ©ļ░▒ņ”ØņØś Ēæ£ņżĆņ╣śļŻīļ▓ĢņØĆ ņĀäĒÅÉņäĖņ▓ÖņłĀļĪ£ 1965ļģä Raminez-Rivera ļō▒ņŚÉ ņØśĒĢ┤ ņ▓śņØī ņŗ£Ē¢ēļÉ£ ņØ┤Ēøä Ēśäņ×¼Ļ╣īņ¦Ć ļäÉļ”¼ ņØ┤ņÜ®ļÉśĻ│Ā ņ׳ļŗż[2]. ņĀäĒÅÉņäĖņ▓ÖņłĀņØä ĒåĄĒĢ┤ ĒÖśņ×ÉņØś ņ”ØņāüĒśĖņĀä ļ░Å ĒÄśĻĖ░ļŖź Ē¢źņāüņØä ĻĖ░ļīĆĒĢĀ ņłś ņ׳ņ£╝ļéś, ņĀäņŗĀļ¦łņĘ©ņÖĆ ĻĖ░Ļ┤Ć ļé┤ ņéĮĻ┤ĆņØ┤ ĒĢäņÜöĒĢśļ®░ ĻĖ░ĒØē, ĒØĪņØĖņä▒ ĒÅÉļĀ┤ ļ░Å ĻĖ░Ļ┤Ćņ¦ĆĻ▓ĮļĀ©Ļ│╝ Ļ░ÖņØĆ ĒĢ®ļ│æņ”ØņØ┤ ļ░£ņāØĒĢĀ ņ£äĒŚśņØ┤ ņ׳ņ¢┤[2] ņĀäĒÅÉ ņäĖņ▓ÖņłĀ ņÖĖņØś ņāłļĪ£ņÜ┤ ņ╣śļŻīļ▓ĢņØ┤ ņÜöĻĄ¼ļÉśņ¢┤ ņÖöļŗż. 1994ļģä Stanley ļō▒[3]ņØĆgranulocyte-macrophage colony-stimulating factor (GM-CSF)ņØś ņĪ░ĒśłĻĖ░ļŖźņŚÉ ļīĆĒĢ£ ņśüĒ¢źņØä ņŗżĒŚśĒĢśļŹś ņżæ GM-CSF ņ£ĀņĀäņ×ÉĻ░Ć ņĀ£Ļ▒░ļÉ£ knock-out miceņØś ĒÅÉņĪ░ņ¦üņØ┤ ņé¼ļ×īņØś ĒÅÉĒżļŗ©ļ░▒ņ”ØĻ│╝ ņ£Āņé¼ĒĢ£ ļ│æļ”¼ņåīĻ▓¼ņØä ļ│┤ņ×äņØä ļ░£Ļ▓¼ĒĢśņśĆĻ│Ā, ņØ┤ļź╝ ĒåĀļīĆļĪ£ GM-CSFĻ░Ć ĒÅÉĒżļŗ©ļ░▒ņ”ØņØś ļ│æņØĖņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢ£ļŗżļŖö Ļ▓āņØä ļ░ØĒśĆļāłļŗż. ņØ┤Ēøä ĒÅÉĒżļŗ©ļ░▒ņ”ØņØś ļ░£ņāØņŚÉ GM-CSF ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ░Ć Ļ┤ĆņŚ¼ĒĢ£ļŗżļŖö ņé¼ņŗżņØ┤ ņĢīļĀżņĀĖ ņ╣śļŻīņŚÉ GM-CSFļź╝ ņØ┤ņÜ®ĒĢ£ ņ×äņāüņŚ░ĻĄ¼ļōżņØ┤ ņ¦äĒ¢ēļÉśņŚłņ£╝ļ®░ ņ╣śļŻīĒÜ©Ļ│╝Ļ░Ć ņ׳ņØīņØ┤ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[4-7].
ņĀĆņ×ÉļōżņØĆ ĒāĆņøÉņŚÉņä£ ĒÅÉĒżļŗ©ļ░▒ņ”ØņØä ņ¦äļŗ©ļ░øĻ│Ā ņ┤Ø 4ņ░©ļĪĆņØś ņĀäĒÅÉ ņäĖņ▓ÖņłĀ ņØ┤ĒøäņŚÉļÅä ņ”ØņāüņØ┤ ĒśĖņĀäļÉśņ¦Ć ņĢŖņĢä GM-CSF ĒØĪņ×ģ ņ╣śļŻī Ēøä ĒśĖņĀäļÉśņŚłļŹś ĒÖśņ×Éļź╝ Ļ▓ĮĒŚśĒĢśņśĆĻĖ░ņŚÉ ļ¼ĖĒŚīĻ│Āņ░░Ļ│╝ ĒĢ©Ļ╗ś ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
ņ”Ø ļĪĆ
ĒÖś ņ×É: ļé©ņ×É, 54ņäĖ
ņŻ╝ ņåī: ĒśĖĒØĪĻ│żļ×Ć
Ēśäļ│æļĀź: ĒÖśņ×ÉļŖö ļé┤ņøÉ 4ļģä ņĀä ņ¦üņןĻ▓Ćņ¦äņ░© ņŗ£Ē¢ēĒĢśņśĆļŹś ļŗ©ņł£ ĒØēļČĆņ┤¼ņśüņŚÉņä£ ņØ┤ņāüņåīĻ▓¼ņØ┤ ļ░£Ļ▓¼ļÉśņŚłļŗż. ņØ┤ņŚÉ ņØĖĻĘ╝ ļ│æņøÉņŚÉņä£ Ļ▓ĮĻ│╝Ļ┤Ćņ░░ĒĢśļŹś ņżæ ĒśĖĒØĪĻ│żļ×ĆņØ┤ ļ░£ņāØĒĢśņŚ¼ ļ╣äļööņśż ĒØēĻ░ĢĻ▓ĮņØä ņØ┤ņÜ®ĒĢ£ ĒÅÉņĪ░ņ¦ü Ļ▓Ćņé¼ļĪ£ ĒÅÉĒżļŗ©ļ░▒ņ”ØņØä ņ¦äļŗ©ļ░øņĢśļŗż. ņØ┤Ēøä ņØĖĻĘ╝ ņóģĒĢ®ļ│æņøÉņŚÉņä£ ņÖĖļל Ļ┤Ćņ░░ĒĢśļŹś ņżæ ļé┤ņøÉ 19Ļ░£ņøö ņĀäļČĆĒä░ ĒśĖĒØĪĻ│żļ×ĆņØ┤ ņĢģĒÖöļÉśņ¢┤, ņĀäņŗĀ ļ¦łņĘ©ĒĢśņŚÉ ņĀäĒÅÉ ņäĖņ▓ÖņłĀņØä 2ĒÜī(ņśżļźĖņ¬Į 2ĒÜī, ņÖ╝ņ¬Į 2ĒÜī) ņŗ£Ē¢ē ļ░øņĢśļŗż. ņŗ£ņłĀ ņØ┤Ēøä ĒśĖĒØĪĻ│żļ×ĆņØĆ ļŗżņåī ĒśĖņĀäļÉśņŚłņ£╝ļéś ĒÅÉĻĖ░ļŖźņØś ĒśĖņĀäņØĆ ņŚåņŚłļŗż. ņĀäĒÅÉ ņäĖņ▓ÖņłĀ Ēøä 15Ļ░£ņøöĻ░ä ņÖĖļל ņČöņĀü Ļ┤Ćņ░░ņØä ĒĢśņśĆļŖöļŹ░ ņĀÉņ░© ĒśĖĒØĪĻ│żļ×ĆņØ┤ ņĢģĒÖöļÉśņ¢┤, ļé┤ņøÉ 4Ļ░£ņøö ņĀä ņ¢æņĖĪ ĒÅÉņŚÉ ņĀäĒÅÉ ņäĖņ▓ÖņłĀņØä 2ĒÜī(ņśżļźĖņ¬Į 2ĒÜī, ņÖ╝ņ¬Į 2ĒÜī) ņČöĻ░ĆļĪ£ ņŗ£Ē¢ē ļ░øņĢśļŗż. ĻĘĖļ¤¼ļéś ņ×äņāü ņ”ØņāüņØś ĒśĖņĀäņØ┤ ņŚåĻ│Ā, ĒØēļČĆ Ļ│ĀĒĢ┤ņāüņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü(high-resolution computed tomography, HRCT)ņŚÉņä£ ņĢģĒÖöļÉ£ ņåīĻ▓¼ņØä ļ│┤ņŚ¼ ļ│ĖņøÉņ£╝ļĪ£ ņĀäņøÉļÉśņŚłļŗż.
Ļ│╝Ļ▒░ļĀź: ĒŖ╣ņØ┤ņé¼ĒĢŁ ņŚåņŚłļŗż.
Ļ░ĆņĪ▒ļĀź: ĒŖ╣ņØ┤ņé¼ĒĢŁ ņŚåņŚłļŗż.
ĒØĪņŚ░ļĀź: ļ╣äĒØĪņŚ░ņ×ÉņśĆļŗż.
ņ¦üņŚģļĀź: 9ļģäĻ░ä ĒÅÉņĀĢņĀ£ņ£Āļź╝ ņ▓śļ”¼ĒĢśļŖö ņØ╝ņØä ĒĢśļŗżĻ░Ć ļé┤ņøÉ 1ļģä ņĀä ņżæļŗ©ĒĢśņśĆļŗż.
ļ¼Ėņ¦ä ņåīĻ▓¼:ĒśĖĒØĪ Ļ│żļ×ĆņØĆ ļ¦ÄņØ┤ Ļ▒ĘĻ▒░ļéś Ļ│äļŗ©, ņé░ņŚÉ ņśżļź╝ ļĢī ņł©ņØ┤ ņ░¼ ņĀĢļÅäņśĆņ£╝ļ®░ ĻĘĖ ņÖĖ Ļ▓ĮĒĢ£ ĻĖ░ņ╣© ņØ┤ņÖĖ ļŗżļźĖ ĒśĖĒØĪĻĖ░ ņ”ØņāüņØĆ ĒśĖņåīĒĢśņ¦Ć ņĢŖņĢśļŗż.
ņ¦äņ░░ ņåīĻ▓¼: ņ×ģņøÉ ļŗ╣ņŗ£ ĒśłņĢĢņØĆ 142/86 mmHg, ļ¦źļ░ĢņØĆ ļČäļŗ╣ 106ĒÜī, ĒśĖĒØĪņłśļŖö ļČäļŗ╣ 22ĒÜī, ņ▓┤ņś©ņØĆ 36.3ŌäāņśĆĻ│Ā, ņØśņŗØņØĆ ļ¬ģļŻīĒĢśņśĆļŗż. ĒØēļČĆ ņ▓Łņ¦äņāü ņĀäĒÅÉņĢ╝ņŚÉ Ļ▒Ėņ│É ņłśĒżņØīņØ┤ ļōżļĀĖĻ│Ā ļ│ĄļČĆ ņ┤ēņ¦äņāü Ļ░ä, ļ╣äņןņØś ņóģļīĆļŖö ņŚåņŚłĻ│Ā, ņ×ģņłĀ, ņé¼ņ¦Ć ļ¦Éļŗ©ņŚÉ ņ▓Łņāēņ”ØņØĆ ņŚåņŚłļŗż.
Ļ▓Ćņé¼ņŗż ņåīĻ▓¼: ļ¦Éņ┤ł ĒśłņĢĪ Ļ▓Ćņé¼ņāü ļ░▒ĒśłĻĄ¼ 6,600/mm3(ĒśĖņżæĻĄ¼ 53.1%, ļ”╝ĒöäĻĄ¼ 36.2%, ļŗ©ĒĢĄĻĄ¼ 8.9%, ĒśĖņé░ĻĄ¼ 1.5%, ĒśĖņŚ╝ĻĄ¼ 0.3%), Ēśłņāēņåī 17.2 g/dL, ĒśłņåīĒīÉ 241,000/mm3ņØ┤ņŚłļŗż. ļÅÖļ¦źĒśł Ļ░ĆņŖż Ļ▓Ćņé¼ņāü pH 7.42, PaCO2 30.9 mmHg, PaO2 70.6 mm Hg, HCO3 20.5 mEq/LņśĆĻ│Ā ĒśłņĢĪ ĒÖöĒĢÖ Ļ▓Ćņé¼ļŖö ņĀĢņāü ņåīĻ▓¼ņØ┤ņŚłļŗż. ĒÅÉĻĖ░ļŖź Ļ▓Ćņé¼ļŖö ļģĖļĀźņä▒ĒÅÉĒÖ£ļ¤ē(forced vital capacity, FVC) 2.34 L (ņĀĢņāüņśłņĖĪņ╣śņØś 57%), 1ņ┤łĻ░ä ļģĖļĀźņä▒ĒśĖĻĖ░ļ¤ē(forced expiratory volume in one second, FEV1) 1.93 L (ņĀĢņāüņśłņĖĪņ╣śņØś 62%), FEV1/FVC 106, ņĀäĒÅÉņÜ®ļ¤ē(total lung capacity, TLC) 3.35 L (ņĀĢņāüņśłņĖĪņ╣śņØś 60%), ĒÅÉĒÖĢņé░ļŖź(diffusing capacity of the lungs for carbon monoxide, DLco) 10.1 mL/mmHg/min (ņĀĢņāüņśłņĖĪņ╣śņØś 49%)ļĪ£ ņĀ£ĒĢ£ņä▒ ĒÖśĻĖ░ņןņĢĀļź╝ ļ│┤ņśĆļŗż. 6ļČä ļ│┤Ē¢ē Ļ▓Ćņé¼ņāü ļ│┤Ē¢ēĻ▒░ļ”¼ļŖö 425 meterņśĆĻ│Ā, ļ│┤Ē¢ē ņżæ ņĄ£ņĀĆņé░ņåīĒżĒÖöļÅäļŖö 89%ņśĆļŗż. ļźśļ¦łĒŗ░ņŖżņØĖņ×É, ĒĢŁĒĢĄĒĢŁņ▓┤ ļō▒ ņ×ÉĻ░ĆĒĢŁņ▓┤ Ļ▓Ćņé¼ņāü ļ¬©ļæÉ ņØīņä▒ņØ┤ņŚłĻ│Ā ņŗ¼ņĀäļÅäļŖö ņĀĢņāüņåīĻ▓¼ņØ┤ņŚłļŗż.
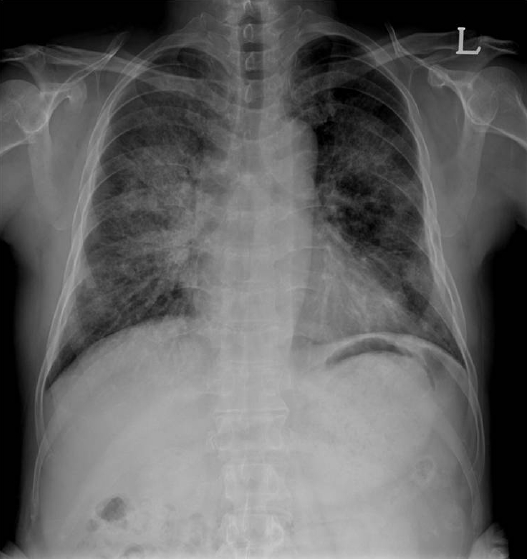
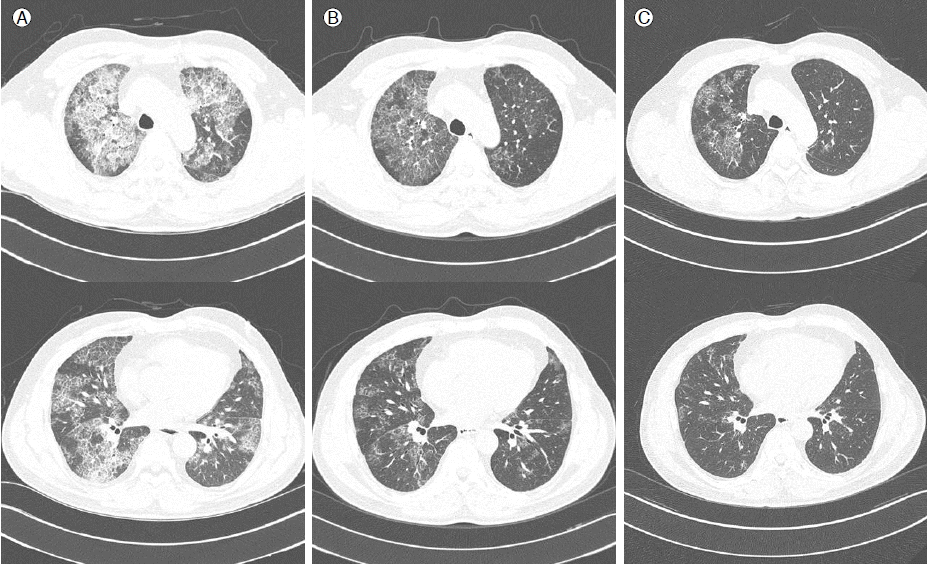
ļ░®ņé¼ņäĀĒĢÖņĀü Ļ▓Ćņé¼: ļŗ©ņł£ ĒØēļČĆņ┤¼ņśüņāü ņ¢æņĖĪ ĒÅÉņĢ╝ņŚÉ Ļ░äņ£Āļ”¼ ņØīņśüņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā(Fig. 1), ĒØēļČĆ HRCTņāüņŚÉņä£ļŖö ņ¢æņĖĪ ĒÅÉņŚÉ Ļ░äņ£Āļ”¼ ņØīņśüĻ│╝ ĒĢ©Ļ╗ś ņåīņŚĮĻ░ä ņżæĻ▓®ņØ┤ ļæÉĻ║╝ņøīņĀĖ ņ׳ņŚłĻ│Ā ņé¼ņØ┤ņ¦ł ņ╣©ņ£żņØä ļ│┤ņśĆļŗż(Fig. 2A).
ĻĖ░Ļ┤Ćņ¦Ć ļé┤ņŗ£Ļ▓Į ņåīĻ▓¼: ĻĖ░Ļ┤Ćņ¦Ć ļé┤ļČĆņŚÉ ņØ┤ņāü ņåīĻ▓¼ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśĻ│Ā, ĒÅÉĒżņäĖņ▓ÖņłĀņØä ņŗ£Ē¢ēĒĢśņŚ¼ ļ»ĖņāēņØś ĒāüĒĢ£ ņ╣©ņĀäļ¼╝ņØ┤ ņ׳ļŖö ņäĖņ▓ÖņĢĪņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ĒÅÉĒżņäĖņ▓ÖņĢĪ ļČäņäØņŚÉņä£ļŖö ļ░▒ĒśłĻĄ¼ 2/mm3(ĒśĖņżæĻĄ¼ 14%, ļ”╝ĒöäĻĄ¼ 36%, ĒśĖņé░ĻĄ¼ 2%, ĒÅÉĒżļīĆņŗØņäĖĒż 48%)ņśĆĻ│Ā, ļ░░ņ¢æ Ļ▓Ćņé¼ņāü ĻĘĀņØĆ ļÅÖņĀĢļÉśņ¦Ć ņĢŖņĢśļŗż.
ņ╣śļŻī ļ░Å Ļ▓ĮĻ│╝: ņÖĖļČĆ ļ│æņøÉņŚÉņä£ ņ┤Ø 4ĒÜīņŚÉ Ļ▒Ėņ╣£ ņĀäĒÅÉ ņäĖņ▓ÖņłĀ ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņ×äņāü ņ”ØņāüņØś ĒśĖņĀäņØ┤ ņŚåņ¢┤, ņé¼ņĀäļÅÖņØśļź╝ ļ░øņØĆ Ēøä recombinant human GM-CSF (rhGM-CSF; sargramostim, [Leukine], lyophilized formulation; Berlex, Seattle, WA)ņØś ĒØĪņ×ģ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśĻĖ░ļĪ£ Ļ▓░ņĀĢĒĢśņśĆļŗż. ņ╣śļŻīļŖö ņĄ£ĻĘ╝ņŚÉ Tazawa ļō▒[6]ņØ┤ ļ░£Ēæ£ĒĢ£ ļģ╝ļ¼ĖņØä ņ░ĖĻ│ĀĒĢśņŚ¼ 12ņŻ╝Ļ░äņØś Ļ│ĀņÜ®ļ¤ē ņ╣śļŻī Ēøä ņĀĆņÜ®ļ¤ē ņ╣śļŻī 12ņŻ╝ļź╝ ņ£Āņ¦ĆĒĢśļŖö ņØ╝ņĀĢņ£╝ļĪ£ ņ×ĪņĢśļŗż. Ļ│ĀņÜ®ļ¤ē ņ╣śļŻī ļ░®ļ▓ĢņØĆ 125 mcgņØś GM-CSFļź╝ 2 mLņØś ļ®ĖĻĘĀ ņāØļ”¼ņŗØņŚ╝ņłśņŚÉ ĒؼņäØĒĢśņŚ¼ ļČäļ¼┤ĻĖ░ļź╝ ņØ┤ņÜ®ĒĢ┤ ĒĢśļŻ© 2ĒÜī ĒØĪņ×ģ(ņ┤Ø 250 mcg/day)ĒĢśļÅäļĪØ ĒĢśņśĆļŗż. ņ╣śļŻī ņŗ£ņ×æņØ╝ 1ņØ╝ļČĆĒä░ 8ņØ╝Ļ╣īņ¦ĆļŖö ĒĢśļŻ© 2ĒÜī ĒØĪņ×ģņØä ņ£Āņ¦ĆĒĢśņśĆĻ│Ā, ņ╣śļŻī ņŗ£ņ×æņØ╝ 9ņØ╝ļČĆĒä░ 14ņØ╝Ļ╣īņ¦ĆļŖö ņżæļŗ©ĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ 2ņŻ╝ ņØ╝ņĀĢņØä ĒĢ£ ņŻ╝ĻĖ░ļĪ£ ņäżņĀĢĒĢśņŚ¼ ņ┤Ø 6ņŻ╝ĻĖ░ļź╝ ņŗ£Ē¢ēĒĢ£ Ēøä 125 mcg/day (125 mcg/day, 1ĒÜī)ļĪ£ ņĀĆņÜ®ļ¤ē ņ╣śļŻīļź╝ ņ¦ĆņåŹĒĢśņśĆļŗż. ņĀĆņÜ®ļ¤ē ņ╣śļŻī ņØ╝ņĀĢņØĆ ņĀĆņÜ®ļ¤ē ņ╣śļŻī ņŗ£ņ×æņØ╝ 1ņØ╝ļČĆĒä░ 4ņØ╝Ļ╣īņ¦Ć ĒØĪņ×ģ ņ╣śļŻīļź╝ ņ£Āņ¦ĆĒĢśĻ│Ā ĻĘĖ Ēøä ņ╣śļŻī ņŗ£ņ×æņØ╝ 5ņØ╝ļČĆĒä░ 14ņØ╝Ļ╣īņ¦ĆļŖö ņżæļŗ©ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ĒĢ£ ņŻ╝ĻĖ░ļź╝ ņäżņĀĢĒĢśņŚ¼ ņ┤Ø 6ņŻ╝ĻĖ░ļź╝ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņ£╝ļĪ£ Ļ│äĒÜŹĒĢśņśĆļŗż. ĒÖśņ×ÉļŖö GM-CSF Ļ│ĀņÜ®ļ¤ē ĒØĪņ×ģ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśĻ│Ā ņ╣śļŻī ņŗ£ņ×æņØ╝ 8ņØ╝Ļ╣īņ¦Ć ļ│æņøÉņŚÉņä£ Ļ▓ĮĻ│╝Ļ┤Ćņ░░ĒĢ£ ņØ┤Ēøä ļéśļ©Ėņ¦Ć ņØ╝ņĀĢņØĆ ņ¦æņŚÉņä£ ņ£Āņ¦ĆĒĢśĻĖ░ļĪ£ ĒĢśĻ│Ā Ēć┤ņøÉĒĢśņśĆļŗż. 12ņŻ╝Ļ░äņØś Ļ│ĀņÜ®ļ¤ē ĒØĪņ×ģ ņ╣śļŻīĻ░Ć ļüØļéśļŖö ņŗ£ņĀÉņŚÉ ĒÖśņ×ÉļŖö ļ│ĖņøÉ ĒśĖĒØĪĻĖ░ ļé┤Ļ│╝ ņÖĖļלļź╝ ļ░®ļ¼ĖĒĢśņśĆĻ│Ā ļō▒ņé░ ņŗ£ņŚÉļÅä ĒśĖĒØĪĻ│żļ×ĆņØ┤ ņŚåņØä ļ¦īĒü╝ ņŻ╝Ļ┤ĆņĀü ņ”ØņāüņØś ĒśĖņĀäņØä ļ│┤ņśĆļŗż. ĒÅÉĻĖ░ļŖź Ļ▓Ćņé¼ņŚÉņä£ FVC 2.92 L (ņĀĢņāüņśłņĖĪņ╣śņØś 71%), FEV1 2.08 L (ņĀĢņāüņśłņĖĪņ╣śņØś 67%), DLco 15.5 mL/mmHg/min (ņĀĢņāüņśłņĖĪņ╣śņØś 76%)ļĪ£ ļŗżņåī ĒśĖņĀäļÉśņŚłĻ│Ā, ĒØēļČĆ HRCTņŚÉņä£ļÅä ņØ┤ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ļ│æļ│ĆņØś ļ▓öņ£äĻ░Ć ĒśĖņĀäļÉ£ Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż(Fig. 2B). ĒÖśņ×ÉļŖö ņĀĆņÜ®ļ¤ē ĒØĪņ×ģņ╣śļŻīĻ░Ć ļüØļéśļŖö ņŗ£ņĀÉņŚÉ ļŗżņŗ£ ĒĢ£ļ▓ł ļ│ĖņøÉ ĒśĖĒØĪĻĖ░ ļé┤Ļ│╝ ņÖĖļלļź╝ ļ░®ļ¼ĖĒĢśņśĆļŗż. ņÖĖļל ļé┤ņøÉ ļŗ╣ņŗ£ ĒśĖĒØĪ Ļ│żļ×Ć ļō▒ņØś ņŻ╝Ļ┤ĆņĀü ņ”ØņāüņØĆ ļ¬©ļæÉ ĒśĖņĀäļÉśņŚłĻ│Ā ĒÅÉĻĖ░ļŖź Ļ▓Ćņé¼ņŚÉņä£ FVC 2.91 L (ņĀĢņāüņśłņĖĪņ╣śņØś 71%), FEV1 2.18 L (ņĀĢņāüņśłņĖĪņ╣śņØś 71%), DLco 18.2 mL/mmHg/min (ņĀĢņāüņśłņĖĪņ╣śņØś 89%), 6ļČä ļ│┤Ē¢ēĻ▓Ćņé¼ņŚÉņä£ ļ│┤Ē¢ēĻ▒░ļ”¼ļŖö 482 meter ļ░Å ļ│┤Ē¢ē ņżæ ņĄ£ņĀĆņé░ņåīĒżĒÖöļÅäļŖö 95%ļĪ£ ņ╣śļŻī ņĀäļ│┤ļŗż ĒśĖņĀäļÉ£ Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ĒØēļČĆ HRCTņŚÉņä£ļÅä ņ╣śļŻī ņØ┤ņĀä ļ░Å Ļ│ĀņÜ®ļ¤ē ĒØĪņ×ģņ╣śļŻī ņóģļŻī ņØ┤ĒøäņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ļ│æļ│ĆņØś ļ▓öņ£äĻ░Ć ĒśĖņĀäļÉśņŚłņØīņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż(Fig. 2C).
Ļ│Ā ņ░░
ĒÅÉĒżļŗ©ļ░▒ņ”ØņØĆ ĒÅÉĒż ļé┤ņŚÉ Ēæ£ļ®┤ĒÖ£ņä▒ņĀ£Ļ░Ć ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ ņČĢņĀüļÉśļŖö ļō£ļ¼Ė ņ¦łĒÖśņ£╝ļĪ£ 1958ļģä Rosen ļō▒ņØ┤ ņ▓śņØīņ£╝ļĪ£ ĻĖ░ņłĀĒĢśņśĆļŗż[1]. ņ×ÉņŚ░ Ļ┤ĆĒĢ┤ņŚÉņä£ ĒśĖĒØĪļČĆņĀäņ£╝ļĪ£ ņØĖĒĢ£ ņé¼ļ¦ØĻ╣īņ¦Ć ļŗżņ¢æĒĢ£ ņ×äņāüĻ▓ĮĻ│╝ļź╝ ļ│┤ņØ┤ļ®░ ņøÉņØĖņ£╝ļĪ£ļŖö 90% ņØ┤ņāüņØ┤ ĒŖ╣ļ░£ņä▒ņ£╝ļĪ£ GM-CSFĻ░Ć ļ░£ļ│æ ĻĖ░ņĀäņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[1]. 1994ļģä Stanley ļō▒[3]ņØĆ GM-CSFņØś ņĪ░ĒśłĻĖ░ļŖźņŚÉ ļīĆĒĢ£ ņŚŁĒĢĀņØä ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ GM-CSF ņ£ĀņĀäņ×ÉĻ░Ć ņĀ£Ļ▒░ļÉ£ knock-out miceļź╝ ņŚ░ĻĄ¼ĒĢśļŹś ņżæ, knock-out-miceņØś ĒÅÉĒż ļé┤ņŚÉ ņé¼ļ×īņØś ĒÅÉĒżļŗ©ļ░▒ņ”ØņŚÉņä£ ļ│┤ņØ┤ļŖö ĒśĖņé░ņä▒ņØś PAS ņ¢æņä▒ ļ¼╝ņ¦łņØ┤ ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ ņČĢņĀüļÉśņ¢┤ ņ׳ļŖö Ļ▓āņØä ļ░£Ļ▓¼ĒĢśņśĆļŗż. ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ GM-CSFņØś Ļ▓░ņåÉņØ┤ ĒÅÉĒżļīĆņŗØņäĖĒżņØś ĻĖ░ļŖźņØ┤ņāüņØä ņ┤łļלĒĢśĻ│Ā, ņØ┤ļĪ£ ņØĖĒĢ┤ ņĀ£ļīĆļĪ£ ļīĆņé¼ļÉśņ¦Ć ņĢŖņØĆ Ēæ£ļ®┤ĒÖ£ņä▒ņĀ£Ļ░Ć ĒÅÉĒż ļé┤ņŚÉ ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ ņČĢņĀüļÉ£ļŗżļŖö Ļ▓āņØä ņĢīĻ▓ī ļÉśņŚłļŗż[1]. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļōżņØä ĒåĀļīĆļĪ£ ĒÅÉĒżļŗ©ļ░▒ņ”ØņŚÉņä£ļÅä GM-CSFņØś Ļ▓░ņåÉņØ┤ ļ░£ļ│æĻĖ░ņĀäņŚÉ ņ׳ņ¢┤ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņØ┤ļØ╝Ļ│Ā ņĀ£ņŗ£ļÉśņŚłņ£╝ļéś, ĻĖ░Ļ┤Ćņ¦Ć ĒÅÉĒżņäĖņ▓ÖņĢĪņØ┤ļéś ĒśłņĢĪņŚÉņä£ GM-CSF ņ£ĀņĀäņ×ÉņØś Ļ▓░ņåÉņØ┤ļéś ļ╣äņĀĢņāüņĀüņØĖ GM-CSF ļŗ©ļ░▒ņ¦ł ņłśņżĆņØĆ ĒÖĢņØĖļÉśņ¦Ć ņĢŖņĢśļŗż. Kitamura ļō▒[8]ņØĆ 11ļ¬ģņØś ĒÅÉĒżļŗ©ļ░▒ņ”Ø ĒÖśņ×ÉļōżņØś ĒśłņĢĪĻ│╝ ĒÄśĒżņäĖņ▓ÖņĢĪņŚÉņä£ GM-CSFņŚÉ ļīĆĒĢ£ ņ×ÉĻ░Ćļ®┤ņŚŁĒĢŁņ▓┤Ļ░Ć ņĪ┤ņ×¼ĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā, ņØ┤Ļ▓āņØ┤ ĒÅÉņĪ░ņ¦üņŚÉņä£ GM-CSFņØś ņ×æņÜ®ņØä ļ░®ĒĢ┤ĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņØ┤Ēøä ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ļōżņØä ĒåĄĒĢ┤ ņ×ÉĻ░Ćļ®┤ņŚŁĒĢŁņ▓┤Ļ░Ć GM-CSFņØś ņ×æņÜ®ņØä ļ░®ĒĢ┤ĒĢśĻ│Ā ņØ┤ļĪ£ ņØĖĒĢ┤ ĒÅÉĒżļīĆņŗØņäĖĒżņØś ĻĖ░ļŖźņØ┤ ņ¢ĄņĀ£ļÉ©ņ£╝ļĪ£ņä£ Ēæ£ļ®┤ĒÖ£ņä▒ņĀ£Ļ░Ć ņČĢņĀüļÉśĻ▓ī ĒĢ£ļŗżļŖö Ļ▓āņØ┤ ļ░£ļ│æĻĖ░ņĀäņ£╝ļĪ£ ļ░øņĢäļōżņŚ¼ņ¦ĆĻ│Ā ņ׳ļŗż[1].
ĒÅÉĒżļŗ©ļ░▒ņ”ØņØś Ēæ£ņżĆņ╣śļŻīļŖö ņĀäĒÅÉ ņäĖņ▓ÖņłĀļĪ£ ņĄ£ļīĆ 50 LņØś ņāØļ”¼ņŗØņŚ╝ņłśļź╝ ĒÅÉņŚÉ ļäŻņ¢┤ ĒÅÉĒż ļé┤ņŚÉ ņČĢņĀüļÉ£ ļ¼╝ņ¦łņØä ĻĖ░Ļ│äņĀüņ£╝ļĪ£ ņĀ£Ļ▒░ĒĢśļŖö Ļ▓āņØ┤ļŗż[2]. ņĀäĒÅÉ ņäĖņ▓ÖņłĀņØĆ ņĀäņŗĀļ¦łņĘ© ļ░Å ĻĖ░ļÅäņéĮĻ┤ĆņØ┤ ĒĢäņÜöĒĢ£ ņ╣©ņŖĄņĀü ņŗ£ņłĀņØ╝ ļ┐Éļ¦ī ņĢäļŗłļØ╝ ĻĖ░ĒØē, ĒØĪņØĖņä▒ ĒÅÉļĀ┤, ņĀĆņé░ņåīĒśłņ”Ø ļśÉļŖö ĻĖ░Ļ┤Ćņ¦ĆĻ▓ĮļĀ©Ļ│╝ Ļ░ÖņØĆ ĒĢ®ļ│æņ”ØņØś ņ£äĒŚśņØ┤ ņ׳ņ£╝ļ®░ ļŗżņŗ£ Ēæ£ļ®┤ĒÖ£ņä▒ņĀ£Ļ░Ć ņČĢņĀüļÉśņ¢┤ ļ░śļ│ĄņĀüņØĖ ņŗ£ņłĀņØä ĒĢäņÜöļĪ£ ĒĢśĻĖ░ļÅä ĒĢ£ļŗż[2]. ĒÅÉĒżļŗ©ļ░▒ņ”ØņØś GM-CSF ņ×ÉĻ░ĆĒĢŁņ▓┤ņŚÉ ņØśĒĢ£ ļ│æņØĖņØ┤ ļ░ØĒśĆņ¦Ćļ®┤ņä£ ļ¬ćļ¬ć ņŚ░ĻĄ¼ņŚÉņä£ ĒÅÉĒżļŗ©ļ░▒ņ”ØņØś ņ╣śļŻīņŚÉ GM-CSF Ēł¼ņŚ¼Ļ░Ć ņŗ£ļÅäļÉśņŚłļŗż[4,6]. Tazawa ļō▒[6]ņØĆ 39ļ¬ģņØś ĒÅÉĒżļŗ©ļ░▒ņ”Ø ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ 12ņŻ╝Ļ░ä GM-CSF 250 mcg/day ĒØĪņ×ģņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢ£ Ēøä ļŗżņŗ£ 12ņŻ╝Ļ░ä GM-CSF 125 mcg/day ĒØĪņ×ģņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ 24ļ¬ģņØś ĒÖśņ×ÉņŚÉĻ▓īņä£ ņ×äņāüņ”Øņāü, ĒÅÉĻĖ░ļŖź ļ░Å ļ░®ņé¼ņäĀĒĢÖņĀü ĒśĖņĀäņØä ļ│┤ņśĆņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. 24ļ¬ģ ņżæ 17ļ¬ģņØś ĒÖśņ×ÉļōżņØĆ Ļ│ĀņÜ®ļ¤ē ņ╣śļŻīļź╝ ļ░øļŖö ņ┤łĻĖ░ņŚÉ ļ░śņØæņØä ļ│┤ņśĆņ£╝ļ®░ 7ļ¬ģņØś ĒÖśņ×ÉļōżņØĆ ņĀĆņÜ®ļ¤ē ĒØĪņ×ģņ╣śļŻīļź╝ ļ░øņØĆ ĒøäĻĖ░ņŚÉ ļ░śņØæņØä ļ│┤ņśĆļŗż. ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö Tazawa ļō▒[6]ņØś ņŚ░ĻĄ¼ņŚÉņä£ņÖĆ Ļ░ÖņØĆ ļ░®ļ▓Ģņ£╝ļĪ£ GM-CSF ĒØĪņ×ģņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā Ļ│ĀņÜ®ļ¤ē ĒØĪņ×ģ ņ╣śļŻīļź╝ ļ░øļŖö ņ╣śļŻī ņ┤łĻĖ░ņŚÉ ņØ┤ļ»Ė ĒÖśņ×ÉņØś ņ×äņāüņ”Øņāü, ĒÅÉĻĖ░ļŖź ļ░Å ļ░®ņé¼ņäĀĒĢÖņĀü ņåīĻ▓¼ņØ┤ ĒśĖņĀäļÉśĻĖ░ ņŗ£ņ×æĒĢśņśĆņ£╝ļ®░ ņĀĆņÜ®ļ¤ē ĒØĪņ×ģņ╣śļŻīĻ░Ć ņóģļŻīļÉ£ ņ╣śļŻī ņŗ£ņ×æ 24ņŻ╝ ņŗ£ņĀÉņŚÉņä£ļŖö ņ╣śļŻīņ┤łĻĖ░ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ĒÖĢņŚ░ĒĢ£ ĒśĖņĀäņØä ļ│┤ņ×äņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ņÖĖņŚÉļÅä Seymour ļō▒[4]ņØĆ 14ļ¬ģņØś ĒÅÉĒżļŗ©ļ░▒ņ”Ø ĒÖśņ×ÉņŚÉņä£ GM-CSFļź╝ 5 mcg/kg/dayņö® 6ņŻ╝ņŚÉņä£ 12ņŻ╝ ļÅÖņĢł Ēö╝ĒĢśņŻ╝ņé¼ļĪ£ Ēł¼ņŚ¼ĒĢśņŚ¼ 5ļ¬ģņŚÉņä£ ņ×äņāüņ”ØņāüĻ│╝ ļ░®ņé¼ņäĀĒĢÖņĀü ĒśĖņĀäņØä ļ│┤ņ×äņØä ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā. ĻĄŁļé┤ņŚÉņä£ļÅä ņ£äņÖĆ ļÅÖņØ╝ĒĢ£ ņŖżņ╝ĆņżäļĪ£ ĒÅÉĒżļŗ©ļ░▒ņ”ØņØä ņ╣śļŻīĒĢ£ ļ│┤Ļ│ĀĻ░Ć ņ׳ņŚłļŗż[5]. ĒĢśņ¦Ćļ¦ī, GM-CSF Ēö╝ĒĢśņŻ╝ņé¼ Ēøä 6Ļ░£ņøö ņŗ£ņĀÉņŚÉņä£ņĢ╝ ĒśĖņĀäņØä ļ│┤ņŚ¼ ļ│Ė ņ”ØļĪĆņŚÉņä£ņÖĆ Ļ░ÖņØĆ ļ╣ĀļźĖ ļ░śņØæņØĆ ļ│┤ņŚ¼ņŻ╝ņ¦Ć ļ¬╗Ē¢łĻ│Ā Ēł¼ņŚ¼ļČĆņ£äņØś ļČłĒÄĖĻ░É, ņĀäņŗĀĒåĄĻ│╝ ļ░£ņŚ┤Ļ░ÉĻ│╝ Ļ░ÖņØĆ ļČĆņ×æņÜ®ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż[4,5,9].
ļ│Ė ņ”ØļĪĆņØś ĒĢ£ Ļ░Ćņ¦Ć ņĀ£ĒĢ£ņĀÉņØĆ GM-CSFņŚÉ ļīĆĒĢ£ ņ×ÉĻ░Ćļ®┤ņŚŁĒĢŁņ▓┤ļź╝ ņĖĪņĀĢĒĢśņ¦Ć ņĢŖņĢśļŗżļŖö ņĀÉņØ┤ļŗż. ņøÉņ╣Öņāü GM-CSF ĒØĪņ×ģņ╣śļŻīļŖö ņ×ÉĻ░Ćļ®┤ņŚŁĒĢŁņ▓┤Ļ░Ć ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ ņŗ£Ē¢ēļÉśņ¢┤ņĢ╝ ĒĢśļéś ņĢäņ¦üĻ╣īņ¦Ć ĻĄŁļé┤ņŚÉņä£ GM-CSF ņ×ÉĻ░Ćļ®┤ņŚŁĒĢŁņ▓┤ņØś ņĀĢņä▒ņĀü, ņĀĢļ¤ēņĀü ņĖĪņĀĢņØĆ ļČłĻ░ĆļŖźĒĢ£ ņāüĒÖ®ņØ┤ļŗż. ĒĢśņ¦Ćļ¦ī ņØ╝ņ░©ņä▒ ĒÅÉĒżļŗ©ļ░▒ņ”ØņØĆ ļīĆĻ░£ ņ×ÉĻ░Ćļ®┤ņŚŁĒĢŁņ▓┤Ļ░Ć ļ│æņØĖĻĖ░ņĀäņ£╝ļĪ£ ņ×æņÜ®ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳Ļ│Ā, ļ│Ė ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ ļ│æļĀźņ▓ŁņĘ© ļ░Å Ļ▓Ćņé¼ ņåīĻ▓¼ņāü 2ņ░©ņä▒ ĒÅÉĒżļŗ©ļ░▒ņ”ØņØä ņ£Āļ░£ĒĢĀ ļ¦īĒĢ£ ņ¦łĒÖśņØĆ ņŚåļŖö Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņ¢┤ GM-CSF ņ╣śļŻīļź╝ ņŗ£ļÅäĒĢśņśĆļŗż.
ļ│Ė ņ”ØļĪĆļŖö ņĀäĒÅÉ ņäĖņ▓ÖņłĀņŚÉ ĒśĖņĀäņØ┤ ņŚåņ¢┤ GM-CSF ĒØĪņ×ģņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢ£ Ēøä ĒśĖņĀäļÉ£ ņ”ØļĪĆļĪ£ ņØ┤ņĀä ļ│┤Ļ│ĀņŚÉ ņØśĒĢśļ®┤ GM-CSF ņ╣śļŻīĻ░Ć ļ¬©ļæÉ ļüØļé£ ņØ┤ĒøäņŚÉ ĒÖśņ×ÉņØś ņ”Øņāü ļ░Å ĒÄśĻĖ░ļŖźņØ┤ ļŗżņŗ£ ņĢģĒÖöļÉ£ ņśłĻ░Ć ņ׳ņ¢┤[10] ĒØĪņ×ģņ╣śļŻīĻ░Ć ļüØļé£ ņØ┤ĒøäņŚÉļÅä ņ¦ĆņåŹņĀüņØĖ ņČöņĀü Ļ┤Ćņ░░ņØ┤ ĒĢäņÜöĒĢśļ”¼ļØ╝ ņāØĻ░üĒĢ£ļŗż. ņØ╝ļĀ©ņØś ņŚ░ĻĄ¼ļōżņØä ĒåĄĒĢ┤ GM-CSFļź╝ ņØ┤ņÜ®ĒĢ£ ņ╣śļŻīļ░®ļ▓ĢņØ┤ ĻĖ░ņĪ┤ņØś ņĀäĒÅÉ ņäĖņ▓ÖņłĀņØä ļīĆņ╣śĒĢĀ ļ¦īĒü╝ĒÜ©Ļ│╝ņĀüņØ┤ļ®░ ņĢłņĀäĒĢśļŗżļŖö Ļ▓░Ļ│╝ļōżņØä ņ¢╗Ļ│Ā ņ׳ņ£╝ļéś GM-CSFņØś ņĀüņĀłĒĢ£ ņÜ®ļ¤ēņØ┤ļéś ĻĖ░Ļ░ä ĻĘĖļ”¼Ļ│Ā ņןĻĖ░ņĀü ĒÜ©Ļ│╝ ļ░Å ļČĆņ×æņÜ®ņŚÉ ļīĆĒĢ£ ņČ®ļČäĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśņ¢┤ņĢ╝ ļÉĀ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






