간세포암의 복강경하 고주파 소작술 후 천자침 경로를 통한 흉벽 전이 1예
A Case of Needle-Track Implantation of Hepatocellular Carcinoma in the Chest Wall after Laparoscopic Radiofrequency Ablation
Article information
Abstract
저자들은 피막하에 위치한 간세포암에 대해 복강경하 고주파 소작술 치료를 받았던 환자에서 천자침 경로를 통해 흉벽, 늑골, 횡격막 전이를 진단하고, 외과적인 국소 절제술을 통하여 전이암을 제거한 간세포암 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Radiofrequency ablation (RFA) is a popular technique and shows excellent local tumor control and acceptable morbidity. Although RFA is considered much safer than surgical treatment, it is not a complication-free procedure. The most common complications of percutaneous RFA areabdominal hemorrhage, abdominal infection (abscess), biliary tract damage, and ground-pad burns. Laparoscopic RFA (LRFA) is a safe, feasible treatment modality to achieve tumor destruction. LRFA has proven superior to the percutaneous approach for lesions that are difficult or impossible to treat percutaneously. Needle-track implantationafter LRFA is a rare complication in HCCs. We report a case of needle-tract implantation of HCC found in the chest wall, ribs,and diaphragm 11 months after LRFA in a 49-year-old man. Although treatment for needle-track implantation is not well established, the metastatic mass was surgically removed. (Korean J Med 2012;82:326-330)
서 론
일차적으로 수술이 어려운 간세포암에 대한 고주파 소작술 치료는 시술 시간이 짧고 수술에 비해 비교적 덜 침습적이지만 높은 치료 효과를 나타내어 많이 사용되는 방법이다. 이 시술에 의한 합병증으로 복강 내 출혈, 감염, 간농양, 화상, 타 장기 전이, 장천공 등의 합병증이 발생할 수 있다[1]. 반면 복강경하 고주파 소작술은 경피적으로 접근하기 어려운 환자들의 치료에 있어서 안전하고 효율적인 방법임이 입증되고 있다[2-5]. 여러 합병증 중에서 주의해야 할 천자침 경로를 따른 전이는 경피적 고주파 소작술에서는 0.2%에서 4%로 다양하게 보고되고 국내에서도 대망(omentum) [6], 피부 전이[7] 등 증례 보고가 있다. 이에 반해 복강경하 고주파 소작술 후 발생하는 합병증에 대해선 체계적인 조사는 미약하며, 그중 천자침 경로를 따라 전이된 증례 보고는 없다. 저자들은 49세 남자 환자에서 피막하의 간세포암에 대한 치료로 시행한 복강경하 고주파 열치료 후 천자침 경로를 따라 횡격막, 흉벽, 늑골에 전이된 1예를 경험하였기에 이를 보고한다.
증 례
환 자: 이○○, 남자 49세
주 소: 복부초음파에서 우연히 발견된 간의 종괴
현병력: 환자는 15년 전에 C형 간염으로 진단받았지만, 이에 대해 특별한 치료나 정기적인 검사는 시행하지 않았다. 그리고 7년 전 당뇨병으로 진단받고 인슐린으로 치료 중이었다. 당시 환자는 별다른 증상을 호소하지는 않았으며, 개인의원에서 건강검진으로 시행한 복부초음파에서 우연히 간의 종괴가 발견되어 본원으로 의뢰되었다.
과거력: C형 간염 보균자
가족력 및 사회력: 특이소견 없음.
신체 검사 소견: 내원 당시 활력징후는 혈압 126/96 mmHg, 맥박 70회/분, 호흡 20회/분, 체온 36.7℃이었고, 공막 황달이나 국소 림프절 비대는 없었다. 복부는 편평하고 부드러웠으며 장음은 정상이었고 간, 비장의 비대나 복부 종괴는 촉지되지 않았다. 이동탁음이나 하지 부종도 관찰되지 않았다.
검사실 소견: 말초 혈액 검사에서 백혈구 4,820/μL, 혈색소 14.1 g/dL, 혈소판 99,000/μL, PT (INR) 11.7초이었고, 총 단백은 7.1 g/dL, 알부민 3.9 g/dL, 총 빌리루빈 0.8 mg/dL, AST 85 IU/L, ALT 152 IU/L, ALP 197 IU/L였다. 간염 표지자 검사에서 HBsAg 음성, anti-HBs 음성이며, anti-HCV는 양성이었다. 알파태아단백(alphafetoprotein, AFP)은 130 ng/mL로 증가되어 있었다.
방사선학적 소견: 외부 병원에서 시행한 복부전산화 단층촬영에서 간 우엽의 제 8번 구역 피막하에 동맥기에 조영 증강이 잘 되며 문맥기에 조영 감소가 있는 약 1.2 × 0.8 cm 크기의 돌출된 병변이 있었다. 본원에서 시행한 자기공명촬영에서는 T2 강조 영상과 조영제를 사용한 T2 강조 영상에서 고신호 강도를 보였다(Fig. 1A). 위와 같은 검사실 소견과 영상 소견을 바탕으로 간세포암으로 진단하였다.
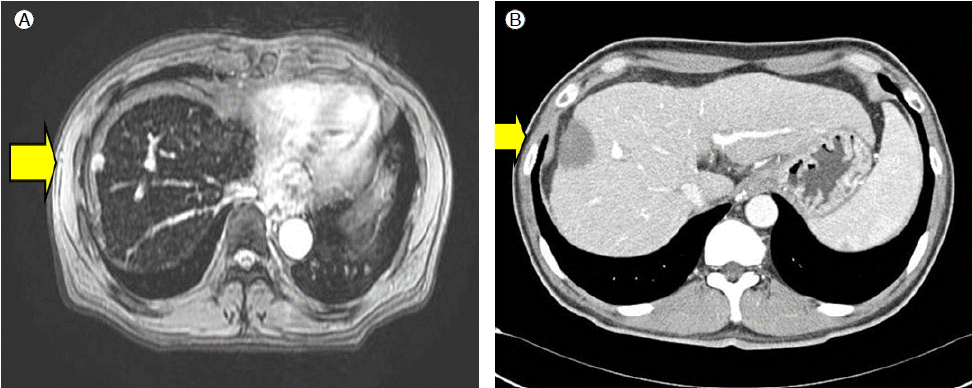
(A) Abdominal MRI (before RFA) shows a low-density 1.2 × 0.8 cm mass. (B) Abdominal CT scan (after RFA) shows a low-density lesion on the portal phase in S8 of the liver.
임상경과 및 치료: 간세포암의 치료를 위해 복강경하에서 고주파 소작술을 시행하였으며, 시술부위에 대한 다른 부작용이 없어서 퇴원하였다. 시술 후 시행한 복부 전산화 단층촬영에서 종양부위의 조영 증강은 없었다(Fig. 1B). 고주파 소작술 시행 4개월 후 알파태아단백은 67 ng/mL로 감소하였고, 복부 전산화 단층 촬영에서도 조영 증강은 관찰되지 않았다. 이후 외래에서 복부 전산화 단층 촬영을 주기적으로 시행하여 재발이 없음을 확인하고 경과관찰하던 중, 고주파소작술 시행 11개월 후 천자 부위인 우측 흉부 아래쪽에서 0.8 × 0.7 cm 크기의 압통이 없는 유동성의 종괴가 만져졌다. 당시 알파태아단백치가 700 ng/mL로 증가하였으며, 흉부 전산화 단층 촬영에서 우측 전측부 흉벽측의 7번과 8번 늑골 사이에 조영 증강되는 연부조직 종괴가 있었다(Fig. 2). 이에 대해 흉부외과에서 흉벽의 종괴와 늑골, 횡격막을 포함한 주위 조직의 절제술을 시행하였다. 육안적으로는 연노랑색의 경계가 불명확한 종괴였으며(Fig. 3A), 조직검사에서는 hepatocyte anti-human, alpha-fetoprotein에 대한 면역조직화학염색 결과 양성이었다(Fig. 3B). 이상의 경과를 종합하여 복강경하 고주파 소작술 시행 후 천자침 경로를 통한 전이성 간세포암으로 진단하였다. 현재 알파태아단백이 16 ng/mL로 감소되었으며, 복부 전산화 단층촬영에서는 재발이 없어 추적 관찰 중이다.
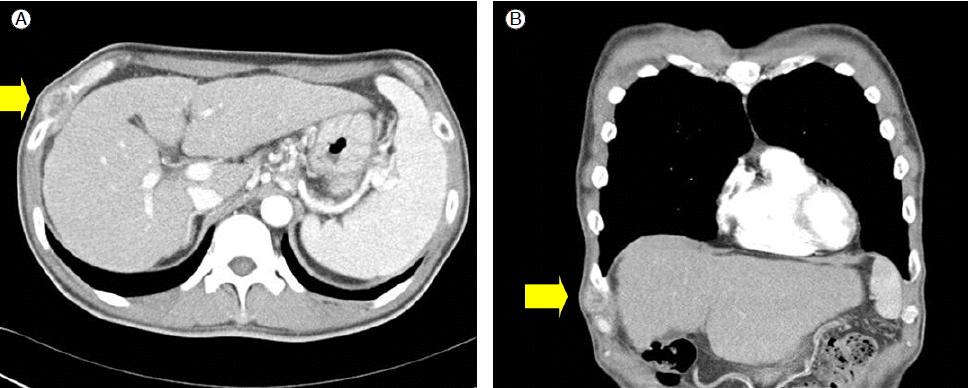
Abdominal CT (11 months after RFA) showing a 1.5 × 0.8 cm round mass with arterial enhancement in intercostal space 7-8 at 11 months after RFA (A: plane scan, B: coronal CT scan).
고 찰
고주파 소작술 치료는 전극을 통해 발생한 고주파로 열을 발생시켜 세포를 응고 괴사시키는 국소적 치료법 중의 하나이다. 이는 수술과 비교하여 정상 간 조직의 손실이 적고 시술이 비교적 간편한 이점이 있다. 최근 연구에서 간 절제 환자와 5년 생존율이 비숫하다는 보고가 있으며, 특히 3 cm 이하 종양의 경우 근치적 치료로서 각광을 받고 있다[8].
다기관 연구에 따르면, 경피적 고주파 소작술의 합병증은 2.3%에서 5% 정도 발생하는 것으로 알려져 있다. 그중에서 복강내 출혈(0.46-0.5%), 간 농양(0.3-2%), 담즙낭종(0-0.2%), 피부 화상(0.2-1.4%), 기흉(0.2-0.8%), 장천공(0.2-0.3%), 그리고 천자침 경로를 통한 전이(0.3-2.8%) 등이 보고되고 있다[1,9].
경피적으로 접근하기 어려운 간세포암에 대해서 경피적 고주파 소작술에 따른 부작용을 최소화하기 위해 최근 복강경하 고주파 소작술이 시행되고 있으며, 이의 안정성과 효율성에 관한 다양한 보고들이 있다. 복강경을 이용한 시술은 복강내의 관찰이 용이하여, 특히 간세포암과 근접한 장, 신장, 담낭 그리고 횡격막에 손상 없이 소작술을 시행할 수 있다. 그리고 시술 후 발생할 수 있는 출혈과 같은 합병증을 직접 확인하여 조치할 수 있어 시술에 따른 부작용을 줄이고, 빠른 회복과 짧은 재원기간 등의 장점이 있다[3]. 또한 복강경 초음파를 이용하였을 때 시술 전 검사상에서 발견하지 못하는 새로운 병변도 확인이 가능하다.
복강경하 고주파 소작술에 대한 적응증은 경피적 초음파로 확인이 어려운 심부에 위치한 종괴의 경우, 병변이 타 장기와 근접거나 표면에 위치한 경우, 수 차례의 천자를 필요로 하는 큰 종괴나 다수의 종괴가 있었던 경우, 출혈의 위험이 높은 환자의 경우 등이 해당된다[2,4]. Jung 등[10]도 복강경을 이용하여 표면에 위치한 종괴, 심부에 위치한 종괴 등을 대상으로 효율적인 고주파 소작술을 시행하였다. Casaccia 등[3]은 간의 둥근천정(liver dome)에 위치한 제 4, 7, 8번 엽에 위치한 간세포암은 기술적인 접근이 필요하여 복강경을 이용하는 것이 효과적인 치료방법이라고 언급하였다.
Santambrogio 등[4]은 경피적 고주파 소작술이 어려운 환자 86명의 환자의 127개 병소에 대한 복강경하 고주파 소작술 치료 결과를 발표하였다. 71%의 환자들이 합병증 없이 시술을 마쳤으며, 평균 14개월의 추적 관찰 기간동안 86%에서 완전 관해를 보였고, 3 cm 이하 크기에서는 92%의 완전 관해율을 보였다. 그리고 경피적 전이는 3 cm 이상 크기의 큰 간세포암을 지닌 1명에서만 발생하였다고 보고하였다. Asahina 등[5]은 92명의 복강경하 고주파 소작술과 1,333명의 경피적 고주파 소작술을 비교한 연구를 발표하였다. 3년 생존율에서 복강경을 이용한 시술에서는 81%인데 반해 경피적 시술에서는 61%로 두 군 간에 차이를 보인다고 보고하였다. 그리고 합병증에서도 인접장기의 손상이 거의 없으며, 종양의 전이(tumor dissemination)는 경피적 고주파 소작술에선 4명(0.3%)인데 반해 복강경하에선 발생하지 않았다.
경피적 고주파 소작술 치료 후 천자침 경로를 통한 전이의 빈도가 0.2%에서 4%까지 다양하게 보고되고 있다[11]. 국내의 단일 기관의 보고는 800예의 경피적 고주파 소작술 치료 중 5예에서 전이를 보고하였다. 이는 국내에서 205명의 초음파 유도하 침생검 환자 중 7명인 3.4%에서 천자침 경로를 통한 전이를 보고한 연구에 비하면 낮은 비율이다[12]. 반면 Llovet 등[13]은 전이의 빈도를 12.5%까지 높게 보고하였는데 모든 종양이 피막하에 존재하였다고 보고하여, 본 증례처럼 피막하 종양에 대해선 경피적 고주파 소작술로 치료하기에는 어려움이 있다.
천자침 경로를 통한 전이의 기전으로 여러 가지 가설이 제안되고 있다. 암세포가 조직검사용 바늘이나 치료용 전극에 묻거나 출혈을 통해 천자침 경로에 전이될 수 있다. 시술 중 종괴안의 압력증가(intratumoral hyperpressure)로 인하여 천자침 경로로 밀려날 수도 있으며, 시술 전후로 종괴안으로 주입하는 식염수에 의해서 암세포가 탈락할 수도 있다. 천자침 경로를 통한 전이에 영향을 주는 요인으로는 바늘의 통과 횟수, 피막하 등의 종양의 위치, 간세포암의 크기, 조직학적 분화도, 고주파 소작술 치료 전 조직검사, cool-tip needle의 사용, 환자의 면역 상태 등을 들 수 있다[14].
Asahina 등[5]은 복강경하 고주파 소작술에서 복벽, 간 실질과 같은 두 지점은 천자침을 삽입하는 것이 기술적으로 난해하여 여러 번 천자하는 것을 피할 수 있는 기술이 필요하다고 언급하였다. 그리고 종양의 전이를 막기 위한 방법으로 종양의 직접적인 천자를 피하고 정상 간 조직을 통하여 삽입해야 한다고 하였다.
간세포암에 대한 고주파 소작술 치료 또는 경피 생검 후 발생한 천자침 경로의 전이에 대한 진단에 있어서 역동학적 전산화 단층 촬영이 도움이 되나, 간세포암과는 다른 영상학적 특징을 지닌다. 전이된 병변은 동맥기에 천자침 경로를 따라서 조영 증강되는 원형 또는 타원형의 모양을 보이고, 간세포암에서 볼 수 있는 지연기의 조영 감소는 대부분의전이암에서는 보이지 않는다. 이는 간세포암과는 다르게 이중혈류공급(dual supply)이 없기 때문이다[15].
천자침 경로를 통한 전이에 대한 치료로 명확하게 정립된 것은 없지만, 대부분의 경우에 수술적 절제가 우선적으로 이루어지고 있다. 수술적 치료와 병행하여 방사선 치료도 보고되고 있다[6,16].
최근 고주파 소작술 치료가 수술을 대신하여 시술 및 적용범위가 증가하고 있다. 경피적인 접근이 어려운 경우 복강경을 이용함으로써 고주파 소작술의 치료범위가 확대되고 있다. 고주파 소작술로 인한 전이는 드물지만, 전이에 대한 치료로 수술적 절제가 가능하므로 전이를 일으킬 위험인자를 인식하여 환자 및 치료 방법 선택에 주의하고, 또한 추적 관찰을 통해서 원발종양부위뿐만 아니라 천자침 경로부위에서의 전이 발생 여부에도 주의를 기울여야 한다.
