현대를 살아가는 사람들 중 스트레스로부터 자유로운 사람은 없을 것이다. 스트레스의 종류는 여러 가지가 있지만 사회가 복잡해지고, 감정적 반응을 해야 하는 상황이 많아지면서 사회적 또는 정신적 스트레스가 일반화되고 있다. 스트레스가 질병의 원인이라는 주장은 일찍이 19세기 말부터 있었으며[1], 1930년대 후반에는 Hans Selye가 스트레스에 의해 유발되는 신체의 변화를 처음으로 체계화하였다. 그는 동물실험에서 외상, 열 및 냉온도와 같은 외부자극, 즉 스트레스를 받은 동물이 뇌하수체와 부신피질에서 나타내는 생물학적 반응을 관찰하여 “일반적응증후군(general adaptation syndrome)”을 발표하였으며, 특히 스트레스 상황에서의 동물의 반응을 단계별로 설명하였는데, 처음에는 공포 혹은 불안(alarm) 단계에 있다가 이후 적응(adaptation) 단계로, 그 다음 피로(exhaustion) 단계로 진행한다고 하였다. 처음 불안상태에서는 집중력이 증가하고 적응 단계에서는 교감 신경 및 hypothalamus-pituitary-adrenal axis (HPA 축)의 활성화를 통한투쟁 혹은 도주반응(flight or fight response)을 보이지만, 이와 같은 신경생리학적 반응은 계속 지속될 수 없으며 결국 피로상태로 들어간다는 것이다[2]. 이러한 스트레스에 대한 개체의 생리 변화에 대한 개념은 현재까지도 이어지고 있으며, 기능성 소화관운동 질환의 병태생리를 이해하는데 근간이 되고 있다.
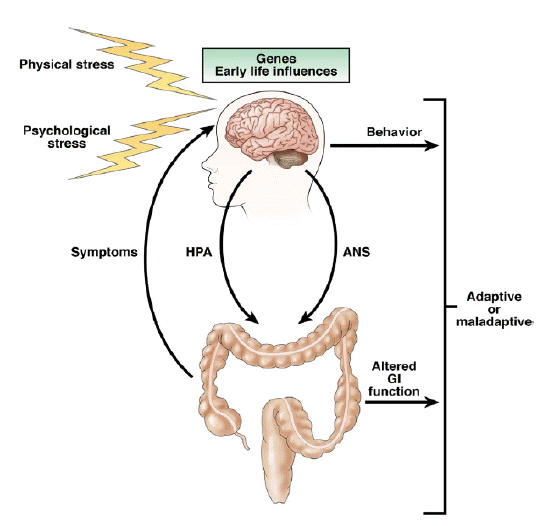
과민성 장증후군(irritable bowel syndrome, IBS)은 아직 발병기전이 확실하지 않지만, 여러 연구 결과 스트레스가 증상의 발생 및 악화에 많은 영향을 준다는 것이 알려져 있다. 생애초기의 부정적 사건(early adverse life events)이란 부모나 보모와의 잘못 형성된 관계, 심한 질병, 부모의 사망, 물리적 학대 혹은 성적이거나 감정적 학대와 같은 경험들을 일컫는 말인데, 과민성 장증후군 환자들 중 이를 경험한 환자들이 많으며[3,4], 특히 출생 전과 임신 20주 이후부터 분만 28일 사이인 주산기의 불안이나 동요가 어른이 되어 발생하는 과민성 장증후군에 영향을 준다고 하였다[5]. 또한 만성 스트레스는 급성 스트레스와는 달리 개체의 스트레스 반응 시스템에 변화를 초래하여[6] 신경내분비적 기능장애를 유발하기 때문에 과민성 장증후군과 같은 기능성 질환이 발생한다고 하는 주장도 있다(Fig. 1) [7]. 이번 종설에서는 스트레스에 의한 신경, 내분비적 변화 및 이에 의한 소화기관의 생리학적 변화에 대하여 알아보고자 한다.
과민성 장증후군 환자에서의 자율신경계 및 hypothalamus-pituitary-adrenal 축의 생리적 변화
자율신경계의 변화
우리 몸의 신경계는 크게 중추신경계(central nervous system)와 말초신경계(peripheral nervous system)로 분류되며, 자율신경계는 12쌍의 뇌신경(cranial nerve) 및 31상의 척수신경(spinal nerve)로 이루어진 체성 신경계(somatic nervous system)과 함께 말초신경을 구성하고 있다. 그런데 소화기관에는 또 다른 신경계인 장신경계(enteric nervous system)가 존재한다. 장신경계는 자율신경계의 한 갈래로, 척수보다 많은 수의 뉴런(neuron; 신경원)을 갖고 있으며, 뇌와 척수로부터 뻗어나온 많은 자율신경의 분포를 받고 있지만 독자적으로 활동할 수 있다는 특징을 갖고 있다.
자율신경은 중추신경계과 장신경계의 상호작용(brain-gut interaction)을 매개하여 위장관의 운동, 분비, 면역기능을 조절하는 역할을 하는데[8], 이러한 자율신경계의 불균형이 과민성 장증후군 환자의 증상을 유발할 수 있다는 가설은 이미 1928년에 보고된 바 있다[9]. 스트레스를 받았을 때 나타나는 교감신경계의 활성화와 부교감신경의 둔화가 일시적이지 않고 지속되는 것이 가장 흔한 과민성 장증후군 환자의 자율신경계 이상이며[10,11], 이는 성별에 따라[12,13], 그리고 주 증상이 설사인지 또는 변비인지에 따라 다르게 나타났다[14]. 그러나 정신적 스트레스하에서 과민성 장증후군 환자의 혈중 norepinephrine 수치의 의미 있는 변화가 없었고[15,16], 대중 앞에서 연설하는 정신적 스트레스 상황에서 과민성 장증후군 환자와 일반인 사이에 혈압 및 맥박수 변화의 차이가 없는 등[17] 가설과 반대되는 결과도 있었다. 따라서 이와 같은 상반되는 연구결과를 고려할 때 자율신경계 이상은 과민성장증후군 환자의 전체가 아닌 일부의 병태생리일 가능성을 생각할 수 있겠다.
HPA 축의 변화
사람은 스트레스를 받으면 시상하부(hypothalamus)의 뇌실곁핵(paraventricular nucleus)에서 corticotropin releasing factor (CRF; corticotropin releasing hormone의 다른 이름) 가분비되며, CRF는 뇌하수체에서 adrenocorticotropin hormone (ACTH)를 ACTH는 부신 피질을 자극하여 cortisol의 분비를 유도한다. 따라서 과민성 장증후군의 발생이 스트레스와 관련되어 있다면 CRF, ACTH, cortisol과 같은 호르몬의 불균형이 증상 발생과 관련되어 있을 수 있을 것이다. 실제 연구에서도 과민성 장증후군 환자의 기저 cortisol치가 증가되어 있었고[18,19], 물리적 및 호르몬 자극에 HPA 축이 과도한 반응을 보이는 등[20,21] 호르몬의 불균형 및 이상반응을 나타내었다. 또한 과민성 장증후군 환자들이 많이 호소하는 생애초기의 부정적 사건이 HPA 축의 기능에 영향을 미치는 요인으로 알려져 있는데, 어렸을 때 부모를 여의거나, 성적 학대를 당했던 경험이 있는 환자 및 정상인의 경우 그렇지 않은 대조군에 비해 외부자극에 대한 cortisol의 반응이 증가되어 있었으며[22,23], 이는 스트레스 상황에서 정상인에게 나타나는 cortisol의 glucocorticoid 수용체에의 음성 되먹임(negative feedback)이 감소되기 때문이라고 하였다[24]. 따라서 스트레스의 신체반응을 매개하는 HPA 축은 과민성 장증후군 환자의 증상 발생 및 악화에 중요한 역할을 한다고 할 수 있겠다.
위장관 운동성의 변화
분노, 공포, 통증, 심한 운동 등의 급성 스트레스는 음식물의 위배출을 지연시키고[25,26], 대장 운동을 촉진한다[26]. 그렇지만 만성 스트레스는 처음 1-2일간 대장운동을 의미 있게 증가시키나, 이후 대장의 운동성이 점점 감소하여 5일째 정상으로 회복되는 등[27] 급성 때와는 다른 양상을 나타낸다. 스트레스에 대한 장운동의 변화는 CRF가 중요한 역할을 하는 것으로 알려져 있다. CRF가 시상하부의 뇌실곁핵과 경핵복합체(dorsal vagal complex)의 CRF 수용체에 반응하면 근육층에 분포해 있는 교감신경, 미주신경 및 골반 부교감 신경(pelvic parasympathetic nerve)를 포함한 장신경계가 활성화되어[28] 위장관 운동을 변화시킨다[29,30].
이와 같이 스트레스에 의해 활성화되고 CRF에 매개되는 뇌-장관 신경계의 상호작용은 기능성 장질환, 특히 과민성 장증후군의 발병기전 중 하나로 추정되고 있다. 과민성 장증후군은 설사와 변비 등 장운동성의 변화가 전형적 증상이며, 장운동의 변화를 유발하는 생애초기의 부정적 사건, 장염과 같은 스트레스와 밀접한 관계를 보이고[31,32], 안정 시에 대장 운동이 정상인에 비해 증가되어 있을 뿐 아니라 분노자극 시 장운동을 유발시키는 spike potential activity가 증가되는 등 스트레스에 의한 생리학적 변화와 일치하는 현상을 보인다[33].
장투과도의 변화
동물실험에서 스트레스는 장투과도를 증가시킨다. 특히 속박스트레스(restraint stress)는 [3H] mannitol과 [51Cr]-labeled EDTA의 장투과도를 증가시키는데 각각 세포횡단(transcellular) 및 세포간(paracellular) 투과도의 증가를 의미한다[34]. 스트레스에 의한 장투과도 변화에는 비만세포(mast cell)와 CRF가 중요한 역할을 한다고 알려져 있다. 수조 한가운데 작은 발판을 설치하고 이위에 실험동물을 위치시켜 공포심을 갖게하는 water avoidance stress (WAS)는 분자량이 큰 horseradish protein의 장투과도 증가를 유발하였으나, 비만세포가 결핍된 mice에서는 이러한 결과가 나타나지 않았다[35]. 또한 CRF를 정맥주사하면 실험동물의 장투과도는 의미 있게 증가하는데, 이는 CRF 길항제에 의해 억제되는 현상을 보였다[36].
장투과도가 증가하면 어떤 문제가 생기는가? 지금까지의 연구 결과에 따르면 장투과도의 증가는 설사를 포함한 장기능의 변화를 초래한다. 증상이 없던 크론병 환자들은 증상이 재발하기 이미 1년 전부터 장투과도가 증가되어 있었으며[37], celiac disease는 발병 초기에 장점막 세포사이를 연결하는 밀착연접(tight junction)이 열리면서 설사를 유발하는 gliadin을 비롯한 여러물질들이 체내로 흡수되는 것이 보고되었고[38], 쥐실험에서 장점막 T lymphocyte의 활성화에 의해 상피의 밀착연접이 붕괴되면 설사가 발생한다고 하였다[39]. 따라서 장점막의 투과도 증가는 설사 등의 증상이 발생하기 위한 필요조건이라 할 수 있겠다.
일반적으로 과민성 장증후군 환자의 장투과도는 증가되어 있으나 아형에 따라, 즉 설사형인지 변비형인지에 따라 다른 결과를 보인다. lactulose/mannitol의 비로 장투과도를 평가한 연구에서 설사형과 감염 후 과민성 장증후군 환자의 근위부 소장 장투과도가 정상인에 비해 증가되어 있었으며[40,41], 설사형 과민성 장증후군 환자로부터 채취한 대장 생검조직의 투과도 역시 증가되어 있었고[42], 동시에 밀착연접의 주요 단백질의 감소와 과민성 장증후군의 대표증상인 복부통증이 연관성을 보였다[43]. 이와 같은 장투과도의 증가는 동물실험에서와 마찬가지로 CRF에 의해 활성화되는 비만세포가 중요한 역할을 할 것으로 생각되고 있다[44,45].
내장 과민성(visceral hypersensitivity)
정신적 스트레스를 받게 되면 내장이 민감해 진다는 사실은 여러 연구를 통해 밝혀진 바 있다. 직장결장팽창(colorectal distension, CRD)이란 직장에 풍선을 위치시킨 다음 풍선을 부풀리면서 통증으로 도저히 참을 수 없을 때의 풍선 압력을 측정하여 감각의 역치를 구하는 방법인데, 정상 자원자에게 정신적 스트레스를 가하고 CRD검사를 하면 감각의 역치가 매우 낮아지며, 이러한 현상은 스트레스가 끝난 후에도 1시간 정도 지속되었다[46]. 동물 실험에서도 마찬가지로 Wistar rat에게 water avoidance stress를 주면 24시간 후 CRD검사결과 내장과민성을 나타내었으며[47], 이보다 더 강한 정신적 스트레스인 구속 스트레스(restraint stress)를 2시간 가하면 내장 과민성이 즉각 발생하였다[48,49]. 또한 만성 스트레스로서 WAS를 매일 1시간씩 10일간 계속 주면, 스트레스 후에도 최장 30일까지 내장 과민성이 유지되어 스트레스 지속기간에 따라 내장 민감도가 더 오래 유지되는 결과를 보였다[50,51].
결 론
만성 스트레스는 체내 자율신경 및 HPA 축의 지속적인 과잉반응을 유도해 이상반응을 초래하고 결국 기능성 소화관기 질환이 발생하기 쉬운 상태로 진행하게 되며, 이미 기능성 질환을 갖고 있는 환자의 증상을 악화시키는 역할을 한다. 만성 스트레스 중 대표적인 예로는 성적, 물리적 학대, 최근에 문제가 되고 있는 왕따와 같은 생애초기의 부정적 사건이 있으며, 이러한 사건들은 그 당시의 문제로 끝나는 것이 아니라 생애 전반에 걸쳐 정신적, 신체적으로 부정적인 영향을 미치고 있으므로 사회적으로 적절한 대책을 세우는 것이 치료약의 개발만큼 중요하다고 할 수 있겠다. 또한, 향후 이러한 스트레스에 유난히 취약한 환자를 미리 선별할 수 있는 위험인자 및 유전자에 대한 연구가 활성화된다면 기능성 소화기 질환의 조절 및 예방에 도움이 될 것으로 생각한다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






