간경변 환자의 관리
Management of Liver Cirrhosis
Article information
Trans Abstract
Liver cirrhosis has distortion of the hepatic architecture and the formation of regenerative nodules due to progressive hepatic fibrosis. Treatment of underlying etiology can slow or reverse the progression of liver fibrosis. Early stage is characterized by asymptomatic phase, termed ‘compensated cirrhosis’ follwed by the development of complications of portal hypertension and/or liver dysfunction, termed ‘decompensated cirrhosis’. The quality of life and survival of patients with cirrhosis can be improved by prevention and treatment of these complications. This review discuss the complication and its management in patients with liver cirrhosis. (Korean J Med 2012;82:159-163)
서 론
간경변의 초기에 대개 증상이 없는 경우를 대상성 간경변증이라고 하며 황달 복수, 정맥류 출혈, 간성뇌증, 자발성복막염, 간신증후군 등 한 가지 이상의 합병증을 나타내는 경우를 비대상성 간경변증이라고 한다. 간경변증의 중증도를 평가하는데 보편적으로 Child-Pugh 분류를 사용하는데 Child-Pugh B/C 등급이 비대상성 간경변증에 해당된다.
간경변증의 원인 질환을 적극적으로 치료함으로써 간섬유화의 진행을 막거나 의미 있게 호전시킬 수 있다. 만성 B형간염에 의한 간경변증 환자에서 바이러스 증식이 있는 경우 항바이러스제 치료가 필요하며, 만성 C형간염으로 인한 간경변증 환자에서 페그인터페론과 리바비린 병합요법이 도움이 된다. 알코올성 간경변증 환자에서 엄격한 금주는 질환의 악화를 막을 수 있으며 비알코올성 지방간질환에서 체중감량, 식이요법, 운동 등의 생활습관 개선이 필요하다.
이번 강의에서는 비대상성 간경변증에서 발생하는 합병증에 대한 치료 및 관리방법에 대해 알아보고자 한다.
본 론
정맥류
진단
식도정맥류는 Child-Pugh A 등급 간경변증 환자의 약 40%에서 발견되며, Child-Pugh C 등급에서는 약 80%에서 동반되어 있다. 출혈의 위험도는 정맥류의 크기와 내시경상 적색증후 및 간기능 부전의 정도(Child-Pugh class)와 관련이 있다[1]. 모든 간경변증 환자는 처음 진단될 때에 정맥류의 존재 여부를 확인하고 출혈의 위험도를 평가하기 위해 내시경검사를 시행하여야 하며 모양과 크기에 따라 작은 정맥류(F1)와 큰 정맥류(F2, F3)로 분류하며 적색증후 유무를 파악해야 한다. 대상성 간경변증 환자는 2-3년마다 내시경 검사를 시행하여 정맥류 발생을 확인하며, 비대상성 간경변증 환자는 1-2년마다 내시경 검사를 시행하는 것을 권장한다. 단, 내시경 검사의 빈도는 간질환의 원인과 진행 정도를 고려하여 조정할 수 있다.
식도정맥류 초출혈 예방
출혈한 적이 없는 큰 정맥류(F2, F3)가 관찰된 경우 식도정맥류의 초출혈을 예방하기 위해 비선택 베타차단제를 사용하거나 내시경 정맥류 결찰술(endoscopic variceal ligation, EVL)을 시행할 것을 권장한다. 출혈한 적이 없는 작은 정맥류가 관찰되면서 출혈의 고위험군(Child-Pugh class B/C, 내시경 적색증후)인 경우 출혈 예방을 위해 비선택적 베타차단제의 사용을 고려한다. 비선택적 베타차단제는 안정 시 심박동수가 25% 감소하거나 분당 55회에 이를 때까지 혹은 부작용이 발생할 때까지 용량을 조절한다. 비선택적 베타차단제를 사용하지 않는 작은 정맥류를 가진 대상성 간경변증 환자는 2년마다 내시경 검사를 시행하여 정맥류의 진행 정도를 확인할 것을 고려한다.
급성 식도정맥류 출혈
급성 식도정맥류 출혈은 문맥압 항진증이 의심되는 환자에서 내원 전 24시간 내에 토혈이나 지속적인 흑색변이 있었던 경우를 말하며 내시경 검사에서 정맥류로부터 활동성 출혈이 관찰되거나 정맥류 표면에 혈괴나 백태가 붙어있는 경우 또는 식도정맥류 외 다른 잠재적인 출혈의 원인이 발견되지 않으면 정맥류 출혈로 진단할 수 있다.
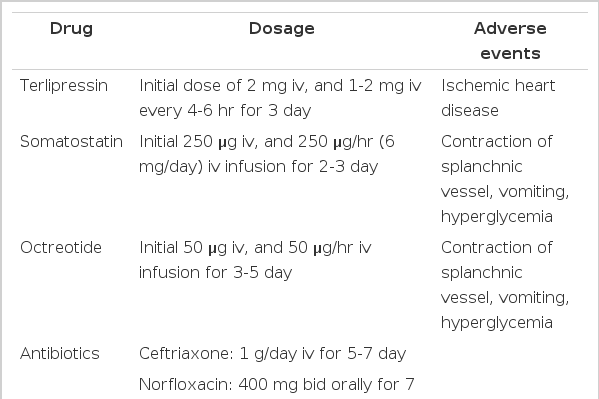
급성 식도정맥류 출혈 환자는 1차 치료로 혈관수축제와 내시경 치료를 권장한다[2]. 내시경 치료로는 EVL이 권장된다. 혈관수축성 약제는 terlipressin, somatostatin, somatostatin analogue가 사용되며 vasopressin은 부작용이 많아 현재는 권장되지 않는다. 항생제는 내시경 치료에 동반하는 균혈증과 재출혈을 예방하므로 5-7일간의 투여를 권장한다[3] (Table 1). 경경정맥 간내문맥전신 단락술(transjugular intrahepatic portosystemic shunt, TIPS)은 약물과 내시경 치료에 실패하였거나, 내시경 치료가 가능하지 않은 경우 고려한다.
식도정맥류 재출혈의 방지
급성 식도정맥류 출혈 후 1-2년 내에 평균 60% 정도에서 재출혈이 발생하며 이로 인한 사망률이 33%에 달하므로 재출혈 방지를 위한 치료가 필요하며 EVL 또는 비선택적 베타차단제를 사용할 수 있으며 EVL과 비선택적 베타차단제의 병합요법이 가장 좋은 방법이다. TIPS는 Child-Pugh A 또는 B등급 환자에서 상기 치료가 실패한 경우 구조 치료로 고려할 수 있다.
위정맥류
위정맥류는 문맥압 항진증 환자의 약 20%에서 발생하며 식도정맥류보다 심한 출혈을 유발하고 재출혈이 더 많이 발생한다. 위저부 정맥류(fundal varix), 간기능의 심한 저하, 적색증후 및 정맥류의 크기가 큰 경우에 초출혈의 위험이 더 높다[4]. 위정맥류는 위식도정맥류(gastroesophageal varices, GOV)와 단독 위정맥류(isolated gastric varices, IGV)로 나뉜다. GOV는 동반된 식도정맥류가 위의 소만을 따라 확장된 경우(GOV1)와 위저부로 확장된 경우(GOV2)로 나뉘며, IGV는 독립된 정맥류가 위저부에 위치한 경우(IGV1)와 그외 다른 부위인 위전정부 또는 십이지장에서 관찰되는 경우(IGV2)로 나뉜다.
GOV1은 EVL을 시행하며 내시경정맥류 폐색술(endoscopic variceal obturation, EVO)도 시행할 수 있다. GOV2와 IGV는 주로 EVO를 우선적으로 시행한다. 내시경적 치료가 불가능할 경우에는 TIPS를 시행할 수 있으며 위신단락이 동반된 경우에는 풍선-폐쇄 역행 경정맥 폐쇄술(balloon occluded retrograde transvenous obliteration, BRTO)을 시행할 수 있다.
문맥압 항진 위병증
내시경 검사에서 뱀 피부 모양 또는 모자이크 모양의 위점막 변화가 관찰되면 진단할 수 있다. 위점막 변화만 관찰되는 경증에 비해서 위점막 변화 소견과 함께 적색 또는 흑갈색 점성변화가 함께 나타나는 중증 문맥압 항진 위병증에서는 만성 출혈을 더 잘 일으킨다. 만성 출혈이 있는 경우에는 문맥압 항진증을 낯추기 위해 비선택적 베타차단제를 투여한다.
복수
복수의 진단
중등도 이상의 복수가 새로 발생한 경우, 복수를 주소로 입원한 경우, 자발성 복막염이 의심되는 경우, 간성뇌증 및 신기능 악화 등이 심해진 경우에 복수천자를 시행하여야 한다. 복수천자시에 혈구 수와 혈구 분획, 알부민, 총 단백질 검사를 포함하여야 하며, 천자 즉시 혈액배양 용기에 배양을 권장한다. 복수 검사에서 혈청-복수 알부민 차(serum- ascites albumin gradient, SAAG)가 1.1 g/dL 이상이면 문맥압 항진증에 의한 복수로 진단할 수 있다.
간경변성 복수의 치료
염분 섭취량은 하루 5 g 이하로 권장한다. 그러나 저염식에 순응하지 못하는 환자는 적당량의 염분을 허용하면서 이뇨제를 증량하여 복수를 조절한다. 간경변성 복수 환자에서 일차적으로 사용되는 이뇨제는 알도스테론 길항제이며, 루프 이뇨제를 병합하여 사용할 수 있다. Spironolactone은 하루 50-100 mg으로 시작하여 최대 400 mg까지 사용할 수 있으며, 이뇨 효과를 높이고 정상 칼륨 농도를 유지하기 위해서 처음부터 furosemide를 20-40 mg 용량으로(100:40 비율) 병합하여 사용한다. 말초 부종이 있는 경우 하루 1 kg, 부종이 없는 경우 하루 0.5 kg의 체중감량을 목표로 한다. 혈청 나트륨이 125 mEq/L 이하로 감소하거나, 혈청 크레아티닌 상승(1.5 mg/dL 이상), 뚜렷한 간성뇌증의 발병 및 근육경련이 발생할 경우에는 이뇨제를 중단한다. 긴장성 복수 환자에서는 대량 복수천자(보통 4-6 L)를 시행할 수 있다. 대량 복수천자를 시행할 때, 순환장애 발생을 막기 위해 복수천자량 1 L당 8-10 g의 알부민을 투입을 권장한다.
난치성 복수
염분제한과 최대량의 이뇨제(spironolactone 400 mg/일, furosemide 160 mg/일)의 사용에도 불구하고 복수가 조절되지 않거나 이뇨제의 합병증으로 인해 충분한 용량의 이뇨제를 투여하지 못해 복수 조절이 되지 않는 경우를 말한다. 난치성 복수의 치료로 대량 복수천자, TIPS를 시행할 수 있다. 난치성 복수 환자는 예후가 매우 불량하므로 간이식을 권장한다.
간신증후군
내장동맥의 확장으로 인해 순환하는 유효혈액량의 감소로 인해 신장으로 유입되는 혈류량의 감소로 기능적인 신기능의 장애를 유발한다. 유효혈액량을 보충하여도 회복되지 않고 진행하는 간신증후군 1형과 비교적 서서히 진행하면서 중등도 이상의 신기능 이상을 보이는 간신증후군 2형으로 구분된다. 1994년 International ascites club에서 처음으로 간신증후군의 진단 기준을 제시한 이후, 최근 2007년에 보다 명확하고 단순화한 개정된 진단 기준을 발표하였다[5] (Table 2).
혈관수축제를 사용하여 확장된 내장동맥을 수축시키거나 혈장확장제를 사용하여 유효 혈액량을 증가시켜 신혈류를 개선시킬 수 있다. 혈관수축제로는 terlipressin, octreotide, midodrine 등이 이용된다. 혈장 확장제로서의 알부민 단독 치료는 효과가 미미하므로 혈관수축제와 병용하였을 때 치료효과가 증대될 수 있다. 자발성 세균성 복막염 환자에서 알부민 및 항생제를 사용하면 간신증후군의 발생을 줄일 수 있다[6]. 간이식만이 현재 간신증후군 환자에게서 유일하게 장기 생존율을 증가시킬 수 있다.
자발성 세균성 복막염
복수를 동반한 간경변증 환자에서 뚜렷한 감염의 원인이 없이 발생한 복수의 세균감염을 의미한다. 복수천자 검사에서 복수의 다형핵 호중구가 250/mm3이상이면 진단할 수 있다. 일반적으로 cefotaxim 또는 3세대 세팔로스포린 계통의 광범위 항생제가 권유된다. 일부 환자에서는 열, 복통, 원인불명의 간성혼수 등의 증상이 동반되지 않는 경우도 많기 때문에 복수가 처음 진단된 환자나 복수를 주증상으로 입원하는 환자는 복수천자가 필요하다.
초기 복수천자에서 다형핵 호중구 수가 수천 이상 매우 높게 증가하거나, 그람 염색과 복수 배양에서 두 개 이상의 균주가 배양되거나, 복수 내 총단백량이 1 g/dL 이상, 복수 내 LDH의 정상 상한치 이상 상승, 복수 glucose가 50 mg/dL 미만으로 감소하는 경우에는 이차성 복막염을 의심하여야 하며 원인 병소를 찾기 위해 CT 등 영상 검사를 시행하는 것이 필요하다.
이전에 자발성 복막염이 발생하였던 환자, 급성 정맥류 출혈 환자, 복수 내 단백 함량이 낮은 환자(1.5 g/dL 이하)에서 자발성 세균성 복막염의 발생을 예방하기 위해 norfloxacin 또는 ciprofloxacin의 경구투여를 고려할 수 있다.
간성뇌증
비대상성 간경변증 환자에서 의식 및 지남력 장애, 각종 신경학적 증상이 생기면 의심할 수 있다. 수면 장애와 수면 습관의 변화를 초기에 관찰할 수 있으며 성격 및 기분의 장애가 나타날 수도 있다. 의식 장애는 건망증이 심해지는 정도에서부터 착란, 혼미, 혼수까지 다양하게 나타날 수 있다. 신경학적 증상으로는 퍼덕이기 진전(asterixis), 경직, 과대반사 및 발작 등이 다양하게 나타날 수 있다. 이러한 증상과 신경학적 이상 정도를 평가하여 간성뇌증을 진단할 수 있다. 혈청 암모니아치가 증가된 경우가 많으나 모든 환자에서 상승하지 않고 상승되어 있는 경우에도 간성뇌증의 정도와 비례하지 않으므로 진단에 필수적이지는 않다.
간성뇌증의 치료를 위해서는 우선 위장관 출혈, 감염, 변비, 단백질 과다 섭취, 탈수, 신기능 장애, 전해질 불균형, 향정신성 약물 복용, 급성 간기능 손상 등의 유발인자를 확인하고 이를 교정하여야 한다. 간성혼수 초기에는 단백질을 가능한 제한하여야 하나 장기간의 지나친 단백질 제한은 단백질분해 대사를 증가시키고 근육양을 감소시켜서 체내 암모니아 농도를 더욱 증가시킬 수 있기 때문에 회복기에는 차츰 환자가 견딜 수 있는 양으로 늘려 나간다. 단백질 섭취로 인해 간성뇌증이 악화 또는 재발하는 경우에는 분지쇄 아미노산을 이용하여 단백질을 공급해주는 것이 도움이 될 수 있다.
간성뇌증의 일차 치료로 lactulse 등 비흡수성 이당류를 하루 2-3회 묽은 변을 볼 수 있는 용량으로 경구투여하며, 3단계 이상으로 간성뇌증이 심한 경우에는 의식이 호전될 때까지 2-4시간 간격으로 관장을 시행한다. Rifaximin은 장에서 거의 흡수되지 않고 요소생성 세균에 작용하여 장내 암모니아 생성을 감소시켜 간성뇌증을 호전시킬 수 있어 일차 치료제로서 사용할 수 있다[7]. 간성뇌증의 재발방지를 위해 비흡수성 이당류를 사용하면 효과적이다.
결 론
간경변증 환자의 예후는 유발원인, 간경변증의 심한 정도, 합병증의 정도 및 동반된 전신 질환 등 여러 가지 인자에 영향을 받는다. 간경변증의 합병증이 유발된 경우를 비대상성 간경변증이라고 하며 이들 합병증의 악화로 인해 이환율 및 사망률이 증가하게 된다. 간경변증의 진행을 억제하기 위한 치료와 함께 간경변증의 합병증의 발생을 예방하거나 적절한 치료를 함으로써 삶의 질과 생존율을 증가시킬 수 있다. 치료에 반응하지 않는 합병증을 가진 환자의 경우 예후가 불량하기 때문에 간이식을 고려하여야 한다.