급성 대동맥 박리가 대동맥 분지혈관을 침범한 경우 경피적 시술로 치료한 2예
Two Cases of Descending Aortic Dissection with Compromised Visceral Artery, Renal Artery, and Iliac Artery Treated with Percutaneous Stent Insertions
Article information
Abstract
Stanford B형 급성 대동맥 박리 환자에서 대동맥부터 나가는 장간막동맥, 신장동맥, 장골동맥과 같은 중요한 분지혈관의 혈류장애로 인한 허혈이 동반 시 수술적 치료 대신 폐쇄된 동맥에 경피적으로 스텐트를 삽입하여 대동맥에서부터 분지혈관으로 가는 동맥혈류를 회복시키는 중재적 치료를 시행하여 좋은 결과를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
The involved area is an important guide to the treatment of an acute aortic dissection. Generally, a Stanford type A aortic dissection requires surgery, whereas an uncomplicated Stanford type B aortic dissection is managed medically. However, managing a Stanford type B aortic dissection involving the visceral, renal, or iliac arteries is controversial because surgical perioperative mortality is higher than that for medically managed patients. Some researchers have attempted endovascular treatment to reduce perioperative mortality and protect vital organs. We experienced two cases of descending aortic dissection with compromised visceral, renal, and iliac arteries that were successfully treated by percutaneous stent insertion. (Korean J Med 2012;82:78-84)
서 론
매년 약 백만 명 당 5-30예씩 발생한다고 알려진 대동맥 박리는 치료하지 않을 경우 48시간 이내에 발병된 환자의 50%가 사망하는 치사율이 매우 높은 응급 질환 중 하나이다[1].상행 대동맥을 침범한 소위 Stanford A형 급성 대동맥 박리의 치료는 수술이 원칙이며, 전체 대동맥 박리 환자에서 25%를 차지하는 하행 대동맥을 침범한 B형 급성 대동맥 박리의 치료는 맥박수, 혈압, 대동맥의 shearing stress (dp/dt) 등을 조절하는 내과적 치료가 원칙이나, 대동맥 박리의 합병증으로 인한 대동맥의 파열, 파열의 위험이 있는 대동맥류의 형성, 대동맥에서 장, 신장, 간, 비장, 하지로 가는 혈관을 대동맥 박리가 침범하여 혈류장애로 인한 목표장기의 허혈 또는 괴사 등이 나타난 경우에는 수술적 치료가 시행되었다[1]. 그러나 수술 관련된 사망률이 A형 급성 대동맥 박리 환자보다 오히려 더 높게 보고되고 있고, 술기 면에서도 하행 대동맥에 분지 혈관들을 각각 대동맥에 연결하는 방법은 쉽지가 않다. 따라서 최근에는 하행 대동맥에서 주요 분지 혈관들로의 혈류장애로 인한 중요장기의 허혈 또는 괴사 등과 같은 합병증이 동반된 경우, 수술적 치료 외에도 개별적인 분지혈관에 스텐트 삽입술, 스텐트 이식편(stent-graft), 창냄술(fenestration)을 이용한 경피적 혈관성형술로 목표 장기의 혈류를 회복시키는 치료가 시도되고 있다[2,3].
일반적으로 신장동맥 협착성 질환의 경우, 적응증이 되는 경우에는 풍선 성형술과 스텐트 삽입술이 시행되고 있으며[4] Stanford B형 급성 대동맥 박리로 인하여 신장동맥으로 가는 혈류가 막힌 경우에도 유사한 시술 방법이 가능하다. 복강동맥(celiac artery) 폐쇄, 상장간막동맥(superior mesenteric artery) 폐쇄가 동반된 급성 대동맥 박리 환자에서 복강동맥, 상장간막동맥에 스텐트나 스텐트 이식편을 이용하여 치료한 예들도 일부 보고가 되었다[5-8].
저자들은 복강동맥 및 신장동맥 폐쇄가 동반된 Stanford B형 급성 대동맥 박리 환자에서 복강동맥 및 신장동맥에 경피적 스텐트를 삽입하여 급성 신부전의 호전을 경험한 증례 1예와 Stanford B형 급성 대동맥 박리로 인해 하지와 신장의 혈류장애가 발생한 환자에서 외장골동맥(external iliac artery) 및 신장동맥에 경피적 스텐트를 삽입하여 혈류를 완전히 회복시킨 증례 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
증례 1
39세 남자가 내원 1시간 전부터 발생한 배부 통증 및 흉통을 주소로 본원에 내원하였다. 환자는 3-4년 전 고혈압을 진단받았으나 항고혈압제를 복용하지 않았다. 10갑년의 흡연력이 있고, 그 밖에 특이 과거력이나 가족력은 없었다. 내원 당시 혈압은 190/110 mmHg, 맥박은 분당 72회였다. 생화학 검사에서 BUN 18.1 mg/dL, Creatinine 1.3 mg/dL이었다. 심전도에서 좌심실 비대 소견이 관찰되었고, 단순 흉부 X-선 촬영에서 상부 종격동 확장 소견이 보였다. 내원 당일 시행한 응급 컴퓨터 단층 촬영 결과 하행 흉부 대동맥의 최대 직경은 4.1 cm로 확장되어 있었고, 좌쇄골하동맥 기시부 직하방 약 0.5 cm의 위치에서부터 기시한 내막판(intimal flap)이 가강(false lumen)을 형성하여 복강동맥, 양측 총장골동맥(common iliac artery)까지 진행되어 있었다. 가강에 의한 진강(true lumen)의 역동성 폐쇄로 인해 복강동맥의 혈류가 감소된 소견이 관찰되었고, 좌신장동맥은 가강에 의한 진강의 완전 폐쇄로 인해 혈류가 감소된 소견이 관찰되었다(Fig. 1A and 1B). 따라서 복강동맥과 좌신장동맥에 스텐트 삽입을 통한 경피적 치료를 시행하기로 하였다. 우측 총대퇴동맥(common femoral artery)을 경피적으로 천자한 후 8 Fr sheath를 삽입하고 8 Fr RDC 유도도자(guiding catheter, Cordis, Miami, FL, USA)를 선택적으로 좌신장동맥 기시부에 위치시켰다. 유도도자를 좌신장동맥의 기시부에 위치시키자 자체 누르는 힘에 의하여 신동맥의 혈류를 일부 확인할 수 있었다. 선택적으로 시행한 신장동맥 조영술에서 좌신장동맥이 가강에서 기시하여 좌측 신장으로의 혈류 감소 소견이 관찰되었다(Fig. 2A). 그 후 0.014 inch 유도철선(guidewire)을 진강 내부를 따라 좌신장동맥 원위부까지 삽입시킨 다음 이를 따라 Genesis 스텐트(8 × 39 mm, Cordis, USA)를 삽입하였고, 좌신장동맥의 혈류 호전소견을 보였다(Fig. 2B and 2C). 신장동맥 스텐트는 대동맥 진강에서 가강을 가로질러서 신장동맥까지 연결되도록 대동맥 내로 많이 빼내어서 스텐트를 삽입하였다. 다음으로, 진강에서 기시하는 복강동맥의 근위부는 가강에 의해 혈류역학적으로 폐쇄되는 소견을 보이며 진강을 통한 복강동맥의 혈류가 매우 감소된 것을 관찰 할 수 있었다(Fig. 2D). 8 French RDC 유도도자(Cordis, USA)를 선택적으로 복강동맥 기시부에 위치시켰다. 0.014 inch 유도철선을 복강동맥 원위부까지 밀어 넣듯이 삽입시킨 다음 이를 따라 Genesis 스텐트(6 × 24 mm, Cordis, USA)를 삽입하였고 이후 복강동맥의 혈류는 호전을 보였다(Fig. 2E and 2F). 복강동맥 스텐트는 대동맥 진강에서 가강을 가로질러서 복강동맥까지 연결되도록 대동맥 내로 많이 빼내어서 스텐트를 삽입하였다. 시술 이후 항혈소판제인 aspirin, clopidogrel을 지속적으로 복용하였다. 입원 후 labetalol, nicardipine을 정맥 투여하였고, 이후 혈압은 정상 및 안정화되어 유지되었다. 내원 시 신기능은 BUN/Creatinine 18.1/1.3 mg/dL에서 입원 3일째 28/2.46 mg/dL로 악화 소견을 보이다 입원 14일째 10.7/1.17 mg/dL로 호전 보였다. 입원 7일, 14일째 시행한 컴퓨터 단층 촬영상 하행 흉부 대동맥에서 진강의 혈류가 잘 유지되고 가강의 크기가 더 이상 증가되지 않았으며 좌신장동맥과 복강동맥으로의 혈류도 잘 유지되는 소견 보여 입원 15일째 퇴원하였다(Fig. 3A and 3B). 퇴원 후 경구 항고혈압제를 복용하면서 14개월이 지난 현재까지 증상 재발 없이 추적관찰 받는 중이다.
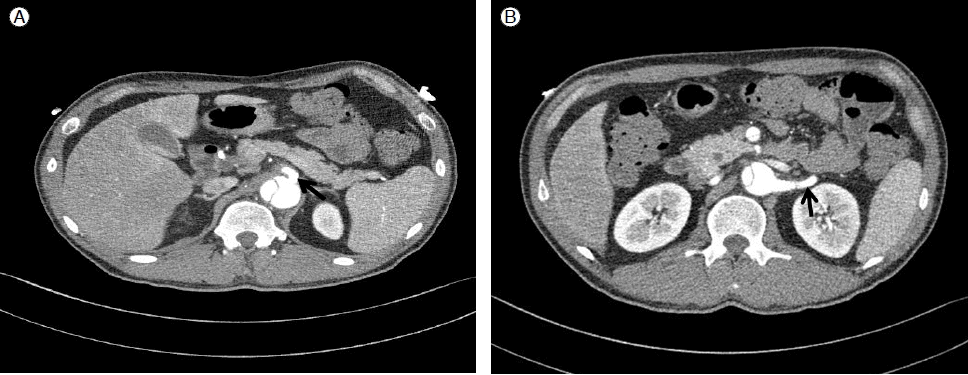
Contrast-enhanced computed tomography (CT) scan shows that the true lumen (black arrow) and false lumen (white arrow) of the descending aorta are separated by an intimal flap. The celiac artery (A) and left renal artery (B), which arise from the false lumen, are compromised.
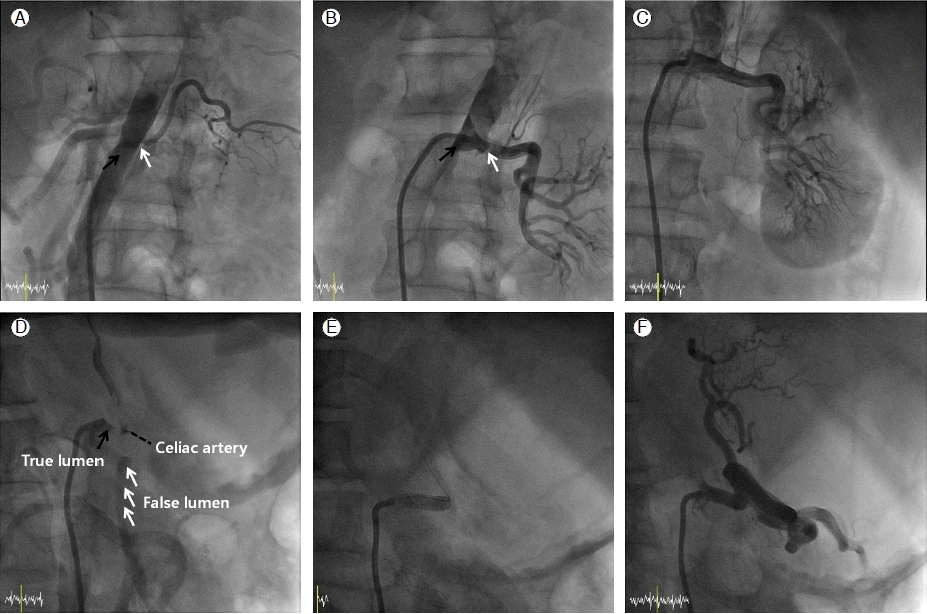
Renal angiography demonstrates that blood flow from the left renal artery, which originates from the false lumen, is compromised (A). A guidewire was passed through the true lumen and inserted into the distal part of the left renal artery (B) (black arrow: true lumen; white arrow: false lumen). Complete restoration of arterial blood flow was achieved after successful stent deployment in the left renal artery (C). Celiac arteriography shows that blood flow from the celiac artery, which originates from the true lumen, was compromised by the false lumen (D, RAO 40° view). The stent is well positioned in the true lumen, and a complete recanalization of the celiac artery was achieved (E and F).
증례 2
40세 남자가 내원 3시간 전부터 발생한 찢어지는 듯한 흉통을 주소로 본원에 내원하였다. 환자는 3년 전 고혈압을 진단받고 항고혈압제를 복용하였으나 최근 1주일간 항고혈압제를 복용하지 않았다고 하였다. 10갑년의 흡연력이 있고, 3년 전 약물로 인한 확장성 심근병증, 심부전(좌심실 구혈률 26%), 좌심실 혈전으로 약물 치료를 한 과거력이 있었다. 이외의 특이 가족력은 없었다. 내원 당시 혈압은 160/100 mmHg, 맥박은 분당 95회였다. 내원 당일 시행한 응급 컴퓨터 단층 촬영 결과 좌쇄골하동맥 기시부 직하방에서부터 기시한 내막판이 가강을 형성하여 우신장동맥, 우측 외장골동맥까지 진행되어 있었다. 가강에 의한 진강의 역동성 폐쇄로 인해 우신장동맥으로의 혈류가 감소된 소견이 관찰되었고(Fig. 4A and 4B) 우측 외장골동맥이 가강에 의한 진강의 완전 폐쇄로 인해 우측 하지로 가는 혈류의 감소를 관찰할 수 있었다(Fig. 4C and 4D). 이러한 경우 수술의 사망률이 높고 기술적으로도 어려움이 있어 우신장동맥과 우측 외장골동맥에 스텐트 삽입을 통한 경피적 치료를 시행하기로 하였다. 좌측 총대퇴동맥을 경피적으로 천자한 후 8 Fr sheath를 삽입하고 8 Fr RDC 유도도자(Cordis, USA)를 선택적으로 우신장동맥 기시부에 위치시키고, 이후 시행한 신장동맥 조영술을 통해 진강에서 기시하는 우신장동맥의 근위부가 가강에 의해 혈류역학적으로 폐쇄되는 소견을 볼 수 있었다. 우신장동맥에 0.035 inch 유도철선을 진강 내부를 따라 우신장동맥 원위부까지 삽입시킨 다음 신장동맥 풍선도자(Sprinter, 3.0 × 20 mm, Medtronic, Minneapolis, MN, USA)를 우신장동맥 입구부위에 위치시키고 확장시켰고, 이후 Genesis 스텐트(7 × 39 mm, Cordis, USA)를 대동맥 내로 많이 빼내어서 삽입한 결과 대동맥 진강에서 우신장동맥으로 가는 혈류가 회복되었다(Fig. 5A and 5B). 우측 외장골동맥 조영 결과, 우측 외장골동맥이 가강에 의해 완전 폐쇄되는 것을 확인하였다(Fig. 5C). 좌측 총대퇴동맥 sheath를 8 Fr Balkin sheath로 바꾼 다음 0.035 inch hydrophilic 유도철선을 우측 대퇴동맥 원위부까지 삽입시키고, 0.035 inch Amplatz Extra Stiff 유도철선(Boston Scientific, Natick, MA, USA)으로 바꾸었다. Powerflex extreme PTA 풍선도자(5 × 4 mm, Cordis, USA)를 우측 외장골동맥 기시부에위치시키고 확장시킨 후 Smart 스텐트(12 × 60 mm, Cordis, USA)를 우측 장골동맥 기시부에 삽입하였다(Fig. 5D). 그 후 잔여협착 소견이나 병변의 근위부와 원위부 사이의 압력차는 관찰되지 않았다. 입원 17일째 시행한 컴퓨터 단층 촬영에서 하행 흉부대동맥에서 진강의 혈류가 잘 유지되고 가강의 크기가 더 이상 증가되지 않았으며 좌신장동맥과 하지로의 혈류도 잘 유지되는 소견 보여 입원 18일째 퇴원하였다. 발목 상완 혈압비는 우측 1.0 좌측 0.95로 회복되었다. 퇴원 후 경구 혈압 강하제를 복용하면서 6개월이 지난 현재까지 증상 재발 없이 추적관찰 중이다.
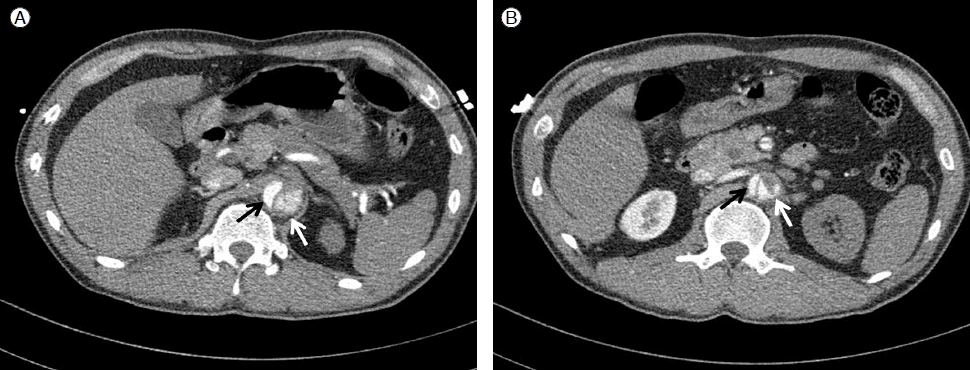
Contrast-enhanced computed tomography (CT) scan shows that the true lumen (black arrow) and false lumen (white arrow) of the descending aorta are separated by an intimal flap. Blood flows from the right renal artery (A and B) and right external iliac artery (C and D) are compromised.
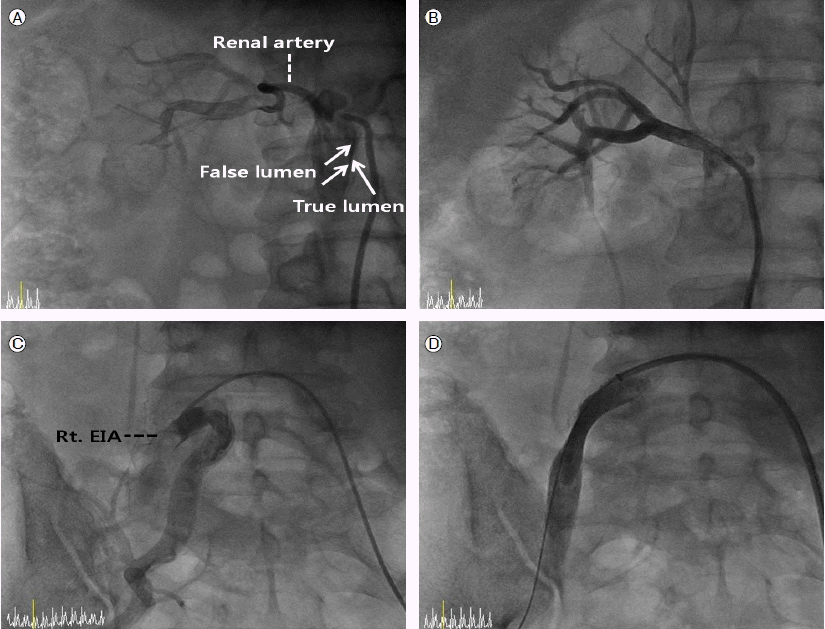
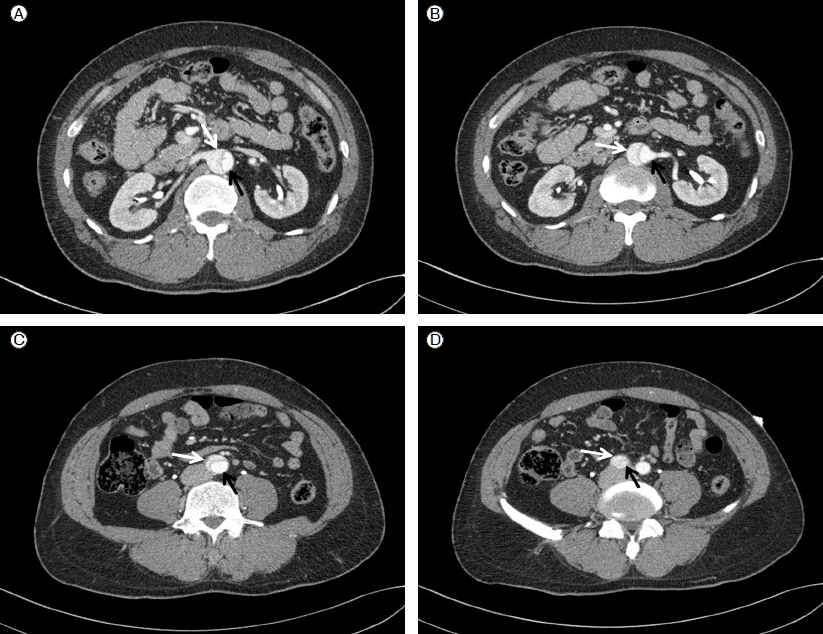
Renal angiography demonstrates that blood flow from the right renal artery, which originates from the true lumen, was compromised (A). Complete restoration of arterial blood flow was achieved after successful stent deployment in the right renal artery (B). Right external iliac arteriography shows that blood flow from the right external iliac artery (EIA), which originates from the true lumen, is compromised by the false lumen (C). The stent is well positioned in the true lumen, and a complete recanalization of the right EIA was achieved (D).
고 찰
급성 대동맥 박리 환자의 30-50%에서는 대동맥에서 경동맥, 복강동맥, 장간막동맥, 신장동맥, 하지로 가는 혈관 등 중요한 분지혈관으로의 혈류장애로 인해 중풍, 하반신마비, 무맥증, 급성 신부전, 장간막허혈 및 괴사 등의 합병증이 동반된다고 보고되어 있는데[10], 이러한 경우에는 사망률은 60% 이상으로 매우 높게 보고되어 적극적인 치료가 필요하다[1,10].
과거에는 내과적 치료가 원칙인 Stanford B형 급성 대동맥 박리 환자에서 상기와 같은 합병증들이 발생하였을 경우 수술적 치료가 시행되었으나, 수술관련 사망률이 6-50%로 매우 높아, 5-27%로 보고된 A형 급성 대동맥 박리 환자의 수술관련 사망률보다 더 높게 보고되고 있다[1,10]. 그 이유는 대동맥 박리가 대동맥에서 나가는 중요한 분지혈관 혈류장애를 유발하였을 때에는 기술적인 면에서 복부나 흉부를 절개해야 하며 대동맥에 각각의 분지혈관을 이식한다는 것이 어렵고, 이식된 분지혈관의 혈류를 유지하기도 힘들기 때문이다. 또한, 경동맥, 장간막동맥, 신장동맥 등은 빠른 혈류의 회복이 이루어지지 않으면 뇌, 장, 신장 등의 심한 손상으로 인하여 사망에 이르게 되기 때문이다.
대동맥 박리에 대한 혈류역학적 이해의 증가, 중재적 시술과 관련된 기구발달 및 경험 축적에 힘입어 급성 대동맥 박리환자에서 대동맥 주분지 혈관들의 혈류장애로 인한 목표장기의 허혈 및 괴사 등과 같은 합병증이 동반된 경우 최근에는 사망률이 높은 수술적 치료 대신에 분지혈관의 혈류장애를 개선할 수 있는 풍선도자를 이용한 개창술, 개별적인 분지혈관에 스텐트 삽입술, 스텐트 이식편으로 내막판을 막는 시술 그리고 개창술과 개별적인 분지혈관에 스텐트 삽입술의 적절한 조합을 통하여 목표장기 혈류를 회복시키는 경피적 중재시술이 시도되고 있다[6,7]. Williams 등[6]은 경피적 개창술 및 스텐트 삽입술을 시행하여 대동맥 박리로 인한 복부 대동맥 주분지 및 하지동맥 허혈 환자의 92%에서 혈류를 회복시켰다고 보고하였고, Slonim 등[7]은 대동맥 박리의 분지혈관 혈류장애를 보인 환자들에서 풍선을 이용한 개창술이나 분지혈관에 개별적인 스텐트 삽입술을 시행함으로써 혈류장애 증후군의 진행을 예방하고 추가적인 외과적 치료의 빈도를 감소시켰다고 보고하였다. Lacombe 등[9]에 의하면 만성신부전의 급성 악화 소견을 보인 하행 흉부대동맥 박리 환자에서 혈류 장애를 보인 신장동맥으로 스텐트 삽입 후 혈청 크레아티닌치가 감소되고 혈압도 안정화되었다고 보고하였다.
대동맥 박리로 인하여 분지 혈관의 혈류장애 시 스텐트 이식편 시술, 개별적인 분지 혈관에 대한 스텐트 시술, 경피적 개창술, 또는 이러한 시술들의 조합을 선택하는 것은 개별적인 환자의 상태에 따라 선택해야겠다. 대부분의 중요한 분지 혈관들이 진강에서 나가고 내막판이 스텐트 이식편을 삽입하기에 좋은 위치라면 스텐트 이식편 시술이 대동맥과 분지혈관의 혈류를 가장 이상적인 회복시키는 시술이 될 수 있다. 그러나 중요한 분지 혈관이 가강에서 나간다면 분지혈관의 혈류는 스텐트 이식편의 삽입 후에 가강이 막히면서 혈류가 차단되어 장기 손상으로 이어질 수 있고 이때 분지혈관에 스텐트를 넣는 것이 반드시 성공하는 것만은 아니므로 신중히 고려되어야겠다. 개창술은 분지혈관들이 진강, 가강에서 섞여 각각 혈류가 공급되는 경우에는 우선적으로 고려되어야 하고 개창술 후에도 혈류가 약한 분지 혈관은 개별적인 스텐트 시술이 필요하겠다. 개별적인 분지혈관의 스텐트 시술시에는 대동맥쪽으로 스텐트를 길게 나오게하여 진강에서 분지혈관으로 가는 가교를 만들어야 한다. 이러한 가교 역할을 하는 스텐트의 장기적인 재협착, 스텐트 혈전증, 스텐트의 이동 등의 성적에 관한 자료는 아직까지는 정확하게 정립되어 있지 않은 실정이다. 그러므로 임상증상, 컴퓨터 촬영술 등을 통한 신중한 추적관찰이 필요하다.
본 증례는 Stanford B형 급성 대동맥 박리 환자에서 장간막동맥, 신장동맥, 장골동맥과 같은 중요한 분지혈관의 혈류장애가 있을 때 경피적으로 스텐트를 가교처럼 삽입하여 혈류를 회복시키는 중재적 시술을 통하여 좋은 결과를 얻었다.