국소적 농흉으로 나타난 Mycobacterium bovis 감염 1예
Localized Empyema due to Mycobacterium bovis
Article information
Abstract
국내에서는 M. bovis에 대한 사람 감염의 보고는 없었으나 소에서의 감염률은 약 0.15%로 보고되고 있고, 개발도상국에서 M. bovis 감염률은 10-15% 정도로 보고되고 있다. 최근 다문화 가정이 증가하고 이주민 특히 개발도상국에서 국내로 이주가 증가함에 따라 이주민들에서 결핵 진단 시 M. bovis 등의 감염을 감별할 필요가 있다.
따라서 저자들은 베트남 이주 여성에서 국소적으로 발생한 농흉에서 얻은 조직으로 M. bovis를 진단하고 치료하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Bovine tuberculosis, which is caused by Mycobacterium bovis, a member of the M. tuberculosis complex, is a zoonosis transmitted through the inhalation of infected droplets or the ingestion of raw milk. Human bovine tuberculosis has been reported rarely in most countries since the introduction of pasteurized milk and M. bovis eradication programs. However, it has been reported in other areas with poorly controlled programs. We encountered a case of localized empyema due to M. bovis infection in a pregnant female immigrant from Vietnam. We report this case with a brief review of the related literature. (Korean J Med 2011;81:792-796)
서 론
Mycobacterium tuberculosis complex (MTBC)는 사람에서 결핵을 일으키는 균으로 Mycobacterium tuberculosis 이외에도 M. bovis, M. africanum, M. microti, M. pinnipedii가 이에 속한다[1,2]. 특히 M. tuberculosis와 M. bovis는 그 유전체를 분석한 결과 99.95% 이상의 상동성을 가진다[2-4].
M. tuberculosis는 주로 사람을 숙주로 하고, 원숭이, 개, 고양이, 토끼, 기니피그 등에 감수성이 있는 것으로 알려져 있으며, M. bovis는 대부분 소를 숙주로 하지만 사람, 돼지, 염소, 양, 고양이와 다른 포유 동물에서도 감염을 일으킨다[1,4,5].
사람에서의 감염은 주로 감염된 개체의 고기나 우유 등을 날 것으로 섭취하였을 때 감염되어 폐와 내장에 결핵병변이 형성하고 만성으로 진행되는 것으로 알려져 있다[4,5]. 전 세계적으로 발생하는데, 특히 농부와 도살업에 종사하는 사람에게 잘 발생한다[4,5]. 우유의 저온 살균법이 도입되고, 소 결핵 근절 프로그램이 시작된 이후에는 M. bovis의 사람 감염이 매우 드물게 보고되었다[4,5]. M. bovis의 사람 감염 증례가 국내에서는 드문 것으로, 저자들은 동남아시아에서 이주한 성인에서 발생한 M. bovis에 의한 농흉을 경험하였기에 보고하는 바이다.
증 례
환 자: 누〇〇〇〇, 19세, 여자
주 소: 4주간의 발열 및 기침
현병력: 임신 29주 3일의 베트남 이주 여성이 내원 4주 전부터 기침이 있어 내원하였다. 타 병원에서 시행한 흉부 X-선 사진에서 우측 농흉 소견이 보여 흉수의 결핵균 도말 검사를 시행하였으나 음성이었다. 내원 3주 전부터 고열이 지속되고, 태아 감시 중 태아곤란이 심화되어 응급 제왕절개술을 위하여 전원되었다.
과거력: 결핵이나 천식의 병력은 없었고, 당뇨, 고혈압, B형 간염, 그리고 수술 등의 병력도 없었다. BCG 예방 접종력은 없었다.
사회력: 베트남의 꽝가이성 반뜨엉에서 태어나 자랐으며, 집 근처에 축사 등의 시설물은 없었다. 내원 1년 전에 베트남에서 한국으로 이주하였다.
가족력: 특이 사항 없었다.
신체 검사 소견: 내원 시 활력 징후는 혈압 110/70 mmHg, 맥박 분당 115회, 호흡수 분당 25회, 체온 38.2℃로 급성 병색을 보였다. 신체 검사에서 우측 폐 하부에 호흡음이 감소되었고 타진 시에 둔탁음이 있었다. 심장 잡음이나 경정맥 종창, 그리고 간-경동맥 반사 등은 관찰되지 않았다. 곤봉지는 보이지 않았다.
검사실 소견: 말초 혈액 검사에서 총 백혈구 10,400/mm3, 혈색소 9.2 g/dL, 혈소판 563,000/mm3였다. 산소 2 L/분를 마스크로 공급한 후 시행한 동맥혈 가스 소견은 pH 7.434, 동맥혈 산소 분압 72.4 mmHg, 동맥혈 이산화탄소 분압 29.7 mmHg, HCO3 19.5 mmol/L, 산소 포화도 95.2%였다. 혈청 생화학 검사에서 총 단백 6.9 g/dL, 알부민 2.4 g/dL, AST 37 IU/L, ALT 12 IU/L, 알칼리 포스파타아제 240 U/L, BUN 8 mg/dL, 혈청 크레아티닌 0.8 mg/dL이었다. 적혈구침강속도 22 mm/분, C-반응성단백 2.7 mg/dL이었고, 사람면역결핍바이러스 항체는 음성이었다.
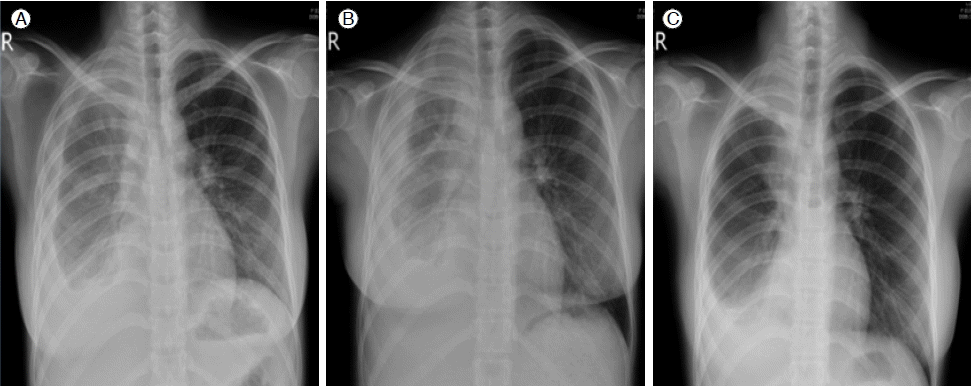
방사선학적 검사: 흉부 X-선 사진에서 우측 흉막강에 다량의 흉수가 있었고, 양측 폐야는 깨끗하였다. 흉부 전산화 단층 촬영에서 오른쪽 흉막삼출액 및 불규칙하게 두꺼워진 흉막의 비후소견이 보였다(Fig. 1).
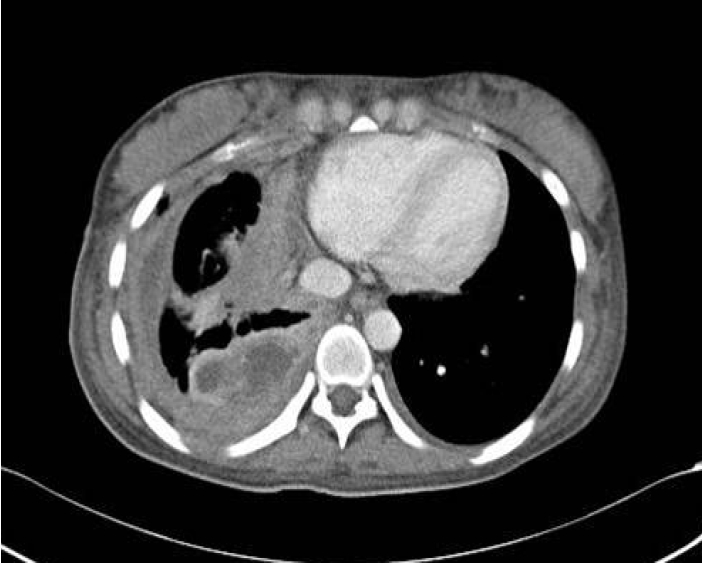
Chest computed tomography scan showing irregular right pleural thickening and empyema in the basal and retrocrural areas. Mediastinal lymphadenopathy was also noted.
객담 검사: 3회 시행한 결핵균 도말 검사는 음성이었고, 결핵 유전자 중합효소 연쇄반응도 음성이었다. 객담 배양검사에서 다른 미생물체는 확인되지 않았다.
흉막액 검사: 내원 직후 흉막액 천자를 시행하여 5 mL가량 흡인되었다. 흉막액 혈구 검사에서 백혈구는 2,600/mm3 (호중구 85%)로 삼출성 흉수가 의심되었으나 검체의 양이 부족하여 흉막액에 대한 생화학검사는 시행하지 못하였다. 결핵균 도말 검사에서 음성이었고, 결핵 유전자 중합효소 연쇄반응도 음성이었다. 재원 16일째에 국소적으로 형성된 농흉 부위의 흡인액에서 시행한 결핵균 도말 검사는 양성이었다.
조직 검사: 재원 2일에 응급 제왕절개술을 하면서 오른쪽 6번 늑골 아래로 5 cm 가량 절개하여 흉막조직검사 및 세척을 시행하였다. 조직 검사에서 만성 육아종성 염증이 보였고, periodic acid-Schiff, gömöri methemamine silver 염색에 미생물체는 관찰되지 않았다. Mesothelial, p53, calrectinin에 대한 특수염색에 음성이었다. 파라핀 포매 조직을 이용한 Real-Time PCR MTB Kit®(BioSewoom, Seoul, Korea)에 음성 반응을 보였다. 재원 16일에 흉막 박피술 및 조직검사를 다시 시행하였고, 조직검사상 만성 육아종성 염증소견이 보였다(Fig. 2). 파라핀 포매 조직을 이용한 Real-Time PCR MTB & NTM Kit®(BioSewoom, Seoul, Korea)을 시행하였다. 이 검사에서 MTBC는 IS6110부위를 대상으로 TB TaqMan® probe를 사용하고, 비결핵 항산균은 RpoB부위를 대상으로 NTM TaqMan® probe를 사용하여 검사하였다. 최종적으로 환자의 검체와 M.bovis BCG, strain Monreau RDJ와 염기서열에 대한 상동성은 100%로 확인되었다.
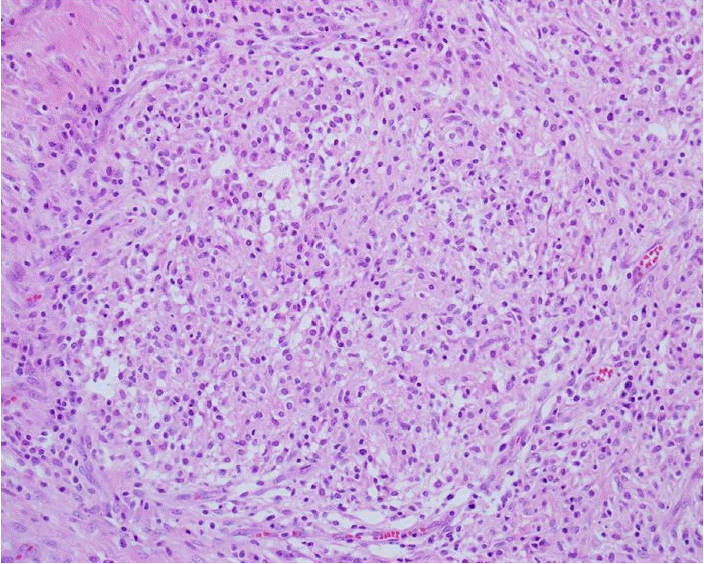
Biopsy showing a chronic granulomatous lesion on the pleura, compatible with tuberculosis (hematoxylin & eosin stain, ×400).
치료 경과: 재원 4일부터 ciprofloxacin 400 mg/일, amikacin 500 mg/일, clarithromycin 500 mg/일으로 3일간 치료하였으나 발열이 지속되고 농흉의 호전이 없었고, 재원 7일에 결핵에 의한 농흉을 의진하고 isoniazid 300 mg/일, rifampin 600 mg/일, etambutol 1,200 mg/일, pyrazinamide 1,500 mg/일으로 치료를 시작하였다. 재원 25일에 Real-Time PCR MTB & NTM Kit®을 통해 M. bovis에 의한 감염으로 진단하였다. 재원 45일에 시행한 흉부 X-선 검사에서 농흉의 호전이 없고, pyrazinamide 내성 및 약제 부작용을 고려하여 재원 46일에 pyrazinamide는 투여 중단하였다. 재원 50일에 시행한 흉부 전산화 단층 촬영 사진에서 수술 부위의 염증은 호전이 되었으나 흉막 아래쪽의 후각부위의 염증이 더 악화된 소견을 보여, 재원 53일에 moxifloxacin 400 mg/일을 추가하여 치료하였다. 재원 71일에 퇴원하였으며 이후 외래에서 약제 투여를 지속하였다. 내원 3개월 후 국소적으로 형성된 농흉 부위의 흡인액에서 시행한 결핵균 배양 검사상 M. bovis가 배양되었고, 내원 4개월 후 항결핵제 감수성 검사에서 모든 약제에 감수성이 있음을 확인하였다. 흉부 X-선 사진에서 우측 늑막의 비후 및 흉수 소견이 호전되고 있는 상태(Fig. 3)로 isoniazid, rifampin, ethambutol, moxifloxacin을 7개월 동안 투여 중이며, 약제에 대한 부작용은 보이지 않고 있다.
고 찰
국내에서 소결핵은 1913년에 최초로 보고되었으며 일제 시대 때부터 튜버클린 피내 접종에 의한 소의 결핵 검진이 실시되어 왔다. 이에 양성인 경우 소를 살 처분하고 보상해 주는 정책의 시행(test and slaughter control program)으로 소결핵에 대한 청정화는 상당한 진전을 보여 왔다[6,7]. 1926-1942년까지 약 16.9%로 높았던 소결핵의 발생은 1950년대 1.62%, 1960년대 0.56%, 1970년대 0.1%, 1980년대에 1.03%로 급격히 감소하였다[6,7]. 1990년대부터 현재에 이르러서 국내 소결핵은 0.15% 정도의 발생률을 보이고 있다[6,7]. Cho [6]에 의하면 2007년까지 국내에는 M. bovis에 의한 사람 감염 보고는 없었고, 이후로도 역시 보고된 바가 없었다[8].
그러나 개발도상국 특히 동남아시아의 경우 동물에서의 M. bovis 감염이 매우 널리 퍼져있음에도 불구하고 이를 통제하기 위한 검사를 드물게 시행하고, 또한 우유 등의 유제품의 저온살균도 잘 이루어지지 않고 있다[9]. M. bovis에 감염된 가축의 수와 사람에서 발병률은 상관관계가 높다[4,9]. 개발도상국에서 HIV에 감염된 사람에서 기회감염의 하나로 M. tuberculosis에 의한 감염이 흔하며, 동물의 M. bovis 감염이 높은 나라에서는 이로 인한 인수공통 감염의 기회가 늘어나고 있다[4,9]. 결핵(MTBC) 감염의 62%는 동남 아시아와 서태평양 지역으로 알려져 있으며, 이들 대부분의 나라에서 결핵(MTBC) 감염이 의심되는 환자에서 균의 동정은 어려운 상태이다[9]. 특히 베트남, 미얀마, 인도네시아 등지에서는 가축 결핵에 대한 검사가 이루어진 적이 없어 이에 대한 정보는 거의 없다[9]. 보고에 의하면 선진국에서 전체 결핵(MTBC) 환자 중에서 M. bovis의 감염으로 인한 발병은 0.5-7.2%이며, 개발도상국에서 새로 발생한 예의 10-15%가 M. bovis에 의한 것으로 추정되고 있다[4,9]. 본 증례의 경우 환자가 국내로 이주한 지 1년 밖에 되지 않아 국내에서 감염되었다기 보다 베트남에서 감염되었을 가능성이 높고, 이는 앞으로도 동남아시아 이주민에서 지속적으로 발생할 가능성이 높음을 보여준다.
전염의 기전은 매우 다양한데 멸균되지 않은 우유, 우유 가공품, 야생동물, 환경 등이 중요한 매개체로 추정되고 있다[1,4,5,7,9]. 이러한 예로, 영국에서 사람에서 M. bovis감염의 발생 요인을 분석하였고 살균하지 않은 우유의 섭취, 살균하지 않은 우유로 만든 유제품의 섭취 및 M. bovis에 감염된 동물 또는 사체로부터 감염성 비말에 노출 등이 감염경로로 확인되었다[4]. 우유의 저온 살균법이 도입되기 이전에는 사람에서 폐외 결핵의 가장 많은 원인이 M. bovis였고, 특히 어린아이에서 주로 발병하였다[1,5]. 감염된 동물과 사체로부터 비말을 통한 감염이나 손 접촉에 의한 감염은 직업과 관련되어 많이 발생한다[1,4]. 본 증례에서는 정확한 감염의 경로를 밝히기는 어렵다. 그러나 개발 도상국에서 자란 점을 고려한다면, 주변에 가축 시설이 없어 노출의 기회가 적었을 것으로, 멸균되지 않은 우유나 우유 가공품에 의한 감염의 가능성이 더 높을 것으로 추정된다.
뉴질랜드에서 사람과 소를 비롯한 여러 동물에서 분리한 M. bovis를 restriction endonuclease analysis으로 비교 분석한 결과 사람에서 분리한 균주의 61%가 여러 동물에서 분리한 균주와 동일하여 동물이 사람에 M. bovis를 전파할 수 있는 병원체 보유숙주로 판단된다[10]. 스위스에서는 M. bovis가 동물로부터 사람에 감염된 후 다시 동물에 재감염된 예를 보고하였다[11]. M. bovis의 사람과 사람 간의 전파는 거의 없을 것으로 알려져 있으나, 영국에서 사람과 사람 간의 전파가 가능함을 보고하였고[12], 또한 사람면역결핍바이러스에 감염된 환자들에서 병원 내 유행의 가능성이 있음을 보고하였다[13].
M. bovis의 감염은 수년에 걸쳐서 천천히 진행한다. 초기 병변은 폐와 경부, 복막의 림프절에서 육아종을 형성하는 것이 특징적이며, 후기 병변은 비뇨생식기계, 뼈, 관절을 침범하거나 만성 수막염으로 나타날 수도 있다[1,5].
M. bovis의 진단법은 지속적으로 연구되어 왔으며, 최근에는 M. bovis를 효율적으로 구분하기 위하여 MTBC만이 가지는 특이 유전자에 기초한 중합효소 연쇄반응 검사가 개발되어서 진단에 적용되고 있다[14]. 본 증례와 같이 진단 초기에 M. tuberculosis에 의한 감염이 의심되어 치료를 시작하였으나 결핵균 도말 검사에서 음성인 경우, M. tuberculosis에 의한 감염을 증명하기 위해서는 배양 결과를 4주 이상 기다려야 한다. 결핵균 도말 검사에서 양성이 확인된다고 하더라도, M. tuberculosis와 다른 MTBC의 아종 및 비결핵 항산균의 구별이 어렵다. 본 증례에서는 흉수에서 시행한 결핵균 도말 검사는 양성이었으나 조직검사에서 M. tuberculosis에 대한 유전자 중합효소 연쇄반응검사에서 음성이어서 MTBC 및 비결핵 항산균의 아종에 대한 검사를 추가로 시행하여 진단할 수 있었다. 파라핀 포매 조직을 통한 유전자 중합효소 연쇄반응법이 도입된 후에 균 수가 적은 검체에서 MTBC 및 비결핵 항산균의 아종에 대한 신속하고 정확한 검사가 가능해 졌다. 또한 세균학적 실험 과정에서 있을 수 있는 실험자에 대한 감염의 우려를 완전히 배제할 수 있다는 장점도 가지고 있다[15,16].
M. bovis의 경우 pyrazinamide를 제외하고는 모든 초치료 약제에 감수성이 있다고 알려져 있고, 대부분의 사람 감염의 경우에 기본적인 초치료에도 완치가 된다[17]. Isoniazid와 rifampin을 포함하는 기본 약제로 치료 후에 재발률은 2-6% 정도 보고되었다[17]. 그러나 M. tuberculosis와 같이 M. bovis에서도 다제내성균이 발생하고 있다는 보고도 있어, 집중 치료를 필요로 하는 환자에게 moxifloxacin이나 streptomycin, ethionamide 등을 투약을 고려할 수 있다[17]. 본 증례에서는 M. bovis에 대한 감수성 검사를 확인하기 이전에 흉부 X-선 검사상 호전이 없어 재원 53일에 moxifloxacin을 추가하여 투여하였으며 이후 임상적인 호전을 확인하였다.
저자들은 국내에서 임신한 베트남 이주 여성에서 국소적으로 발생한 농흉에서 수술을 통해 얻은 조직으로 유전자 중합효소연쇄반응검사와 배양검사를 통하여 M.bovis를 진단하고 치료하였다.