서 론
만성콩팥병의 발생은 전 세계적으로 증가하고 있으며 이에 따라 말기신부전의 발생도 급격하게 증가하고 있다. 만성콩팥병에서 신기능 저하를 지연시키는 방법으로는 고혈압의 조절, 철저한 혈당관리, 레닌 안지오텐신 체계의 조절, 고지혈증의 개선 그리고 금연 등이 잘 알려진 치료 방법이다. 그러나 이러한 치료에도 불구하고 만성콩팥병이 지속적으로 진행되는 경우가 많다. 이에 따라 만성콩팥병의 진행에 관여하는 기전이나 이를 예방하거나 지연시키기 위한 추가적인 치료 방법들에 대한 연구가 필요하다.
3-hydroxy-3-methylgutaryl (HMG)-CoA 환원 효소는 mevalonate pathway를 통한 콜레스테롤 합성에 관여하는 중요한 효소로 isoprenoid (farnesylpyrophosphate, FPP; geranyl geranylpyrophosphate, GGPP)를 합성하는데, isoprenoid는 세포내 전달 체계 단백질과의 결합을 통해 growth factor 수용체가 세포의 cytoskeletal과 결합하는 것을 촉진하고 전사 인자(transcriptional factor)를 활성화하여 세포 증식과 여러 cytokine 및 chemokine들을 활성화시킨다[1,2]. HMG-CoA 환원 효소 억제제(statin)는 isoprenoid에 의한 세포내 신호 전달(signal transduction)을 차단하여 항염증 효과와 면역 반응의 조절, 세포 증식의 억제 등의 효과를 나타낸다[2,3].
Statin은 고지혈증을 호전시켜 얻는 효과와 함께 항염증 효과로 만성콩팥병 환자의 심혈관 질환의 사망률을 낮추고 신기능의 유지에 도움이 된다는 것이 여러 임상 연구를 통해 알려져 있다[4-8].
그러나 이전에 시행된 만성콩팥병에서의 연구는 대부분 신기능이 정상이거나 초기 콩팥병 또는 당뇨병성 콩팥병 등에서 단백뇨 감소 효과나 사구체여과율 유지 등의 statin 치료 효과에 대한 연구로 이미 만성신부전으로 진행된 콩팥병에서 statin의 치료 효과에 대한 연구는 많지 않다. 더구나 신기능 보호에 미치는 효과에 관하여 뚜렷하게 결론을 내릴 수 있는 연구 결과는 미흡한 실정이다.
이에 저자들은 신부전으로 진행된 만성콩팥병 쥐 모델에서 rosuvastatin 치료에 의한 단백뇨 감소 효과 및 신기능 보호 효과를 밝히기 위해 연구를 하였다.
대상 및 방법
실험 동물군
6주령의 Sprague-Dwaley (SD) 수컷 쥐를 5/6 신장을 절제하여 만성신부전 실험쥐를 만들었다. 우측 신은 명주 봉합사를 이용하여 결찰 후 완전히 제거하였고, 동시에 좌측 신은 신문부 1/3을 보존하고 신 실질 상극과 하극을 명주 봉합사로 결찰하였다. 신절제술을 시행한 쥐는 6주간 사육 후 대조군과 치료군으로 구분하여 치료군은 rosuvastatin을 격일로 8주간 투여하였다. 약물의 투여는 rosuvastatin을 생리식염수에 용해시킨 후 10 mg/kg의 용량을 격일로 복강내 주사하였다. 채혈과 24시간 소변 수집은 신절제 후 6주와 14주에 각각 시행하였고, 조직 검사를 위해 6주에 4마리를 희생하여 신장을 회수하였고, 14주째에 대조군 4마리, 치료군 4마리를 희생하여 신장을 회수하였다. 회수한 신장은 절편하여 일부는 4% paraformaldehyde 용액에 고정하고, 나머지 부위는 영하 190℃의 액화질소에 급속 냉동하여 보관하였다.
신기능 검사 및 혈액 검사
신기능과 단백뇨를 검사하기 위해 24시간 소변을 수집하고 채혈하여 검사하였다. 소변 채집과 혈액 검사는 5/6 신절제 후 6주에 시행하였고, 대조군과 치료군으로 나누어 각각 8주 후에 채혈과 소변 채집을 하였다. 신기능은 혈중 크레아티닌과 크레아티닌 청소율(creatinine clearance, Ccr)로 비교하였다. Ccr은 다음과 같이 계산하였다.
Ccr = urine volume (mL/day) × urine Cr (mg/dL) / serum Cr (mg/dL)
단백뇨는 24시간 소변의 단백뇨 농도(mg/dL)를 소변 내 creatinine 농도(mg/dL)로 나누어 TP/Cr ratio (mg/mg)로 비교하였다.
광학현미경 검사(light microscopy)
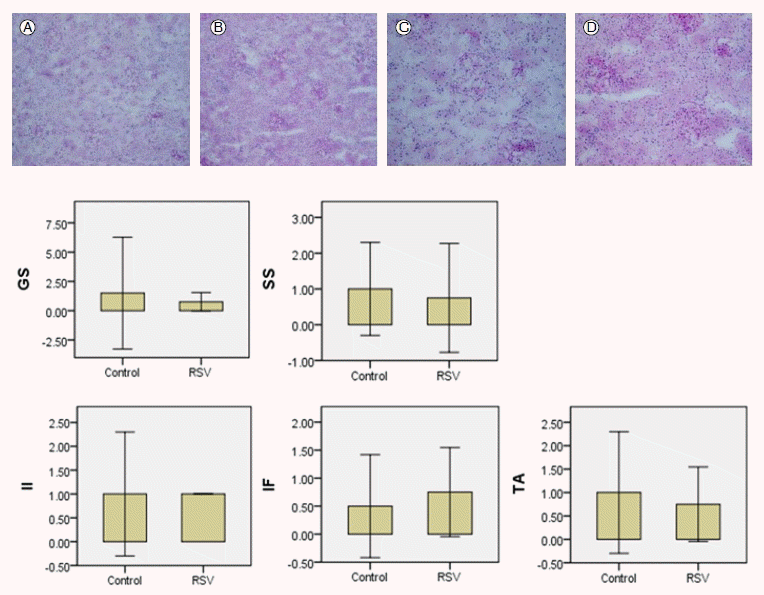
신장의 절편을 10% 중성 포르말린 완충액에 하룻밤 고정하고 탈수와 침투 과정을 거쳐 파라핀에 포매한 후 3 μm 두께로 절편을 만들어 hematoxyln-eosin 염색과 periodic acid-Schiff (PAS) 염색을 하여 광학현미경으로 관찰하였다. 사구체경화를 평가하기 위해 하나의 조직 당 100개의 사구체 중 국소 및 전체 경화의 개수로 표시하였다. 요세관과 간질의 조직학적 변화를 반 정량화하기 위해 간질의 림프구 침윤, 간질의 섬유화, 그리고 요세관의 위축 정도를 지표로 삼았다. 각각의 지표는 정도에 따라 0에서 3으로 표시하였다. 점수 기준은 다음과 같다: 0점, 변화 없음; 1점, 간질 전체의 25% 미만 손상; 2점, 전체 간질의 25-50% 손상; 3점, 전체 간질의 50% 이상 손상.
면역조직화학 염색(immunohistochemical stain)
냉동 보관한 신장을 4 μm 두께로 동결 절편한 후, 실온에서 0.3% H2O2/methanol에 30분 동안 반응시켜 조직내의 과산화효소를 제거하였다. Tris-buffered saline (TBS)에 20분간 담가 세척한 후, 정상 horse 혈청에 30분 동안 반응시켜 비특이적인 항원-항체 결합을 제거하였다. 1차 항체 처리는 TGF-β1 항체(Santa-Cruz Biotechnologies, Santa Cruz, CA, USA)와 intracellular adhesion molecule-1 (ICAM-1) 항체(Abcam, Cambridge, UK)로 4℃에서 16시간 동안 반응시켰다. 2차 항체 처리로 biotinylated anti-mouse IgG antibody와 30분간 반응시키고, 세척 후 avidin-biotinylated enzyme complex (ABC, Vectastain Kit)를 30분간 반응시켰다. 3,3-diaminobenzidine (DAB) 용액에 1분 동안 처리한 후 증류수로 씻어 표본을 제작하였다. 면역조직화학 염색결과의 정량적인 분석을 위해 IMAGEPRO 4.0 program (Media Cybermetics, Silver Spring, MD, USA)를 이용한 밀도를 전산측정 하였다.
효소결합면역흡착검사(enzyme-linked immunosorbent assay, ELISA)
신장 조직의 TGF-β1과 malondialdehyde (MDA)를 측정하기 위해 냉동 보관한 신장을 이용하였다. 조직은 단백질 lysis buffer (10 mM Tris-HCl (pH 7.5), 200 mM NaCl, 5 mM EDTA, 1 mM phenylmethylsulfonyl fluoride, 1 μg/mL leupeptin, 28 μg/mL aprotinin)를 혼합한 후 sonicator, Vibra Cell™ (Sonics & Materials inc., Newtown, CT, USA)를 이용하여 분쇄하였다. 이를 4℃에서 14,000 rpm으로 20분간 2차례 원심분리 후 상층액을 채취하였다. 단백질은 BCA protein assay kit (Pierce, Rockford, IL, USA)를 이용하여 정량하였다. TGF-β1을 측정하기 위해 ELISA kit (R&D systems, Minneapolis, MN, USA)을 이용하였으며, 검체를 microplate에 코팅하여 배양한 후 내용물을 버리고 2차 항체(biotinylated anti-rat TGF-β1 antibody)를 처리하고 배양하였다. 다시 microplate를 씻은 후 avidin-biotin-peroxidase complex 용액으로 처리, 배양한 후 microplate를 세척하고 substrate로 tetramethylbenzidine (TBM) 용액을 각 well에 반응시켰다. H2SO4로 반응을 멈추게 하고 결과 값인 optical density는 microplate reader, VERSA max (Molecular devices, Sunnyvale, CL, USA)를 이용하여 450 nm에서 측정하였다. MDA 농도의 측정은 ELISA kit (Cell Biolabs Inc., USA)를 이용하였고 1차 항체로 anti-MDA rabbit IgG, 2차 항체로 horseradish peroxidase (HRP) conjugate를 이용하여 측정하였다.
Western blot
ELISA와 동일한 방법으로 신장의 단백질을 추출하고 정량하였다. 일정량(20 μg)의 단백질을 10% SDS-PAGE에 전기영동으로 분획하였고, nitrocellulose membrane으로 전이시켰다. 이 membrane을 1차 항체인 anti-rat ICAM-1 antibody (1:1,000 dilution; Abcam, Cambridge, UK)와 4℃에서 하룻밤 동안 반응시킨 후 결합하지 않은 1차 항체를 0.01% Tween20이 포함된 TBS로 세척하였다. 2차 항체인 peroxidase-conjugated anti-mouse IgG (Santa Cruz Biotechnology, Santa Cruz, CA, USA)와 실온에서 2시간 반응 후 세척하고 enhanced chemiluminescence system (ECL, Amersham Biosciences, Piscataway, NJ, USA)을 이용하여 발광 반응을 일으켜 영상화하였다.
결 과
신부전 쥐의 체중 변화와 콜레스테롤 변화
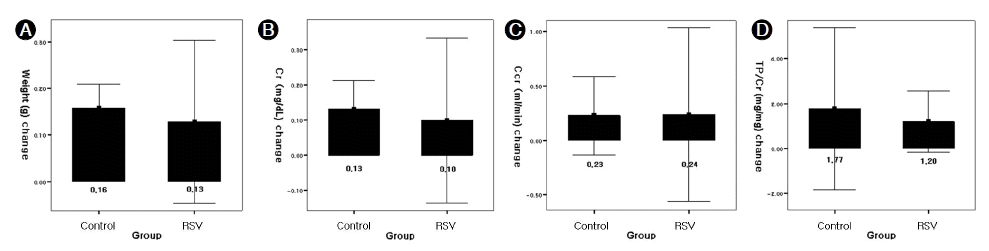
대조군(n = 4)과 치료군(n = 4)의 신절제 6주째의 평균 체중은 각각 236.6 ± 7.9, 267.4 ± 15.9 g이었으며, 14주째의 평균 체중은 각각 274.0 ± 12.5, 302.0 ± 35.7 g이었다. 실험 기간 중의 각 개체의 체중 변화를 비교해 볼 때 두 군 모두에서 체중이 증가하는 추세이나 두 군 사이에 체중 변화의 차이는 없었다(p = 1, Fig. 1A).
두 군 간의 콜레스테롤 상태를 비교했을 때, 신절제 6주에 대조군과 치료군의 총 콜레스테롤은 각각 98.8 ± 22.9 mg/dL, 95.7 ± 15.1 mg/dL로 차이가 없었으며(p = 0.69), LDL 콜레스테롤은 14.5 ± 3.5 mg/dL, 14.3 ± 4.6 mg/dL로 두 군 간의 차이가 없었다(p = 1). 신절제 14주에 대조군과 치료군의 총 콜레스테롤은 각각 105.8 ± 19.3 mg/dL, 103.5 ± 12.6 mg/dL, LDL 콜레스테롤은 각각 13.7 ± 4.0 mg/dL, 10.7 ± 3.7 mg/dL로 두 군 간의 유의한 차이는 없었다(p =1, p =0.31). 실험 기간 중의 각 개체의 총 콜레스테롤, LDL 콜레스테롤의 변화를 비교할 때도 대조군과 치료군 사이에 유의한 차이는 없었다(p = 0.89, p = 0.24, Table 1).
신부전 쥐에서 신보호 효과 및 단백뇨 변화
대조군과 치료군의 혈중 크레아티닌의 농도 변화를 보면, 신절제 6주 후 대조군과 치료군의 평균 크레아티닌 농도는 각각 0.89 ± 0.14 mg/dL, 0.86 ± 0.05 mg/dL이며, 14주에서 대조군과 치료군의 평균 크레아티닌 농도는 각각 0.97 ± 0.05 mg/dL, 0.94 ± 0.11 mg/dL이었다. 신절제 6주에서 14주의 기간 동안 모든 개체의 혈중 크레아티닌 농도는 증가하는 추세를 보였으나 증가 정도에 있어 대조군과 치료군 사이에 유의한 차이는 없었다(p = 0.24, Fig. 1B).
24시간 소변을 수집하여 계산한 크레아티닌 청소율의 변화를 비교하였다. 신절제 6주에서 대조군과 치료군의 크레아티닌 청소율은 각각 0.54 ± 0.09 mL/min, 0.67 ± 0.23 mL/min이었고 신절제 14주에서는 각각 0.66 ± 0.08 mL/min, 0.75 ± 0.16 mL/min이었으며 각 개체 별로 이 기간 동안 크레아티닌 청소율의 변화는 대조군과 치료군 모두에게서 통계적으로 유의한 수준은 아니었다(p = 0.07, p = 0.46, Fig. 1C).
단백뇨의 변화를 TP/Cr ratio를 계산하여 비교하였는데, 대조군의 평균 TP/Cr ratio은 5/6 신절제 후 6주와 14주 각각 0.31 ± 0.07 mg/mg, 0.92 ± 0.83 mg/mg이었고, 치료 군에서는 5/6 신절제 후 6주와 14주에 각각 0.32 ± 0.07 mg/mg, 0.74 ± 0.39 mg/mg이었다. 이 기간 중 각 개체 별로 단백뇨량의 변화를 분석하였을 때, 대조군과 치료군 모두에서 단백뇨가 증가되었으나 증가 정도에 있어 두 군 간의 유의한 차이는 없었다(p = 0.77, Fig. 1D).
Statin과 항산화 효과
5/6 신절제 후 14주째에 신장 조직의 MDA 농도를 ELISA를 이용하여 측정하였다. 치료군에서 측정된 MDA의 평균 농도는 1.26 ± 0.09 pmol/mg로 대조군의 평균 MDA 농도인 1.69 ± 0.53 pmol/mg보다 낮았으나, 통계적으로 의미 있는 정도는 아니었다(p = 0.34).
신장 조직의 광학현미경 검사
대조군과 치료군 간의 사구체경화 정도를 비교할 때 전체 사구체경화는 두 군 간의 차이가 없었으며(p = 1), 치료군에서 국소 사구체경화가 적게 관찰되었으나 두 군 간의 유의한 차이는 없었다(p = 0.69). 요세관 손상을 평가하기 위해 측정한 요세관의 림프구 침윤 정도는 두 군 간의 차이가 없었으며(p = 1), 간질의 섬유화는 치료군에서 더 심하게 관찰되었으나 두 군 간의 유의한 차이는 없었다(p = 0.69). 요세관 위축도 치료군에서 약간 감소되어 있었으나 두 군 간의 유의한 차이가 없었다(p = 0.69, Table 2, Fig. 2).
Statin의 항염증 효과
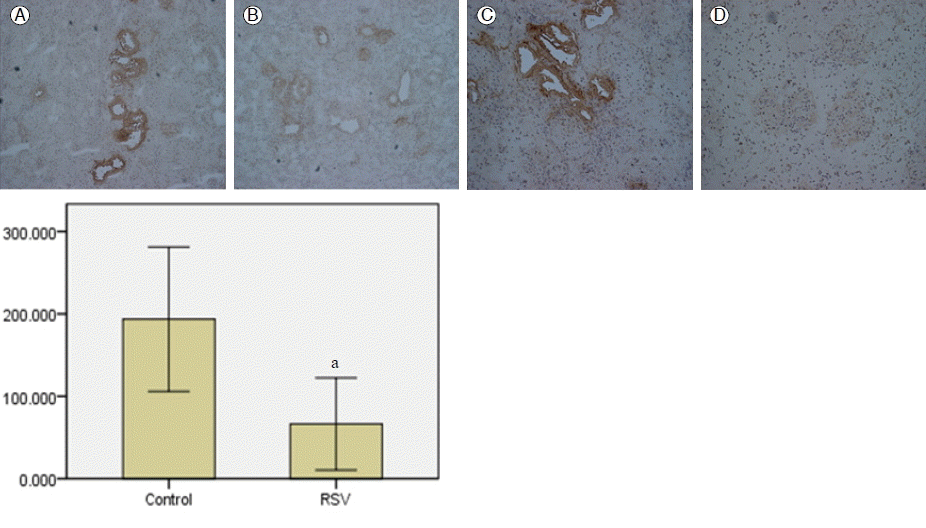
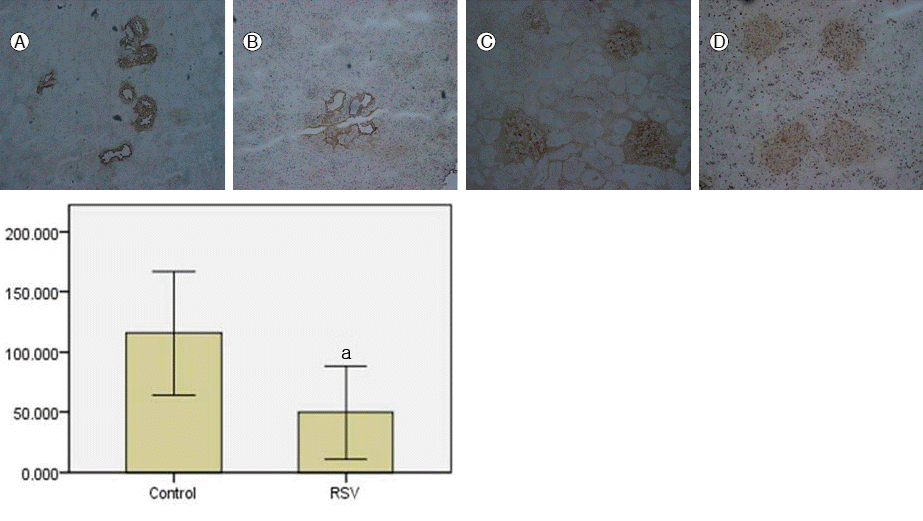
5/6 신절제 후 6주와 14주째에 ELISA를 이용하여 신장 조직의 TGF-β1의 농도를 측정하였다. 5/6 신절제 후 6주에 4마리의 쥐를 희생하여 회수한 신장 조직에서 측정한 TGF-β1의 평균 농도는 1.67 ± 0.60 ng/mg이었고, 14주째 대조군과 치료군의 농도는 각각 11.13 ± 3.43 ng/mg, 5.00 ± 1.43 ng/mg으로 치료군 신장 조직의 TGF-β1이 의미 있게 낮았다(p = 0.029, Fig. 3). 백서 신장의 면역조직화학 염색에서도 대조군과 비교할 때 치료군 신장에서 TGF-β1 발현이 적었다(Fig. 4).
고 찰
이 연구에서 만성신부전으로 진행된 콩팥병에서 statin의 치료가 신기능 악화를 지연시키거나 단백뇨를 감소시키는 등의 신기능 보호 효과를 보여주지는 못했고, 또한 광학현미경 검사에서도 사구체경화 정도와 요세관 손상의 정도에서 대조군에 비하여 뚜렷한 보호 효과를 관찰하지 못했다. 그러나 만성콩팥병의 진행이나 심혈관 질환의 발생에 중요한 역할을 하는 TGF-β1이나 ICAM-1 등의 발현을 감소시키는 효과가 있었고 통계적으로 유의한 수준은 아니었으나 신장조직의 MDA를 감소시켰다.
Statin은 콜레스테롤 강하 또는 이와는 독립적인 효과로 여러 유형의 만성 콩팥병에서 단백뇨 감소와 사구체여과율 보존 등의 신기능 보호 효과가 있는 것으로 널리 알려져 있다[3-10]. Statin의 cholesterol-independent (pleiotropic) 효과는 mevalonate pathway 중 isoprenylation 억제를 통해 나타나게 된다[2]. Statin은 isoprenoid (FPP, GGPP)의 생성을 줄여주고, growth factor가 세포막에 결합하여 세포내 신호 전달 과정을 통해 전사인자를 활성화하고 혈관 내피 세포에서 세포 증식을 유발하는 것을 억제한다[2]. Bae 등[11]은 rosuvastatin이 deoxycorticosterone acetate (DOCA)-salt 고혈압 쥐에서 신장 피질의 TNF-α, MCP-1, ET-1, ICAM-1, TGF-β1 등 염증 및 섬유화와 관련된 cytokine이나 growth factor 등을 감소시키고 사구체 손상을 줄였다고 보고하였다. 그 외에도 statin이 허혈-재관류 신손상, 메산지움 증식성 신염, 싸이클로스포린 유발 신증 등 여러 동물 실험모델에서 신보호 효과가 있음이 알려져 있다[12-15].
만성콩팥병의 진행으로 나타나는 병리적 변화로는 사구체경화와 요세관간질 섬유화 등에 의한 신 손상이 관찰된다. Growth factor 특히 transforming growth factor-β1 (TGF-β1)의 영향으로 사구체메산지움 세포(mesangial cell)는 mesangioblast로 형질 전환되어 세포외 기질(extracellular matrix, ECM)을 분비하게 되고 사구체메산지움 세포의 확장을 유발하는 등의 초기 사구체 경화증 과정이 나타난다[16,17]. 요세관간질 섬유화도 신기능의 감소와 밀접한 관련이 있는데 사구체경화증처럼 염증, 세포 증식, 세포 소멸 그리고 섬유화의 일련의 과정이 진행된다[17,18].
그러나 본 연구에서는 8주간의 statin 치료 및 관찰 기간 동안 치료군과 대조군에서 신기능 변화에서 의미 있는 차이를 보이지 않았으며, 조직 검사를 시행하였을 때 사구체경화 정도, 요세관과 기질의 염증이나 섬유화에서 두 군 간에 차이를 보이지 못했다. 이는 이미 진행된 만성신부전에는 다른 콩팥병 모델에서 보여준 statin의 효과가 현저하게 나타나지 않음을 의미할 수 있다.
그러나 본 연구 관찰기간이 8주로 비교적 짧아 만성신부전에서 신장 병리 변화에 대한 statin 치료의 효과를 확정하기 위해서는 보다 장기적인 관찰이 필요하다.
Reactive oxygen species (ROS)는 활성화된 leukocyte와 macrophage에 의해 생성되는데, 과도한 생성이나 항산화 방어력의 장애는 oxidative stress를 초래하고 거대 분자들의 산화, 조직의 손상 및 기능 부전을 초래한다[19]. 만성콩팥병의 진행에 oxidative stress가 중요한 역할을 한다는 것은 이전부터 널리 알려져 있다. 당뇨병성 콩팥병의 진행에서 oxidative stress는 메산지움 세포에 영향을 주어 TGF-β1, fibronectin 등을 증가시키고, 전사 인자인 nuclear factor kappa B (NF-κβ)를 활성화시킨다[20,21]. 당뇨병성 콩팥병뿐만 아니라 다른 종류의 만성콩팥병에서도 oxidative stress가 신 손상의 진행에 중요한 역할을 한다는 보고들이 있다[22,23].
본 연구에서는 oxidative stress의 지표로 조직의 MDA 농도를 측정하였는데 통계적으로 의미 있는 차이는 없었으나 대조군에 비해 치료군에서 MDA농도가 감소되었다. 이러한 결과는 만성신부전에서도 statin에 의한 항산화 효과를 기대할 수 있음을 의미한다. 그러나 대조군과의 의미 있는 차이를 보여주지는 못했는데, 뚜렷한 항산화 효과를 확인하기 위해서는 이 연구에서 투여한 용량(10 mg/kg, 격일) 외에도 다양한 용량을 투여하는 연구가 필요하다. Whaley-Connell 등[24]은 유전자 변환을 통해 renin을 활성화시킨 6주령의 SD 쥐에게 rosuvastatin, 20 mg/kg을 복강 내로 투여하여 신장과 족세포의 NADPH oxidase 활성과 ROS 생성을 감소시켰고 oxidative stress에 의한 사구체여과막의 손상과 단백뇨를 줄이는 효과를 확인했다.
이 연구에서 의미 있는 결과로는 rosuvastatin을 투여한 군에서 TGF-β1이 감소했다는 점이다. TGF-β는 가장 강력한 pro-fibrotic cytokine 중의 하나로 기질의 증식을 유발하는 데 중요한 역할을 하고 있다는 것은 잘 알려져 있으며, 다양한 만성콩팥병에서 TGF-β의 발현이 증가하고, TGF-β의 투여 및 과도한 발현은 신장의 섬유화를 유발한다[18,25]. 특히, TGF-β의 subtype 중 하나인 TGF-β1은 내피 세포, 혈관의 평활근 세포, 근섬유아세포, 대식세포 등에서 발현되고 여러 TGF-β 중 심혈관계에서 가장 중요한 역할을 하며, 여러 가지 실험 모델에서 신질환의 진행을 유발하는 것으로 알려져 있다[26,27].
Statin은 고혈압성 신 손상에서 대식세포의 사구체 침윤을 감소시키고 TGF-β1의 발현을 감소시킬 뿐만 아니라 TGF-β1 신호 전달 체계 과정에서 중요한 Smad 2/3 phosphorylation을 억제하는 효과가 있다[28,29]. 싸이클로스포린 유발 신증에서도 사구체내의 대식세포 침윤을 억제를 통해 TGF-β1 mRNA의 발현을 감소시키고, eNOS 단백질의 발현을 증가시켜 요세관과 간질의 염증을 줄여준다[13]. 그 외에도, 당뇨병성 콩팥병이나 사구체신염 실험 모델에서도 statin이 TGF-β1 mRNA의 발현을 감소시켰으며, ox-LDL에 의한 TGF-β1 mRNA 발현을 줄여 주는 효과가 있었다[30-32].
본 연구에서도 이전의 다른 만성콩팥병에 대한 연구에서 보여준 결과와 같이 만성신부전에서도 statin 치료가 TGF-β1의 발현을 억제하는 효과가 있다는 것을 알 수 있었다. 이러한 효과는 statin 치료가 만성신부전에서도 항염증 효과를 통한 신기능 보호 효과를 기대할 수 있는 근거를 제시해 준다. 만성신부전에서도 다른 종류의 만성콩팥병에서 보고된 것과 같은 기전들이 관여하여 TGF-β1의 발현을 감소시켰을 것으로 생각된다.
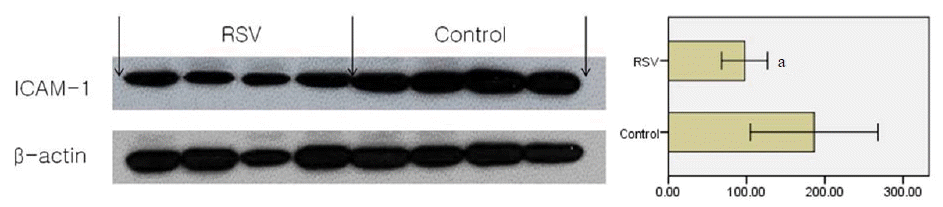
ICAM-1은 백혈구가 혈관 내피 세포에 단단히 부착하게 하여 혈관 밖으로 이동하도록 유도하는데 중요한 역할을 하는 물질이다[33]. Kido 등[34]은 ICAM-1 발현을 소실시킨 5/6 신절제 쥐를 6개월간 관찰하여 ICAM-1이 사구체내 대식세포의 침윤을 촉진하고 신장의 TGF-β1 발현 및 메산지움의 증식을 유발하여 과여과에 의한 신 손상의 진행에 중요한 역할을 한다고 보고하였다. 이전의 동물 연구에서도 당뇨병성 콩팥병이나 안지오텐신 유발 신 손상 모델에서 statin을 투여하여 ICMA-1 발현의 감소와 함께 신 손상을 줄일 수 있다고 하였다[35,36]. Statin이 ICAM-1이나 MCP-1, IL-6 등의 염증유발 물질을 감소시키는 기전으로는 TNF-α, IL-1 등의 cytokine이나 산화스트레스, 자외선 등의 여러 세포외 자극에 의해 활성화된 c-jun N-terminal kinase (JNK)가 NK-κB를 phosphorylation 및 활성화시키는 단계를 억제하며, 활성화된 NK-κB가 핵 내부로 전이되는 것을 막아 항염증 효과를 나타낸다는 보고가 있다[37].
본 연구를 통해 5/6 신절제로 유발한 만성신부전 모델에서도 statin 치료가 ICAM-1의 발현을 감소시킴을 밝혔으며, 만성신부전에서도 statin이 TGF-β1의 발현을 감소시키는 기전에 ICAM-1이 관련되어 있음을 알 수 있었다. 그리고 만성신부전에서 statin 투여로 ICAM-1 발현의 감소를 유발한 것은 statin이 만성신부전에서 혈관내 염증반응을 감소시킬 수 있으며, 이와 관련된 죽상경화증이나 혈관 질환 예방 효과가 있다는 이전의 연구들과 일치하는 것이다[2,3].
그러나 본 연구에는 몇 가지 중요한 제한점이 있다. 첫 번째는, 신부전 유발 후 대조군 및 치료군의 관찰 기간이 짧은 것이다. Kido 등[34]은 5/6 신절제 시행 후 6개월간 관찰 후 신 조직 소견, 신기능 및 단백뇨의 변화를 비교하였다. 그 외 5/6 신절제를 쥐를 이용한 신부전 모델 실험에서도 12주 이상 관찰하여 신장의 조직학적인 변화를 비교하였다[38-40]. 따라서 신절제술 후 과여과에 의한 신 손상의 진행을 확인하기 위해서는 좀 더 장기간 관찰하는 연구가 필요하다. 두 번째는, 약제 투여 방법에서 다양한 용량을 투여하여 용량에 따른 효과와 부작용을 확인하지 못했다. 이전의 연구에서 rosuvastatin, 20 mg/kg를 복강 내로 투여하여 신장의 항산화 효과와 단백뇨 감소 등 신 보호 효과를 확인한 연구가 있다[24]. Bulhak 등[28]은 rosuvastatin (10 mg/kg)을 복강 내로 주사하여 GGPP의 생성을 억제하여 심장의 허혈-재관류 손상을 줄여주는 효과를 확인하였다. 본 연구에서는 rosuvastatin을 단일 용량(10 mg/kg, 격일)으로 복강내 주사 방법으로 투여하여 용량에 따른 효과의 차이나 부작용을 확인할 수 없었다. 세 번째는 실험 개체 수가 적어 실험 과정의 오차로 발생할 수 있는 오류를 충분히 배제할 수 없으며 검사 결과 수치들의 통계적인 의미가 부족할 수 있다. 마지막으로, 연구 기간 동안 혈압을 측정하지 않아 혈압 변화에 의한 신 손상의 차이를 반영하지 못했다.
결론적으로, 만성신부전에서 단기간의 statin의 투여로 단백뇨 감소나 사구체여과율 등의 신기능을 보존하는 효과를 확인할 수는 없었으나, statin이 만성신부전에서도 항산화 효과와 항염증 효과가 있음을 알 수 있었다. 본 연구 결과는 statin이 만성 신부전의 진행을 지연시키는 효과를 기대할 수 있는 근거를 제시해 주는 것으로, 이 분야에 대한 향후 추가적인 연구가 필요하다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






