과거 20년 전 시행된 관상동맥 우회술과 약물치료의 비교 연구의 결과에 기반하여 보호 받지 않는 좌주간부 병변(unprotected left main coronary artery disease)의 표준 치료로서 관상동맥 우회 수술이 표준치료로 최근까지 자리매김해 왔다[1,2]. 좌주간부는 해부학적으로 접근이 용이하며 상대적으로 큰 직경을 가지고 있어, 이 부위에서 경피적 관상동맥 중재술의 적용은 중재시술분야의 심장 전문의에게 매우 흥미로운 도전 분야로 여겨졌다. 최근 수년 동안의 관상동맥 시술분야의 진보와 보조적 약물치료의 발전에 힘입어 좌주간부 협착에서의 중재시술이 각광을 받고 있으며, 약물용출 스텐트의 도입 후에 보호되지 않는 좌주간부 병변의 대체 치료로서 관상동맥 중재술의 의미가 재해석 되고 있다[3]. 하지만 아직까지 좌주간부 병변에 대한 관상동맥 중재술과 관상동맥 우회수술 간의 임상 연구 및 장기적 결과가 매우 미흡한 것이 사실이다. 이에 저자는 최근까지의 문헌고찰을 통하여 좌주간부 병변에 대한 표준치료의 대안으로 관상동맥 중재술의 현재 의미와 미래에 대해 고찰해 보고자 한다.
스텐트를 이용한 관상동맥 중재술의 결과
지난 수년 동안, 좌주간부 병변에서 일반 스텐트(bare-metal stent)를 이용한 관상동맥 중재술은 중ㆍ단기결과에서 그 가능성을 보여 주었다. 이러한 경험을 초석으로 약물용출 스텐트가 개발되었고, 일반 금속 스텐트의 단점이 보완되면서 경험이 풍부한 중재 시술자들은 현재 보호되지 않는 좌주간부 병변에 대해 중재시술을 널리 시행하고 있다.
여러 비 무작위 관찰 연구의 결과를 살펴보면, 소규모의 단기 결과임을 감안하더라도, 일반 스텐트에 비해 약물용출 스텐트의 결과가 낙관적임을 알 수 있다[4-7]. 최근, 보호되지 않은 좌주간부 병변에서 약물용출 스텐트와 일반 스텐트를 비교한 대규모의 메타 분석이 보고되었다[8]. 44개의 연구에서, 일반 스텐트나 약물용출 스텐트를 시술 받은 10,342명의 환자가 분석되었다. 3년째 각 사건의 누적 발생률은 사망은 일반 스텐트 사용 군에서 12.7%, 약물용출 스텐트 사용 군에서 8.8%의 비율을 보였으며 심근 경색은 각각 3.4%와 4.0%, 표적혈관 재관류 또는 표적병변 재관류는 각각 16.4%와 8.0%, 주요 심장 사건은 31.6%와 21.4%으로 나타났다. 각 임상사건별 스텐트 종류에 다른 보정 위험도는 그림 1에 기술되어 있다.
개구부 및 체부 좌주간부 병변(ostial and/or shaft disease)
좌주간부 병변에서 스텐트 삽입술의 성공과 실행 가능성 여부를 판단하기 위해선 우선 좌주간부 병변의 해부학적 특징이 면밀히 검토되어야 한다. 또한 관상동맥 경화반이 좌주간부의 개구부내 분포 여부, 좌주간부의 길이 및 좌주간부 말단에 위치하여 좌전하행지나 좌회선지까지 침범하면서 분지부의 혈류를 막는 경화반의 범위도 확인하여 시술의 적용 가능성을 가늠해봐야 한다. 약물용출 스텐트의 사용으로 인한 재협착의 괄목할 만한 감소와 접근 용이성으로 인해 중재시술의 성공 가능성이 높아짐에 따라, 좌주간부 개구부 및 체부 병변에 대한 중재시술은 매력적인 시술 대상이 되어왔다. 최근 발표된 다기관 관찰연구에서 시술 성공률이 환자의 99%에 이르며, 입원 중 Q-wave 심근경색이나 사망이 발생하지 않고, 재협착 및 조영술 상 후기 스텐 내 직경의 후기소실이 0.01 mm 및 재협착률이 0.9%으로 낮아 약물방출 스텐트의 장기 성적이 양호함을 보여 주고 있다[9]. 또한 2년여의 임상관찰 동안 누적 사망률은 3.4%, 목표혈관 재개통률은 4.7%로 양호하였다.
말단 분지부 병변
좌주간부 병변이 있는 환자의 절반 이상(60-90%)은 분지부 말단에 병변이 존재한다. 여러 연구에서 좌주간부 말단에서 단일 스텐스 시술의 결과가 두 개 이상의 스텐트를 이용한 복합 스텐트 시술보다 임상경과가 우수함을 증명하였다[10,11]. 말단 분지부에 병변이 있다 하더라도 단일 스텐트를 이용한 중재술시 목표병변 재협착의 발생 비율이 매우 낮으며(< 5%), 이는 좌주간부 개구부와 중간부에서의 성적과 거의 유사하다[4-6]. 그러나 좌주간부 말단 병변을 2개 이상의스텐트로 치료한 복합 스텐트 시술시 목표병변 재협착의 발생이 25%까지 증가하며, 이때 재협착은 좌회선지의 개구부에 주로 발생하는 것으로 알려져 있다. 최근 보호되지 않은 좌주간부 병변에 약물용출 스텐트를 시술 받은 1,111 환자를 대상으로 한 대규모 관찰 연구에[12] 따르면 개구부와 중간부 병변에 비하여 말단 분지부 좌주간부 병변에서 50% 이상 더 많은 임상 사건이 발생하였으며 특히 분지부에서 복잡하게 스텐트를 삽입한 경우에 더욱 그런 경향을 보였다. 하지만, 단일 스텐트 시술을 받은 경우와 개구부 또는 중간부 병변에서 시술을 받은 경우와의 비교에서는 유의한 임상사건 차이를 보이지 않았다.
좌주간기 병변 중재술의 안전성
약물용출 스텐트를 이용한 관상동맥 중재술이 광범위하게 이용됨에 따라 장기적 안전성, 특히 후기 스텐트 혈전과 사망률 등에 대한 관심도 높아지고 있다[13-15]. 이와 관련하여 보호되지 않은 좌주간부 병변에서의 스텐트 삽입 술 후 스텐트 혈전증 발생시 직접적으로 돌연사의 위험을 높일 수 있다는 우려와 장기적인 임상 자료의 부족으로 약물용출 스텐트를 이용한 중재술이 좌주간부 병변에서 관상동맥 우회술을 대체 하는 방법으로의 선택에 주저함 있는 것이 사실이다. 하지만, 최근 발표된 보호되지 않는 좌주간부 병변에서 약물용출 스텐트을 이용한 중재술의 안전성에 대한 결과들은 이러한 우려를 약화 시키고 있다[16-19]. 여러 대규모 관찰연구의 결과를 살펴 보면 좌주간부에서 1-3년 이내 발생하는 스텐트 혈전증의 빈도는 약 1-2% 정도이며, 이는 통상적으로 실제 임상에서 좌주간부가 아닌 다른 관상동맥 부위의 스텐트 삽입술 이후 발생하는 스텐트 혈전증의 빈도와 유사하거나 오히려 낮은 빈도라 할 수 있다. 또한 1세대보다 효용성과 안정성이 뛰어난 2,3세대 스텐트를[20,21] 사용이 이러한 장기 안정성에 대한 우려가 많이 감소될 것으로 판단된다.
스텐트를 이용한 중재술의 기술적인 측면
분획혈류 예비력(fractional flow reserve, FFR)을 이용한 진단(decision-making)
최근 다혈관 관상동맥 질환에서 분획 혈류 예비력을 이용한 관상동맥 중재술 시행을 결정하는 것이 주요 심장 사건의 발생을 줄일 수 있다는 연구 결과들이 발표되고 있다[22]. 이전 연구 결과에 따르면 좌주간부 질환에서 FFR이 0.75-0.80 이상이면 장기 관찰의 예후가 양호한 것이 증명되었다[23-25]. Jasti 등은 FFR이 0.75 미만인 군(혈관개통술 시행군)과 이상인 군(약물치료군) 사이에 38개월간 생존율(100% vs. 100%, p > 0.05)과 무사건 생존율(event-free survival)에서 유의한 차이가 없음(100% vs. 90%, p > 0.05)을 보고하였다[23].
또한 좌주간부 협착이 모호한 경우, FFR 0.80을 기준으로 치료효과를 비교한 연구에서는 FFR이 0.80 미만에서 우회수술을 받은 경우와 0.80 이상에서 약물 치료를 한 군 사이에서 두 군 간에 5년 생존율(85.4% vs. 89.8%, p = 0.48)과 5년 무사건 생존율(74.2% vs. 82.8%, p = 0.50)에서 유의한 차이가 관찰되지 않았다[25]. 따라서 중등도의(intermediate) 좌주간부 협착에서 FFR의 측정은 높은 생존율과 낮은 사건 발생을 뒷받침하면서 중재술을 연기할 수 있는 좋은 근거 자료가 된다.
해부학적 측면에서 볼 때 FFR은 좌주간부 관상동맥 질환 중 특히 개구부나 체부 병변의 허혈 평가를 위해서 반드시 고려해야 할 사항이라고 볼 수 있다. 최근 중등도의 협착을 동반한 좌주간부 질환에서 FFR와 IVUS를 비교한 연구를 보면 혈관조영술의 협착 정도와 FFR의 수치는 일치도가 매우 부족했으며, 조영술상 50% 이상의 협착이 FFR 0.80 이하를 예측할 민감도는 51%, 특이도는 75%에 불과하여 중등도의 협착이 동반된 환자에서는 반드시 FFR의 측정에 따른 치료 계획이 필요할 것으로 판단된다[26].
혈관 조영술을 통한 좌주간부 협착 정도의 평가는 여러 원인으로 인하여 부정확한 경우가 많았으며, 혈관내 초음파(intravascular ultrasound, IVUS)를 이용하여 좌주간부 병변의 기능적 특징과 임상적 결과의 관련성이나 형태학적, 생리학적 그리고 장기적 예후와의 통합적 해석에 대한 시도가 계속되어 왔다. 최근 FFR threshold 수치를 바탕으로 의미 있는 좌주간부 병변으로 판정되었을 때 이에 해당되는 혈관내 초음파의 최소 혈관 내경(minimal lumen area; MLA)의 한계점(cut-point)은 5.9 mm2-9.6 mm2으로 다양하였으며, 의미 있는 좌주간부 병변을 정의 할 명확한 한계점의 정의에 대해서는 아직까지 매우 부족한 실정이다. 최근 Kang 등의 연구에 의하면 혈관조영술의 협착 정도에 비하여 IVUS로 측정한 MLA가 더욱 FFR의 변화를 잘 반영하였으며, FFR 0.80 이하를 예측하는 IVUS-MLA의 예측 수치는 4.8 mm2으로 이때 민감도 89%, 특이도 83%, 양성 예측도 82%, 음성 예측도 89%, 및 정확도 86%였다[26]. 이 연구는 중등도의 병변을 보이는 좌주간부 병변에서 FFR을 이용한 생리학적 의미를 갖는 IVUS의 적절한 기준을 제시한 중요한 연구로 사료 된다. 이는 결론적으로 좌주간부 질환에서 FFR로 대변되는 관상동맥 협착의 기능적 협착 정도(functional significance)를 혈관조영술상의 협착 정도보다 IVUS상의 최소혈관내경이 더욱더 잘 반영함을 나타내는 소견이다.
IVUS를 기반으로 한 시술 최적화
일반적인 관상동맥 조영술은 혈관내경을 통한 내경기록(lumenogram)에 국한된 정보만 제공하기 때문에 병변이나 경화반(plaque)의 특성을 파악하는데 제약이 있다. 특히 좌주간부 병변은 큰 혈관 직경, 짧은 정상 참조부분(short normal reference segment), 주요 혈관과의 겹침, 대동맥 판막 첨판으로 인한 혼탁화(aortic cusp opacification), 조영제의 유동성, 다양한 각형성 등의 특성을 보이기 때문에 혈관 조영술 만으로는 병변의 정확한 파악에 제한이 따를 수 있다.
좌주간부 병변에서 중재시술 동안, 특히 말단 분지부 병변에서 IVUS를 통한 중재술은 협착의 정도, 경화반 특성, 해부학적 구조(특히 주요 분지의 윤곽)와 함께, 정확한 스텐트 삽입을 위한 스텐트의 적절한 직경과 길이 선택 및 중재술 후 stent underexpansion, 병변의 적용범위의 적절성 여부, 잔여 경화반, 스텐트의 안착(apposition) 여부 등을 확인하는데 매우 유용하게 사용 될 수 있다. 최근 대규모 다기관 연구에서 좌주간부 질환 중재시술시 조영술만을 이용한 일반적인 중재술과 비교하여 IVUS를 이용한 중재술에서 장기사망률을 더 낮출 수 있음이 확인되었다[27]. 또한 제한적인 결과이지만 말단 좌주간부 병변에서 약물 방출 스텐트 중재술 전후에 IVUS를 통한 정밀 관찰이 추후 adverse event를 예측할 수 있음을 시사하고 있다. 특히 좌주간부 병변의 개시부나 체부의 협착 정도에 비하여 분지부 병변의 진단 및 치료에 있어서 IVUS 소견을 바탕으로 한 치료가 매우 중요할 것으로 판단된다.
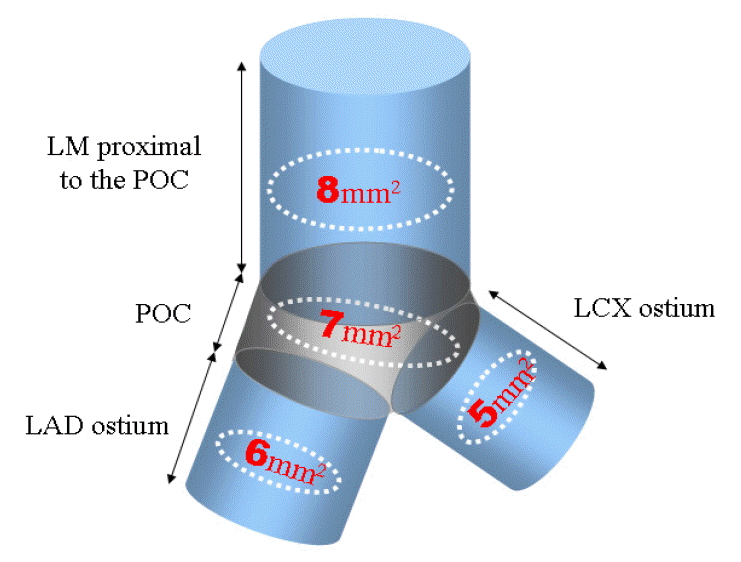
Kang 등은 말단 좌주간부 병변의 분지부에 약물용출 스텐트를 삽입한 169명의 환자를 대상으로 한 연구에서, 좌주간부 말단부터 좌전하행지 분지부(LAD carina) 내에 있는 병변에서 스텐스 시술 이후 최소 스텐트내 면적(minimal stent area)을 예측하는 독립적 인자로 좌전하방 동맥 분기부의 최소 혈관내경(β = 0.253, 95% CI = 0.10-0.36, p = 0.001)과 좌전하행지 동맥과 좌회선지가 합류하는 다각부(polygon of confluence)에서의 최소 혈관내경(β = 0.205, 95% CI = 0.04-0.23, p = 0.008)을 제시하였다[28]. 다변량 Cox 모델 분석에 의하면 3년내 사건 발생의 독립적 예측 인자는 여성(adjusted HR = 2.56, 95% CI = 1.173-5.594, p = 0.018)과 다각부의 최소 혈관내경(adjusted HR = 0.829, 95% CI = 0.708-0.971, p = 0.020)으로 나타났다. 즉, 좌전하행지에서 IVUS를 pullback하는 간단한 방법을 통해 다각부의 최소 혈관내경을 확인하는 것이 좌전주간지 분지부의 전반적인 중증도와 좌주간부 말단 분지부의 스텐트 후 최소 스텐트 면적 및 추적기간 동안 장기적 임상 결과를 예측할 수 있는 중요한 인자라 할 수 있겠다.
좌주간부 중재술 이후 발생한 스텐트내 협착(in-stent restenosis)의 최적의 치료방법
보호되지 않은 좌주간부 병변에서 스텐트 내 협착에 대한 임상경과나 치료방법에 대한 자료는 많지 않다. FAILS (Failure in Left Main Study) 연구에서는 좌전주간부 병변에서 스텐트 이후 재협착이 발생한 70명의 환자를 대상으로 한 연구로써, 59명(84.3%, DES, BMS, 또는 풍선확장술을 받은 경우)은 재시술을 받았고, 7명(10%)에서는 우회수술을 시행하였으며, 4명(5.7%)는 약물적 치료를 받은 환자가 대상이 되었다[30]. 27개월간의 추적관찰 기간 동안, 장기 주요 심장 사건의 누적 발생률은 약물적 치료 군에서 50%에 달하였으며, 재시술을 받은 군에서는 25%, 우회수술을 받은 군에서는 14%의 빈도를 보이고 있었다.
Lee 등은 좌주간부 병변에서 약물용출 스텐트 시술을 받은 402명의 환자 중 재협착이 발생한 71명(17.6%)의 환자를 보고 하였다[31]. 이들 중 57명은 국소적 재협착 소견이었으며, 14명은 미만성 재협착을 보이고 있었다. 40명(56.3%)에서는 재시술을 받았으며, 10명(14.1%)은 우회수술을 그리고 21명(29.6%)은 약물 치료를 받았다. 장기간의 추적관찰 기간 동안(중앙값 31.7개월) 발생한 주요 심장 사건은 약물 치료 군에서는 14.4%, 중재술을 받은 군에서는 13.6%, 우회수술을 받은 군에서는 10.0%의 분포를 보이며 통계학적으로 유의한 차이를 보이지 않았다. 이러한 결과는 좌주간부에서 약물용출 스텐트 시술 이후 발생한 스텐트내 재협착의 임상적 장기경과가 치료방법에 상관없이 비교적 안정적인 임상경과를 보이는 것을 시사하며, 여러가지 임상상황을 바탕으로한 시술자의 선택에 의하여 재치료 방법을 선택하는 것이 바람직함을 보여주고 있다.
중재시술과 우회수술 간의 효용성과 안정성
현재까지의 치료 가이드라인에 의하면 관상동맥 우회수술이 의미 있는 좌주간부 질환에서 재개통술 방법으로 추천되고 있는 표준 치료법이다. 수술적 접근방법은 대동맥에서직접 좌전하행지나 좌회선지 말단으로 우회하기 때문에좌주간부 병변이 갖는 해부학적인 난해성을 쉽게 극복할 수있고, 또한 다혈관 질환의 근치적 재개통화(complete revascularization)를 쉽게 이룰 수 있다. 하지만 이러한 잇점에도 불구하고, 수술 후 심근이 전적으로 정맥을 통해 혈류를 공급 받게 되며, 정맥 이식으로 인해 개통 유지에 제한이 있다는 점이 간과할 수 없는 단점으로 알려져 있다. 반면에 큰 혈관구경과 접근 하기 쉬운 점에서 좌주간부 병변에서의 중재술은 기술적으로 용이하며, 성공적 시술이 이루어 진다면 기존의 관상동맥 혈관 구조를 유지하면서 완전한 동맥의 재개통화(arterial revascularization)를 보장할 수 있다는 장점을 가지고 있다[32].
최근까지 좌주간부 질환에서 관상동맥 우회술과 중재시술을 비교한 연구는 표 1에 요약되어 있으며, 정리되어 있으며 연구의 형태별로 자세히 정리하면 다음과 같다.
Registry data
최근까지 여러 작은 연구에서 좌주간부 병변에서 관상동맥 중재술과 관상동맥 우회술의 중단기 안전성과 유용성에 대한 비교 연구가 있었다[33-37]. 이들 연구 결과를 보면, 관상동맥 우회술을 받는 경우 수술직후에 심근경색이나[33] 뇌혈관 질환의 발생이[34] 스텐트 시술에 비하여 유의하게 증가하기 때문에 초기 임상적 사건의 발생 빈도는 우회술보다 조금 높거나 비슷하게 나타났으며, 1년간의 중단기 사망률은 양 군 간에 유사하였다. 하지만 목표병변 재개통화의 빈도는 우회술에서보다 중재술 군에서 지속적으로 높게 나타나고 있었다.
MAIN-COMPARE registry는 대규모 다기관 환자모집을 통하여 보호되지 않은 좌주간부 병변에서 일반 스텐트나 약물용출 스텐트를 이용한 스텐트 시술과 우회술의 장기적 경과를 비교한 연구이다[19]. 국내 유수의 심장 센터에서 2,240명의 보호되지 않은 좌주간부 병변에서 스텐트 시술(일반스텐트; 318명, 약물용출성스텐트; 784명) 및 관상동맥 우회술을 받은 환자(1,138명)가 연구에 참여하였다. 통계학적 방법인 propensity-matching 후 3년째 발표된 결과를 살펴보면, 사망 위험도와 사망, Q파 심근경색, 뇌졸중 등의 위험도는 중재술 군과 우회술군에서 유사하게 나타났으며, 일반 스텐트나 약물용출 스텐트 각각과 우회술을 비교한 경우에도 비슷한 경향을 보였다. 그러나 목표병변 재개통화의 비율은 우회술 군에서보다 중재술 군에서 의미 있게 높게 나타 났으며 상대적 위험도는 스텐트 종류에 따른 차이가 있었으며, 우회술과 비교 하여 약물용출 스텐트에서는 약 6배, 일반 스텐트에서는 10배에 가까운 재개통화가 필요하였다. 최근 발표된 MAIN-COMPARE registry의 5년 장기 결과에서도[38] 중재술 군과 우회수술 군간에 5년째 사망(HR: 1.13; 95% CI: 0.88-1.44, p = 0.35)이나 사망, Q파 심근경색, 뇌졸중의 통합 위험도(HR: 1.07; 95% CI: 0.84-1.37, p = 0.59)에서 의미 있는 차이는 없었다. 그러나 목표병변 재개통화의 위험도는 우회술의 경우보다 스텐트 시술을 받은 경우에서 높게 나타났다(HR: 5.11; 95% CI: 3.52-7.42, p = 0.001).
무작위 임상 시험연구
좌주간부 병변에서 관상동맥 우회술과 중재술을 무작위로 비교한 연구는 극히 제한적이다. 두 가지 치료 법을 무작위 배정으로 통해 혈관 재개통화를 시도한 경우에라도, 종료점이 너무 복합적이거나, 대상 환자수가 너무 작거나, 추적 기간에 제한이 있는 연구가 대부분이었다. 또한 연구에 참여하는 과정에서 바이어스가 발생할 수 있어 연구가 종료된 이후 주요 제한점이 될 수 있으나, 여러 교란변수를 배제한 실제 치료 효과를 평가할 수 있는 유일한 임상연구 형태이다.
보호되지 않은 좌주간부 병변에서 관상동맥 중재술과 우회술을 무작위 배정으로 비교한 첫 연구는 LeMANS trial이다. 이 연구에서 중재술은 52명의 환자에서 우회술은 53명의 환자에서 시행되었으며, 다혈관 병변 동반 여부와 상관없이 좌주간부 병변이 있는 환자들이었다[39]. 관상동맥 중재술 군에서 약물용출 스텐트는 35%에서 사용되었으며, 우회술을 받은 경우 72%에서 좌내유동맥을 이식하였다. 1년째 일차 연구종료점인 좌심실 박출률의 절대적 변화는 우회술군보다 중재술 군에서 유의하게 높게 나타났으나(0.5 ± 0.8% vs. 3.3 ± 6.7%; p = 0.047), 이차 연구종료점인 생존율과 주요 뇌-심장 주요사건의 발생 정도는 두 군에서 비슷하게 나타났다. 그러나 이 연구는 환자수가 적고 비특이적인 일차 연구 연구종료점을 정함으로써 임상적 치료 효과를 적절히 해석하는데 많은 제한점이 있다.
SYNTAX trial의 좌주간부 질환환자 분석에서는[40] 우회술을 받은 군과 중재술을 받은 환자 군에서 12개월 동안 주요 심장 또는 뇌혈관 사건이나, 사망, 심근경색, 뇌졸중이 유사하게 나타났으나, 목표혈관 재개통화는 약물용출 스텐트를 사용한 군에서 높게 나타났다. 특히, 좌주간부 병변이 있는 환자의 세부 분석에서 좌주간부 병변만 있거나, 단일혈관 병변만 동반된 경우에 비해 둘 또는 세 가지 혈관에 동시에 병변이 동반되었던 경우에서 임상사건의 발생이 높은 비율로 나타났으며(7.1% vs. 7.5% vs. 19.8% vs. 19.3%), 이러한 경향은 3년간의 장기 임상 경과 관찰에서도 지속되는 소견이었다[41].
최근 Boudriot 등은 보호되지 않은 좌주간부 병변에서 무작위로, sirolimus-용출 스텐트를 사용한 경우와(100명) 관상동맥 우회술(101명)을 받은 경우의 비교한 결과를 보고하였다[42]. 12개월째 비열 등 검정을 통한 일차연구 종결점은 중재술 군에서 우회술 군과 비교하여 열등하지 않은 결과를 보여주었으며(19.0% vs. 13.9%), 사망과 심근경색을 통합한 발생률에서도 비슷한 결과를 보였다(5.0% vs. 7.9%). 하지만 재개통술의 발생률은 중재술군에서 유의하게 높게 나타났다(14.0% vs. 5.9%).
최근 좌주간부 치료로 관상동맥 우회술과 sirolimus-용출 스텐트를 이용한 관상동맥 중재술을 무작위로 배정한 대규모 연구의 하나인 PRECOMBAT (Randomized Comparison of Bypass Surgery Versus Angioplasty Using Sirolimus-Eluting Stent in Patients With Left Main Coronary Artery Disease)의 결과가 발표되었다[43]. 치료방법에 따라 각각 300명씩의 환자가 연구에 참여하였으며, 일차 연구종결점은 주요 심장사건 또는 뇌혈관 사건으로 사망, 심근경색, 뇌졸중, 목표 혈관 재개통화등을 포함하고 있으며, 2년째 일차 종결점의 발생률은 양 군 간에 통계학적으로 유의한 차이가 없었다(스텐트 시술, 12.1% vs. 우회술, 8.1%, p = 0.12). 또한 사망, 심근경색, 뇌졸중의 통합 발생률 또한 양 군에서 유사하였다(4.4% vs. 4.7%). 하지만 혈관 재개통술은 중재술군에서 유의하게 높게 발생하였다(9.0% vs. 4.2%; p = 0.02). 앞으로 발표될 대규모 무작위 임상연구인 EXCEL (Evaluation of Xience Prime versus Coronary Artery Bypass Surgery for Effectiveness of Left Main Revascularization) 연구 또한 약물용출 스텐트(에버로리무스 용출성 스텐트)를 이용한 중재술과 관상동맥 우회술의 효용성과 안정성을 비교할 연구로써 좌주간부 병변에서 우회술과 중재술의 위치를 재조명할 것으로 여겨져 귀추가 주목된다.
메타 분석(meta-analysis)
Taggart 등이 발표한 통합 분석(systemic analysis)에 의하면 초기(병원 입원 중 사망 또는 30일 이내) 사망률이나, 장기 사망률(1-2년 이내)이 우회술과 비교하여 일반 스텐트를 사용한 경우(초기 0-14%, 평균 6%; 후기 3-31%, 평균 17%)나, 약물용출 스텐트를 사용한 경우(초기 0-10%, 평균 2%; 후기 0-14%, 평균 7%)에서 높게 나타남을 발표하였다[44].
이와 다른 연구 결과로 Takagi 등은 보호되지 않은 좌주간부 병변이 있는 2,181명의 환자(중재술 1,006명, 우회술 1,175명)의 6개 연구(무작위 연구 1개, 관찰연구 5개)를 메타분석 하였다[45]. 이 연구에서 두 군 간에 사망률에는 유의한 차이를 보이지 않았으나(OR 0.99, 95% CI 0.69-1.43, p = 0.97), 중재술 군에서 재개통화가 유의하게 높게 나타났다(OR 5.05, 95% CI 3.07-8.30, p< 0.001).
Lee 등도 최근 보호되지 않은 좌주간부 병변에서 약물용출 스텐트 중재술과 우회술을 비교한 비슷한 메타 분석을 발표 하였으며[46], 8개의 임상 연구(무작위 연구 2, 관찰 연구 6)에서 2,905명의 환자가 분석되었는데, 1년의 추적 기간 동안 사망률(OR 1.12, 95% CI 0.80-1.56)이나 사망, 심근 경색, 뇌졸중의 통합 발생률(OR 1.25, 95% CI 0.86-1.82)은 두 군 간에 유의한 차이가 없었다. 하지만 목표혈관 재개통화의 비율은 중재술 군에 비해 우회술 군에서 유의하게 낮게 나타났다(OR 0.44, 95% CI 0.32-0.59). 그러나 이와 같은 전반적 분석이나, 메타 분석은 환자수의 제한이나 선택 바이어스 또는 검토되는 과정에서 출판 바이어스가 있을 수 있어 그 해석에 있어 주의를 요하는 예비 결과임을 알아야 하며, 임상 연구를 포함하고 있어 내적 타당성을 온전히 신뢰하는 것은 옳지 않다.
장기적 임상 결과들
좌주간부 병변에서 우회술과 비교하여 관상동맥 중재술의 성공적인 이용에 대한 여러 연구가 보고되었으나 5-10년까지의 장기적인 비교 결과에 대해서는 아직 제한적이다. 다른 부위의 관상동맥 질환에서 관상동맥 스텐트 삽입술이 5-10년 동안 안정적이라 하더라도 보호되지 않은 좌주간부 병변에서 스텐스 시술의 적용에 대해서는 아직 확립된 바가 없다. ASAN-MAIN (ASAN Medical Center-Left MAIN Revascularization) registry는 우회술과 중재술을 가장 장기간 비교한 연구 결과로써 일반 스텐트는 10년간 약물용출 스텐트는 5년간 추적관찰되었다[45].
우회술과 비교하여 일반스텐트 중재술을 받은 10년 코호트 군에서 보정 후의 사망 위험도(HR: 0.81; 95% CI: 0.44 to 1.50; p = 0.50)와 사망, Q파 심근경색, 뇌졸중의 통합 발생 위험도(HR: 0.92; 95% CI: 0.55 to 1.53; p = 0.74)는 두 군 간에 유의한 차이를 보이지 않았다. 다만, 목표혈관 재개통의 위험도는 유의하게 일반스텐트 중재술을 시행 받은 군에서 높게 나타났다(HR: 10.34; 95% CI: 4.61 to 23.18; p = 0.001). 약물용출 스텐트 시술을 받은 5년 추적 코호트 군과 우회술을 받은 환자의 비교에서도 보정 후 사망 위험도(HR: 0.83; 95% CI: 0.34 to 2.07; p = 0.70)와 사망 등의 통합 발생률의 위험도(HR: 0.91; 95% CI: 0.45 to 1.83; p = 0.79)는 여전히 유의한 차이가 없었으나, 목표혈관 재개통률의 위험도(HR: 6.22; 95% CI: 2.26 to 17.14; p = 0.001)는 중재술 군에서 높게 나타났다.
미국심장협회/미국심장학회의 현재의 가이드 라인의 변화
미국심장협회/미국심장학회에서 관상동맥 중재술에 대한 가이드 라인이 최근 개정되었다. 스텐트 시술에 대해 off-label 경험과 임상연구(특히 SYNTAX 연구 및 MAINCOMPARE 연구)의 증가를 반영하여 치료 가이드 라인을 개정하고자 하고 있으며, 좌주간부 협착의 지침으로 중재술 치료를 Class IIb로 승격시키고자 하고 있다[47]. 현재의 축적된 지식과 향후의 연구를 기반으로 한다면, 좌주간부 병변에서 스텐트 중재술을 IIb보다는 IIa으로 여기는 것이 타당할 것으로 여겨지며 이에 대한 추가적인 논의가 있을 것으로 예상된다.
최근 유럽 심장학회와 유럽 심장-흉부 학회에서도 좌주간부 병변에서으로 관상동맥 우회술을 대신할만한 치료법으로 관상동맥 중재술을 적용할 진료 지침을 발표하였는데 정리하면 다음과 같다; (1) 좌주간부 단일 병변이거나 단일 혈관 병변이면서 개구부 인경우(class IIa B), (2) 좌주간부 단일 병변이거나 단일 혈관 병변이면서 말단 분지부인 경우(class IIb B), (3) 2 또는 3혈관 병변이 동반된 좌주간부 협착이면서 SYNTAX score가 32이하인 경우(class IIb B), (4) 2 또는 3혈관 병변이 동반된 좌주간부 협착이면서 SYNTAX score가 33 이상인 경우(class III B)이다[47].
표 2는 최근까지의 미국 및 유럽의 좌주간부 질환 치료에 대한 과거 및 현재의 가이드 라인을 정리한 내용이다.
결론: “좌주간부 스텐트 시술의 현재와 미래”
최근까지의 임상 연구와 대규모 off-label의 경험들을 바탕으로 좌주간부 관상동맥 질환에서 스텐트를 이용한 관상동맥 중재술이 기존의 표준치료 방법인 관상동맥 우회술과 비교하여 사망률과 이환율에서 긍정적인 결과를 보여주고 있어 우회술을 대치할 만한 치료로 각광받고 있다. 또한 최근 발표된 다기관 무작위 임상연구인 PRECOMBAT 연구의 결과가 발표되면서 좌주간부 병변에서 약물스텐트를 이용한 시술방법이 더욱더 확고한 입지를 다지게 되었다. 향후 머지않은 미래에 더욱 정교한 기술과 기구의 발전 및 생리학적, 영상학적 보조와 더불어 우수한 약제의 병합으로 관상동맥 중재술은 좌주간부 병변에서 향상된 성공률과 장기 임상 안정성을 증명함으로써 그 위상을 더욱 확고히 할 것으로 예상된다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






