면역글로불린과 Leflunomide로 치료한 BK 바이러스 신병증 1예
A Case of Combining Intravenous Immunoglobulin and Leflunomide for BK Nephropathy
Article information
Abstract
저자들은 면역억제제의 감량과 항바이러스제치료에도 진행하는 BK 바이러스 신병증을 면역글로불린으로 치료한 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
BK virus nephropathy has emerged as an important cause of renal allograft dysfunction. It affects 1-10% of renal transplant patients and results in significant graft dysfunction in more than 50% of cases. A reduction in the amount of immunosuppressants is not an appropriate treatment option for advanced stage BK nephropathy; therefore, other treatment strategies need to be considered such as cidofovir, leflunomide, and intravenous immunoglobulin (IVIG) in combination with reduced immunosuppression. The use of IVIG may be a valuable treatment option in patients with BK virus nephropathy. We report our experience with IVIG rescue therapy in a patient and the progression of BK nephropathy despite leflunomide therapy. (Korean J Med 2011;81:512-516)
서 론
BK 바이러스 신병증은 신장 이식 환자에서 이식 신 기능 저하를 일으키는 중요한 원인이다. 국내에서는 아직까지 BK 바이러스 신병증의 정확한 발생빈도가 알려져 있지 않으나 몇몇 보고에 의하면 0.5-1%이고[1], 외국의 경우에는 1-10%로 보고하고 있다[2]. BK 바이러스 신병증이 진행된 시기에 진단하면 이식 신 소실이 1년 내에 약 50%에서 발생하기 때문에[3] 항바이러스 제제와 면역글로불린 등이 BK 신병증의 치료제로 이용되고 있다. 특히 면역글로불린은 급성거부반응이 동반된 경우에 항거부반응과 함께 항바이러스 효과로 사용되고 있다. 이에 저자들은 BK 바이러스 신병증 환자에서 면역 억제제를 감량하고 leuflunomide를 투여한 후에도 혈중 BK 바이러스가 지속적으로 증가하는 환자에서 면역글로불린을 병용하여 치료한 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 남자, 66세
주 소: 크레아티닌 수치의 상승
현병력: 약 3년 전 당뇨병으로 인한 말기신부전으로 필리핀에서 사체신장 이식을 받았고 유지 면역억제제로 prednisolone 5 mg, tacrolimus 2 mg, mycophenolate mofetil (MMF) 1.5 g을 매일 복용하고 있었다. 신이식 19개월에 크레아티닌이 1.0 mg/dL에서 1.3 mg/dL로 상승하였으나, 당뇨병성 족부 감염으로 항생제를 간헐적으로 복용하고 있어, 약제로 인한 부작용의 가능성이 높다고 판단되어 외래에서 주기적으로 관찰하던 중 신이식 29개월에 크레아티닌이 1.8 mg/dL로 상승하여 입원하였다.
과거력: 제2형 당뇨로 9년 전부터 인슐린을 사용하였다.
가족력: 특이사항 없었다.
진찰 소견: 입원 시 혈압은 130/80 mmHg, 맥박은 70회/분, 호흡수는 15회/분, 체온은 36.5℃이었다. 호흡음이나 심음에는 이상 소견이 없었고, 흉부 및 복부 진찰상 이상 소견 없었다.
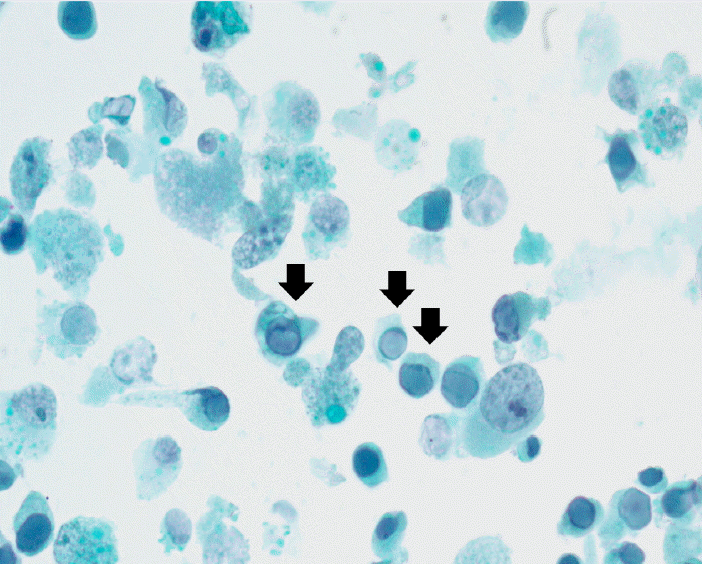
검사 소견: 입원하여 시행한 검사결과는 백혈구 10,580/mm3, 혈색소 11.7 g/dL, 혈소판 242,000/mm3이었다. 혈청 크레아티닌은 1.8 mg/dL, tacrolimus 혈중농도는 9.7 ng/mL였다. 소변검사에서 단백뇨나 현미경적 혈뇨는 없었다. 이식 신 도플러 초음파 결과 관류 상태는 정상이었고, 신 주변의 액체 저류는 없었으며, 신 동맥 저항 계수는 0.75였다. 거대세포 바이러스 pp65항원혈청 검사 및 중합연쇄반응 검사는 음성이었다. 소변의 광학현미경 소견에서 이형세포(decoy cell)가 관찰되었고(Fig. 1), 혈청 BK 바이러스 DNA는 1.1 × 106 copies/ mL, 소변 BK 바이러스 DNA는 2 × 109 copies/mL였다.
병리조직 검사: 이식 후 29개월째에 이식 신 조직 검사를 시행하였고, 광학 현미경 소견에서 대부분의 세뇨관 세포 핵 내에 호염기성 봉입체가 관찰되었다(Fig. 2). Simian virus 40 (SV 40) 항원에 대한 면역조직화학 염색에서 핵내 양성을 보여 BK 바이러스에 의한 신병증으로 확진하였다(Fig. 3).
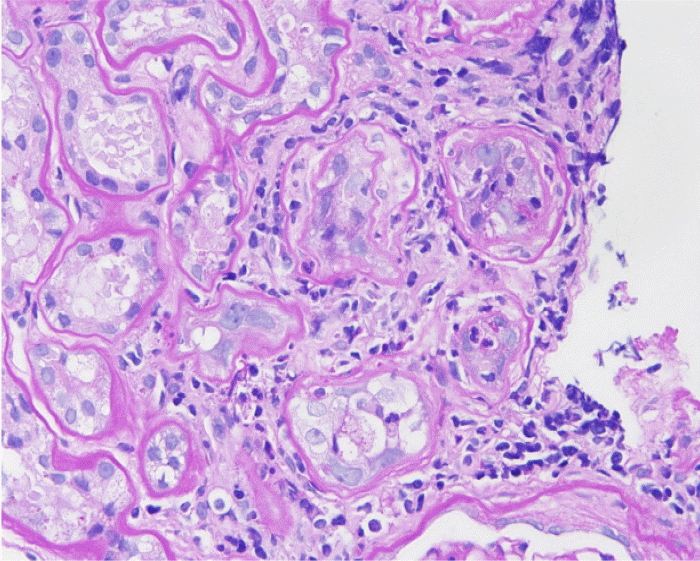
Tubular epithelial cells show nuclear enlargement, discrete intranuclear inclusions, and marked inflammatory cell infiltration in the interstitium (PAS stain, ×600).
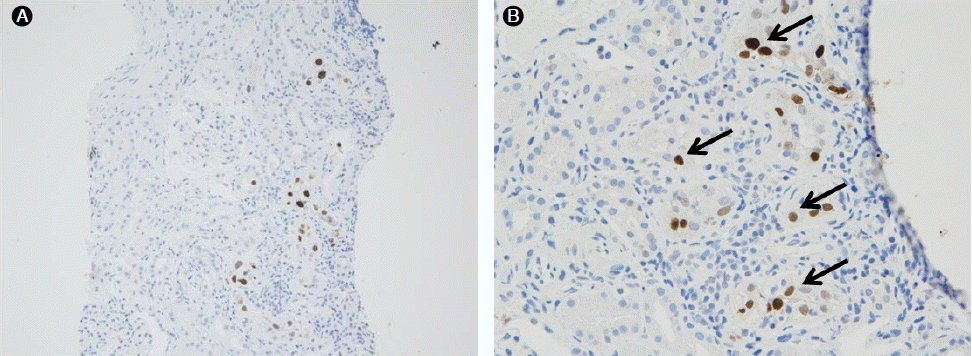
Immunohistochemical analysis for polyomavirus antigen (SV40 T-antigen) shows positive staining (arrows) in the tubular epithelial cells (A: ×200, B: ×400).
치료 및 경과: MMF을 중단하고 tacrolimus는 cyclosporine으로 변경하였으며, prednisolone은 5 mg을 유지하면서 크레아티닌은 1.9 mg/dL로 호전이 없어 leflunomide 유지용량 60 mg을 경구로 투여하였으나 14일 뒤 혈청 및 소변 BK 바이러스 DNA는 3.7 × 106, 1.2 × 1010 copies/mL로 각각 증가하였다. 이에 leflunomide을 유지하면서 면역글로불린 500 mg/kg/day를 7일간 정맥으로 주사하였다. 치료 2주 뒤에 크레아티닌은 1.8 mg/dL로 유지되었고, 소변에서 decoy 세포는 음전되었으며 혈중 BK 바이러스 DNA는 0.5 × 106 copies/mL으로 크게 감소하였다. 치료 8개월 후 cyclosporine 150 mg, leuflunomide 60 mg을 유지하고 있으며 혈중 cyclosporine 농도는 104 ng/mL, 크레아티닌은 1.8 mg/dL이며 혈청 및 소변 BK 바이러스 DNA는 2.7 × 104, 7.8 × 107 copies/mL로 각각 감소하면서 외래에서 경과관찰 중이다(Fig. 4).
고 찰
BK 바이러스는 polyoma 바이러스에 속하며, 보통 아동기에 호흡기를 통해서 처음 감염되고 신장에 잠복해 있다가 이식 후 면역이 억제되면서 재활성화된다. 1995년에 이식신에서 신병증을 일으키는 원인의 하나로 BK 바이러스가 알려졌으며, tacrolimus와 MMF 등의 강력한 면역억제제가 도입되면서 이식신 기능장애의 주요 원인으로 부상하였다[4]. 전형적으로 수주에서 수개월에 거쳐 특별한 증상 없이 혈중 크레아티닌 수치를 증가시키며, 조직소견에서 간질성 신염을 일으킨다.
BK 바이러스 신병증을 진단하기 위해서는 신생검에서 특징적인 세포 봉입체와 바이러스 입자가 보이면 도움이 되지만, 이와 같은 소견은 아데노 바이러스를 비롯한 다른 바이러스 감염에서도 보일 수 있어서, SV 40 항원에 대한 면역화학염색검사 결과 핵내 양성을 보이는 경우에는 확진에 도움이 된다. BK 바이러스 신병증의 선별검사로 제일 간단한 방법은 소변에서 원위부 신세관 상피세포가 바이러스에 감염된 후 탈락하여 발생하는 Decoy cell를 확인하는 것이지만 민감도와 예민도, 검사자의 숙련도 등의 제한점이 있다. 최근에는 혈액이나 소변에서 중합연쇄반응을 이용한 BK 바이러스를 진단하는 방법이 도입되면서, 조기진단과 치료에 대한 반응을 확인하는데 사용되고 있다. 본 예에서도 약물의 조기반응을 확인하는 데 사용하였다.
면역억제제를 줄이는 것이 치료의 첫 단계이며 여러 가지 방법이 있으나 MMF는 중단하고, calcineurin 억제제 용량을 가능한 낮은 수준으로 유지하며(tacrolimus < 6 ng/mL, cyclosporine A 100-150 ng/mL) tacrolimus를 사용 중이라면 cyclosporine으로 전환하기도 한다. MMF의 유지가 필요할 경우 하루 용량은 1 g 이내로 감량한다. 치료반응은 센터 별로 많은 차이가 나 이식신 소실률이 10% 미만에서 80% 이상까지 다양하게 보고되고 있으며 진행된 경우에는 1년 내에 50%에서 신기능을 소실하는 것으로 알려져 있다[5].
진행된 BK 신병증에는 면역억제제를 감량하는 것으로는 부족하며 항바이러스 치료를 고려해야 한다. 항바이러스 치료제 중에 하나인 leflunomide는 류마티스 관절염 치료약제로 사용되는 약물로 체내에서 A77 1726으로 즉각 대사되는데 이물질이 면역 억제 작용과 더불어 효과적인 항바이러스 효과를 동시에 가지는 것으로 밝혀졌다. A77 1726는 mitochondrial dihydroorotate dehydrogenase 효소를 차단하고 tyrosine kinase 활동성을 억제하여 pyrimidine의 합성을 차단함으로써 T와 B세포 기능을 억제한다[6]. 1999년 Waldman 등[7]에 의하여 A77 1726이 시험관 실험과 인체 내에서 거대세포 바이러스 증식을 억제함이 밝혀진 이후 leflunomide를 BK 바이러스 신병증 치료에 사용하기 시작하였다. Williams 등[8]도 17명의 환자에서 면역억제제의 감량과 함께 leflunomide를 투여하여 15명의 환자에서 신기능 유지와 바이러스 감소를 보였다고 보고하였다. 하지만 Faguer 등[9]은 leflunomide와 면역억제제 감량으로는 BK 바이러스 혈증이 42%에서만 개선된다고 보고하였다. 본 예에서는 BK 바이러스 신병증 진단 이후 면역억제제 감량과 leuflunomide을 사용하였으나 혈중 바이러스 DNA 수치가 증가하여서 활성화된 BK 바이러스 신병증의 초기치료보다는 유지치료에 도움이 될 것으로 보인다. BK 바이러스 신병증 치료제로서의 leflunomide의 적절한 용량은 아직 정립되어 있지 않은데 초기 외국의 두 보고에서는 A77 1726의 혈중농도를 40 µg/mL 이상 유지해야 효과가 있으며 이를 유지하기 위해서는 하루 평균 40 mg (20-60)의 leuflunomide을 복용하여야 한다고 하였다[8,10]. 하지만 최근 Leca 등[11]에 의하면 저용량으로도 효과에 유의한 차이가 없고 오히려 고용량에서 용혈 등의 부작용이 보고되어 유지용량으로 60 mg를 초과하지 않는 것이 권고된다. 본 환자의 경우에는 leuflunomide 60 mg를 복용한 뒤에도 신기능이 악화되어 면역글로불린을 투여했기 때문에 최대용량인 60 mg을 계속 유지하였고 부작용은 관찰되지 않았다.
면역억제제의 감량과 항바이러스 치료 후에 반응이 없는 경우에 선택할 수 있는 치료방법은 아직 정립되어 있지 않다. 급성 항체매개성 거부반응과 BK 바이러스 감염이 동반된 2명의 환자에서 정맥 주사용 면역글로불린(500 mg/kg/day)을 투여하여 성공적으로 치료한 예를 보고한 적이 있다[12]. 또한 급성거부반응이 동반되지 않은 8명의 BK 바이러스 신병증 환자에서 면역억제제 감량과 함께 2 g/kg 용량의 면역글로불린을 투여하여 7명에서 신기능을 보존하고 4명의 환자에서 혈중 BK 바이러스가 소실되었다는 보고도 있었다[13]. 이에 본 예에서는 leuflunomide 치료에도 신기능이 악화된 BK 바이러스 감염에 면역글로불린을 정주하였고, 이후 혈중 바이러스의 유의한 감소와 신기능 안정을 보였다. 비록 8개월간 추적관찰에도 불구하고, 혈장에서 BK 바이러스 DNA가 양성을 보이긴 하나, decoy cell이 음전되고 신기능이 안정적인 것으로 보아 효과적인 치료로 생각한다. 항바이러스제제들과 비교하여 글로불린 투여의 가장 큰 장점은 약제 자체에 의한 신독성이 없다는 점이나 비용 등의 문제로 항바이러스제제보다 우선 사용될 수 없다는 단점이 있다. 하지만 본 예와 같이 BK 바이러스 감염을 치료하면서 항바이러스 치료에 불충분한 반응을 보이는 경우에 이차 치료제로서 항바이러스 효과와 면역 조절 작용을 동시에 갖춘 정주용 면역 글로불린 병용 치료는 시도해 볼 수 있겠으며, 추후 연구가 더 필요할 것으로 보인다.