서 론
유건종(desmoid tumor)은 섬유아세포에서 기원하는 아주 드문 결체조직 종양으로, 수술을 포함한 외상이나 에스트로겐, 유전적 결함 등이 발생요인으로 알려져 있으나 질병의 자연경과는 아직까지 밝혀지지 않았다[1]. 일반적으로 조직학적으로는 양성이고 무통성이지만, 천천히 성장하면서 주위 조직으로의 광범위한 침윤, 압박을 일으켜 완전 제거가 어렵고 제거하더라도 재발률이 높다[2]. 저자들은 진행성 위암으로 인한 위전절제술 이후 복강 내 종괴가 발생하여 시행한 수술에서 유건종으로 진단되었으나 완전 절제를 시행치 못하고 경과관찰 중 자연소실을 경험한 1예를 문헌고찰과 함께 보고한다.
증 례
환자: 전〇철, 59세
주소: 우연히 발견된 복강내 종물
과거력 및 현병력: B형 간염 바이러스 보유자이며 6년 전 진행성 위암으로 인근 병원에서 위전절제술을 받은 후 외래 추적관찰 중 우연히 복강 내 종물이 발견되어 본원 소화기내과 외래에 내원하였다.
가족력과 사회력: 특이 병력은 없었다.
진찰 소견: 내원 당시 혈압 120/80 mmHg, 맥박 76회/분, 호흡수는 18회/분, 체온은 36.5℃였다. 환자는 만성 병색을 보였으며 결막의 빈혈소견과 공막에 황달소견은 관찰되지 않았다. 복부 진찰에서 압통 및 반발통은 없었으며 장기 비대 소견이나 종괴는 촉지되지 않았다.
검사실 소견: 말초 혈액 검사에서 백혈구 8,120/mm³ (중성구 40.6%, 림프구 45.4%, 단핵구 7.8%), 혈색소는 13.4 g/dL, 헤마토크리트 42%, 혈소판 168,000/mm³이었다. 혈청 생화학 검사에서 총 단백 7.6 g/dL, 알부민 3.6 g/dL, 총 빌리루빈 0.9 mg/dL, 알칼리 포스파타제 105 IU/L, AST/ALT 37/33 IU/L이었다. 혈청학적검사에서 HBsAg 양성, anti-HBs 음성, anti-HCV 음성이었으며, 종양표지자검사에서 α-FP 204.44 ng/mL, CEA 6.61 ng/mL, CA19-9 0.01 U/mL였다.
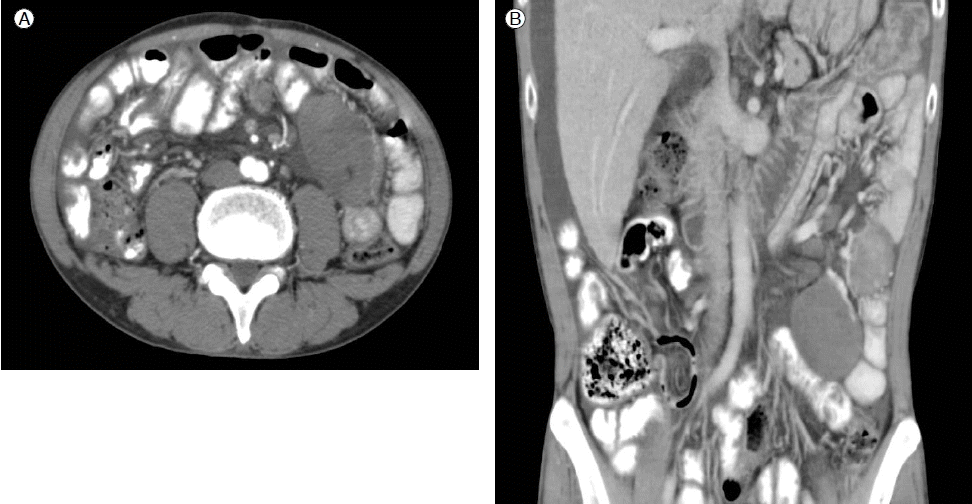
방사선학적 소견: 본원에서 시행한 복부 컴퓨터단층 촬영에서 좌하복부에 위치한 소장의 장간막에 림프절 종대로 의심되는 7.1 × 4.6 cm, 4.2 × 3.1 cm 크기의 경계가 좋은 저음영의 연부조직 종괴 2개가 관찰되었다(Fig. 1).
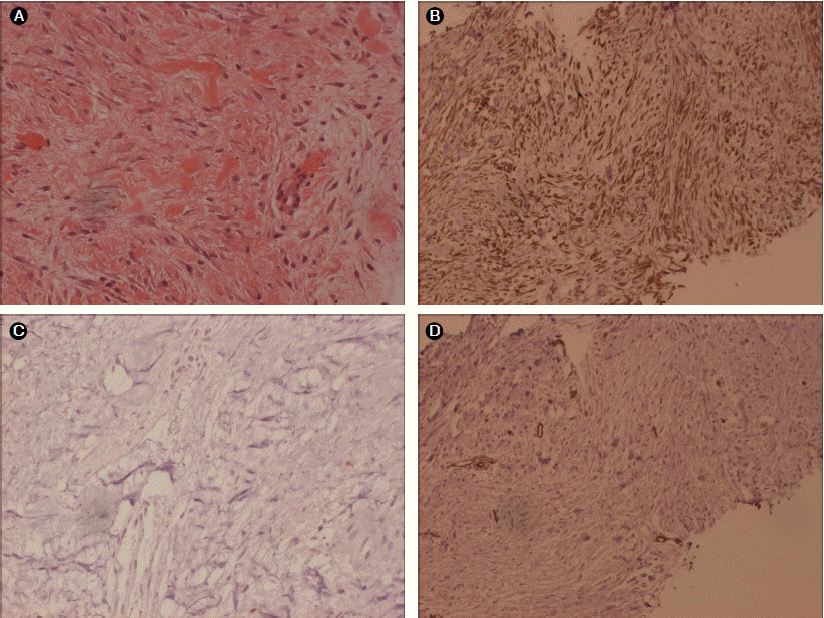
경과 및 치료: 상부위장관 내시경 검사를 시행하였으나 위암의 재발을 의심하는 소견은 관찰되지 않았고 대장 내시경 검사에서도 특이 소견 없었다. 위암의 재발에 따른 전이성 병변 유무를 확인하기 위하여 초음파 유도하에 경피적 조직 생검을 시행하였다. 조직검사 결과 섬유종증을 의심하는 소견이었지만 위선암의 재발 가능성과 위장관 간질종양을 배제하기 어려워 정확한 진단 및 제거를 위해 수술을 시행하였다. 수술 소견은 장간막에 10 × 8 cm과 5 × 6 cm의 종괴와 그 외 전 소장에 걸쳐 약 1-3 cm 가량의 다발성 종괴가 10군데 이상 있었다. 큰 종괴들은 장간막에 둘러싸여 있지만 소장 내로 침윤되지는 않았다. 종괴 일부를 절제하여 시행한 냉동절편조직 검사에서 비교적 풍부한 교원질과 함께 방추형의 섬유모세포들로 이루어진 양성 섬유종으로 확인되었으며, 종괴들은 장간막과 유착이 심하여 완전 절제가 불가능하였다. 수술 후 시행한 면역 조직화학 염색에서 vimentin에 양성, desmin과 smooth muscle actin에 약양성, S-100 및 cytokeratin, CD 34, CD 117에 음성 반응을 보여 이전 수술 상흔에 이차적으로 생긴 양성 섬유화 증식인 유건종이라고 진단하였다(Fig. 2). 환자는 수술 2개월 후 외래 추적관찰에서 AST/ALT 132/143 IU/L, 알부민 2.8 g/dL, 총 빌리루빈 1.3 mg/dL, 프로트롬빈 시간 17.6초(INR 1.44) 등의 간기능의 악화에 따른 복부 팽만으로 재입원하였다. 입원 당시 시행한 복부 컴퓨터단층 촬영에서 복강 내 많은 양의 복수와 종괴의 크기가 증가되는 소견을 보였으며, 혈청검사에서 HBeAg 양성, HBeAb 음성, HBV DNA 2620.9 pg/mL로 확인되어 B형 간염바이러스의 활성에 따른 간염의 급성 악화 의심하에 항바이러스제인 라미부딘 100 mg 복용을 시작하였다. 1년 후 시행한 추적 간기능 AST/ALT 25/14 IU/L, 알부민 4.1 g/dL, 총 빌리루빈 0.5 mg/dL, 프로트롬빈 시간 13.초(INR1.04)로 호전되었고, 복부 컴퓨터 단층 촬영에서 복수의 호전과 유건종은 더 이상 관찰되지 않았다. 유건종 진단 2년 후 시행한 추적 복부 컴퓨터 단층 촬영에서도 여전히 유건종의 재발은 없어 현재 외래에서 추적관찰 중이다(Fig. 3).
고 찰
유건종은 근초나 근건막 연조직에서 유래하는 양성 섬유종증으로 분화도가 양호하며 일정한 형태의 교원질의 섬유아세포와 섬유세포로 구성되어 있다. 발생 빈도는 일반인에서는 매년 백만 명당 2-4명 정도로 전체 종양의 0.03%, 섬유조직 종양의 3%로 매우 드물게 발생한다[1,3].
유건종의 발생 원인에 대하여는 아직 명확히 규명되어 있지는 않으나 임신, 외상, 유전적 결함 등이 유발인자로 알려져 있다[2,4]. 과거에는 외상을 받은 자리 특히 수술반흔 부위에서 흔하게 발견되어 원인적 요소로 외상이 강조되었다. 그러나 유건종이 가족성 선종성 용종증 환자에서는 12.4-29.0%의 빈도로 일반인에 비해 약 825배 높은 발생률을 보이며, 5번 염색체 22번 장암(chromosome 5q22)에 존재하는 APC 유전자 변이와 관련이 있다고 알려져 있다[5,6]. 또한 최근 복강내 유건종 증례의 대부분이 가족성 선종성 용종증으로 전대장 절제술 후 발생하였다고 보고하였으며 이는 유건종 발생에 유전적인 영향이 크다는 것을 시사한다. 그리고 최근 가임기 여성에서 발생 빈도가 높고, 드물지만 난소절제술 또는 폐경 후에 종양의 퇴행 변성이 관찰되며 종양 절제 표면에서 에스트로겐 수용체의 존재와 종양에 대한 항에스트로겐 화학요법의 긍정적인 효과는 호르몬계 이상의 가능성을 시사한다[7,8]. 본 증례는 이전 수술 상흔에 의해 이차적으로 발생하였다고 생각되며, 유건종 제거 수술 이후 간기능의 변화에 따른 유건종의 악화와 소실을 보여 간기능의 변화가 에스트로겐 대사에 영향을 주어 초래된 것으로 추정된다.
유건종의 발생위치는 복벽 및 사지, 복강내 장간막에서 흔하다. 복벽 및 체간의 근층에서 종양의 약 50%가 발생하고 사지에서 약 40%, 그리고 나머지 10% 이하가 장간막에서 발견되며 다발성 침범도 약 5% 이하에서 보고되고 있다[2,7]. 유건종은 종양 자체와 관련한 특이한 증상은 없고 대부분 무통성으로 천천히 성장하여 종괴를 형성하며 발생위치에 따라 주위 조직을 광범위하게 침범하는 경우에는 통증 및 장폐쇄, 요로폐쇄, 관절의 운동제한 등이 나타날 수 있다[1,2].
유건종의 병리학적 소견은 풍부한 교원질의 침착과 동일한 모양의 잘 분화된 섬유아세포 다발의 광범위한 분포 및 침윤성 성장이 특징적이고 대부분 방추 모양의 세포로 밀도가 높지 않으며 이형성 세포들이 관찰되지 않는다[9-11]. 면역 조직화학 염색에서 β-catenin, vimentin, smooth muscle actin, desmin에 양성소견과 S-100, CD 34, Keratin에는 음성소견을 보여 위장관 간질종양, 신경초종, 고립섬유종양, 평활근육종, 섬유육종 등과 감별진단이 가능하다[12].
일반적으로 조직생검이나 수술 전 임상증상, 초음파나 CT 등의 영상진단법으로 유건종을 미리 진단하기란 어렵다. 그러나 유건종의 진단에 있어서 초음파나 CT검사는 종양의 위치 결정 및 농양이나 혈종 그 외 다른 양성종양으로부터 구분하는 데 도움이 되며[13] 자기공명영상은 T1강조영상과 T2강조영상 모두에서 저신호 강도의 불균질한 타원형의 종괴로 나타나고 이는 섬유모세포 증식과 콜라겐의 증가를 반영한다[14].
유건종의 치료는 완전절제이지만, 증상 없이 서서히 자라 진단이 늦어지므로 진단 당시 종양이 크고 중요 장기의 침윤 가능성이 높아 완전 절제가 불가능하거나 완전 절제를 시행하더라도 출혈 등의 여러 합병증이 따르게 된다. 또한 전이를 하지는 않지만 광범위 절제 이후에 약 50%의 높은 재발률 때문에 합병증의 발생 가능성이 높아져 사망률이 높다. 따라서 수술 후 완전 절제가 되지 않았거나 뚜렷한 기능성 장애나 지연성 합병증을 피하기 위해 방사선 요법을 시행하면 효과적이었다는 보고가 있으나 아직까지는 제한적으로만 사용되고 있다[15]. 유건종이 다발성이거나 복강내 광범위한 침범이 있다면 NSAIDs, tamoxifen, Interferon-α, doxorubicin, dacarbazine 등의 약물치료가 효과적이었다는 보고와 최근 유건종의 75%에서 C-kit (CD 117) 발현이 있어 tyrosine kinase 억제제인 imatinib mesylate가 종양을 억제한다고 보고하였다[8,16,17]. 그러나 유건종은 일반적으로 드물며 질병의 자연사도 다양하기 때문에 약물학적인 치료의 효능을 평가하기가 매우 어렵다. 본 증례처럼 치료 없이도 유건종의 10%는 자연소실, 50%에서는 진행을 하지 않는다는 보고들이 있어 크기가 작고 증상이 없거나, 주요장기로의 침범이 없는 경우 또는 수술에 따른 합병증이나 심각한 기능성 장애를 초래할 경우 치료 없이 환자를 추적관찰하는 것도 하나의 방법이라고 제시할 수 있다[1,7,18].
결론적으로 이전 복강 내 수술을 받았던 환자에서 복강내 종괴가 발견되었을 경우 드물지만 유건종을 생각해야 하겠다. 유건종은 악성도는 낮지만 주변 조직을 광범위하게 침윤하기 때문에 완전 절제가 치료원칙이나 본 증례와 같이 경과관찰 시 자연소실의 가능성도 있기 때문에 증상이 없는 경우 신중하게 추적관찰하는 것도 하나의 방법이라고 생각한다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






