다량의 심낭 삼출로 발현된 POEMS 증후군 1예
A Case of POEMS Syndrome that Presented with a Moderate Pericardial Effusion
Article information
Abstract
심낭 삼출은 악성종양, 결핵 등 다양한 원인에 의해 유발되는 질환으로 과거와는 달리 선험적인 치료에 의존하기 보다 정확한 원인 규명의 중요성이 점차 커지고 있다. 저자들은 심낭 삼출을 주된 증상으로 하면서 말초신경병증, 비장 비대, 갑상샘저하증, 단세포감마글로불린병증, 피부색소침착, 다모증, 흉막 삼출, 전신 부종, 폐동맥고혈압 등을 동반한 POEMS 증후군 1예를 경험하여 문헌고찰과 함께 보고한다. 심낭 삼출의 치료에 반응이 없으면서 원인을 찾지 못하여 특발성 심낭염으로 진단한 환자의 추가적인 감별 진단의 하나로 POEMS 증후군이 고려되어야 하겠다.
Trans Abstract
Pericardial effusions can be caused by a wide variety of infectious or noninfectious diseases. After a conventional diagnostic work-up, the etiology of pericardial effusion often remains idiopathic. We report a patient with POEMS syndrome whose main clinical problem was recurrent pericardial effusions. Patients with POEMS syndrome often have generalized edema and a pleural effusion, while a pericardial effusion is a very rare complication. A 44-year-old man visited our hospital because of a recurrent pericardial effusion. He was initially diagnosed with idiopathic pericarditis five months prior. We reassessed the patient meticulously and found IgG lambda type monoclonal gammopathy, polyneuropathy, lymphadenopathy, peripheral edema, pleural effusion, hypothyroidism, pulmonary hypertension, hyperpigmentation, hypertrichosis, and papilledema, which we diagnosed as POEMS syndrome. (Korean J Med 2011;81:245-250)
서 론
심낭 삼출은 다양한 감염성 및 비감염성 질환에서 동반되며 정확한 원인을 찾기 위해 때로는 심낭 천자나 심낭 생검과 같은 침습적인 시술을 필요로 한다. 그러나 심낭 삼출이 혈역학적으로 문제가 없을 때에는 이러한 침습적인 시술이 시행되지 않는 경우가 많으며, 일부는 이러한 침습적 평가를 수행할지라도 원인을 규명하지 못해 특발성 심낭염(idiopathic pericarditis)으로 진단된다[1]. 국내에서는 과거 결핵의 유병률이 높아 특발성 심낭염 환자에게 선험적으로 항결핵치료를 시행하는 경우가 많았으나, 사회 경제적 환경의 변화에 따라 결핵의 유병률이 점차 감소하고 있어[2] 과거와 같은 선험적인 치료에 의존하기 보다 정확한 원인 규명의 중요성이 커지고 있다.
POEMS 증후군은 단세포감마글로불린혈증(monoclonal gammopathy), 다발성 신경병증(polyneuropathy), 장기 비대(organomegaly), 내분비 병증(endocrinopathy), 피부변화(skin changes)를 주 증상으로 하는 드문 질환으로 다양한 염증반응이 병태생리에 관여한다고 알려져 있다. 경화성 골수종, Castleman병, 부종이나 안구의 유두 부종 등이 동반될 수 있으며[3], 활막염(serositis)도 동반될 수 있으나 심낭 삼출은 매우 드물게 나타나는 것으로 알려져 있다[4].
저자들은 심낭 삼출을 주소로 내원한 환자에서 심낭 천자 및 심낭 조직 검사를 포함한 포괄적인 검사를 시행하였으나 원인을 찾지 못해 특발성 심낭염으로 진단하였으나, 추가적으로 동반된 하지 통증에 대해 신경전도 검사와 함께 면역 전기 영동 검사 및 골수 조직 검사 등을 시행하여 POEMS 증후군으로 진단한 증례를 경험하였기에 이와 관련된 문헌을 고찰하여 함께 보고하고자 한다.
증 례
환 자:지○○, 남자, 44세
주 소: 호흡 곤란
현병력: 환자는 내원 5개월 전 전신 부종 및 호흡 곤란을 주소로 거주지 인근 3차 병원에 내원하여 심장 기능 평가 위해 시행한 심장 초음파 검사상 좌심실 비대 및 중등도의 심낭 삼출이 관찰되었다. 정확한 원인을 찾기 위하여 진단적 심낭 천자를 시행하였으며 천자액 검사상 결핵이나 바이러스, 세균 감염을 의심할 만한 특이 소견 보이지 않았다. 흉부 및 복부 전산화 단층 촬영과 종양 표지자 검사상 악성 종양을 의심할 만한 소견 보이지 않았다. 정확한 진단을 위하여 심낭 조직 검사를 시행하였으나 비특이적 염증 소견 이외 다른 이상소견은 관찰되지 않았다. 환자는 특발성 심낭염으로 진단 받고 심낭 삼출 배액 및 보전적 치료 후 퇴원하였다. 퇴원 후 4개월째 다시 호흡곤란 발생하여 시행한 추적 심장초음파에서 중등도의 심낭 삼출이 다시 관찰되어 본원 외래 경유 정확한 진단을 위해 입원하였다. 환자는 입원 당시 호흡 곤란 및 양 발바닥의 저림 증세 및 무릎 통증을 호소하였다.
과거력: 10년 전부터 고혈압으로 약물을 복용해온 것 외에 특이병력은 없었다.
신체 검사 소견: 입원 당시 혈압 130/80 mmHg, 맥박수 68회/분, 체온은 36.5℃였으며 의식은 명료하였다. 흉부 청진상 심음은 줄어들어 있었으나 호흡음은 정상이었고, 심잡음도 청진되지 않았다. 복부 진찰에서 압통 및 반발통은 없었다. 양 하지에 중등도의 함요부종이 관찰되었다. 전신적인 다모증 및 갈색 색소침착이 관찰되었으며 우측 서혜부에 2.5 × 2 cm의 종괴가 촉진되었다.
심전도 및 심장초음파 소견: 거주지 병원에서 처음 시행한 심장초음파에서 좌심실 후벽에 11 mm 깊이의 심낭 삼출이 관찰되었으나 교착성 움직임(constrictive physiology)나 심낭 압전을 의심할 만한 소견은 보이지 않았으며, 본원에서 검사한 심장초음파에서도 우심방 측벽에 17 mm 깊이의 중등도의 심낭 삼출이 관찰되었으나 역시 혈역동학적으로 영향을 주지는 않았다(Fig. 1A). 좌심실 구혈률은 72%로 정상 소견이었다. 삼첨판 역류로 추정한 우심실의 수축기 혈압이 54 mmHg로 경도의 폐동맥 고혈압이 의심되었다. 심전도상 특이 소견 보이지 않았다.
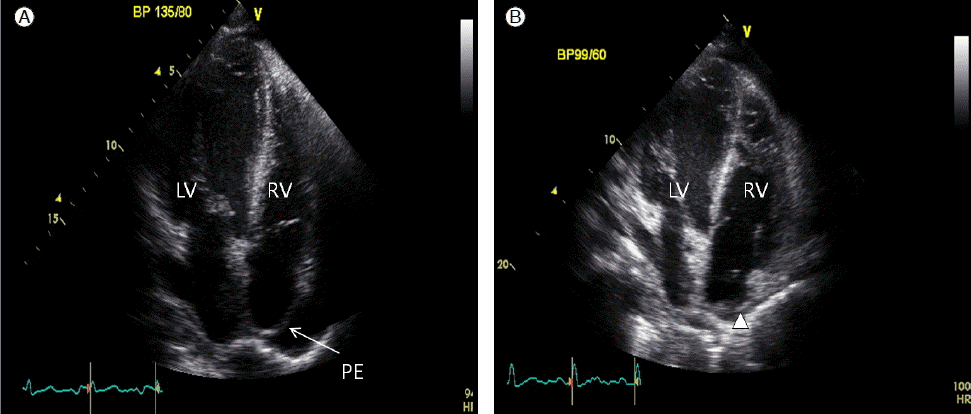
(A) Apical four-chamber view echocardiography performed on the first hospital day shows a moderate pericardial effusion. (B) Follow-up echocardiography after one month of high-dose steroid therapy shows that the pericardial effusion has nearly disappeared (see arrowhead). LV, left ventricle; RV, right ventricle; PE, pericardial effusion.
방사선학적 소견: 흉부 단순 촬영상 심비대 소견 및 양측 늑막 삼출이 관찰되었다. 심장 자기공명영상 검사상 심낭 삼출이 관찰되었으나 심막이나 심근에 특별한 이상소견은 관찰되지 않았다(Fig. 2). 두개골, 척추골, 대퇴골, 골반골 등의 단순 촬영상 골병변은 관찰되지 않았다. 복부 초음파 검사상 비장 비대(12.8 cm)가 발견되었다. 악성 종양에 대한 검사 위해 시행한 18F-FDG PET-CT에서 우측 서혜부 림프절 비대 및 두개골, T5, T7, L5 번 척추골, 천골, 양측 골반골 및 좌측 대퇴골에서 FDG 대사능 항진 소견이 관찰되었으며 다량의 늑막 삼출 및 복수가 관찰되었다.
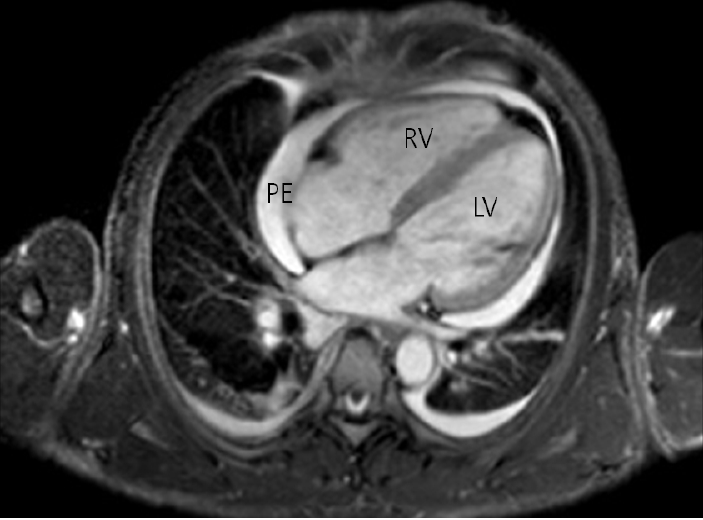
Heart magnetic resonance imaging (MRI) shows a moderate pericardial effusion without pericardial thickening or enhancement and a mild pleural effusion. LV, left ventricle; RV, right ventricle; PE, pericardial effusion.
조직검사 소견: 접근이 쉬운 우측 서혜부 림프절에서 조직검사를 시행하였으며 혈관종성 과오종(angiomyomatous hamartoma)으로 양성 질환이었다.
심도자 검사 소견: 복수, 늑막 삼출 및 하지 함요부종에 대한 원인이 뚜렷하지 않아, 심낭 삼출에 동반된 교착성 심낭염(constrictive pericarditis)에 의한 것인지를 알아보기 위하여 심도자 검사를 시행하였다. 검사상 호흡 변화에 따른 심실상호의존성(ventricular interdependence) 등의 교착성 심낭염에 합당한 소견은 관찰되지 않았다.
혈액검사 소견: 입원 당시 말초혈액 검사에서 백혈구 8,720/uL, 혈색소 12.3 g/dL, 혈소판 438,000/uL였고, 혈청 생화학 검사에서 혈청 총 단백 6.5 g/dL, 알부민 4 g/dL, AST/ALT 9/7 U/L, BUN/Cr 25/1.34 mg/dL, Na/K/Cl 142/5.1/23 mEq/L이었다. 간염바이러스나 CMV, EBV, HSV, Coxsackie virus, Echo virus, HIV 등에 대한 검사는 음성이었으며 AFP, CEA, CA 19-9, PSA 등의 종양 표지자 역시 음성이었다. LDH는 125 IU/L였으며 β2-microglobulin 3.95 mg/dL로 증가되어 있었다.
면역화학검사 소견: 혈청 검사상 ANA, anti-ds DNA는 정상이었으며 혈청 IgG 1137 mg/dL (700-1600), IgA 650 mg/dL (70-400), IgM 81 mg/dL (40-230), kappa light chain 286.9 mg/dL (170-370), lambda light chain 238.9 mg/dL (90-210)로 IgA와 lambda light chain이 약간 증가되어 있었다. 혈청 단백 전기영동 검사에서 a1 Globulin과 β1 Globulin이 증가되어 있었으며 소변 단백전기영동 검사에서는 모든 혈청 단백이 관찰되었다. 면역전기영동 검사에서는 단세포군감마글로불린병증 IgA, lamda형이 관찰되었다(Fig. 3).
내분비 기능 검사 소견: 갑상샘 기능은 free T4 11.9 pmol/L, TSH 9.5 mIU/L로 저하된 소견을 보였다. 테스토스테론은 161.15 ng/dL (181-772)로 저하된 소견을 보였으며 부신피질자극호르몬 156.7 pg/mL (7.2-63.3), 코티졸 13.6 ug/dL (6.2-19.4)로 부신피질 기능 부전이 의심되었다.
골수검사 소견: 말초혈액 도말 소견에서는 백혈구 수가 증가되어 있는 것 이외 특이 소견은 없었다. 골수의 조직검사상 세포충실도는 정상이었으며 비전형 형질세포의 비율이 20%로 증가되어 있었다(Fig. 4).

Bone marrow biopsy shows immature atypical plasma cells occupying 20% of the surface, consistent with plasma cell myeloma (H&E, ×400).
신경전도 검사 및 근전도 검사 소견: 정중신경 및 척골신경에서 운동 및 감각 신경전도 속도가 감소되어 있었으며 양측 비골신경 및 죄측 표지배골신경의 감각 신경전도 속도도 감소되어 있었다. 근전도 검사에서는 좌측앞정강근에서 탈수초형의 근전도 이상소견이 관찰되었다.
안과 검사: 안과 검사상 양안에서 유두부종 소견이 관찰되었다.
임상경과 및 치료: 환자는 다발성 신경병증, 단세포감마글로불린병증, 비장 비대와 림프절 종대, 갑상샘 저하증, 그리고 피부색소침착, 다모증이 관찰되어 POEMS 증후군에 따른 이차적 심낭 삼출로 진단받고 혈액내과로 전과되었다. 현재 고용량의 스테로이드 정맥 치료를 시작 후 심낭 삼출 재발 없는 상태로 추후 자가 말초 조혈모세포 이식술 예정이다(Fig. 1B).
고 찰
본 증례는 반복적인 호흡곤란과 중등도의 심낭 삼출을 주소로 입원하여 심장초음파 검사, 심낭 천자 및 조직검사, 복부 및 흉부 전산화 단층 촬영, 심장 자기공명영상 검사까지 시행하였으나 별다른 원인을 찾지 못해 특발성 심낭염으로 진단하였다가, 하지 통증 평가를 위해 시행한 근전도 검사의 이상 및 악성종양 여부 감별을 위해 시행한 PET-CT상 다발성 골 대사항진 소견이 발견되어 면역전기영동 검사 및 골수 검사를 통해 단세포감마글로불린혈증을 확인하고 이후 추가적인 검사 및 임상 소견을 종합하여 POEMS 증후군으로 진단되었다.
심낭 삼출의 원인 진단을 위해서는 일반 혈액 검사 및 일반 화학 검사, ESR, CRP, LDH, 심근 효소 수치 및 갑상샘 기능 검사, 류마티스 인자, 항핵항체 검사, 세균 배양 검사 및 바이러스 항체 검사, 종양 표지자 검사, 그리고 PPD 검사 등을 시행하며 비침습적인 영상 검사로 심장 초음파, 흉부 전산화단층촬영, 자기공명영상 등을 고려한다. 침습적인 검사로 심낭 천자를 시행하여 심낭 삼출액에 대하여 total protein, LDH, 호중구 수치, 그람 염색 및 세균 및 바이러스 배양 검사, ADA (adenosine deaminase) 수치 등을 확인해야 한다. 악성 종양 여부를 확인하기 위해서 심낭 삼출액에서 CEA 등의 검사와 함께 세포병리 검사를 시행하며 필요 시에는 심낭 생검까지 시행하기도 한다[5].
심낭 삼출의 흔한 원인들로는 바이러스, 요독증, 세균, 급성 심근 경색, 심장 수술, 결핵, 악성 종양이나 외상 등이 있으며 특별한 원인을 찾지 못하는 경우가 가장 많다[1,6]. 국내에서는 과거에 결핵의 유병률이 높아 특발성 심낭염 환자에게 선험적으로 항결핵치료를 시행하는 경우가 많았다. 그러나 사회 경제적 환경의 변화에 따라 결핵이 점차 감소하고 있어 최근 보고에 따르면 국내 심낭 삼출의 원인은 악성 종양이 45%, 수술 후 15%이며 결핵은 14%를 차지하고 있다[7].
갑상샘저하증이 심낭 삼출을 유발할 수 있는 질환이기는 하지만 환자가 첫 입원 당시부터 갑상샘 호르몬 보충을 시작하였고 5개월 후 심낭 삼출이 재발하였을 때 시행한 갑상샘 호르몬 수치가 정상 범위로 임상적으로 POEMS 증후군의 병태생리가 심낭 삼출을 유발한 것으로 생각된다. 복수나 늑막 삼출, 하지 함요 부종 역시 심장초음파나 심도자 검사 소견을 종합해보면 심낭 삼출에 따른 2차적인 결과라기 보다는 POEMS 증후군에 의한 병태생리에 의해 발생한 것으로 생각된다. 본 증례는 심낭 삼출로 설명되지 않는 체액 저류 및 신경학적 증상에 대하여 원인을 밝히는 과정에서 결국 POEMS 증후군을 진단할 수 있었다.
POEMS 증후군은 대부분 만성적인 임상경과를 보이는 질환으로 2003년 Mayo clinic에서 보고된 바에 의하면 중앙 생존 기간은 13.7년이었다[4]. 곤봉수지나 혈관외용적 과부하(복수, 늑막 삼출, 부종)가 나쁜 예후인자인데, 이 경우 중앙 생존기간이 각각 2.6년과 6.6년으로 낮았다. Dispenzieri 등[4]이 미국에서 발표한 자료에 따르면 평균 연령은 51세 (30-83세), 남성이 63%였으며, Nakanishi 등이 일본에서 발표한 자료에 따르면 평균 연령은 46세(27-80세), 남녀 비율은 2:1이었다[8,9]. 지금까지 국내에서 발표된 POEMS 증후군에 대해 살펴보면, 한국의학논문 데이터베이스 및 Medline에서 검색 결과 총 21개의 증례 보고가 있었는데, 22명의 환자에서 평균 연령은 42세였으며 이 중 71%가 남자였다. 주로 다발성 신경병증과 함께 복수나 하지 부종 등을 주소로 내원하였으며 심낭 삼출이 동반된 경우는 2예가 있었는데, 심낭 압전이나 교착성 심낭염 등의 소견은 보이지 않았다[10,11].
POEMS 증후군의 병태생리기전은 아직 확실히 규명되지 않았으나 혈관내피성장인자(vascular endothelial growth factor, VEGF) 및 interleukin-1β (IL-1β), interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α) 등 전염증 사이토카인(pro-inflammatory cytokine)이 POEMS 증후군의 여러 증상과 관련이 있는 것으로 알려져 있다[12]. 이들은 POEMS 증후군 환자에서 정상인에 비해 높은 혈중 농도를 보이며, 특히 혈관내피성장인자의 경우에는 성공적으로 치료 받은 환자에서 의미 있게 농도가 감소하는 것으로 알려져 있다[13].
다발성 신경병증은 원위부에서 시작되며 점차적으로 근위부로 이동하는 질환으로 양측성 대칭적인 운동 및 감각 이상을 보이며 뇌신경 및 자율신경의 침범은 드물다. 신경전도 검사상 양측 상하지의 신경전달 속도의 감소, 지연 및 진폭의 감소를 보이며 말초 신경조직 검사에서는 축삭 변성과 분절성 탈수초성 변화가 관찰된다[14]. 장기비대는 간 비대, 림프절 병증, 비장 비대 등이 주로 보고되고 있으며 림프절 병증이 있는 POEMS 증후군 환자의 림프절 조직 검사에서 Castleman 병에 합당한 조직 소견을 보인다고 알려져 있다[15].
내분비 병증은 뇌하수체, 갑상샘, 췌장, 생식샘 등을 침범하여 생기는 것으로 생각된다. Mayo clinic이 2008년에 발표한 바에 의하면 2/3 이상의 환자들이 처음 진단 당시에 한 가지 이상의 내분비 이상을 보이며, 처음에 이상을 보이지 않더라도 뒤늦게 발병하는 경우도 있어서 전체적으로는 POEMS 증후군 환자의 84%에서 내분비 병증을 보인다[16].
단세포감마글로불린병증은 모든 환자에서 나타나며 IgG lambda 또는 IgA lambda 형이 대부분으로 75% 정도를 차지하는 것으로 알려져 있다[12]. 골수 검사에서 10% 이상의 형질세포 증가를 보이는 경우는 5-20% 정도이며, 정상 소견을 보이는 경우가 가장 많아 진단에 반드시 필요하지는 않다[4].
피부 병변은 색소침착 과다가 가장 많이 나타나며 다모증, 피부 비후, 다한증, 곤봉수지, 백조갑, 피부 혈관종 등이 다양한 증상들이 동반된다[9]. 그밖에 유두부종, 복수, 늑막 삼출, 말초 부종 및 심낭 삼출 등이 동반될 수 있으며 폐기능 장애, 폐동맥 고혈압 등을 보이기도 한다. 심낭 삼출이 나타나는 기전은 명확히 밝혀져 있지 않지만 interleukin-6나 혈관내피성장인자 등이 연관되어 있을 것으로 생각된다[17].
POEMS 증후군에 대한 표준 치료는 아직 없는 상태로 방사선 치료, 고용량 스테로이드, 항암화학요법, 면역글로불린투여, 혈장교환술 등이 시도되고 있다. 국소적으로 경화성 골수종이 있는 경우에는 방사선 치료가 효과가 있는 것으로 알려져 있으며, 자가 조혈모세포 이식술의 경우 여러 연구에서 신경 증상의 호전 및 여러 임상 증상의 호전을 보이는 것으로 알려져 있다[18]. 최근에는 thalidomide, bevasizumab과 같은 사이토카인이나 혈관내피성장인자의 기능을 억제하는 약물이 환자의 증상을 조절하는 데에 효과가 있다는 연구들이 보고되고 있다[19,20].
