심혈관 질환에서의 흉수
Pleural Effusion in Cardiovascular Disease
Article information
Trans Abstract
There are many different diseases that can be associated with pleural effusion and cardiovascular disease is one of them. As the management of secondary pleural effusion is guided mainly by its etiology, it is important to identify the cause of pleural effusion. Major cause of pleural effusion due to cardiovascular disease is congestive heart failure, and diagnosis can be easily made by clinical features without diagnostic thoracentesis. Pulmonary thromboembolism, post-coronary artery bypass surgery, post-cardiac injury syndrome and superior vena cava obstruction are also considered as possible causes of pleural effusion in undiagnosed cases. Knowing certain characteristics of these pleural effusions in cardiovascular disease is helpful to identify the underlying causes and also helpful in the management of these conditions. (Korean J Med 2011;81:161-166)
서 론
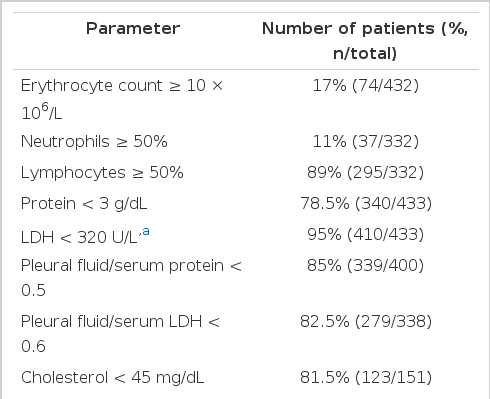
흉수는 다양한 원인들에 의하여 생성되는데, 여출액(transudate)은 흉수의 생성과 흡수에 변화를 가져오는 전신적 요소에 변화가 있을 때 주로 발생하며, 그 원인으로는 울혈성 심부전, 간경화, 신부전 등이 있다. 삼출액(exudates)은 흉수의 생성과 흡수에 변화를 가져오는 국소적 요인에 변화가 있을 때 주로 발생하며, 암종, 세균이나 결핵과 같은 염증성 질환, 폐색전증, 약물이나 교원성 질환에 의한 경우 등을 감별하여야 한다(Table 1) [1].
임상에서 마주하게 되는 흉수의 원인 중, 상당수가 심혈관계 질환과 연관이 있으며, 이들 질환으로 인해 발생되는 흉수의 성상과 임상적 특성을 숙지하고 있다면, 기저 질환에 대한 접근과 치료가 훨씬 용이할 것이다.
이 종설에서는 심혈관 질환과 관련된 흉수의 비교적 흔한 원인인 심부전, 폐 혈전 색전증, 심근 손상 후 증후군(post-cardiac injury syndrome)을 중심으로, 각각의 진단적 접근과 치료에 관해 알아보고자 한다.
심부전과 흉수
심부전에서 흉수의 발생 기전
심혈관 질환과 관련된 흉수의 가장 흔한 원인은 좌심부전이다[1]. 심부전에서 흉수가 발생하는 주된 기전은 폐 간질로부터 흉강 내로의 액체의 이동이다[2]. 좌심실 부전에서는 좌심실 확장기말 압력과 좌심방 압력이 상승하게 되고, 이 압력이 폐포 모세혈관으로 전달된다. 이렇게 증가된 정수압은 폐 내 간질액을 증가시키고, 이는 압력차를 따라 장측 흉막을 통과하여 폐 간질로부터 흉강 내로 이동하게 된다. 흡수 능력 이상으로 흉수가 생성되면 결국 흉강 내에 축적된다.
심부전으로 인한 흉수는 주로 우심실 부전보다는 좌심실 부전과 관련이 있으리라고 여겨져 왔으나, 특발성 혹은 가족성 폐 고혈압 환자를 대상으로 한 최근의 연구에서는 147명의 환자들 중 19명(13%)에서 우심실 부전 단독으로도 흉수가 발생하였다고 보고되었다[3]. 이러한 상황에서의 흉수는 심인성 간경변, 진단되지 않은 정맥 폐쇄성 질환, 좌심실 이완 기능 부전 등으로 인한 것일 가능성이 크다.
심부전으로 인한 흉수의 진단
심부전으로 인한 흉수를 가진 환자들은 보통 심부전의 특징적인 증상과 증후를 나타낸다[4]. 대부분의 환자들은 운동 시 호흡 곤란, 말초 부종, 기좌호흡 등의 증상을 호소하며, 신체 검진상 경정맥 확장, 말초 부종, 간경정맥 반사, 양폐야의 수포음, S3 심음 등 심부전과 관련된 증후들이 발견된다.
흉부 방사선 사진에서는 대개 심비대를 동반한 양측성 흉수로 나타나며, 폐울혈과 폐부종을 동반한 경우가 많으며(Fig. 1). 흉부 방사선 사진상 비전형적인 양상을 보일 경우에는 흉수의 다른 원인도 감별해야 한다. 일측성 흉수일 경우, 우측 흉수가 좌측보다 흔하며, 일측성 흉수나 심비대를 동반하지 않은 양측성 흉수인 경우에도 심부전의 가능성을 완전히 배제할 수는 없다.
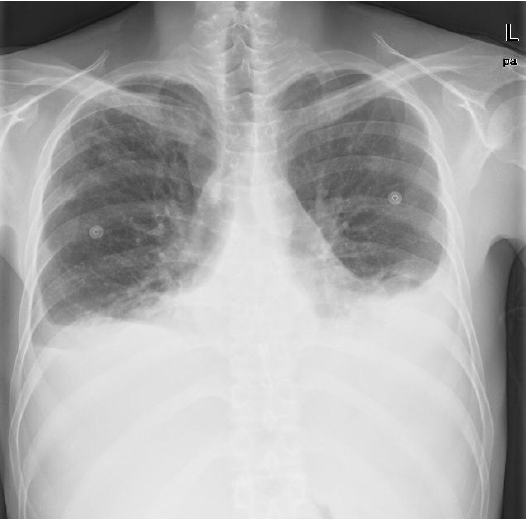
Radiographic findings in congestive heart failure.
Chest X-ray shows cardiomegaly, pulmonary edema and both pleural effusion.
임상양상이 비전형적일 경우에는 진단적 흉수 천자가 시행되어야 한다. 진단적 흉수 천자의 적응증으로는 일측성 흉수나 양측 흉수 양의 차이가 현저한 경우, 이뇨제에 반응이 없는 경우, 발열이 동반된 경우, 흉막성 흉통을 동반한 경우를 들 수 있다[1,4,5]. 흉수 천자상, 여출성 흉수에 합당한 소견이라면 심부전에 의한 흉수일 가능성이 커지지만, 다른 임상적 상황이 심부전을 시사한다면, 진단적 흉수 천자를 반드시 시행할 필요는 없다.
심부전 환자에서 발생한 흉수는 전형적으로 흉수와 혈청 단백질 비 0.5 미만, 흉수와 혈청 LDH (lactate dehydrogenase) 비 0.6 미만, 그리고 흉수 LDH 절대치가 혈청 정상 LDH 값의 3분의 2 미만인 여출액 소견을 보인다(Table 2) [6]. 이 기준은 약 25%의 여출액을 삼출액으로 잘못 분류할 수 있는데, 삼출액으로 분류되었으나 임상적으로 맞지 않다면, 혈청과 흉수의 단백질 차이를 구하여 3.1 g/dL 이상이라면 여출액이라 할 수 있다[1].
최근, 혈액 내 나트륨 이뇨 펩타이드(natriuretic peptide)가 심부전의 진단에 유용함이 밝혀졌다. BNP (B-type natriuretic peptide)와 NT-proBNP (N-terminal proBNP) 모두 압력과 용적 부하에 반응하여 증가한다. 혈청 BNP 100 pg/mL 미만이거나 NT-proBNP 400 pg/mL 미만인 환자는 심부전의 가능성이 적은 반면, 혈청 BNP 400 pg/mL 이상이고 NT-proBNP 2,000 pg/mL 이상인 환자는 심부전일 가능성이 크다. 최근에 이루어진 8개 연구에 대한 메타 분석 결과, 흉수 NT-proBNP의 측정은 95%의 민감도와 94%의 특이도를 보였다[7].
치료
심부전에 의한 흉수 치료의 근간은, 기저 심부전의 치료에 있다. 정상 체액량 유지를 위해 고리 이뇨제를 사용하고, 안지오텐신 전환 효소 억제제나 알도스테론 수용체 길항제, 베타 차단제 등의 근거 중심 치료가 이루어져야 한다.
유증상의 대량 흉수인 경우에는 치료적 흉수 천자가 빠른 증상 호전에 도움이 될 수 있다. 드물게 치료 불응성인 흉수에서 흉막 유착술이나, 지속적인 흉관 삽입이 필요한 경우도 있다.
폐 혈전 색전증으로 인한 흉수
역학 및 발생 기전
폐 혈전 색전증이 있는 환자의 30-50%에서 흉수가 발생하지 만, 흉수 천자를 시행 받는 환자들은 5%에 불과하다[8]. 이는 폐 혈전 색전증과 연관된 대부분의 흉수가 단지 늑골횡격막각(costophrenic angle)의 소실만을 보여 진단적 흉수 천자가 어려우며, 진단되지 않은 흉수의 원인으로 폐 혈전 색전증이 흔히 고려되지 않기 때문이다.
폐 혈전 색전증과 연관된 흉수는 대부분 삼출성 흉수이며[9] 주된 생성 기전은 폐 모세혈관의 투과도 증가에 따른 폐 간질액 증가이다. 혈소판이 풍부한 혈전으로부터 염증 매개 물질이 분비되는데, 이 중 혈관내피세포성장인자(VEGF, vascular endothelial growth factor)가 폐 모세혈관의 투과도를 증가시키는 주요 인자이며, 이전의 연구에서 폐 혈전 색전증으로 인한 흉수에서 높은 VEGF 농도가 보고된 바 있다[10]. 색전 원위부의 허혈성 폐 모세혈관 또한 폐 모세혈관의 투과도 증가에 기여할 것으로 보인다.
폐 혈전 색전증과 연관된 흉수의 진단
진단이 불확실한 삼출성 흉수 환자에서 폐 혈전 색전증은 반드시 원인으로 고려되어야 한다. 임상적으로 폐 혈전 색전증의 가능성이 큰 환자에서는 즉시 항응고 치료를 시행하면서 폐 혈전 색전증의 진단을 위한 검사를 진행하여야 한다.
최근의 한 연구에서 흉부 전산화 단층 촬영과 흉부 단순 방사선 촬영을 시행한 230명의 폐 혈전 색전증 환자 중 단순 흉부 방사선 촬영에서는 32%, 흉부 전산화 단층 촬영상에서는 47%의 환자에서 흉수가 동반되어 있었고, 47%는 좌측, 38%는 우측, 15%는 양측 흉수를 보였으나 폐 혈전 색전증의 위치와 관련성은 없었다[9]. 대부분 적은 양으로, 90% 이상의 환자들에서 일측 흉곽의 3분의 1 미만을 차지하였다. PIOPED 연구에서도 흉수가 있었던 환자 56명 중 48명(86%)이 단지 늑골횡격막각의 소실만을 보였다[11].
폐 혈전 색전증과 연관된 흉수의 진단에서 흉수 천자 소견은 매우 다양하여 진단에 도움이 되지는 않는다. 만약 폐 혈전 색전증이 이미 진단이 된 상태라면, 흉수 천자는 발열이 동반된 환자에서 흉막 감염을 배제하거나, 흉수의 양이 늘고 있는 환자에서 혈흉을 배제하기 위해서만 시행되어야 한다. 폐 혈전 색전증이 증명되지 않았다면, 전산화 단층 촬영, 측와위 방사선 사진, 초음파 등에서 10 mm 이상의 양일 경우에는 흉수 천자를 시행해야 한다.
과거에는 폐 혈전 색전증으로 인한 흉수는 삼출액과 여출액이 모두 가능하다고 하였으나, 대부분은 여출액인 것으로 보인다. 각각 60명과 26명의 환자를 대상으로 했던 최근의 연구들에서, 모든 환자들은 여출액 소견을 보였고, 반드시 혈성 흉수를 보이지는 않는 것으로 보고되었다[9,12].
치료
폐 혈전 색전증의 일차 치료는 항응고 치료이며, 흉수의 동반 여부가 이 치료를 변화시키지는 않는다. 혈성 흉수를 가진 대부분의 환자들은 항응고 치료에도 흉강 내로의 유의한 출혈이 없으므로, 혈성 흉수는 항응고 치료의 비적응증이 아니다.
흉수를 동반한 폐 혈전 색전증에서 두 가지 중요한 합병증은 혈흉과 흉막 감염이다. 항응고 치료 중, 흉수의 양이 늘거나, 반대측 흉수가 발생한다면 혈흉이나 흉막 감염, 재발성 폐 혈전 색전증을 의심해야 한다. 이러한 경우에는 합병증 유무를 확인하기 위하여 흉수 천자를 시행하여야 한다.
관상동맥 우회술 후의 흉수
역학 및 발생 기전
관상동맥 우회술을 시행받은 대부분의 환자들은 수술 후 수 일 내에 소량의 흉수가 나타나며, 이는 보통 좌측 흉강에 국한되어 있다[13]. 약 10% 정도의 환자들에서만 일측 흉강의 25% 이상을 차지하는 양의 흉수가 발생한다.
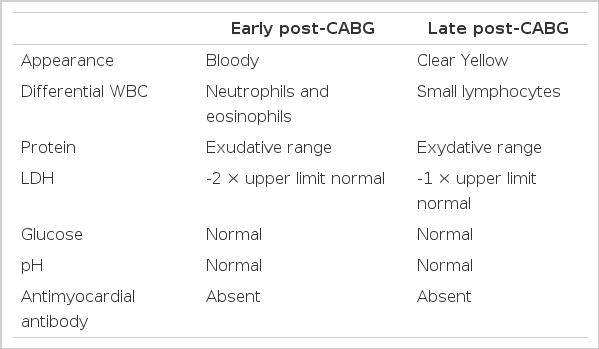
관상동맥 우회술 후 발생하는 흉수의 병태생리는 아직 명확히 밝혀져 있지는 않으나, 수술 직후에 발생하는 소량의 좌측에 국한된 흉수는 수술로 인한 손상과 연관이 있을 것으로 생각되고 있다. 이 흉수는 심장의 기능 부전이나, 심외막 질환과는 관련이 없다고 알려져 있다[14]. 일측 흉강의 25% 이상을 차지하는 대량 흉수는 모두 삼출성 흉수로, 수술 첫 30일 이내에 발생하는 경우와 30일 이후에 발생하는 경우로 나누어 볼 수 있다[15,16]. 조기에 발생하는 흉수는 대개 혈성으로 적혈구 용적률(hematocrit)이 약 5% 정도이며, 호산구가 많은 경우가 흔하고(중앙값 40%), LDH 또한 높아 평균적으로 혈성 정상치의 2배 정도가 된다. 이는 수술로 인한 손상이나 수술 후 흉강 내로의 출혈로 인해 발생하는 것으로 보인다[16]. 후기에 발생하는 흉수는 맑은 황색의 삼출액으로, 보통 림프구로 구성되어 있으며, LDH 값은 정상값의 상한치 정도이다. 그 발생 기전은 아직 명확히 알려져 있지 않다(Table 3) [13].
임상양상과 진단
관상동맥 우회술 후 흉수가 발생한 환자들의 가장 흔한 증상은 호흡 곤란이며, 흉통이나 발열은 비교적 드물다[13].
수술 후 흉수가 발견되었을 경우에는 관상동맥 우회술로 인한 2차적인 흉수의 발생 외에도 심부전, 폐 혈전 색전증, 흉강 감염, 부폐렴성 흉수, 심손상 후 증후군(postcardiac injury syndrome), 교착성 심막염, 유미흉 등 흉수의 다른 원인을 배제하여야 한다. 무증상의 환자가 일측 흉강의 25% 미만을 차지하는 좌측 흉수를 보인다면, 진단적 흉수 천자 없이 관상동맥 우회술로 인한 흉수로 진단할 수 있다. 환자가 발열이나 흉통을 호소한다면, 진단적 흉수 천자를 시행하여 다른 원인을 배제해야 한다.
치료
관상동맥 우회술 후 발생한 흉수의 치료에 대한 무작위 배정 연구는 없다. 흉수의 양이 적고 무증상이라면, 대부분은 시간에 따라 자연적으로 흡수되므로 치료는 필요하지 않다[13]. 흉수의 양이 많아 증상을 유발한다면, 치료적 흉수 천자가 시행되어야 하며, 반복적으로 흉수 천자가 필요한 경우도 있다. 지속적으로 재발하는 경우 비스테로이드성 소염 진통제나 스테로이드를 투여하는 경우도 있으나, 효과가 증명되지는 않았다. 화학적 흉막 유착술이 도움이 되는 경우도 있다. 극히 드물지만, 수술 후 장측 흉막이 섬유화된 조직으로 둘러싸여 반복적으로 흉수를 유발하는 경우에는 흉막 박피술이 도움이 될 수 있다.
심손상 후 증후군
심손상 후 증후군(postcardiac injury syndrome, PCIS)은 심근 경색, 심장 수술, 외상 등 여러 종류의 심장 자극 이후에 심외막, 흉막 또는 폐 실질에 발생하는 염증성 질환으로, 발열, 흉막성 흉통, 심외막염, 호흡기 관련 질환을 유발한다. 백혈구 증가증, 적혈구 침강속도(erythrocyte sedimentation rate, ESR)의 증가, 흉부 방사선 사진상 흉수의 발생 등이 동반된다[17]. 질환의 발생 기전이 명확히 알려져 있지는 않으나, 면역학적 반응이 관여할 것으로 생각되고 있다. 경과는 비교적 양호하여 질환 자체의 경과에 영향을 주지는 않으나, 심낭 압전, 교착성 심막염, 관상동맥 우회로 폐쇄 등의 합병증이 발생하는 경우도 있다. 항 염증제가 질병의 경과에 도움이 되어, 아스피린이 주로 사용되며 스테로이드나 비스테로이드성 소염진통제는 피하는 것이 좋다.
상대정맥 폐쇄로 인한 흉수
현재까지 흉수가 동반된 상대정맥 증후군에 관한 많은 증례가 보고되어 있으며, 78명의 상대정맥 증후군 환자를 대상으로 한 최근의 연구에 의하면 상대정맥 증후군 환자의 60%에서 흉수가 동반되어 있었다[18]. 이들 환자에서 흉수는 대부분 양이 적고, 양 측에 균일하게 분포했다. 지금까지 상대정맥 증후군에 의한 흉수는 대부분 여출성 흉수인 것으로 알려져 있으며, 이는 상대정맥의 폐쇄로 인한 정수압의 증가에 인한다. 상대정맥의 폐쇄와 동반된 흉관 폐쇄로 인한 유미흉과 기전이 명확치는 않으나 일부 삼출성 흉수에 관한 보고도 있다[19]. 대부분의 흉수는 상대정맥 증후군을 일으킨 기저 질환을 치료하면 호전된다.
결 론
흉수는 일차 진료 시에 접하게 되는 매우 흔한 질환으로, 다양한 원인에 의해 발생할 수 있다. 심부전은 흉수의 가장 흔한 원인 중의 하나로, 환자의 증상과 임상양상에 근거하여 진단적 흉수 천자 없이도 진단 및 치료가 가능하다. 진단되지 않은 흉수의 원인으로 폐 혈전 색전증과 관상동맥 우회술, 심손상 후 증후군 등도 고려해 볼 수 있겠다. 심혈관 질환으로 인한 흉수를 다른 원인들로부터 구별해 내는 것은 불필요한 검사를 피하고 조기에 적절한 치료를 할 수 있게 하므로, 흉수의 가능한 원인으로 반드시 고려하여야 한다.