서 론
Birt-Hogg-Dubé (BHD) 증후군은 섬유털집종(fibrofolliculoma) 혹은 털원반종(trichodiscoma) 등의 피부 양성 종양과 폐낭종, 자발성 기흉으로 나타나는 호흡기 질환, 그리고 신장 종양 등이 동반되어 나타나는 드문 질환이다. 이 질환은 1977년에 Birt, Hogg, 그리고 Dubé에 의해서 처음 유전성 피부 질환으로 보고되었으며[1], 2001년에 17p11.2에 위치한 folliculin 유전자의 변이가 이 질환의 원인임이 처음 밝혀졌다[2]. 이 유전자가 밝혀진 이후 최근에는 호흡기 분야에서 이에 대한 유전자 연구가 활발하게 이루어졌으며, 피부 병변 없이도 발견되는 BHD 증후군이 보고되고 있다[3,4]. 국내에서는 섬유털집종 등의 다발성 피부 병변을 주소로 내원하여 folliculin 유전자 변이 검사를 통하여 BHD 증후군이 증명된 증례가 1차례 보고된 바가 있으나[5], 폐질환만을 보인 BHD 증후군은 아직 국내 보고가 없다.
이에 저자들은 폐렴 치료를 받은 65세 여자 환자가 흡연력 없이도 반복적 자발성 기흉 기왕력 및 양측성 다발성 폐낭종 소견 관찰되어 folliculin 유전자 변이 검사를 시행하였고, 이를 확인함으로써 BHD 증후군을 진단한 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 한○○, 여자, 65세
주 소: 내원 2주 전부터 발생한 기침과 호흡곤란
현병력: 내원 2주 전부터 발생한 기침과 호흡곤란을 주소로 자가 약물 치료하였으나 호전이 없어 내원하였다.
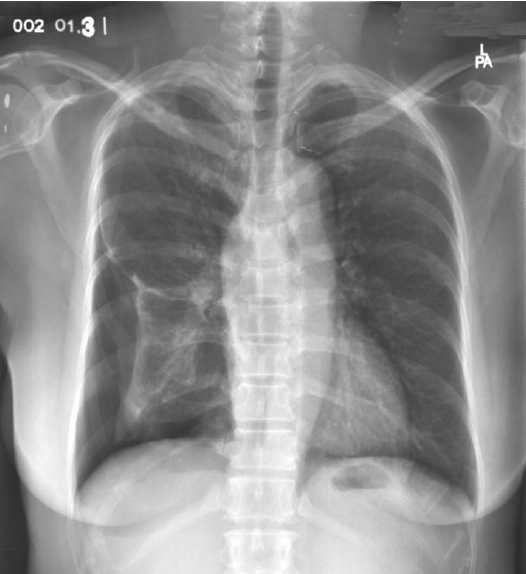
과거력: 8년 전 2차례의 자발성 기흉으로 흉관 삽관 및 흉막 유착술로 치료받은 과거력이 있었다(Fig. 1). 이후 특별한 증상 없이 지냈다.
가족력: 2남 4녀 중 둘째로 특이소견 없다.
사회력: 음주 및 흡연력은 없었다.
이학적 소견: 내원 시 혈압은 130/80 mmHg, 맥박수 90회/분, 호흡수 22회/분, 체온은 37.8oC였으며 의식은 명료하였다. 청진상 우중엽에서 수포음이 청진되었다. 신체검사에서 경부 림프절은 촉진되지 않았고, 복부 진찰에서 압통이나 반발 압통도 없었다. 피부에 특이 소견은 관찰되지 않았다.
검사실 소견: 내원 시 백혈구 12,980/mm3 (분엽핵호중구 69.8%, 림프구 21.3%), 혈색소 12.7 g/dL, 혈소판 수 314,000/mm3, 프로트롬빈시간 11초(INR 1.0), 활성화부분트롬보플라스틴시간 29.2초였다. 생화학 검사상 혈청 나트륨 141 mmol/L, 칼륨 4.5 mmol/L, 혈액요소질소 9.2 mg/dL, 크레아티닌 0.75 mg/dL, 총 단백 6.9 g/dL. 알부민 4.0 g/dL, 총 빌리루빈 0.49 mg/dL, AST/ALT 23/22 U/L, 총 빌리루빈 0.49 mg/dL, 유산탈수소효소 356 U/L로 정상범위였다. ESR 63mm/hr, C-reactive protein은 12.78 mg/dL로 증가되어 있었으며, 암종배양항원(CEA)은 3.65 ng/mL이었다. 소변검사에서도 이상소견 없었다.
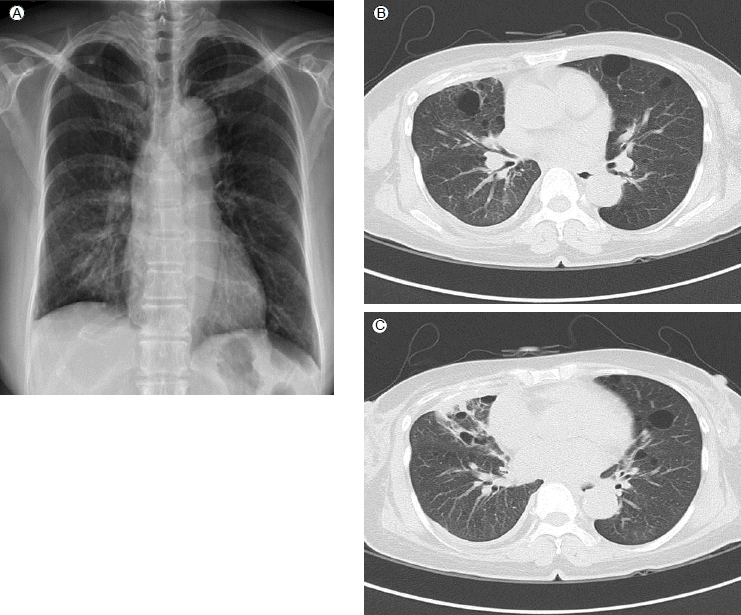
방사선 소견: 단순 흉부 X-선(Fig. 2A)에서 우하부에 기관지주위 침윤소견 관찰되고 있다. 흉부전산화단층촬영(Fig. 2B and 2C)에서는 우중엽에 경화 및 무기폐 소견과 더불어 양폐에 수 mm에서 약 2 cm에 달하는 다양한 크기의 공기 낭종들이 주로 양폐 하부에 보이며, 그 벽은 뚜렷하게 관찰되지 않았다.
기관지경 소견: 우중엽 및 우하엽에 약간의 기관지 점막 비후 소견 외에는 특이 소견 관찰되지 않았으며 우중엽에서 기관지 세척액 검사 시행하였다. 기관지 세척액 검사에서는 Streptococcus pneumonia가 배양되었으며 항상균 도말 검사 및 결핵균에 대한 핵산 증폭 검사는 음성이었다.
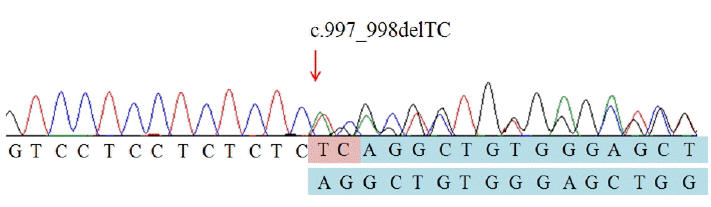
유전자 검사: 환자는 비록 BHD 증후군에서 관찰되는 특징적인 피부소견 및 가족력은 관찰되지 않았으나 흡연력이 전혀 없음에도 불구하고 자발성 기흉 기왕력 동반한 양측성 다발성 폐낭종이 관찰되어 환자 동의하에 folliculin 유전자 변이 검사를 시행하였다. 환자의 말초혈액에서 DNA를 추출하여 PCR과 direct sequencing을 시행하였으며, 염기서열분석 결과 997_998번째 염기인 TC가 결실되면서 frameshift가 일어나 333번째 아미노산인 Serine이 Arginine으로 바뀌고 이로부터 56번째에 premature stop codon이 생기는 변이가 발견되었다(Fig. 3).
치료 및 경과: 세균성 폐렴 진단하에 내원 당시부터 Levofloxacin 정주용 항생제를 사용하여 치료 2일째부터 발열 소견이 사라졌고 치료 3일째는 백혈구 5,110/mm3, C-reactive protein 5.87 mg/dL로 감소하였으며 단순 흉부 X-선에서도 우하부 기관지주위 침윤이 호전된 소견이 관찰되었다. 이후 환자는 Levofloxacin 경구용 항생제로 바꾸어 치료 5일째 퇴원하였으며 퇴원 후에도 폐렴 증세는 더 이상 나타나지 않았다. 이후 내원하여 시행하였던 folliculin 유전자 검사 변이 결과를 확인(약 20일 경과)하여 환자에게 전화 통보하였고, 직계 가족 유전자 검사 및 환자 본인의 신장 종양 유무 감별을 위해 복부전산화단층촬영을 권유하였으나 환자가 더 이상 외래를 방문하지 않아 시행하지 못하였다.
고 찰
BHD 증후군은 1977년 처음 보고 당시 얼굴, 목, 그리고 상부에 관찰되는 섬유털집종 혹은 털원반종 등의 피부 양성 종양을 보이는 상염색체 우성 질환으로 보고되었으며[1], 2001년에 이 질환이 염색체 17p11.2에 위치한 folliculin 유전자의 돌연변이에 의해서 발생함이 밝혀졌다[2]. 13개의 exon으로 구성된 유전자가 만들어내는 folliculin 단백질의 기능은 정확히 알려져 있지 않지만 다양한 장기에서 발현되며 그중에서도 특히 피부, 신장, 그리고 폐(기질 세포와 1형 폐포세포)에서 주로 발현된다고 알려져 있다[6]. Folliculin 유전자가 밝혀진 이후 BHD 증후군에 대한 연구가 활발히 이루어졌으며 폐낭종과 자발성 기흉 등의 폐질환과 다양한 형태의 신장 종양이 BHD 증후군과 관련이 있음이 밝혀졌다. Zbar 등[7]은 BHD 증후군을 진단받은 환자는 50배의 자발성 기흉 발생 가능성과 7배의 신장 종양 발생 가능성이 있다고 보고하였다.
BHD 증후군에서 나타나는 특징적인 폐질환 소견은 다발성 폐낭종과 자발성 기흉이다. Toro 등[8]이 흉부전산화단층촬영을 시행한 198명의 BHD 증후군 환자를 비교 분석한 결과에 의하면, 환자의 89%에서 다발성 폐낭종이 관찰되며 24%가 1회 이상의 자발성 기흉을 경험한 것으로 나타났다. 또한 일반적으로 자발성 기흉이 남성과 흡연자에서 높게 나타나는 반면에 BHD 증후군 환자에서의 자발성 기흉의 발생 비율은 성별과 흡연 유무에 관계가 없는 것으로 밝혀졌다. 자발성 기흉의 발생 비율은 BHD 증후군에서 흔히 동반되는 피부 질환 및 신장 종양의 유무와도 관련이 없었으며 다만 폐낭종의 수와 면적에만 관련이 있었다. Tobino 등[9]은 12명의 BHD 증후군 환자의 흉부전산화단층촬영을 분석한 결과 폐하부의 내측면 및 흉막하 영역에 주로 위치한 얇은 벽을 가진 다양한 크기의 다발성 폐낭종 소견을 BHD 증후군의 특징적인 폐낭종 소견으로 보고하였다. BHD 증후군에서 보이는 폐낭종성 질환은 미만성 다발성 폐낭종을 보일 수 있는 림프관평활근종증(Lymphanioleiomyomatosis), 랑게르한스 세포 조직구증(Langerhans cell histiocytosis), 림프구성 간질성 폐렴(Lymphocytic interstitial pneumonitis) 등의 질환과의 감별이 필요하다. 림프구성 간질성 폐렴의 경우는 폐낭종과 더불어 간유리음영 혹은 경화 등의 폐실질 침범 소견이 관찰되며, 랑게르한스 세포 조직구증의 경우는 주로 폐하부보다는 상부에 폐낭종들이 관찰되고 흡연과의 연관성이 있다[10]. 림프관평활근종증은 BHD 증후군과 가장 감별이 어려운 질환으로 폐실질의 침범이 없고 다양한 크기의 양측성 폐낭종이 폐전반에 걸쳐 관찰되며 신장종양도 동반되어 나타나는 특징이 있다는 점이 두 질환에서 유사하게 나타난다. 그러나 림프관평활근종증의 경우는 주로 30-40대 이전의 여성에게 주로 증상이 발현되는 반면에 BHD 증후군의 폐질환은 주로 50대 이후 남녀에서 동등한 비율로 발견되며 가족력을 동반하는 특징이 있다[11].
본 증례의 환자는 BHD 증후군에서 흔히 나타나는 피부 질환이나 가족력이 없었으며 비록 복부전산화단층촬영은 시행하지는 못하였지만 흉부전산화단층촬영 통해 관찰되는 신장에는 종양을 의심할 만한 소견은 관찰되지 않았고, 혈뇨도 보이지 않았다. 그러나 50세 이후의 비흡연 여성에서 나타나는 반복적인 자발성 기흉은 일반적으로는 매우 드물며 흉부전산화단층촬영 소견이 BHD 증후군에서 나타나는 폐질환 소견과 부합하였기에 이에 대한 감별진단을 위하여 folliculin 유전자 변이 검사를 진행하게 되었다. 아직 folliculin 유전자 변이 검사를 시행하는 명확한 기준은 없다. Ren 등[12]이 자발성 기흉 환자 102명을 대상으로 folliculin 유전자 변이 검사를 시행하였을 때, 기흉의 가족력이 있는 환자는 10명 중 5명(50%)에서 양성 소견을 보였지만 기흉의 가족력이 없는 환자는 92명 중 5명(5.4%)에서만 folliculin 유전자 변이가 관찰되었다. 또한 자발성 기흉이 발생했던 환자 10명 모두에서 폐낭종 소견은 관찰되었으나 BHD 증후군에서 나타나는 특징적인 피부 병변이나 신장 종양은 아무도 관찰되지 않았다. 가족력과 타장기 침범 소견이 없이 폐낭종과 자발성 기흉을 갖는 모든 환자에서 folliculin 유전자 변이 검사를 진행하는 것에 대해서는 논란의 여지가 있겠으나, 폐질환으로만 발현되는 BHD 증후군의 가능성에 대해서는 염두에 두어야 할 필요성이 있겠다.
유전자 연구가 활발해짐에 따라 Menko 등[13]은 임상적 양상과 유전자 검사 결과에 바탕을 둔 BHD 증후군의 진단 기준을 제시하였다(Table 1). 진단 기준에 알 수 있듯이 folliculin 유전자 변이의 확인은 BHD 증후군의 주진단 기준이다. 17p11.2에 위치하며 14개의 exon으로 구성된 folliculin 유전자는 그 변이가 현재까지 전 세계적으로 총 70종이 밝혀졌으며 온라인 데이터베이스를 통하여 관리되고 있다[14]. Folliculin 유전자의 14개 exon 중에서 11번 exon에서 약 절반 가량의 변이가 관찰되며 이를 “hotspot”이라고 부른다. 또한 Toro 등[8]이 198명의 BHD 증후군 환자에서 유전자를 분석한 결과 유전자 변이의 종류(삽입, 결손, 넌센스 등)와 임상 발현 양상의 차이는 없었으나, 유전자 변이 장소가 9번 exon일 경우는 다른 장소에서 나타나는 유전자 변이보다 기흉의 발생이 유의하게 높았다(8/17 (47%) vs. 28/112 (25%), p value = 0.01). 본 증례의 유전자 변이도 9번 exon에서 발생하였으며 돌연변이 데이터베이스에 등재되어 있지 않은 새로운 변이로서 이 역시 환자의 폐질환과 관련되어 있을 것으로 생각한다.
Folliculin 유전자 변이를 갖는 BHD 증후군 환자는 추후 종양 발생에 대한 정기적인 검사가 필요하다. 신장 종양 발생률은 일반인에 비해 8배 가량 높으며 유방암 및 대장암의 발생률도 일반인에 비해 높다고 보고되고 있다[15]. 또한 그 직계 가족에 대한 folliculin 유전자 변이 검사도 병행하여 시행함으로써 이 질환에 대한 조기 진단이 필요하겠다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






