영양, 대사 및 감염에 미치는 프로톤펌프억제제의 영향: Safe 측면
The Effect of Proton Pump Inhibitors on Nutrition, Metabolism, Infection and Small Intestinal Bacterial Overgrowth: Safe Perspective
Article information
Trans Abstract
Proton pump inhibitors (PPIs) have been widely used to treat patients with acid-related disorders because they are perceived to be safe and effective. However, they have the potential for side effects. Many studies have examined the side effects of long-term PPI exposure. We review the side effects of long-term PPIs, focusing on nutrition, metabolism, and infection. (Korean J Med 2011;81:11-16)
서 론
프로톤펌프억제제(proton pump inhibitor, PPI)는 소화성 궤양, 역류성 식도염 등 위산 관련 질환에서 사용되는 약제로, 국내에서도 역류성 식도염의 발생빈도가 증가하고 있어 이 약제의 장기사용 증가가 예상된다. PPI 투여의 부작용에 대해서는 1986년부터 꾸준히 연구가 되었으나 특히 최근에 보고가 증가하는 추세이다[1]. PPI 부작용에 대한 인지는 약제의 사용 빈도 증가뿐 아니라 긴 혈중 반감기와 좀 더 강하게 산을 억제하는 약제들이 개발되는 현시점에서 중요할 수 있다.
PPI 부작용은 약제의 특성을 고려할 때, 산억제에 대한 영향, 간의 cytochrome P450과의 상호작용에 대한 영향 등에 의하여 발생할 수 있으며, 따라서 카르시노이드 종양, 위축성 위염, 위암, 위저선 용종, 흡수장애, 감염, 약물상호작용 등이 부작용으로 알려져 있다[1,2]. 이 중 위산저하에 의한 흡수 및 대사 장애 즉 영양적 측면과 위산저하에 의한 감염적 측면에서 PPI 부작용을 살펴봄으로써 PPI 장기 사용에 대한 안전성을 검토해보고자 한다.
본 론
영양적 측면
PPI의 위산억제에 의한 비타민 및 미네랄 흡수 장애가 발생할 수 있으며, 특히 칼슘 흡수 장애로 골(bone)에 대한 영향을 생각해 볼 수 있다.
비타민 및 미네랄 흡수 장애
비타민 B12
위의 산성도는 비타민 B12 흡수에 중요하다. 음식물에서 비타민 B12는 단백과 강하게 결합되어 있는데, 위산과 펩신에 의해 단백과 분리되어 타액 R 단백과 결합하게 되므로, PPI 사용에 의한 위산억제는 비타민 B12 흡수를 저해하게 된다. 또한, 위산 감소에 의해 소장의 세균 과다 증식이 발생하게 되면 세균에 의한 비타민 B12 소비 증가가 발생하여 비타민 B12 결핍이 발생할 수 있다. 이와 같이 이론적으로 PPI 사용에 의한 위산억제는 비타민 B12 결핍을 초래할 수 있으나 임상적으로 PPI 장기 사용에 의한 비타민 B12 결핍은 뚜렷하지 않다.
6개의 PPI 장기 사용에 따른 혈청 비타민 B12 농도를 측정한 연구 중 5개의 연구에서 혈청 비타민 B12 농도는 감소하지 않았으며, 감소를 보인 연구는 Zollinger-Ellison 증후군 환자를 대상으로 장기간 동안 고용량의 PPI를 사용한 것이었다[3-10]. 하지만 노인을 대상으로 한 연구에서는 PPI를 장기사용 하였을 경우 혈청 비타민 B12 감소 가능성을 보여주었다[11-13]. 따라서 일반적으로 PPI 장기사용이 혈청 비타민 B12 감소를 유발할 가능성은 적으나, 노인들의 경우는 이미 위의 위축성 변화가 동반되었을 가능성이 있기 때문에 PPI 장기사용에 있어 비타민 B12 감소될 가능성이 있으므로 주의를 요하며, Zollinger-Ellison 증후군 환자와 같이 PPI를 고농도로 장기 사용할 경우에도 혈청 비타민 B12 감소 가능성을 염두에 두어야 하겠다.
철(iron)
PPI 장기사용과 철흡수에 대한 연구를 많지 않다. 이론적으로 PPI 장기사용에 의한 위산감소는 철흡수를 감소시킬 수 있다. 음식물에 포함된 철은 non-heme (66%) 또는 heme 철(32%)로 존재하게 되는데, 위산은 non-heme 철이 포함된 음식물에서 철염을 분리하고 용해하도록 도와준다.
PPI 장기사용과 철흡수 감소에 대한 보고는 증례보고 정도만이 있는 상태로, 철보충제에 반응이 적던 철결핍성 빈혈 환자가 PPI 중단 이후 호전된 경우이다[3]. 이외에 다른 연구들에서는 임상적으로 PPI 장기사용이 철흡수 감소에 뚜렷한 영향을 보여주지 못하였다[14,15].
마그네슘
PPI 사용 시 저마그네슘 혈증이 유발됨이 보고되고 있으며, 증상을 유발하는 심한 저마그네슘 혈증 및 저칼륨 혈증이나 고칼슘 혈증의 동반도 보고되고 있다[16-20]. 이와 같은 환자들은 위장내 흡수 장애나 신장 소실의 증거가 없이 저마그네슘이 발생한 경우로 PPI의 중단 또는 H2RA로의 교체 1-2주만에 정상으로 회복되었다. 따라서 PPI 사용에 의한 저마그네슘 혈증이 발생하였음을 알 수 있으나, 이에 대한 기전은 밝혀진 것이 없다. 특이약물반응 가능성이 제기되기도 하며, 저마그네슘 혈증을 유발할 수 있는 다른 위험인자와의 반응 등이 제기되기도 하나 현재까지 밝혀진 기전은 없는 상태이다.
따라서 저마그네슘 혈증을 유발할 가능성이 높은 환자들 선정을 위한 연구가 추후 필요한 상태이며, 현재까지는 PPI 사용에 있어 저마그네슘 혈증이 동반될 가능성을 염두에 두는 것이 중요하다고 하겠다.
칼슘 및 골(bone)에 대한 영향
위산은 음식물의 칼슘염 용해와 관계된다는 점에서 칼슘흡수에 중요하다고 하겠다. 따라서 PPI에 의한 위산억제는 칼슘흡수의 저하를 유발할 수 있고 이는 임상적으로 골밀도 감소와 연관될 수 있다. 하지만 위산의 골밀도에 대한 영향은 칼슘에 의해서만 영향을 받는 것은 아니다.
PPI가 골(bone)에 영향을 미치는 기전은 여러가지로 보고되고 있다. 파골세포(osteoclast)에 존재하는 프로톤 펌프에 작용하여 오히려 골흡수를 저해한다는 보고도 있지만, PPI에 의해 골밀도가 감소하는 여러 가지 기전에 의해 PPI 장기사용에 따른 골밀도 저하, 이에 따른 골절 여부가 임상적으로 중요한 부분이라 하겠다. PPI에 의해 골강도가 감소하는 기전은 그림 1과 같다[1].
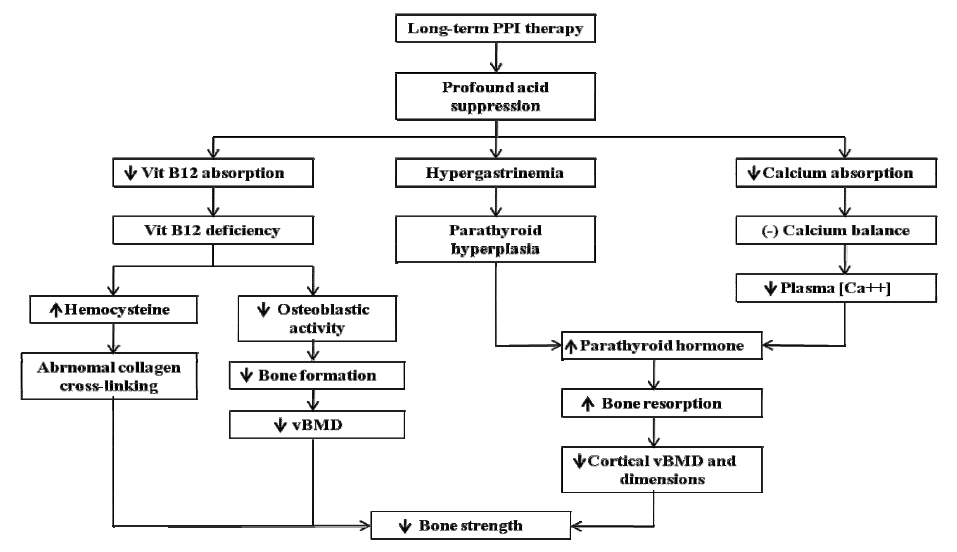
Pathways through which proton pump inhibitor therapy can decrease bone strength. PPI, proton pump inhibitor; Vit, vitamin; vBMD, volumetric bone mineral density.
환자, 대조군 연구에 따르면 PPI 사용과 골절의 위험도 증가는 PPI의 용량 및 사용기간과 연관이 있다고 알려져 있다[21]. 즉, 한 연구에서는 5년 이상 PPI를 복용하였을 때 골다공증에 의한 골절의 위험도가 1.62배 증가하였다고 보고하였으며, 다른 연구에서는 7년 이상 복용하였을 때 고관절 골절의 위험도가 4.55배 증가하였다고 보고하였다[22,23]. 하지만 이와 같은 환자, 대조군 연구에서 골절의 위험도 증가를 분석함에 있어 중요한 것은 다른 골다골증 골절의 위험인자가 배제된 즉, PPI 사용과 골절 여부만의 새로운 연관관계를 제대로 분석하였느냐가 중요할 수 있을 것이다. 그러나 대부분의 연구들이 골절과 관련된 다른 위험인자들이 배제가 된 후 PPI와 골절과의 연관관계만을 분석하지는 못하였다[24,25]. 따라서 캐나다 소화기 학회(The Canadian Association of Gastroenterology, CAG)에서는 현재까지의 연구들은 PPI를 처방함에 있어 고관절 골절의 위험성을 고려할 근거가 부족하다고 언급하였다[26]. 가장 최근의 연구를 살펴보면, 2년 이상 PPI를 장기복용한 환자들에서 고관절 골절의 정도를 다른 골절의 위험인자와 같이 분석하여 보았을 때 1개 이상의 골절의 위험인자를 가진 환자들에서만 1.25배로 골절의 위험도가 증가함을 보고하면서 산억제는 골다공증의 위험인자를 가지고 있는 사람들에게 있어 골절의 위험도를 증가시킬 수 있다고 결론지었다[27].
따라서 PPI 장기 사용이 골절과 연관이 있을 수 있지만 모든 PPI 사용자를 대상으로 고려하였을 때 임상적으로 미치는 위험도는 적다고 하겠다. 이미 골다공증 위험인자를 가지고 있는 경우 PPI 장기 사용시 골절의 위험도를 인지하는 것이 중요할 수 있으며 되도록 가장 효과적이면서 적은 용량의 PPI 사용이 골절 예방에 도움이 될 수 있겠다.
감염적 측면
위산은 상부위장관에서 세균 집락형성에 대한 장벽역할을 하며, 장의 상재균 구성에 영향을 미치는 것으로 알려져 있다. 따라서, PPI에 의한 위산저하는 위장관내 세균 감염 및 집락형성을 유발할 수 있으며 이의 역류에 의한 호흡기 감염을 유발할 수 있고, 장의 상재균 구성 변화 및 세균성 위장염을 일으킬 가능성이 있다.
폐렴
이론적으로는 PPI에 의한 위산저하가 폐렴을 유발할 수 있으나 이에 대한 임상적 근거는 희박한 상태이다. 지역사회획득폐렴(community-acquired pneumonia, CAP)의 경우 현재 PPI 사용 여부 및 PPI 사용기간과 CAP 발생 사이에 연관성이 부족한 상태이다. 즉, 현재 PPI를 사용하는 경우 CAP가 발생할 가능성이 1.89배인데 반해 이전에 PPI를 사용한 경우에도 CAP 발생가능성이 1.5배로 PPI 사용여부와 CAP 발생 사이의 연관성이 부족하며, PPI 사용이 짧을수록 CAP 발생가능성이 높아진다는 결과가 보고된 것에서도 PPI 사용과 CAP 발생 사이의 연관성을 찾기는 부족하다 하겠다[28-30]. 실제로 한 메타연구에서는 CAP와 PPI 사이에 의미 있는 관련이 없다고 결론지었다[30].
원내폐렴(nosocomial pneumonia, NP)의 경우에는 오히려 PPI 사용이 NP를 증가시키지 않는다고 보고되고 있다[31-33]. 한 연구에서는 PPI를 비위관으로 주입하였을 때 NP의 위험성이 감소한다고 보고하였다[34].
Clostridium difficile 관련 설사(Clostridium difficile-associated diarrhea, CDAD)
CDAD의 발생 위험인자로 항생제 사용, 나이, 감염 환자와의 접촉, 위생, 환자의 면역력 정도 등 다양한 인자들이 보고되어 있다. CDAD와 PPI와의 관련성을 분석함에 있어서 이와 같은 다른 위험인자들을 배제하는 것이 중요할 수 있다. 실제로 만성 신부전 환자에서 CDAD와 PPI 사용과의 연관성을 본 연구에서는 CDAD 발생이 5.7배로 증가함을 보고하였지만[35], 메타분석에서는 PPI 사용의 경우 CDAD 발생이 1.96배로 증가함을 보고하였다[36]. 하지만 이 메타분석에서 몇몇 연구들은 굉장히 강한 독성의 Clostridium difficile을 대상으로 연구가 진행되었으며, 실제 항생제 사용과 같은 다른 위험인자를 고려하였을 때 PPI 사용과 CDAD와는 관련성이 없다고 하였다[36]. 즉, 아직까지는 PPI 장기사용이 CDAD 발생을 증가시킨다는 확실한 근거는 없다고 하겠다.
소장세균과다증식증(Small intestinal bacterial overgrowth, SIBO)
PPI 사용에 의한 위산억제는 위, 십이지장, 장관내 세균 구성에 변화를 가져올 수 있으며 이에 의한 SIBO의 위험인자임이 보고되었다[37]. 실제로 십이지장액을 배양하여 보았을 때 PPI 사용군에서 더 많은 세균과다증식증이 확인되었다[38]. SIBO를 포도당호기검사로 측정하여 본 연구에서도 PPI 사용군에서 과민성장증후군이나 대조군과 비교하였을 때 의미 있게 포도당호기검사가 양성임을 보고하였으며 PPI 사용기간에 대해 분석하여보았을 때 13개월 이상 복용한 경우 의미 있게 SIBO가 증가함을 보여주었다[39]. 이와 같은 PPI 관련 SIBO에 의해 발생하는 증상은 과민성장증후군과 비슷한 증상을 유발할 수 있으며, 특히 PPI에 의해 비결합 담즙산 농도 증가에 의한 삼투압 증가 및 장운동의 증가로 설사가 많이 동반될 수 있다고 보고되었다[40,41].
따라서 이와 같이 PPI 사용과 SIBO, 이에 의한 과민성장증후군과 같은 증상에 대해 과민성장증후군 환자들에서 PPI를 사용할 경우 과민성장증후군 증상의 악화를 유발할 수 있으며, 과민성장증후군 환자에서 SIBO를 고려하여 항생제를 사용하기 전에 PPI를 사용 중일 경우 PPI 중단을 먼저 고려하여야 할 가능성에 대해 언급되기도 한다[42]. 하지만 이에 대해서는 추후 연구가 필요하겠다.
결 론
영양, 대사 및 감염에 미치는 연구결과들을 보았을 때 PPI 장기사용은 이와 같은 측면에서 보면 비교적 안전하다고 할 수 있다. PPI 사용이 절대적 적응증이 된다면 아직까지는 이와 같은 부작용을 고려하여 PPI 사용을 저해할 만한 근거는 부족하겠다. 하지만 PPI 장기사용에 따른 부작용에 대한 인지는 PPI 사용에 있어 적절한 적응증의 선택, 효과를 나타내는 최소용량 및 적절한 기간에 대한 중요성을 한 번 더 인식할 수 있다는 점에서 매우 의미 있는 일이다. 또한, 이론적으로 가능한 부작용에 대하여 임상적 고위험군 선정에 대한 추후 연구가 필요하다고 하겠다.