Tranexamic Acid 투여 후 발생한 양측성 급성 신피질 괴사 1예
A Case of Bilateral Acute Renal Cortical Necrosis Complicated by Tranexamic Acid Administration
Article information
Abstract
저자들은 Tranexamic acid 투여 후 갑작스런 혈소판 수 저하를 보이면서 발생한 양측성 급성 신피질 괴사 환자 1예를 경험하였기에 보고하는 바이다.
Trans Abstract
Acute renal cortical necrosis is an anuric form of acute renal failure. We experienced a case of renal cortical necrosis complicated by tranexamic acid administration. To our knowledge, only three cases of renal cortical necrosis have been reported worldwide. A 49-year-old man was referred with hemothorax and multiple bone fractures following a traffic accident. Tranexamic acid, and hemocoagulase were injected three times a day. After the 4th dose of hemostatics, anuria developed abruptly, the platelet count decreased to 84,000 /μL, and the serum creatinine was increased to 2.56 from 1.06 mg/dL. On the 4th Intensive Care Unit (ICU) day, computed tomography (CT) showed bilateral renal cortical necrosis with normal renal arteries and aorta. The oliguria persisted for 14 days and temporary hemodialysis was performed. The serum creatinine had decreased to 2.12 mg/dL 8 months after discharge. (Korean J Med 2011;80:723-728)
서 론
신피질 괴사는 급성 신부전의 원인 중의 하나로서 1883년 Friedlander에 의해 처음 소개가 되었으며 주로 임신과 관련된 합병증으로 보고가 되었다[1]. 신피질의 혈류가 차단되어 사구체 여과가 일어나지 못하므로 무뇨를 특징적으로 보이며, 간혹 옆구리 통증, 혈뇨, 발열 등이 동반될 수도 있고, 조직의 괴사로 인하여 예후가 좋지 않은 것으로 되어 있다[2]. 신피질 괴사의 원인은 태반조기박리, 자간증, 전치태반으로 인한 출혈 등 임신 합병증과 관련된 질환이 많으나 최근에는 비산과적 원인으로서 뱀독, HUS, 패혈증, 췌장염, 당뇨병성 케톤산증, 박리성 동맥류, 소화기 출혈, 화상, 외상 등 비산과적인 원인이 늘어나고 있는 추세이다[3]. 매우 드물게 약제로 인한 원인도 있으며 항섬유소용해제(Antifibrinolytic drug), 항생제[4] 및 NSAID [5] 등 몇몇 사례의 보고가 있다. 본 증례는 전형적인 무뇨를 보였던 신피질 괴사 환자로, 드문 원인 중의 하나인 약제유발(Tranexamic acid)에 의한 1예를 경험하였기에 보고한다.
증 례
환 자: 49세 남자
주 소: 흉통 및 골반통증
현병력: 과거 특이 병력 없는 건강한 환자로 내원일 운전자 교통사고로 인한 흉통 및 골반통증을 주소로 본원 응급의료센터에 내원하였다. 본원으로 이송되기 전 타 병원에서 혈흉으로 인해 왼쪽에 폐쇄 가슴 삽관술을 하였고, 요도관이 삽입된 채 이송되었다. 타 병원에서의 혈색소는 12.2 g/dL, 적혈구용적은 35.6%였다.
신체 검진: 내원 시 혈압 110/70 mmHg, 맥박수 114회/분, 호흡수 24회/분, 체온 36.6℃로, 의식은 명료하였으나, 급성 병색을 보였다. 결막은 창백하지 않았고, 공막 황달 등은 관찰되지 않았다. 흉부청진상 왼쪽의 호흡음이 감소되어 있었으며, 촉진상 피하기종으로 생각되는 비빔소리(crepitation)가 있었다. 수포음이나 천명음 등은 들리지 않았다. 장음은 감소되어 있었으나, 압통이나 반발통은 없었다. 이외 기타 검진상 특이사항은 없었다.
검사실 소견: 말초혈액검사에서 백혈구 16,500/mm3, 혈색소 11.4 g/dL, 혈소판 수 200,000/uL이었다. 프로트롬빈 시간(PT)은 14.8초, 국제 정상화 비율(INR)은 1.15였으며, 활성화 부분 트롬보플라스틴 시간(aPTT)은 38.5초였다. 혈장 내 포도당은 218 mg/dL, 단백질 5.64 g/dL, 알부민 3.20 g/dL, 아스파르테이트 아미노전이효소/알라닌 아미노전이효소(AST/ALT) 202/127 IU/L, 췌장 아밀라아제/췌장 리파아제 42.9/45.4 U/L였다. 혈액요소질소/크레아티닌(Blood Urea Nitrogen/Creatinine, BUN/Cr) 17.4/1.23 mg/dL였으며, 나트륨/칼륨/염소 130/4.01/100.9 mmol/L, 비강배관으로 산소 분당 5 L 흡입 유지한 채 동맥혈 가스 분석검사상 pH는 7.404, 이산화탄소 분압 26.3 mmHg, 산소 분압 64.2 mmHg, 중탄산나트륨 18.5 mEq/L, 산소 포화도는 92.2%였다. 보체 C3 90 mg/dL, C4 48 mg/dL, Cryoglobulin (-), Anti-nuclear antibody (-), ANCA (-)로 측정되었다.
방사선학적 소견: 응급실에서 시행한 복부 전산화 단층 촬영상 골반 골절 등이 확인되었으며, 신장에는 특이사항이 없었다. 그러나 4병일째 시행한 흉부 전산화 단층 촬영상 양쪽 신장 피질로 조영제 증강이 되지 않는 소견이 보였다(Figs. 1 and 2).
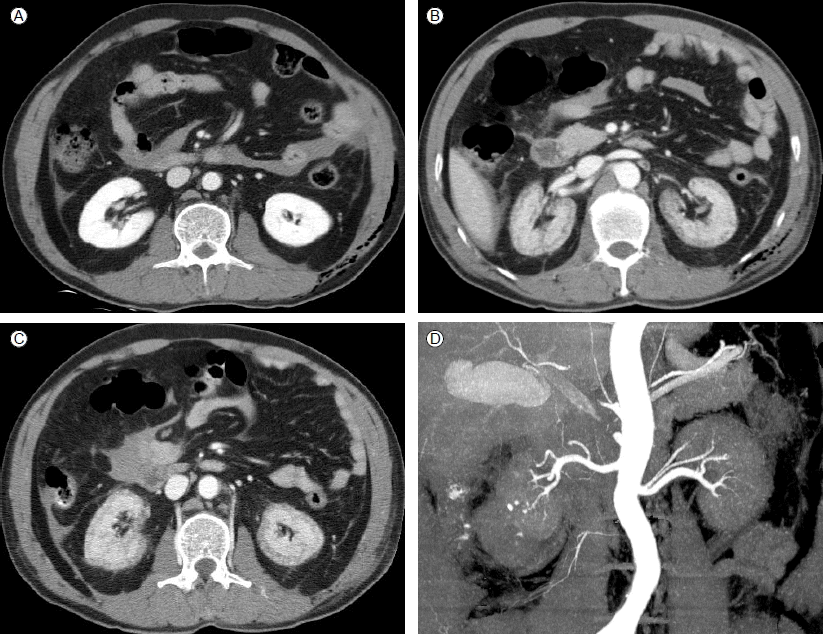
Contrast-enhanced CT shows normal kidney enhancement in the emergency department (A) and 4 days later demonstrates medullary enhancement and lack of cortical enhancement (B, C). Both renal arteries appear normal (D).
치료 및 경과: 환자는 응급실에서 tranexamic acid 500 mg과 hemocoagulase 2 KU를 정주한 후 중환자실로 입원하였다. 2병일 오전 3시의 BUN/Cr 20.3/1.06 mg/dL이며, 혈압과 맥박은 안정적이며, 출혈의 증거도 없었고, 혈색소 9.4 g/dL, 혈소판 수 165,000/uL였다. 완전비경구영양 수액제가 공급되었고, 하루 3회 tranexamic acid 500 mg와 hemocoagulase 2 KU가 투여되었다. 2병일째 tranexamic acid와 hemocoagulase의 오전량이 투여된 직후부터 갑자기 무뇨가 발생하였다(Fig. 3). Furosemide를 투여했지만, 소변량은 증가하지 않았으며 오후 6시의 BUN/Cr 48.8/2.56 mg/dL, 혈소판 수 84,000/uL을 나타내었다. 토혈이나 혈변 등 위장관 출혈의 증상은 없었으며, 중심 정맥압은 9-12 mmHg로 유지되었고, 혈압과 맥박도 정상범위였다. 방광조영술을 시행하였으나 특이소견은 없어 물콩팥증 및 물요관증은 배제할 수 있었다. 오후 8시경의 검사는 혈소판 58,000/uL, 젖산탈수소효소(LDH) 2,294 IU/mL였다. PT 14.8초, INR 1.15, aPTT 41.2초, fibrinogen 1.69 g/L, antithrombin III 102%로 파종혈관내응고(DIC)는 아닌 것으로 판단하였다. 농축적혈구 2 단위가 수혈되었고(Fig. 3), 오후 11시경부터 지속적 신대치 요법을 시작하였다. 3병일째, 혈색소 9.9 g/dL, 혈소판 수 54,000/uL, LDH 2,954 IU/mL로 용혈요독증후군/혈전저혈소판혈증자색반병(HUS/TTP)을 의심하여 말초혈액 도말검사를 시행하였으나, 뚜렷한 증거를 찾을 수 없었다. 이후의 반복검사에서도 HUS/TTP 혹은 DIC의 증거는 찾을 수 없었다. 4병일째 복합 갈비뼈 골절에 대한 평가를 위해 흉부 전산화 단층촬영을 하였을 때 양쪽 신장의 신피질 괴사와 일치하는 소견이 발견되었다. 신혈관단층촬영으로 신혈관조영을 시행하였으며 양쪽의 신장동맥 기시부나 대동맥은 정상이었으나 신피질만 혈액이 공급되지 않는 소견을 얻었다(Figs. 1 and 2). 환자는 발열이나 감염의 증상은 없어 DIC나 패혈증은 배제하였고, 약제와 연관된 신피질 괴사를 의심하였다. 환자에게 사용한 약제는 tranexamic acid, ranitidine, tramadol, flomoxef, furosemide였으며 NSAID는 전혀 사용하지 않았다. 이 중 항섬유소용해제(Antifibrinolytic agent)인 tranexamic acid로 인한 가능성이 제일 높다고 판단하여 tranexamic acid 투여를 중지하였다. 3병일 이후에는 무뇨 상태가 지속되어 지속적 신대치 요법을 하다가 간헐적 혈액투석으로 전환하였다(Fig. 4). 14병일의 소변량이 420 mL이며, 이후부터 소변량이 증가하였다. 43병일째 간헐적 혈액투석 요법을 중단하였고, 63병일째 퇴원하였다. 8개월이 지난 현재 외래에서 경과관찰 중이며, 마지막 BUN/Cr은 22.1/2.12 mg/dL이다.

The hourly urine output and laboratory findings associated with tranexamic acid administration during the early admission period. PRC, packed red blood cells; FSM, furosemide.
고 찰
급성 신피질 괴사의 원인으로는 태반조기박리, 자간증, 전치태반으로 인한 출혈 등 임신 합병증과 관련된 질환이 많으나, 최근에는 비산과적인 원인인 뱀독, HUS, DIC, 패혈증, 췌장염, 당뇨병성 케톤산증, 박리성 동맥류, 소화기 출혈, 화상, 외상 등의 사례가 증가하고 있다[3,6]. 또한 약제로 인한 신피질 괴사에는 항섬유소용해제, NSAID, rifampicin, sulfonamide, cefmetazole, 톨루엔 등에 의해 보고된 증례가 있다[7,8].
Amino acid lysine의 합성 유도체인 aminocaproic acid, tranexamic acid는 출혈이 있는 환자나 수술 중에 사용하는 일종의 지혈제로 사용하는 약제이다. 특히 tranexamic acid는 내과 및 외과계를 망라하여 흔히 사용되고 있으며 부작용은 오심, 구토, 복통 등의 일반적인 증상이다. 그러나 드물지만 혈전형성으로 인한 부작용이 있으며[9], 이러한 혈전형성의 경우 aminocaproic acid는 비교적 많은 사례를 찾을 수 있어 어느 정도는 알려진 사실이지만[10], tranexamic acid에 의한 사례는 매우 드문 상태이다. 전 세계적으로 심근경색, 폐색전증, 동맥혈전증 등이 발생한 몇몇의 보고가 있고[11,12], 본 증례처럼 신피질 괴사가 발생한 증례는 국내 발생 1예를 포함하여 3예의 보고가 있을 뿐이다. 국내 보고는 37세의 남자에게 객혈을 치료하기 위해 정맥 내로 tranexamic acid를 3 g씩 5일간 투여 후 발생한 신피질 괴사의 증례이며[13], 국외에서는 혈우병이 있는 21세 남자 환자에게서 tranexamic acid를 3 g씩 4일간 투여 후 발생한 증례[14], 그리고 acute promyelocytic leukemia의 24세 여자 환자에게 tranexamic acid를 3일간 투여 후 발생한 증례이다[15].
Tranexamic acid의 작용기전은 plsaminogen이 섬유소분해(fibrinolysis)하는 부위를 방해하여 항섬유소분해(antifibrinolytic)작용을 나타내고 이로 인하여 지혈(hemostasis) 및 혈전형성이 촉진되는 것으로 알려져 있다[9]. 기존의 해외보고 중에서 acute promyelocytic leukemia의 경우는 DIC가 잘 발생하는 질환이므로, 혈전형성의 경향이 내재되어 있다가 tranexamic acid 투여로 혈전형성이 촉진되어 신피질괴사가 일어났다고 추정할 수도 있다. 본 증례의 경우는 tranexamic acid와 hemocoagulase가 수 차례 동시에 투여되었다. Hemocoagulase는 작용기전이 thrombin 생성을 촉진하여 혈액응고를 일으키는 것이므로 두 가지 약제가 같이 투여된다는 것은 각각 약제의 작용인 항섬유소분해와 혈액응고가 동시에 작용할 수 있다는 것을 의미하며, 따라서 혈전형성을 촉진시키는 결과를 초래했을 것이다. 실제로 환자는 응급실에서 혈소판 수 200,000/uL였다가, 두 가지 약제를 동시 투여한 2번째 후 혈소판 수 165,000/uL였고, 4번째 투여 후 갑자기 무뇨를 보이면서 혈소판 수 84,000/uL로 저하되었다. 혈소판이 갑자기 저하되고 무뇨를 보였으므로 환자를 담당했던 의료진은 HUS/TTP를 가장 염두에 두고 검사를 시행하였으나, 그 증거를 찾을 수 없었다. 혈소판 감소를 보이는 대표적 질환인 DIC도 고려했으나, PT/aPTT가 정상인 검사결과를 얻어 그 가능성을 배제하였다. 기타 혈소판 감소를 보일 수 있는 경우인 현증의 출혈도 전혀 증거가 없었다. 원래 hemocoagulase는 과민반응 이외의 부작용은 잘 알려져 있지 않고 해외에서도 혈전형성의 보고 사례를 찾을 수는 없어, 저자들은 일단 tranexamic acid가 주된 혈전생성 작용을 했을 것으로 결론을 내렸으나, 두 가지 약제의 작용 기전을 고찰할 때 서로 상승작용이 없다고 말할 수는 없을 것이다.
급성 신피질 괴사는 궁상동맥(arcuate artery) 이하의 소엽간동맥(interlobular artery)과 수입성 세동맥(afferent arteriole)이 침범되어 신피질 괴사가 일어나며 신수질은 비교적 정상의 병리 소견을 보인다. 일반적인 신피질 괴사의 발병기전으로는 여러 가지가 제시되고 있는데 세균성 내독소에 의한 혈관 내피손상(Shwartzman반응), 소혈관의 수축, 혈관내 미세 혈전생성 등이 있으며, 최근에는 vasoactive substance로서 endothelin-1이 소개되고 있다[3,16].사구체여과가 일어나는 피질 부위가 손상되므로 소변을 형성하지 못하며 따라서 임상에서는 무뇨의 형태로 표현된다. 일반적인 급성신부전은 핍뇨(oliguria) 혹은 이뇨(non-oliguric)를 보여주므로 무뇨를 보이는 신부전 환자에서 그 진단명을 의심해 볼 수 있다. 본 증례의 경우도 tranexamic acid 투여 후 갑자기 무뇨가 발생되었으며, 총 11일간 지속되었다. 혈청학적 검사에서 LDH 및 AST가 초기에 증가하는데 이 효소들은 신피질의 근위세뇨관에서 유래하는 것으로 되어 있다[17]. 본 증례에서도 LDH가 3병일에서 10병일까지 증가하였으며(Fig. 4), 최대치는 8,170 IU/L였다. 확진을 위해서는 신조직 생검이 필요할 수도 있지만, 환자의 임상경과를 고려할 때 시행하기는 어려운 경우가 많으며, 최근에는 조영제 증강 컴퓨터 단층 촬영(CT scan)이 진단에 유용하게 사용되고 있다[6]. 그 특징적인 소견으로는 피막하의 조영 증강, 신피질의 저음영, 신수질의 조영 증강을 들 수 있다[18]. 비록 컴퓨터 단층촬영이 조영제로 인한 위험성(급성 세뇨관괴사 유발)이 염려되지만 질병경과 중 진단을 확실하게 하는 것이 치료에 더 유리하다고 판단되면 투석을 시행하는 조건으로 컴퓨터 단층촬영을 시행하는 것이 좋을 것이다. 자기공명영상(MRI)도 혈관조영술로 이용할 수 있었으나 최근 Gadolinium의 부작용이 쟁점이 되면서 그 중요성이 현저히 저하되었다. 본 증례도 컴퓨터 단층 촬영을 통하여 신피질 괴사를 진단하였으며 신조직 검사는 시행치 못하였다.
치료는 일반적인 급성신부전의 경우와 같이 대증적 치료를 하며, 대부분의 경우에서 신대치 요법을 사용하였다. 본 증례에서도 무뇨시기에는 일시적인 신대치 요법을 시행하였으며, 외래 추적관찰에서는 퇴원 8개월 후의 Cr이 2.12 mg/dL로 완전한 회복은 되지 않았다. 일반적으로 신피질 괴사는 예후가 좋지 않아 대부분이 말기신부전으로 진행한다. 과거 산과적 질환이 원인인 경우에는 예후가 좋지 않아서 대부분 말기 신부전으로 진행하며 사망률도 58-61%에 이른다고 하였으나 1980년대 이후에는 투석치료의 발전으로 약 1/3은 사망, 약 1/3은 신대치 요법 유지, 약 1/3은 신기능의 회복으로 투석중단 등이 보고되고 있다[1]. 그러나 이는 일반적인 신피질 괴사의 예후로, 약제 유발성으로 인한 경우는 증례보고로만 되어있어 향후 종합적인 연구가 필요하다고 생각한다.

