서 론
자가면역성 간염(autoimmune hepatitis)은 원인 미상의 지속적인 간세포 손상을 보이는 만성 간질환으로 여성에서 호발하며 자가 항체 양성, 고감마글로불린혈증, 조직 검사에서 문맥주위부의 형질 세포 및 림프구의 침윤, 그리고 스테로이드를 포함한 면역억제요법에 좋은 반응을 보이는 특징을 가진다[1]. 원인은 아직 확실히 밝혀지진 않았지만 류마티스 관절염, 염증성 장질환, 비열대성 스프루(Celiac disease), 자가면역성 갑상선염, 제1형 당뇨, 특발성 혈소판 감소증 등 다른 자가 면역 질환을 흔히 동반할 수 있다. 그러나 전신성 홍반성 낭창과 쇼그렌 증후군 같은 교원성 질환과 동반되는 경우는 1% 정도로 흔하지 않다[1-3]. 전신성 홍반성 낭창은 전신을 침범하는 자가 면역 질환으로 신장, 폐, 중추신경계를 잘 침범하지만 간 침범은 흔하지 않고[4,5] 원발성 쇼그렌 증후군도 타액선과 누액선에 림프구 침윤을 보이는 전신 면역 질환으로 피부, 폐, 신경, 콩팥을 침범하기도 하며, 간을 침범하는 경우 원발성 담즙성 간경변증을 일으킬 수 있으나 자가면역성 간염과 동반되는 경우는 흔하지 않다[6-8]. 이런 교원성 질환 환자에서 간 기능 이상을 보일 때 이들 질환 자체에 의한 경우와 흔하지 않지만 자가면역성 간염에 의한 경우를 생각해 볼 수 있다. 두 질환의 임상 소견 및 혈청학적인 소견이 유사한 경우가 많아 사실상 구분하기 쉽지 않으나 치료 및 예후가 다르므로 교원성 질환의 동반여부에 대하여 감별진단이 필요하다. 저자들은 제1형 자가면역성 간염에서 병발한 전신성 홍반성 낭창 및 원발성 쇼그렌 증후군을 각각 1예 경험하여 이를 문헌고찰과 함께 보고하고자 한다.
증 례
증례 1
환 자: 여자 52세
주 소: 황달 및 가려움증
현병력: 환자는 내원 2주 전 갑자기 발생한 황달 및 전신 소양증으로 본원 외래 통해 입원하였다.
과거력: 특이사항은 없었고 약물 복용의 병력도 없었다.
가족력 및 사회력: 특이사항이 없었다.
계통 문진(review of system): 평소 피부의 광과민반응(photosensitivity)과 무릎 통증이 있었던 것 외에는 특이사항 없었다.
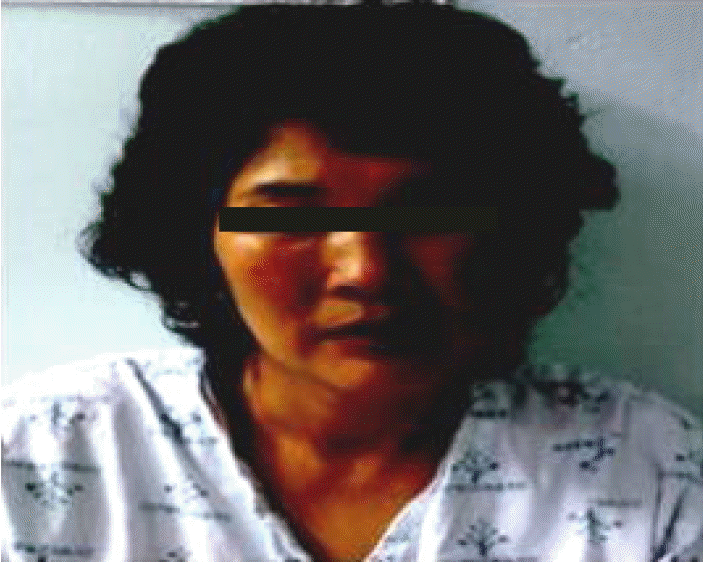
이학적 소견: 내원 당시 활력징후는 혈압은 120/80 mmHg, 맥박수는 70회/분, 호흡수 18회/분, 체온은 36.8℃이었다. 공막에 황달 소견이 보였으며, 얼굴에 협부 발진(malar rash)이 관찰되었으며(Fig. 1), 복부 촉진에서 간이 2횡지 정도로 만져지며 우상복부 압통을 호소하였다. 그 외 특이소견은 없었다.
검사실 소견: 말초 혈액 검사에서 백혈구 6,900/mm3, 혈색소 11.9 g/dL, 혈소판 269,000/mm3, 총 단백 8.2 g/dL, 알부민 3.1 g/dL, AST 999 IU/L, ALT 799 IU/L, ALP 106 IU/L, γ-GTP 65 IU/L, 총 빌리루빈 19.9 mg/dL, 직접 빌리루빈 19 mg/dL, HBs Ag 음성, IgM anti-HBc 음성, IgM anti-HAV 음성, anti-HCV 음성, CMV 및 EBV항체 음성, IgG 4120.9 mg/dL, 항핵항체 양성(1:1290), anti-ds DNA 항체 양성(1:40), 항 미토콘드리아 항체 음성, anti-LKM1항체 음성 소견을 보였다. 소변 검사에서 단백뇨가 미량 검출되어 24시간 소변 검사를 시행하였고 총 단백량이 465 mg이었다.
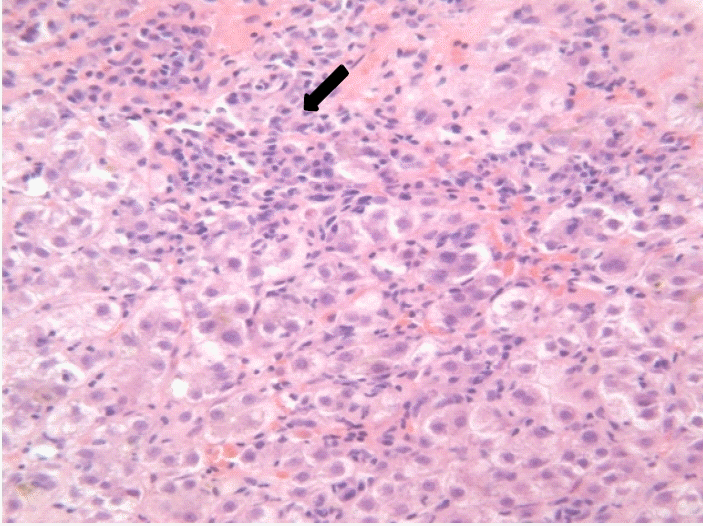
병리학적 소견: 간 조직 검사에서 간 문맥 주위 및 소엽에 림프구와 형질세포의 침윤이 관찰되었다(Fig. 2).
방사선학적 소견: 복부 초음파 및 컴퓨터 단층 촬영에서 경도의 간 및 비장 비대가 관찰되었다.
치료 및 경과: 환자는 자가 항체 등 검사실 소견 및 간 조직 소견 등으로 자가면역성 간염 진단하에 일일 prednisolone 30 mg으로 경구투여를 시작하여 6개월 동안 점진적인 감량을 하였으며 현재는 prednisolone을 중단한 상태이다. AST 999 IU/L에서 35 IU/L, ALT 799 IU/L에서 17 IU/L로 감소되었으며, 간수치는 계속 정상 수치를 유지하고 있다. 또한 환자는 임상 소견 및 자가 항체 등의 소견으로 전신성 홍반성 낭창을 진단받고 하루 두 번 hydroxychloroquine 200 mg을 계속 복용 중이다. anti-ds DNA 항체가 양성(1:40)에서 현재는 negative로 측정되고 있다.
증례 2
환 자: 여자 60세
주 소: 황달 및 가려움증
현병력: 환자는 내원 10년 전부터 구강 건조증이 있었으며 이후 안구 건조감이 있었으나 특별한 검사 및 치료는 하지 않았다. 내원 5개월 전 황달과 전신 쇠약감으로 타 병원에서 상세 불명의 염증성 간질환 등으로 진단 후 보존적 치료를 시행하였고 내원 1개월 전 황달 등의 증상이 심해져 본원 외래 통해 입원하였다.
과거력: 특이사항은 없었고, 약물 복용의 병력도 없었다.
가족력 및 사회력: 특이사항이 없었다.
이학적 소견: 내원 당시 활력징후는 혈압은 100/60 mmHg, 맥박수는 82회/분, 호흡수 18회/분, 체온은 36.6℃이었다. 진찰 소견에서 공막의 황달 소견 외 특이한 소견은 없었으며 복부 촉진 시 간과 비장은 만져지지 않았다.
검사실 소견: 말초 혈액 검사 소견에서 백혈구 7,700/mm3, 혈색소 10.4 g/dL, 혈소판 197,000/mm3, 총 단백 7.8 g/dL, 알부민 3.5 g/dL, AST 201 IU/L, ALT 153 IU/L, ALP 752 IU/L, γ-GTP 649 IU/L, 총 빌리루빈 4.2 mg/dL, 직접 빌리루빈 3.5 mg/dL, HBs Ag 음성, HBs Ab 양성, IgM anti-HAV 음성, anti-HCV 음성, IgG 1668 mg/dL, 항핵항체 양성(1:80), anti-ds DNA 항체 음성, anti-LKM항체 음성, 항 미토콘드리아 항체 음성, Anti-Ro Ab 양성(+++), Anti-LA Ab 양성(+) 소견을 보였으며 소변 검사는 정상이었다.
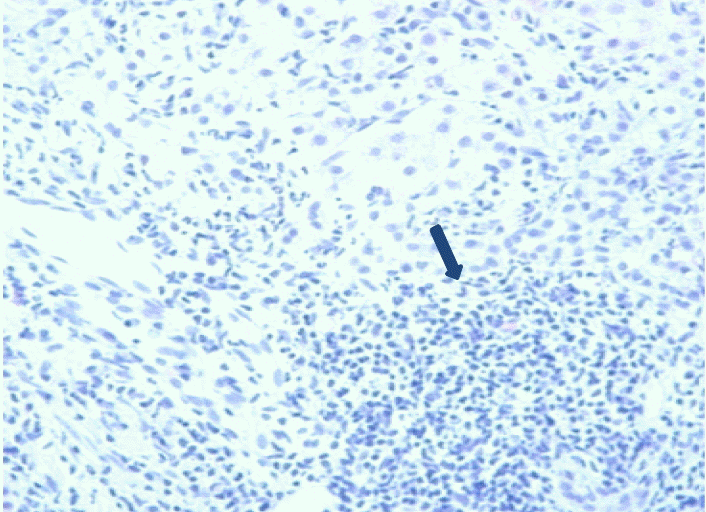
병리학적 소견: 하순점막의 생검에서 소타액선에 소수의 림프구와 형질세포의 침윤이 보였고, 간 조직 검사에서는 문맥, 문맥 주위 그리고 소엽에서 림프구 및 형질 세포가 침윤된 소견 및 문맥 주위 경화 소견이었다(Fig. 3).
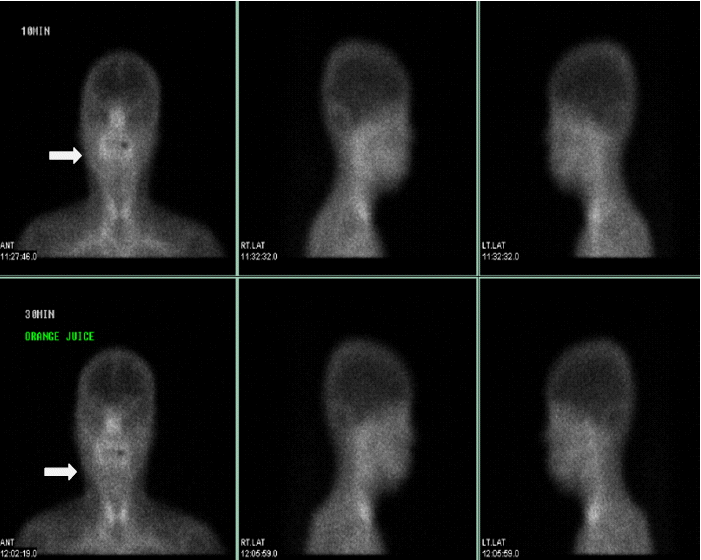
방사선학적 소견: 복부 초음파에서 경미한 간의 위축과 결절성 표면을 보였다. 타액선 스캔에서 혀밑샘, 귀밑샘과 하악골하선의 동위 원소의 섭취 감소가 관찰되었다(Fig. 4).
그 외 검사 소견: Schirmer's test에서 우안 5 mm, 좌안 2 mm (정상 15 mm)로 안구 건조를 보였다.
치료 및 경과: 환자는 특징적인 임상 소견, 자가 항체 반응, 타액선 스캔 및 Schirmer’s test, 간조직 검사 소견 등으로 원발성 쇼그렌 증후군 및 자가면역성 간염으로 진단받은 후 prednisolone 60 mg으로 경구투여를 시작하여 증상 및 간수치 호전을 보여 prednisolone 30 mg으로 감량 후 입원 20일째 퇴원하여 외래 통하여 스테로이드 용량 조절 중이다.
고 찰
자가면역성 간염의 병태생리는 현재까지 명확히 밝혀지진 않았지만 유전적 소인이 있는 환자에서 바이러스, 약물 등의 환경요인이 유발인자가 되어 주로 CD4양성 T림프구가 간세포의 항원에 감작되고 이 면역반응에 의해서 지속적으로 간세포의 염증, 괴사 및 섬유화를 일으키는 것으로 알려져 있다[1,9]. 자가면역성 간염은 출현하는 자가 항체의 종류와 임상양상에 따라 제1, 2, 3형으로 분류하는데 제1형 자가면역성 간염은 ANA (antinuclear antibody), anti-SMA (anti smooth muscle antibody) 등의 자가 항체가 양성이며 제2형 자가면역성 간염은 anti-LKM1, Anti-liver cytosol1이 양성이며 제3형 자가면역성 간염은 Anti-soluble antigen (ant-SLA)이 검출된다. 제2형 자가면역성 간염의 경우 젊은 연령 및 여성에서 호발하며 간염의 정도가 더 심하고 스테로이드 등 치료에 반응을 잘하지 않는 경우가 많아 예후가 더 나쁘다[1,2]. 자가면역성 간염의 진단은 1993년 국제자가면역성간염연구회(International Autoimmune Hepatitis Group)에서 제시한 배점 체계를 통해서 이루어져 왔으며 배점 체계는 1999년 한 차례 개정되었으며 이후 2008년 임상적용이 편리하도록 배점 기준이 고감마글로불린혈증, 혈청 자가 항체, 간 조직 소견 및 바이러스성 간염의 유무 등의 항목으로 간소화되었다[10-12].
전신성 홍반성 낭창은 면역 조절 작용의 이상으로 자가항체가 생성되고 혈액 내 면역복합체의 존재, 보체의 활성화를 특징으로 하는 자가면역 질환으로 조직 손상의 기전은 명확하지 않지만 혈액 내 ds DNA에 대한 면역 복합체가 조직 손상에 관여할 것으로 여겨진다[13]. 주로 피부, 신장, 혈액, 근골격계를 침범하며 표적 장기로서 간 침범은 드문 것으로 알려져 있다[4,5]. 전신성 홍반성 낭창이 간을 침범한 경우와 자가면역성 간염은 실제로 두 질환이 임상 소견 및 혈청학적인 소견이 유사한 경우가 많아 사실상 구분하기 쉽지 않으나 자가면역성 간염과 전신성 홍반성 낭창의 진단 기준이 제시되면서 구분하기 어려웠던 두 질환을 감별 진단할 수 있게 되었다[12-14]. 자가면역성 간염 환자에서 전신성 홍반성 낭창이 병발하는 정확한 기전은 밝혀지지 않았지만 간세포의 손상으로 인한 과도한 항원성이 초래되면서 면역체계의 부조화로 추정되고 있다[15]. Abraham 등[5]에 의하면 전신성 홍반성 낭창을 진단받은 환자에서 혈청학적 및 조직학적으로 간질환을 진단할 수 있는 경우는 21%로 보고하였고, 이 중 4.4%에서 간경변증, 원발성 담즙성 간경변증 및 간부전 등 심한 만성 간질환을 동반하였다. 전신성 홍반성 낭창이 간을 침범한 경우 조직 소견으로는 지방 침착이 가장 많았으며, 간수치의 이상의 원인으로는 동반된 바이러스성 간염의 악화, 약제(특히 salicylate, NSAID), 알코올 등이 있다[4,5]. 전신성 홍반성 낭창에 의한 간염과 자가면역성 간염은 여성에서 호발하며 임상양상 및 자가 항체 양성이라는 점에서 유사하다. 그러나 간염을 일으키는 기전이 다르기 때문에 자가면역성 간염은 간부전을 초래하며 전신성 홍반성 낭창은 주로 말기 신부전을 초래하여 치료, 예후 및 합병증이 달라지므로 두 질환을 감별하는 것은 중요하다[16]. 혈청검사에서 ribosomal P proteins antibody는 전신성 홍반성 낭창의 간 침범과 관련이 있으며 간 침범의 정도를 반영한다. 간침범이 없는 전신성 홍반성 낭창의 경우에는 10%만 ribosomal P proteins antibody가 양성이며 자가면역성 간염만 있는 경우에는 음성이므로 감별진단에 도움이 될 수 있다고 보고되었으나[17,18] 본 환자에서 검사를 시행하지 못하였다. 그 외 anti-ds DNA는 자가면역성 간염에서 34-64%로 검출되지만 전신성 홍반성 낭창에 의한 간염보다 상대적으로 저역가로 나타나는 반면, anti-SMA는 자가면역성 간염에서 60-80%로 더 높은 역가로 나타나 감별 진단에 도움을 준다[15,19]. 조직 소견은 두 질환을 감별하는 데 매우 중요한데 전신성 홍반성 낭창에 의한 간염의 경우에는 주로 간 소엽에 림프구가 분포하지만 자가면역성 간염에서는 주로 문맥 주위에 단핵 세포(주로 림프구와 형질 세포)의 침윤을 특징으로 하며 계면 간염(interface hepatitis), 조각성 괴사(piecemeal necrosis)가 나타난다[18,19]. 임상적으로는 홍반 발진, 구강 궤양, 활막염, 광과민, 관절염 등의 전신성 홍반성 낭창의 특징적 소견으로 두 질환을 감별할 수 있다[14].
증례 1의 경우에는 항핵항체 양성, 고감마글로불린혈증, 바이러스성 간염의 배제 및 간 조직 검사에서 자가면역성 간염 등의 소견을 보였으므로 1999년 개정된 국제자가면역성간염연구회의 배점 체계에 따라 치료 전 19점, 2008년 간소화된 배점 체계에 의해서도 8점으로 명확한 자가면역성 간염으로 진단할 수 있었고, 항핵항체 양성, ant-LKM1 항체 음성으로 제 1형 자가면역성 간염에 해당한다. 그리고 진단 당시 얼굴의 홍반, 관절염 및 광과민 과거력, 자가항체 양성(ANA와 anti-ds DNA)으로 ARA (American Rheumatism Association) 진단 기준 11개 중 5개를 만족하여 전신성 홍반성 낭창을 진단할 수 있었다. 1일 0.5 g 미만으로 단백뇨가 나와 전신성 홍반성 낭창에 의한 신염은 배제할 수 있었으며 anti-ds DNA가 저역가이고 보체가 정상 범위, 병변이 피부에 국한되었으므로 질병의 정도가 경미하여 항말라리아 제제인 hydroxychloroquine을 처방하였고, 또한 간 조직 검사에서 간 문맥 주위 및 소엽에 림프 형질세포의 침윤 등 자가면역성 간염의 특징적인 소견이 관찰되어 전신성 홍반성 낭창에 의한 간염을 배제할 수 있었다.
쇼그렌 증후군은 림프구에 의해 외분비선이 파괴되어 외분비선의 분비 억제와 점막 건조를 일으키는 만성 염증성 자가면역 질환으로 주로 타액선과 누액선을 침범한다[8]. 특징적으로 자가 항체인 Ro (SS-A) 항체와 La (SS-B) 항체가 관여하는 것으로 알려져 있다[8]. 쇼그렌 증후군은 원발성과 다른 교원성 질환과 동반되는 이차성으로 분류할 수 있는데 원발성인 경우에는 주로 타액선과 누액선을 침범하며 그 밖에 피부, 신장, 간, 폐, 신경계 등을 침범할 수 있다[6-8]. 특히 간을 침범하는 경우는 7-20% 정도로 보고되고 있으며[5], 주로 원발성 담즙성 간경변증과 연관되어 있고 자가면역성 간염을 동반하는 경우는 드물다고 보고되고 있다[7]. Csepregi 등[6]의 연구에 의하면 원발성 쇼그렌 증후군 환자 180명 중 26명(14%)이 간질환이 있었으며 그중 2명(1%)이 자가면역성 간염과 동반되었다고 보고하였다. 원발성 쇼그렌 증후군의 병인으로 Herpes virus, Retrovirus, Epstein-Barr virus, Human immunodeficiency virus, human T lymphotropic virus 및 hepatitis C virus가 원인이 될 것으로 알려져 있지만 아직 명확한 기전은 밝혀져 있지 않다[20]. 쇼그렌 증후군과 다른 자가 면역 질환이 동반되는 기전은 두 질환의 과도한 염증 반응으로 인해서 CD4양성 T림프구가 활성화되어 담관, 누액 및 타액선을 침범하는 것으로 알려져 있다[5].
증례 2의 경우에는 유럽의 다기관 연구 기준에 따라 3개월 이상의 구강 건조와 안구 건조, Schirmer's test 양성, anti-Ro/La 항체 양성, 타액선 스캔에서 분비능 저하 소견, 항핵항체 양성으로 원발성 쇼그렌 증후군으로 진단하였다[8]. 간 조직검사 소견 및 AMA음성으로 원발성 담즙성 간경변증을 배제할 수 있었으며 혈청학적 검사로 다른 바이러스성 간염 또한 배제할 수 있었다. 이 환자의 경우 항핵항체 양성, 고감마글로불린혈증, 바이러스성 간염의 배제 및 간 조직 검사상 자가면역성 간염 등의 소견을 보였으므로 1999년 개정된 국제자가면역성간염연구회의 배점 체계에 따라 치료 전 16점, 2008년 간소화된 배점 체계에 의해서도 7점으로 명확한 자가면역성 간염으로 진단할 수 있었고, 항핵항체 양성, ant-LKM1 항체 음성으로 제1형 자가면역성 간염에 해당하였다.
자가면역성 간염 환자들은 다른 다양한 자가면역 질환 및 교원성 질환을 동반할 수 있으므로 진단 시 주의 깊은 관심과 검사가 필요하며 또한 다른 자가면역 질환 환자들이 간 기능 이상 및 기타 간 손상의 소견이 보이면 환자의 치료 및 예후가 달라질 수 있으므로 자가면역성 간염 동반 유무에 대한 검사가 필요할 것으로 생각한다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






