 |
 |
| Korean J Med > Volume 80(6); 2011 > Article |
|
요약
목적:
신세뇨관산증은 요중 산 배설이 감소하는 질환으로, 대부분 요 암모니아 배설의 감소에 의한 것이다. 본 연구는 아밀로라이드로 유발된 신세뇨관산증 흰쥐에서 산 배설의 변화와 암모니아 운반체인 Rh B Glycoprotein (Rhbg)와 Rh C Glycoprotein (Rhcg)의 발현 변화를 확인하여 신세뇨관산증의 병인에 암모니아 운반체의 역할을 규명하고자 하였다.
방법:
Sprague-Dawley계 웅성 흰쥐를 사용하였으며, 실험군에는 amiloride (3 mg/kg/day)를 6일간 복강 내 주입하였다. 7일째 대사케이지에 mineral oil을 처리하여 24시간 동안 요를 수집하였다. Rhbg와 Rhcg의 단백 발현을 평가하기 위하여 immunoblot와 면역조직화학염색을 시행하였고, 면역조직화학염색법을 정량화 분석하였다.
결과:
아밀로라이드 투여군에서 혈중 tCO2 농도는 대조군 25.6 ± 1.5 mEq/L에 비하여 23.0 ± 1.5 mEq/L로 감소하였으며(p < 0.05), 혈중 K+농도는 대조군 3.84 ± 0.34 mmol/L에 비하여 4.50 ± 0.46 mmol/L로 약간 높았다(p < 0.05). 아밀로라이드 투여군에서 24시간 요 암모니아 배설은 대조군 0.52 ± 0.07 mmol에 비하여 0.30 ± 0.03 mmol으로 요 암모니아 배설이 감소하였으며(p < 0.05), Urine pH는 양 군 간에 차이가 없어 아밀라이드 투여에 의해 신세뇨관산증이 유발되었음을 확인하였다.
반정량적 immunoblot 검사에서 Rhbg와 Rhcg의 단백 발현은 양 군 간에 유의한 차이가 없었다. 면역조직화학염색과 정량화 분석 결과 아밀로라이드 유발 신세뇨관산증군에서 Rhcg의 면역반응성은 감소하였으나, Rhbg의 면역반응성은 유의한 차이가 없었다.
Abstract
Background/Aims:
Renal tubular acidosis (RTA) decreases the net acid excretion, predominantly due to a decrease in urinary ammonia excretion. This study examined whether this decrement is associated with changes in the renal expression of the ammonia transporter family members, Rh B glycoprotein (Rhbg) and Rh C glycoprotein (Rhcg), in rats with amiloride-induced RTA.
Methods:
Male Sprague-Dawley rats were treated intraperitoneally with amiloride (3 mg/kg/day) for 6 days. Rhbg and Rhcg expression was evaluated by immunoblotting and immunohistochemistry. Cell height, total cellular expression, expression in the apical 25% of the cell, and apical expression as a percentage of total expression were quantified using immunohistochemistry with quantitative morphometric analysis.
Results:
After amiloride treatment for 6 days, the serum bicarbonate level was decreased, and serum potassium was increased. The total urinary ammonia excretion and potassium excretion were decreased. The total Rhbg and Rhcg protein expression levels were not changed in the cortex or outer medulla of the kidney. Light microscopy and immunohistochemistry with quantitative morphometric analysis demonstrated that total Rhcg expression was decreased in the cortical collecting duct (CCD) and outer medullary collecting duct (OMCD) in amiloride-induced RTA, whereas Rhbg immunoreactivity was unchanged.
신세뇨관산증은 사구체의 기능은 비교적 잘 유지되지만 신세뇨관을 통한 산의 배설이 감소하여 만성 대사성 산증이 야기된 경우이며, 요 암모니움 배설이 감소하는 대표적인 질환이다. 대사성 산증이 있음에도 불구하고 수소이온의 분비가 저하되어 요 pH가 5.5 이상이고, 과염소 대사성 산증으로 혈청 음이온차는 정상을 보인다[1,2].
신장에서 산의 배설은 총 산배설량의 60-70%를 차지하고 생리적 요구량에 따라 크게 변동될 수 있는 암모니움 이온(NH4+)을 통한 배설이 가장 중요하다[3,4]. 암모니아 운반체(ammonia transporter)는 1994년 Marini 등[5]과 Ninnemann 등[6]이 식물과 미생물은 특이한 운반체를 통해 토양에서 이온 형태의 암모니아를 직접 흡수할 수 있다는 사실에 착안하여 새로운 암모니아 운반 단백질을 처음으로 확인하였다. Rh B Glycoprotein (Rhbg)와 Rh C Glycoprotein (Rhcg)는 이와 구조적으로 유사한 당단백질로서 포유류의 간, 피부, 난소, 신장 등 암모니아 대사와 관련된 다양한 장기에서 발현되고[7,8], 생쥐와 흰쥐의 신장에서 암모니아 배설의 중요한 역할을 하는 집합관과 연결세관에서 주로 발현됨이 보고되었다. 최근 인체의 신장조직에서도 Rhcg가 발현됨이 밝혀지고 있다[7,9-11]. 또한, 암모니아 대사가 증가하는 대표적인 질환인 만성 대사성 산증 모델과 신실질 감소 모델에서 요중 암모니아 배설이 증가되고, 이것은 원위신원에서 암모니아 운반체인 Rhcg의 발현증가와 동반됨을 확인하여[12,13] 암모니아 운반체가 신장의 산-염기 조절에 중요한 역할을 할 것으로 제시되고 있다.
아밀로라이드(amiloride)는 상피 소디움 운반체를 직접 차단하여 소디움 배설을 촉진하는 약물로 신세뇨관 세포내로의 소디움의 유입이 감소하면 내강내 음전하의 형성이 줄어들게 되기 때문에 수소이온의 분비의 감소를 초래하여 원위부 신세뇨관산증을 유발할 수 있다고 알려져 있다[14,15].
본 연구는 아밀로라이드 유발 신세뇨관산증 모델에서 요 암모니아 배설량과 암모니아 운반체의 발현 변화를 확인하여 세뇨관성 산증의 병인에 암모니아 운반체인 Rhbg와 Rhcg의 역할을 알아보고자 하였다. 이를 위하여 Sprague-Dawley rat에 아밀로라이드를 3 mg/kg/day의 농도로 6일간 복강내 투여 후 생리학적 평가지표와 반정량적 immunoblot을 시행하였고 면역조직화학염색을 시행 후 정량화하였다.
실험동물은 200-250 g 사이의 웅성 Sprague-Dawley계 흰쥐(대한바이오링크, Eumseong, Korea)를 사용하였다. 실험쥐를 대조군과 실험군인 아밀로라이드 유발 신세뇨관산증군으로 구분한 후 무작위로 각각 5마리씩을 선정하였다. 신세뇨관산증군은 amiloride 3 mg/kg/day의 농도로 6일간 복강 내 주입하였다.
실험 종료 후 1일간 대사케이지(metabolic cage)에 두고, mineral oil을 처리하여 24시간 소변을 채취하고, 혈액은 대동맥으로부터 채취하여 원심분리 후 -80℃에 보관하였다.
신장 적출 전에 수집한 혈청 Na+, K+, Cl-, tCO2의 농도와 요 Na+, K+, Cl-의 농도는 Nova Stat Profile M critical care analyzer (Nova Biomedical Co., Waltham, MA, USA)를 이용하여 측정하였다. 요 pH는 pH meter (Orion 3 star plus, Thermo, Beverly, MA, USA)를 사용하였고, 요중 암모니아 농도는 상용화된 제품을 이용하여 측정하였다(Sigma Ammonia Assay Kit; Sigma-Aldrich Corp, St, Louis, MO, USA).
동물실험이 종료되는 시점에서 실험군과 대조군의 신장을 적출하였다. 신장을 얻기 전에 대동맥을 통해 phosphate-buffered saline (PBS)를 관류시켜 혈액을 제거한 후 신장을 적출하였다. 적출된 신장은 반정량적 immunoblotting을 위하여 내수질, 외수질, 피질을 분리한 다음 액화질소용액에서 급속 냉각시킨 후 -80℃ 냉동고에 보관하였다. 면역조직화학법을 위해서는 적출한 신장을 횡단면으로 자른 후 8% periodate-lysine-paraformaldehyde (PLP) solution에 밤새 고정하였다.
냉각된 조직을 칼로 잘게 조각낸 다음 protein extraction solution (PRO-PREP, Intron, Seongnam, Korea)을 조직 10 mg당 600 μL를 넣고 tissue homogenizer (Polytron PT MR2100; Kinematica, AG, Littau, Switzerland)로 15,000 rpm 10초씩 3번 균질화하였다. 균질화된 용액을 -20℃ 냉동고에서 30분 동안 조직을 용해시킨 후 13,000 rpm centrifuge (Hanil science industrial, Incheon, Korea)한 후 상등액을 취하였다. 단백질 추출액을 bovine serum albumin (BSA)을 표준으로 하였으며, Bradford 방법으로 595 nm 파장에서 분광광도계로 측정하여 단백량을 정량하였다.
각 검체들을 10% polyacrylamide-SDS mini gel에 전기영동(SE 250 mini-vertical gel electrophoresis unit; Amersham Biosciences, Piscataway, NJ, USA)하고 electroelution법을 이용하여 polyvinylidene fluoride (PVDF) membrane (Immobilon-P Membrane, Millipore, Bedford, MA, USA)에 200 mA로 4시간 30분동안 transfer (TE 22 tank transfer unit; Amersham Biosciences, Piscataway, NJ, USA)시켰다. PVDF membrane을 5% non-fat dry milk를 tris-buffered saline-0.1% tween20 (TBS-T)에 용해시켜 2시간 동안 처리한 다음, TBS-T로 간단히 세척하고 일차항체를 TBS-T에 희석하여 2시간 동안 반응시킨 후, PVDF membrane를 TBS-T로 10분간 4회 세척하였다. 이차항체(goat anti-rabbit IgG-HRP, Santa cruz biotechnology, Santa Cruz, CA, USA)를 1:5,000 희석하여 1시간 동안 반응시킨 후, TBS-T로 10분간 4회 세척하였다.
반응이 모두 끝난 PVDF membrane을 West-Zol plus (Intron, Seongnam, Korea)의 용액 A와 B를 1:1로 섞어 PVDF membrane에 반응시킨 후 이를 LAS-3000 imaging system (Fujipilm life scince, Minato-ku, Tokyo)에 노출시켜 image capture하였다. Capture한 image를 Multi Gauge V3.1 프로그램을 사용하여 band-densitometry를 측정하고, 이를 대조군 평균치에 100%에 대한 상대값으로 표시하였다.
Rhcg에 대한 일차항체는 Interdisciplinary center for Biotechnology Research, University of Florida College of Medicine에서 제작한 rabbit polyclonal antibody를 사용하였다. Vacuolar H+-ATPase rabbit polyclonal antibody (Santa Cruz Biotechnology, Santa Cruz, CA, USA)를 사용하고, loading control로 Monoclonal Anti-β-Actin (Sigma-Aldrich, St. Louis, MO, USA)을 사용하였다.
면역조직화학 염색법은 PLP 용액에 고정된 신장조직을 신장유두를 중심으로 중심부위를 2 mm 두께로 자른 후 paraffin block에 포매하였다. 포매된 신장 절편을 microtome을 이용하여 4 μm의 절편을 슬라이드를 제작하여 면역조직화학염색을 시행하였다. Xylene을 사용하여 절편을 탈파라핀시키고, 에탄올 농도를 100%부터 70%까지 점진적으로 낮추면서 재수화시킨다. 내재성 Peroxidase 활성을 제거하기 위하여 3% H2O2로 4℃ 냉장고에서 45분간 반응시켰다. PBS로 세척 후 조직내 비특이적인 면역반응을 제거하기 위해 PBS에 희석한 염소혈청(nomal goat serum; Vector Laboratories, inc. Burlingame, CA, USA)을 4℃ 냉장고에서 30분간 반응시켰다. PBS에 희석한 일차항체를 4℃ 냉장고에서 밤새 반응시키고 PBS로 일차항체를 세척 후 PBS에 희석한 이차항체 biotinylated goat anti-rabbit IgG (MACH 2 Rabbit HRP Polymer; Biocare medical, Concord, USA)를 30분간 상온에서 반응시켰다. PBS로 세척 후 peroxidase 3, 3'-diaminobenzidine (DAB) substrate kit에 반응시켰다. 증류수로 peroxidase 반응을 정지시킨 후 에탄올과 xylene으로 탈수시킨 후 permount로 봉입하였다.
원위세관의 세포 분자수준에서 Rhbg와 Rhcg의 발현변화를 확인하기 위하여 NIH image J, V1.34s 프로그램을 이용하여 면역조직화학법을 정량화하였으며, 이전 연구의 방법에 근거하여 시행하였다[13]. 면역조직화학염색 후 광학현미경으로 각 실험군에서 피질과 수질 집합관 5개를 임의선정하고, 사이세포를 각 3개 세포씩 사진 촬영하였다. 세포내강으로부터 기저외측세포막까지 일직선으로 그어 거리에 따른 pixel intensity를 측정하고, 이 값은 컴퓨터 프로그램에서 변환하여 세포 크기, 총 Rhcg intensity, 자유면세포막 Rhcg의 발현 비율을 계산하였다. 자유면세포막은 세포내강부터 25%까지로 선정하여 자유면세포막 Rhcg의 발현으로 분석하였다. 정량화된 값은 동물군별로 통계 분석하였다.
신세뇨관산증을 유발하기 위하여 아밀로라이드를 3 mg/kg/day의 농도로 6일간 복강내에 투여하였다. 혈중 Na+과 Cl- 농도는 대조군과 실험군에서 차이가 없었으나, 혈중 K+ 농도는 대조군 3.84 ± 0.34 mmol/L에 비하여 실험군은 4.50 ± 0.46 mmol/L로 약간 높았다(p < 0.05). 혈중 tCO2 농도는 대조군 25.6 ± 1.5 mEq/L에 비하여 실험군은 23.0 ± 1.5 mEq/L로 감소하여 대사성산증이 유발되었다(p < 0.05, Table 1). 24시간 요 암모니아 배설은 대조군 0.52 ± 0.07 mmol에 비하여 실험군에서 0.30 ± 0.03 mmol으로 요 암모니아 배설이 감소하였으며(p < 0.05), Urine pH는 양 군 간에 차이가 없어 아밀라이드 투여에 의해 신세뇨관산증이 유발되었음을 확인하였다(Table 2). 24시간 소변량은 대조군 21.8 ± 3.7 mL, 실험군 25.4 ± 4.3 mL으로 양 군 간에 차이는 없었다. 24시간 요 Na+은 대조군 3.59 ± 0.67 mmol, 실험군 5.72 ± 0.82 mmol, 24시간 요 Cl-은 대조군 4.02 ± 0.48 mmol, 실험군 5.42 ± 0.61로 실험군에서 증가하였으며, 24시간 요 K+은 대조군 5.82 ± 0.52 mmol, 실험군 5.03 ± 0.54 mmol로 실험군에서 감소하였다(p < 0.05, Table 2).
면역조직화학염색 결과 Rhbg는 피질과 수질 집합관의 A형 사이세포의 기저외측세포막에 강하게 발현되었으며, 주세포에서는 발현이 약하였다. 실험군의 Rhbg 면역반응성은 대조군에 비하여 유의한 차이는 없었다(Fig. 2). Rhcg는 피질과 수질 집합관의 A형 사이세포의 자유면세포막에 주로 발현되었으며, 기저외측세포막에는 상대적으로 약하게 발현되었다. 실험군에서 Rhcg 면역반응성은 대조군에 비하여 감소하였다(Fig. 3). A형 사이세포의 자유면세포막에 존재하는 것으로 알려진 H+-ATPase의 발현도 실험군에서 대조군에 비하여 감소하였다(Fig. 4).
면역조직화학염색에서 확인한 Rhcg 발현 변화를 정량화하기 위하여 NIH image J, V1.34s 프로그램을 이용하였고, 이 값을 대조군 평균치 100%에 대한 상대값으로 표시하였다. 피질과 수질 집합관의 A형 사이세포의 높이는 대조군과 차이가 없었다. 실험군에서 피질 집합관 사이세포의 총 Rhcg 발현은 46.6 ± 1.8%로 대조군에 비하여 감소하였으며, 자유면 세포막에서의 Rhcg 발현은 43.4 ± 1.7%로 감소하였다(p < 0.05). 자유면 세포막의 총 Rhcg의 상대적 발현 비율은 양 군 간에 차이가 없었다. 실험군에서 외수질 집합관의 총 Rhcg 발현과 자유면 세포막의 Rhcg 발현은 53.9 ± 2.0%와 53.6 ± 2.2%로 대조군에 비하여 감소하였으나(p < 0.05), 자유면 세포막의 총 Rhcg의 상대적 발현 비율은 유의한 차이는 없었다(Table 3).
신장에서 암모니아의 배설은 산-염기 평형을 조절하는 주요기전으로 작용한다[14,16]. 암모니아 분자는 암모니아 가스와 암모니움 이온의 두 가지 형태로 존재하며, 전통적으로는 암모니아 가스형태로 전환되면 생체 내에서 확산에 의해 세포막을 자유롭게 통과하는 것으로 여겨졌으나, 최근 사람을 비롯한 동물의 생체 내에서는 98% 이상의 암모니아가 이온 형태로 존재하는 사실이 알려지면서 확산에 의한 암모니아의 운반 기전 외에 운반 단백질을 통한 암모니아 운반에 대한 가능성이 제시되어 왔다[17]. 암모니아 운반 단백질인 Rhbg와 Rhcg는 생쥐와 흰쥐의 신장에서 암모니아 배설의 주요 부분인 집합관과 연결세관에서 주로 발현됨이 확인되었고[4-11,18], Rhbg는 A형 사이세포와 주세포의 기저외측세포막에 발현되고, Rhcg는 동일세포의 자유면세포막과 기저외측세포막에 동시에 발현됨이 보고되고 있다[12,13,19].
최근 암모니아 대사가 증가하는 대표적인 질환인 만성 대사성 산증과 신절제 모델에서 요중 암모니아 배설의 증가와 원위신원에서 암모니아 운반체인 Rhcg의 발현증가가 동반됨이 확인되었으며[12,13], 만성 사이클로스포린 신증 모델에서 요 암모니아 배설의 감소와 함께 암모니아 운반체인 Rhcg의 면역반응성이 감소한다고 보고되어[20], 신장의 암모니아 배설에 있어서 암모니아 운반체 Rhcg의 중요성이 부각되고 있다.
본 연구에서 투여한 아밀로라이드는 집합관의 상피 소디움 통로를 직접 차단하여 소디움 배설을 촉진함으로써 신세뇨관 세포내로의 소디움 유입의 감소을 일으키고 내강 음전위를 충분히 형성하지 못하게 하여 전위차 결함형 원위부 신세뇨관산증을 유발하는 것으로 알려져 있다[14,15].
본 연구 결과에 따르면 아밀로라이드 투여 후 대조군에 비하여 혈중 중탄산염 농도가 감소하고 칼륨 농도가 증가하였으며, 24시간 요 검사에서 요중 칼륨 배설과 요중 암모니아 배설이 감소되어 아밀로라이드 투여에 의해 신세뇨관산증이 유발됨을 확인하였으며, 이와 함께 암모니아 운반체인 Rhcg의 면역반응성이 감소함을 확인할 수 있었다.
본 연구에서 암모니아 운반체인 Rhbg의 면역반응성은 아밀로라이드 투여 후 대조군과 유의한 차이가 없었다. 이 결과는 이전에 보고된 만성 대사성 산증과 신절제 모델에서도 일치하는 결과를 보여주고 있다[12,13].
아밀로라이드 유발 신세뇨관산증에서 Rhcg의 면역반응성은 immunoblot 결과에서는 Rhcg의 단백 발현은 감소하는 경향은 보였으나 유의한 차이를 보이지 않았으며 면역조직화학염색법과 이를 이용한 정량적 분석에서는 유의한 감소를 보였다. 이와 같은 결과는 요중 암모니아 배설량이 대조군의 25배 정도 증가한 만성 대사성산증 모델에서는 Rhcg의 면역반응성이 immunoblot에서도 유의한 상승을 보였으나, 요중 암모니아 배설량이 대조군의 2배 정도 증가한 신절제 모델에서는 Rhcg의 발현이 immunoblot에서는 큰 차이를 보이지 않았고, 면역조직화학염색 검사에서는 Rhcg의 발현이 증가한 소견을 보였던 결과와 비슷한 소견으로 생각된다[12,13].
신장의 원위신원에는 산을 분비하는 A형 사이세포와 염기를 분비하는 B형 사이세포가 상피세포의 40%를 차지하고 있으며, 산-염기 평형에 중요한 역할을 하는 것으로 알려져 있다[21-24]. 원위신원의 60%를 차지하는 주세포는 기저외측세포막에 존재하는 Na+/K+-ATPase의 활성에 의해 자유면세포막에 존재하는 상피 소디움 통로를 통해 소디움의 세포유입이 이루어지고, 세뇨관강 내의 음전하가 생성되어 사이세포의 수소이온을 분비를 증가시켜 산-염기 평형 조절에 관여한다. 원위신원의 A형 사이세포의 자유면세포막에 존재하는 vacuolar H+-ATPase는 원위신원의 수소이온 분비에 중요한 운반체로 알려져 있다[23,24].
원위부 신세뇨관산증에서 A형 사이세포의 자유면세포막에 있는 H+-ATPase와 기저외측세포막에 있는 음이온 교환자(anion exchanger-1, AE1)의 발현이 결손됨을 확인하여 신세뇨관성 산증의 병태 생리를 규명하는데 요산성화에 관여하는 산-염기 운반체의 결손이 세포단위의 분자수준에서 증명되고 있다[25-27].
본 연구에서도 아밀라이드 유발 신세뇨관산증군에서는 면역조직화학염색 검사에서 H+-ATPase의 면역반응성도 대조군에 비하여 감소하였다. 이는 아밀로라이드에 의한 세관강내의 음전하 형성이 감소하게 되어 A형 사이세포 자유면세포막의 H+-ATPase의 활성이 감소하였을 가능성을 생각해볼 수 있다.
원위부 신세뇨관성 산증은 다양한 병태생리학적 기전으로 발생하며, 그 기전으로는 H+-ATPase의 결손이나 기능적 장애가 있는 수소이온 분비장애형, 경사차 결함형, 수소이온 분비에 필요한 경세포막 전위차를 형성하지 못하는 전위차 결함형, 수소이온이 분비되었다가 역확산되는 투과형 등이 있다[1,2,28]. 본 연구에서는 아밀로라이드 투여 후 암모니아 배설의 감소와 함께 신세뇨관산증이 유발됨을 확인하였고, 피질 및 외수질 집합관에서의 Rhcg이 감소함을 확인하였으나, 향후 신세뇨관산증의 다양한 병인기전에 따른 암모니아 운반체의 발현 변화에 차이가 있는지를 확인하는 것이 필요할 것으로 생각한다.
본 연구의 결과를 종합하면 아밀로라이드 유발 신세뇨관산증에서 요중 암모니아 배설 감소와 암모니아 운반체 Rhcg 발현 감소를 확인하였으며, 신세뇨관산증 병인에 있어서 암모니아 운반체 Rhcg가 중요한 역할을 할 것으로 생각한다.
REFERENCES
1. Bastani B, Gluck SL. New insights into the pathogenesis of distal renal tubular acidosis. Miner Electrolyte Metab 1996;22:396–409.

2. Gregory MJ, Schwartz GJ. Diagnosis and treatment of renal tubular disorders. Semin Nephrol 1998;18:317–329.

3. DuBose TD Jr, Good DW, Hamm LL, Wall SM. Ammonium transport in the kidney: new physiological concepts and their clinical implications. J Am Soc Nephrol 1991;1:1193–1203.

4. Knepper MA. NH4+ transport in the kidney. Kidney Int Suppl 1991;33:S95–S102.
5. Marini AM, Vissers S, Urrestarazu A, André B. Cloning and expression of the MEP1 gene encoding an ammonium transporter in Saccharomyces cerevisiae. EMBO J 1994;13:3464–3471.


6. Ninnemann O, Jauniaux JC, Frommer WB. Identification of a high affinity NH4+ transporter from plants. EMBO J 1994;13:3464–3471.


7. Weiner ID, Verlander JW. Renal and hepatic expression of the ammonium transporter proteins, Rh B Glycoprotein and Rh C Glycoprotein. Acta Physiol Scand 2003;179:331–338.


8. Liu Z, Peng J, Mo R, Hui C, Huang CH. Rh type B glycoprotein is a new member of the Rh superfamily and a putative ammonia transporter in mammals. J Biol Chem 2001;276:1424–1433.


9. Eladari D, Cheval L, Quentin F, et al. Expression of RhCG, a new putative NH(3)/NH4+ transporter, along the rat nephron. J Am Soc Nephrol 2002;13:1999–2008.


10. Verlander JW, Miller RT, Frank AE, Royaux IE, Kim YH, Weiner ID. Localization of the ammonium transporter proteins RhBG and RhCG in mouse kidney. Am J Physiol Renal Physiol 2003;284:F323–F337.


11. Han KH, Croker BP, Clapp WL, et al. Expression of the ammonia transporter, rh C glycoprotein, in normal and neoplastic human kidney. J Am Soc Nephrol 2006;17:2670–2679.


12. Seshadri RM, Klein JD, Kozlowski S, et al. Renal expression of the ammonia transporters, Rhbg and Rhcg, in response to chronic metabolic acidosis. Am J Physiol Renal Physiol 2006;290:F397–F408.

13. Kim HY, Baylis C, Verlander JW, et al. Effect of reduced renal mass on renal ammonia transporter family, Rh C glycoprotein and Rh B glycoprotein, expression. Am J Physiol Renal Physiol 2007;293:F1238–F1247.


17. Lang W, Blöck TM, Zander R. Solubility of NH3 and apparent pK of NH4+ in human plasma, isotonic salt solutions and water at 37 degrees C. Clin Chim Acta 1998;273:43–58.


18. Weiner ID. The Rh gene family and renal ammonium transport. Curr Opin Nephrol Hypertens 2004;13:533–540.


19. Kim HY, Verlander JW, Bishop JM, et al. Basolateral expression of the ammonia transporter family member, Rh C glycoprotein, in the mouse kidney. Am J Physiol Renal Physiol 2009;296:F543–F555.



20. Lim SW, Ahn KO, Kim WY, et al. Expression of ammonia transporters, Rhbg and Rhcg, in chronic cyclosporine nephropathy in rats. Nephron Exp Nephrol 2008;110:e49–e58.


21. Hamm LL, Simon EE. Roles and mechanisms of urinary buffer excretion. Am J Physiol 1987;253:F595–F605.

22. Sabatini S. Experimental studies in distal urinary acidification: bringing the bedside to the bench. Semin Nephrol 1999;19:188–194.

23. Brown D, Gluck S, Nartwig J. Structure of the novel membranecoating material in proton-secreting epithelial cells and identification as an H+ATPase. J Cell Biol 1987;105:1637–1648.



24. Gluck SL, Underhill DM, Iyori M, Holliday LS, Kostrominova TY, Lee BS. Physiology and biochemistry of the kidney vacuolar H+-ATPase. Annu Rev Physiol 1996;58:427–445.


25. DuBose TD Jr. Autosomal dominant distal renal tubular acidosis and the AE1 gene. Am J Kidney Dis 1999;33:1190–1197.


26. Dafnis E, Spohn M, Lonis B, Kurtzman NA, Sabatini S. Vanadate causes hypokalemic distal renal tubular acidosis. Am J Physiol 1992;262:F449–F453.

27. Kim HY, Han JS, Jeon ES, et al. Defect of acid-base transporters in distal renal tubular acidosis. Korean J Nephrol 2000;19:899–909.
Rhbg (A, B) and Rhcg (C, D) protein expression in response to amiloride-induced renal tubular acidosis (RTA). (A, B) Immunoblots for Rhbg. (A) Immunoblot of protein from the renal cortex of control and RTA kidneys. Each lane was loaded with a sample from a different animal. (B) Mean densitometries for the cortex and outer medulla, where the band density is relative to the mean (100%) expression in control kidneys. Rhbg protein expression did not differ significantly between the RTA and controls. (C, D) Immunoblot for Rhcg. (C) Immunoblot of protein from the renal cortex of control and RTA kidneys. (D) Mean densitometries from the cortex and outer medulla. Rhcg protein expression did not differ significantly between the RTA and controls. Data are presented as means ± SD; n = 5 per group. NS, not significant.
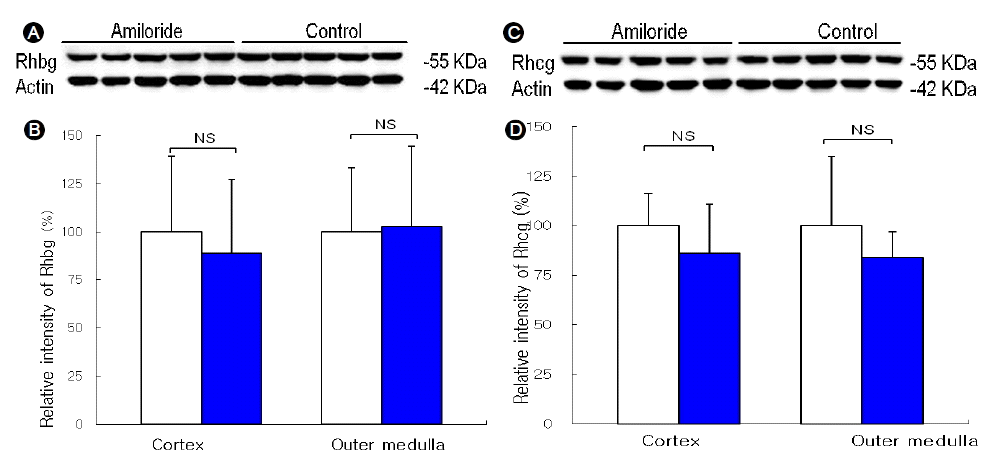
Figure 1.
Rhbg immunoreactivity in the cortical collecting duct (CCD) and outer medulla collecting duct (OMCD) of control kidneys and amiloride-induced renal tubular acidosis (RTA) kidneys. Predominant Rhbg immunoreactivity was detected in the basolateral plasma membrane of intercalated cells in the CCD and OMCD. Rhbg expression was not altered in the kidneys of rats with amiloride-induced RTA compared with controls. (A) CCD of control kidney; (B) OMCD of control kidney; (C) CCD of amilorideinduced RTA kidney; (D) OMCD of amiloride-induced RTA kidney. All panels are representative of the findings in five controls and five amiloride-induced RTA kidneys. All panels were photographed and reproduced at the same magnification. The solid black arrows indicate the basolateral Rhbg immunoreactivity.
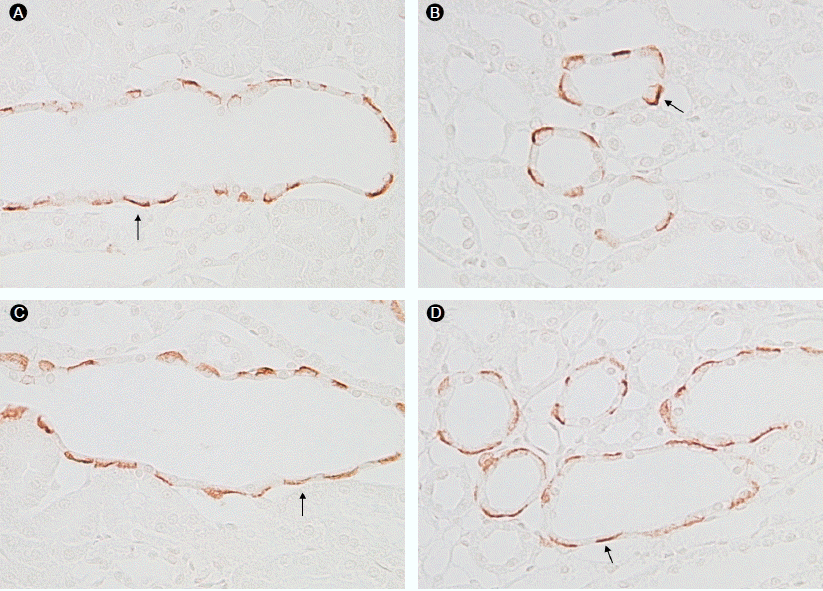
Figure 2.
Rhcg immunoreactivity in the cortical collecting duct (CCD) and outer medulla collecting duct (OMCD) of control kidneys and amiloride-induced renal tubular acidosis (RTA) kidneys. CCD intercalated cells show a broad apical band of intense immunoreactivity (black arrow); the basolateral immunoreactivity (black arrowhead) is a weaker, thinner band compared with the apical immunoreactivity. Rhcg expression was reduced in the regions of the rat kidney with amiloride-induced RTA compared with controls. (A) CCD of control kidney; (B) OMCD of control kidney; (C) CCD of amiloride-induced RTA kidney; (D) OMCD of amiloride-induced RTA kidney. All panels are representative of findings in five controls and five amiloride-induced RTA kidneys. All panels were photographed and reproduced at the identical magnification.
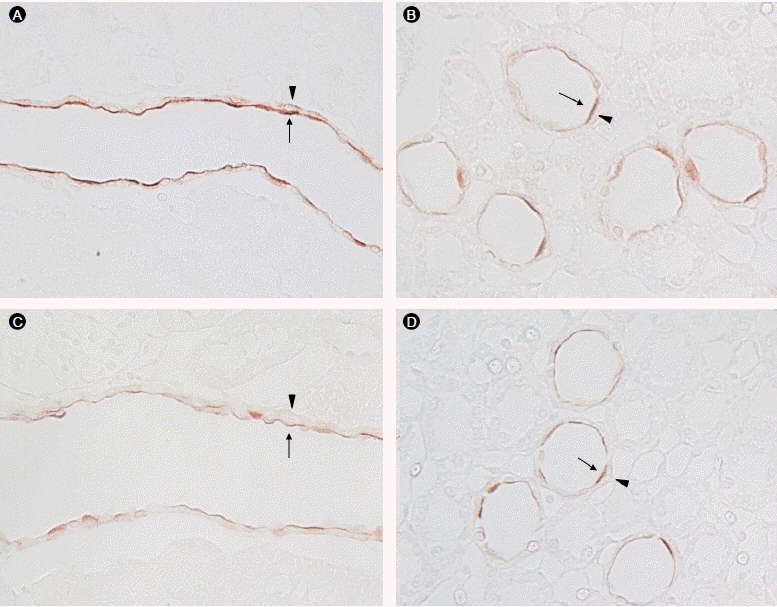
Figure 3.
H+-ATPase immunoreactivity in the cortical collecting duct (CCD) and outer medulla collecting duct (OMCD) of control kidneys and amiloride-induced renal tubular acidosis (RTA) kidneys. Predominant H+-ATPase immunoreactivity was detected in the apical plasma membrane of intercalated cells in the OMCD and CCD (black arrow). H+-ATPase expression was reduced in the regions in the kidneys of rats with amiloride-induced RTA compared with controls. (A) CCD of control kidney; (B) OMCD of control kidney; (C) CCD of amiloride-induced RTA kidney; (D) OMCD of amiloride-induced RTA kidney. All panels are representative of findings in five controls and five amiloride-induced RTA kidneys. All panels were photographed and reproduced at identical magnification.
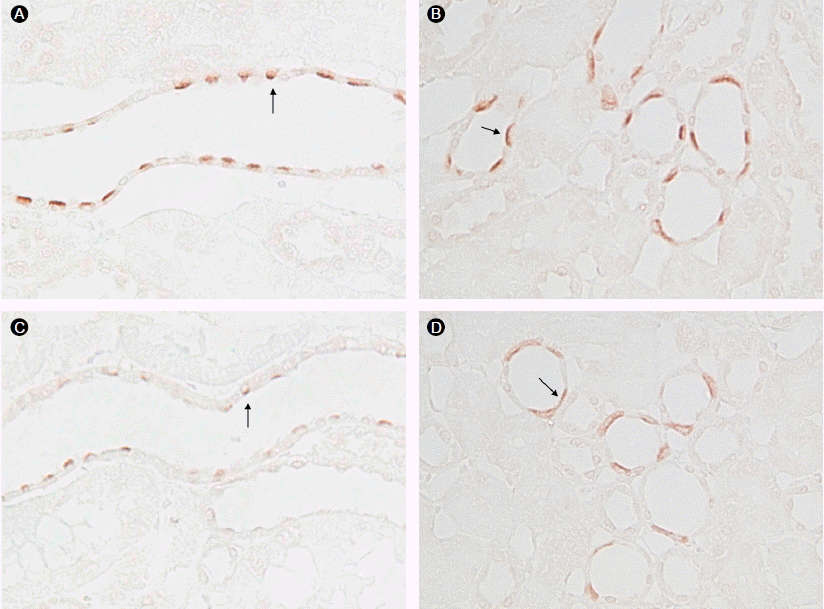
Figure 4.
Table 1.
Serum chemistry and electrolytes in amiloride-induced renal tubular acidosis
| Parameter | Control (n = 5) | Amiloride (n = 5) |
|---|---|---|
| Na+ (mmol/L) | 144.4 ± 2.5 | 145.0 ± 6.4 |
| K+ (mmol/L) | 3.84 ± 0.35 | 4.50 ± 0.46a) |
| Cl- (mmol/L) | 96.8 ± 1.7 | 93.2 ± 4.9 |
| tCO2 (mEq/L) | 25.6 ± 1.5 | 23.0 ± 1.5a) |
| Body weight (g) | 322.4 ± 18.9 | 315.4 ± 7.3 |
Table 2.
The 24-hr urine parameters in amiloride-induced renal tubular acidosis
| Parameter | Control (n = 5) | Amiloride (n = 5) |
|---|---|---|
| Ammonia (mmol/24 hr) | 0.52 ± 0.07 | 0.30 ± 0.03a) |
| Urine pH | 7.91 ± 0.19 | 7.99 ± 0.15 |
| Urine volume (mL/24 hr) | 21.8 ± 3.7 | 25.4 ± 4.3 |
| Na+ (mmol/24 hr) | 3.59 ± 0.67 | 5.72 ± 0.82a) |
| K+ (mmol/24 hr) | 5.82 ± 0.52 | 5.03 ± 0.54a) |
| Cl- (mmol/24 hr) | 4.02 ± 0.48 | 5.42 ± 0.61a) |
Table 3.
Quantitative immunohistochemical analysis of Rhcg expression in response to amiloride-induced renal tubular acidosis
| Parameter | CCD | OMCD |
|---|---|---|
| Height of type A intercalated cells | 99.4 ± 1.8 | 98.3 ± 2.2 |
| Total Rhcg expression | 46.6 ± 1.8a) | 53.9 ± 2.0a) |
| Rhcg expression in the apical region | 43.4 ± 1.7a) | 53.6 ± 2.2a) |
| Relative proportion of apical Rhcg | 101.0 ± 9.7 | 98.6 ± 1.7 |
- TOOLS
-
 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link XML Download
XML Download Full text via DOI
Full text via DOI-
 Download Citation
Download Citation
 Print
Print-
Share :








