심방세동 환자에서 주요 항부정맥제의 전기생리 작용의 차이
Differing Electrophysiological Effects of Various Antiarrhythmic Drugs on the Cardiac Chamber in Atrial Fibrillation
Article information
Abstract
목적:
장기적인 항부정맥 약물요법은 주로 심방세동에서 시행되고 있으며 심방세동을 억제하고 동율동을 유지하는 것이 그 목적이다. 심방세동의 항부정맥 약물요법에 흔히 사용되는 amiodarone, flecainide, propafenone 등의 심방과 심실에 대한 전기생리 작용의 차이를 파악하고자 하였다.
방법:
2006년 1월부터 2009년 12월까지 전남대학교병원에 내원한 심방세동으로 amiodarone, flecainide, propafenone 중 한 가지 약제를 6개월 이상 복용하고 있으며, 동율동이 유지되고 있는 134명(60.4 ± 12.5세, 남:여 = 1.14:1)을 대상으로 하였으며 발작성 심방세동으로 약물을 투여하지 않고 동율동이 유지되고 있는 환자(28명)을 약물 투여군과 비교하였다. 표준 12유도 심전도를 사용하여, P파 간격과 분산, QRS 간격과 분산, QT 간격과 분산을 측정하여 분석하였다.
결과:
P파와 QRS파의 폭과 분산은 amiodarone 복용 군에서 가장 작았으며 P파와 QRS파 최대 폭의 비는(Pmax/QRSmax) amiodarone 복용 군에서 가장 컸다(amiodarone군 1.2, flecainide군 0.9, propafenone군 1.0, p < 0.001). QT 간격은(amiodarone군 454 ± 34, flecainide군 428 ± 52, propafenone군 434 ± 25, p = 0.006) amiodarone 복용 군에서 가장 길었고 QT 분산과 (amiodarone군 28 ± 13, flecainide군 38 ± 16, propafenone군 35 ± 13, p = 0.002) QTpe 분산은(amiodarone군 13.3 ± 11.2, flecainide군 30.7 ± 24.9, propafenone군 31.8 ± 21.6, p < 0.001) amiodarone 복용 군에서 가장 작았다.
결론:
Amiodarone은 flecainide나 propafenone에 비하여 심방과 심실의 전도 억제작용이 약하나 심방에 대한 선택성이 더 크며, 심실의 재분극 억제 작용이 강하지만 비교적 균일하게 작용함을 알 수 있었다. 이러한 전기생리학적 특성으로 인하여 심방세동의 치료에 flecainide 혹은 propafenone보다 amiodarone이 더 우월한 것으로 생각되었다.
Trans Abstract
Background/Aims:
Long-term antiarrhythmic drug therapy remains the principal approach for suppressing atrial fibrillation (AF) and maintaining sinus rhythm. In this study, we examined the differing electrophysiological effects of various antiarrhythmic drugs on the cardiac chamber and atrial selectivity in patients with AF.
Methods:
We analyzed 134 patients (60.4 ± 12.5 years, M:F = 1.14:1) who were administered a single antiarrhythmic agent for AF over 6 months: amiodarone (group A), flecainide (group F), or propafenone (group P). The P wave, QRS complex duration and dispersion, and QT interval and its dispersion were evaluated using a standard 12-lead electrocardiogram.
Results:
There was no significant difference in age, gender ratio, or associated diseases among the three groups. In group A, Pmax, Pmin, P dispersion, QRSmax, QRSmin, and QRS dispersion were shorter than in groups F and P, whereas Pmax/QRSmax was the highest in group A (A = 1.2, F = 0.9, P = 1.0; p < 0.01). QRcmax and QTcmin were longer in group A, whereas QTc dispersion and the QT peak to end (A = 13.3 ± 11.2, F = 30.7 ± 24.9, P = 31.8 ± 21.6; p < 0.01) were shorter in group A than in the other groups.
Conclusions:
Amiodarone had a weaker, but more selective, inhibitory effect on intra-atrial conduction, and inhibited ventricular repolarization more effectively and homogenously than flecainide or propafenone. These differing electrophysiological effects may contribute to the superior effectiveness and safety of amiodarone over flecainide or propafenone. (Korean J Med 2011;80:672-679)
서 론
심방세동은 임상에서 가장 흔하게 관찰되는 부정맥이며, 연령의 증가와 더불어 유병률도 증가한다. 심방세동은 심장기능의 저하와 뇌경색증이나 전신 색전증을 일으켜 질병 이환율과 사망률을 증가시킬 수 있으므로 임상적으로 매우 중요한 부정맥이다[1-3]. 심방세동을 치료하기 위하여 근래에 전극도자 절제술이 이용되기도 하지만[4-6] 항부정맥제를 이용한 율동조절 요법과 방실전도 억제제를 이용한 심박수조절 요법 등의 약물치료가 주로 시행되고 있다.
항부정맥 약물요법에서 가장 심각한 문제는 치명적인 심실성 부정맥 유발이며. 심실성 부정맥의 유발은 항부정맥제가 심방과 심실에 비선택적으로 작용하는 데에서 기인한다. 따라서 최근에 심방 선택성 약제 개발을 위한 연구가 활발히 진행되고 있다[7]. 그간 연구의 주된 관심은 심방에만 존재하는 ultra-rapid delayed rectifier outward potassium channel (IKur)의 선택적 억제제의 개발에 있었다[8]. 하지만 최근에 IKur 억제가 심방세동을 유발한다고 보고되어 다른 방편을 찾기 위한 연구가 시행되고 있다[9]. 또한 칼륨 통로뿐만 아니라 나트륨 통로도 심방과 심실 사이에 기능적으로 차이가 있다는 것이 규명되었다[10,11]. 심방세동의 약물요법에서 amiodarone과 함께 가장 많이 사용되는 약제는 class Ic 제제인 flecainide와 propafenone 등이며, 이들 약제는 나트륨 통로를 억제하여 전도를 억제하여 항부정맥 작용을 나타낸다[12].
심방세동 환자를 대상으로 표준 12유도 심전도를 사용하여 항부정맥제의 심방과 심실에 대한 작용에 대한 차이에 대해 국내에 발표된 논문은 거의 없는 실정이다. 이 연구에서는 심방세동 환자에서 흔히 사용되는 amiodarone, flecainide, propafenone의 심방과 심실에 대한 전기생리 작용의 차이를 평가하고 그 임상적 의미를 규명하고자 하였다.
대상 및 방법
대상
2006년 1월부터 2009년 12월까지 전남대학교병원에 심방세동으로 외래 통원치료 중인 환자에서 amiodarone (49명), flecainide (52명), propafenone (33명) 중 한 가지 약제를 6개월 이상 복용하고 있는 환자를 대상으로 하였다. 약제에 대한 부작용이 없고, 외래 내원 시 표준 12유도 심전도를 기록하여 동율동으로 전환된 134명(60.4 ± 12.5세, 남:여 = 1.14:1)을 대상으로 하였으며, 각 차단이 있거나 약물치료 중에 약제가 바뀌었거나 두 가지 이상 항부정맥제를 병합한 경우는 제외하였다.
후향적으로 병력 기록을 검토하여 대상 환자를 선정하였고, 환자들은 항부정맥제를 경구투여하였으며, amiodarone (A군: 200-600 mg/day), flecainide (F군: 100-400 mg/day), propafenone (P군: 450-600 mg/day) 등을 투여 받았다.
항부정맥제를 복용하지 않고 동율동이 유지되고 있는 발작성 심방세동 환자군 28명(62.4 ± 11.8세, 남:여 = 1:1)을 대조군으로 하여 항부정맥제 투여군과 비교하였다.
방법
동반 질환 및 투여 약물 분석
대상 환자 중 고혈압이 동반된 환자는 안지오텐신 전환효소 억제제와 안지오텐신 수용체 억제제, 이뇨제를 복용하였고, 칼슘길항제와 베타차단제를 복용하고 있는 환자는 검사결과에 영향을 줄 수 있어 제외하였다. 이상지질혈증은 National Cholesterol Education Program Adult Treatment Panel III (NECP ATP III) 가이드라인[13]에 따라서 정의하였고, statin, fibrates 등의 지질저하제를 복용 중인 환자를 포함하였다. 당뇨병 환자는 American Diabetes Association (ADA) 가이드라인[14]에 따라 경구 혈당강하제 혹은 인슐린으로 혈당 조절 중인 환자를 포함하였다.
심초음파 검사
이면성 및 M형 심초음파도, Tissue Doppler Imaging를 VIVID 7 (GE, Milwaukee, WI, USA), Acuson Sequoia C256 (Siemens, Erlangen, Germany) 심초음파기를 이용하여 좌측 와위 (left lateral decubitus position)에서 표준방법으로 시행하였다. 좌심실 구혈률은 Simpson’s method [15] 및 Teichloz method [15]로 측정하였으며, 좌심방 직경을 동시에 측정하였다.
심전도 분석
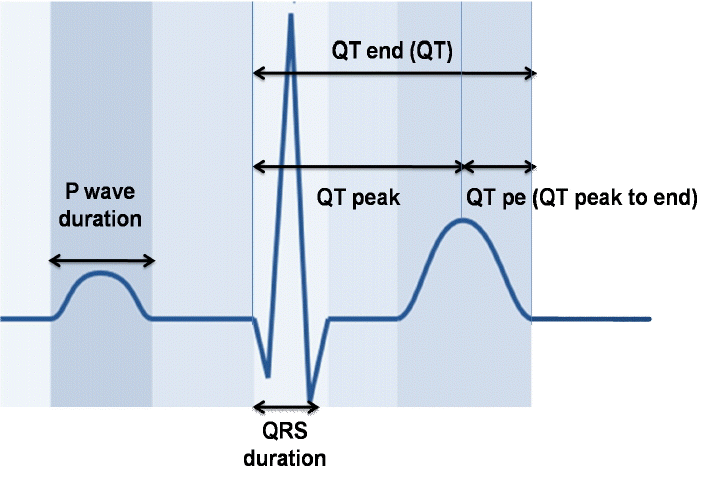
표준방법으로 기록된 심전도를 스캔한 후 Screen caliper (ICONICO SOFTWARE version 4.0, New York City, NY, USA)를 사용하여 2배 확대하여 두 명의 연구자가 눈가림 방식으로 측정하였다(Fig. 1). P파 폭(P)은 P파의 시작점에서 끝점까지 시간 간격으로 측정하였고 12유도에서 이들의 최대값과 최소값의 차이를 P파 분산(P dispersion)이라고 정의하였다. QRS파 폭(QRS)은 QRS파의 시작점에서 끝점까지 시간 간격으로 측정하였고 12유도에서 이들의 최대값과 최소값의 차이를 QRS파 분산(QRS dispersion)이라고 정의하였다. QT간격(QT)은 QRS의 시작에서 T파가 끝나는 시점까지의 간격으로 측정하였다. U파가 있는 경우는 T파와 U파가 만나는 점의 최저점을 T파의 끝점으로 하였다. 교정 QT간격(QTc)은 Bazett’s 공식 [QTc=QT/√(R-R)] [16]에 따라 심박동수로 교정하여 산출하였다. 12유도에서 QT의 최대값과 최소값의 차이를 QT분산(QT dispersion)이라고 정의하였다. QTpe는 QRS의 시작에서 T파의 정점까지 간격(QTp)과 QT간격의 차이로 정의하였고 QT의 최대값(QTmax)과 QTp의 최소값의 차이를 QTpe dispersion이라고 정의하였다.
자료 분석
자료 분석은 SPSS 15.0을 이용하였다. 모든 측정값은 평균 ± 표준편차로 표시하였다. 연속형 변수의 평균 값의 차이 분석에는 Student t-test와 ANOVA test를 사후 검정에는 Tukey’s test를 이용하였다. 환자의 기본적인 특성과 연관성 평가에는 카이제곱 검정 및 Fisher’s Exact test를 사용하였다. p 값이 0.05 미만의 경우를 의미있는 것으로 간주하였다.
결 과
대상 환자의 임상 특성
전체 환자의 평균 연령은 60.4 ± 12.5세였으며, A군 60.3 ± 12.3세, F군 61.4 ± 11.8세, P군 59.0 ± 13.9세였다. 전체 환자의 남녀 비는 1.48:1였다(A군 2.2:1, F군 1.0:1, P군 1.2:1). 평균 분당 심박수는 A군 62.2 ± 11.5회, F군 65.8 ± 10.9회, P군 63.8 ± 9.2회로서 세 군 간에 유의한 차이는 없었다. 전체 환자 중 고혈압이 48명(38.8%)으로 가장 많았으며, 당뇨병(39명, 29.1%), 이상지질혈증(37명, 27.6%), 흡연(18명, 13.4%), 관상동맥 질환(9명, 6.7%), 판막 질환(8명, 16.5%) 순이었다. 대상 환자 중에는 갑상선기능항진증이나 저하증 환자는 없었으며, 동반 질환 빈도는 세 군 사이에 유의한 차이는 없었다. 심초음파로 측정한 좌심방직경과 좌심실 구혈률도 세 군 사이에 유의한 차이가 없었다(Table 1).
대조군에서 동반 질환으로 고혈압이 7명(25%)으로 가장 많았다. 각 약물을 사용한 군을 대조군과 비교해 보았을 때 나이(p = 0.181), 성별(p = 0.277), 심박수(p = 0.130), 고지혈증(p = 0.213), 관상동맥 질환(p = 0.081), 판막 질환(p = 0.261), 좌심방직경(p = 0.117), 좌심실 구혈률(p = 0.067)로 모두 유의한 차이가 없었다.
심전도에서 각 지표의 측정값
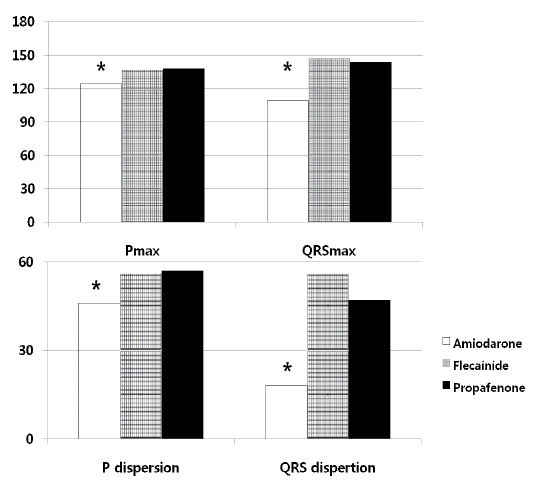
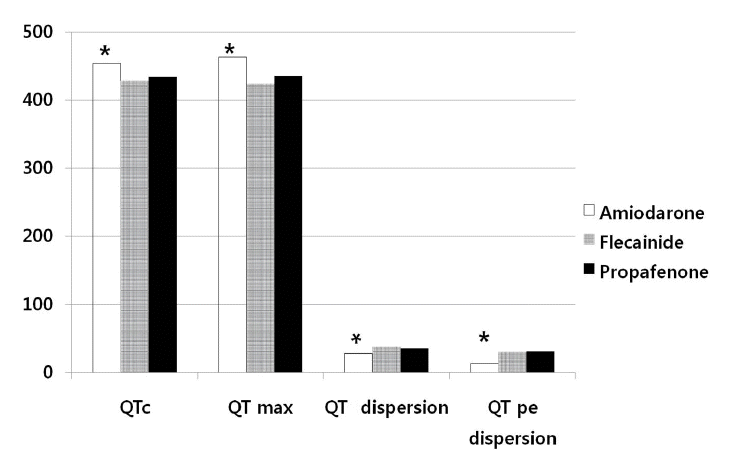
항부정맥제를 복용하지 않고 동율동을 유지하고 있었던 대조군(n = 28)에서 Pmax와 P dispersion은 각각 92 ± 5 ms, 10 ± 4 ms이었고, QRSmax, QRS dispersion은 각각 98 ± 7 ms, 12 ± 7 ms이었고, Pmax/QRSmax는 0.8 ± 0.1이었다. 또한 QTmax, QTc, QT dispersion은 각각 406 ± 19, 382 ± 13, 22 ± 11 ms이었고 QTpe, QTpe dispersion은 74 ± 5 ms, 8 ± 4 ms이었다. Pmax와 P dispersion은 A군에서 각각 124 ± 32 ms, 46 ± 19 ms, F군에서 각각 137 ± 27 ms, 56 ± 17 ms, P군에서 각각 138±29 ms, 47 ± 16 ms로서 대조군에 비해서 의미 있게 증가되어 있었고(각각 A군: p < 0.01, p < 0.01; P군: p < 0.01, p < 0.01; F군: p < 0.01, p < 0.01), 약물치료군 사이에서는 A군에서 다른 군에 비해 의미 있게 작았다(Table 2, Fig. 2). QRSmax, QRS dispersion은 A군에서 각각 109 ± 21 ms, 18 ± 20 ms, F군에서 각각 147 ± 16 ms, 46± 15 ms, P군에서 각각 144 ± 16 ms, 35 ± 10 ms로서 대조군에 비해서 의미 있게 증가되어 있었고(각각 A군: p = 0.01, p = 0.03; P군: p < 0.01, p < 0.01; F군: p < 0.01, p < 0.01), 약물치료군 사이에서는 A군에서 다른 군에 비해 유의하게 작았다(Table 2, Fig. 2). P파와 QRS파 최대 폭의 비(Pmax/QRSmax)는 A군에서 가장 컸다(amiodarone군 1.2, flecainide군 0.9, propafenone군 1.0, p < 0.01, Table 2, Fig. 3). QTmax는 각각 A군에서 463 ± 48 ms, F군에서 424 ± 37 ms, P군에서 435 ± 40 ms로서 대조군에 비해서 의미 있게 증가되어 있었고(각각 A군: p < 0.01, P군: p < 0.01, F군: p = 0.03), 약물치료군 사이에서는 A군에서 의미 있게 증가되어 있었다(Table 2, Fig. 4). QT dispersion은 각각 A군에서 28 ± 13 ms, F군에서 각각 38 ± 16 ms, P군에서 35 ± 13 ms로서 대조군에 비해서 의미 있게 증가되어 있었고(각각 A군: p < 0.01, P군: p < 0.01, F군: p = 0.02) 약물치료군 사이에서는 A군에서 의미 있게 감소되어 있었다(Table 2, Fig. 4). QTpe 분산은 A군에서 13 ± 11 ms, F군에서 각각 30 ± 24 ms, P군에서 31 ± 21 ms로서 대조군에 비해서 의미 있게 증가되어 있었고(각각 A군: p < 0.01, P군: p = 0.01, F군: p = 0.02), 약물치료군 사이에서는 A군에서 가장 작았다(Table 2, Fig. 4).
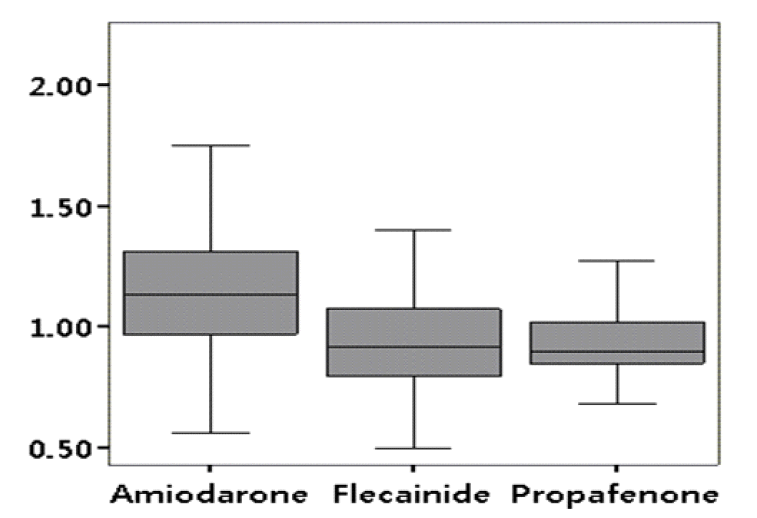
Pmax/QRSmax measured in the surface 12-lead electrocardiogram. Pmax/Qmax was highest in the amiodarone group (p < 0.001).
고 찰
본 연구에서 심방세동 환자에게 투여되는 amiodarone은 flecainide나 propafenone에 비해 심방과 심실의 전도 억제작용이 약하나 심방 선택성은 크며, 심실의 재분극 억제 작용이 강하지만 비교적 균일하게 작용함을 알 수 있었다. 이와 같은 전기생리 작용의 차이는 심방세동의 치료에서 amiodarone이 flecainide나 propafenone에 비하여 우월한 효과와 안전성에 기여할 것으로 생각된다.
심방세동 환자에서 동율동 유지를 위해서는 약물 요법이 주로 사용되고 있으며 2006년 발표된 American College of Cardiology/American Heart Association/European Society of Cardiology (ACC/AHA/ESC) 가이드라인[17]에 따르면 flecainide, propafenone은 기저 심장 질환이 없거나 미미한 경우와 좌심실 비대가 없는 환자에서 사용할 수 있다. Amiodarone은 벤조퓨란(benzofurane) 유도체로 1985년 미국식품의약품안전청에서 일차약제에 반응하지 않는 심실성 및 심실상성 부정맥의 치료에 승인되어 사용되고 있으며, 특히 좌심실부전이 동반된 환자에서도 안전하게 사용할 수 있어 가장 많이 사용되는 항부정맥제 가운데 하나이다[18,19]. Amiodarone은 Vaughan Williams 분류[20]의 class Ⅲ에 속하는 항부정맥제이며 칼륨 통로를 억제하여 활동전위의 3기를 지연시키는 것이 주된 작용이지만[21,22], class I, II, IV 작용도 갖고 있는 다중 통로 억제제이다[23,24]. 따라서 amiodarone은 나트륨 통로를 억제하여 전도 시간을 연장시킬 뿐만 아니라 칼륨 통로를 억제하여 재분극 시간을 지연시키는 작용을 가지고 있다. 칼륨 통로뿐만 아니라 나트륨 통로도 심방과 심실 사이에 기능적으로 차이가 있다는 것이 규명되었으며, Ranolazine은 심근세포의 활동전위에서 후기 나트륨 유입을 억제하는 것으로 밝혀졌다[10,11]. 동물실험에서 Ranolazine은 심방에 선택적이며 우선적으로 작용하여 심방세동을 효과적으로 억제하였으며 심실에는 전혀 영향을 주지 않았다[25]. 이는 Ranolazine이 심방의 나트륨 통로를 선택적으로 차단하여 심실부정맥 유발 없이 심방세동을 억제할 것임을 시사해 준다. Burashnikov 등[26]은 amiodarone을 장기간 복용시킨 개에서 장기적인 amiodarone 복용이 심방에서만 선택적으로 나트륨 통로를 억제함을 보고하였고, 이러한 작용이 amiodarone의 심방세동 억제에 기여할 것이라고 하였다.
본 연구에서 A군에서 P파와 QRS파의 폭과 분산이 가장 작았으며 P파와 QRS파의 최대 폭의 비(Pmax/QRSmax)는 가장 컸던 것은 amiodarone의 전도억제 작용은 flecainide나 propafenone에 비해 약하지만 심실보다는 심방에 대한 작용이 더 크다는 것을 시사해주었다. 이는 장기적인 amiodarone 투여가 선택적으로 심방의 나트륨 통로를 억제한다는 이전 연구의 결과와 일치되는 소견이다[12].
P파와 QRS파의 폭은 심방과 심실의 전도 시간을 반영하고 QT 간격은 심실의 재분극 시간을 나타낸다. 12유도 심전도에서 P파나 QRS파 폭의 분산은 전도 속도의 비균일성을 나타내고 QT간격의 분산은 심실 재분극 속도의 비균일성을 나타낸다. 본 연구에서 P파와 QRS 파 폭의 분산은 A군에서 유의하게 낮았고, 이는 amiodarone이 비교적 균일하게 심방과 심실의 전도를 억제함을 시사하였다. Class Ic 제제에 의해 유발되는 심실성 부정맥은 전도 지연과 관련이 있는 회귀가 주된 기전이나, amiodarone에 의한 심실성 부정맥은 전도 지연과 관련된 경우가 극히 드문 것도 이와 같은 이유 때문으로 생각된다. QT 간격의 연장은 A군에서 가장 커서 심실 재분극 억제 작용이 flecainide와 propafenone보다 크다는 것을 알 수 있었다. 하지만 QT 분산은 amiodarone군에서 가장 작아 amiodarone이 다른 약제에 비해 더 균일하게 억제한다는 것을 알 수 있었다. Amiodarone의 QT 연장 작용이 다른 약제 보다 큼에도 불구하고 다형 심실성 빈맥인 Torsades de Pointes의 발생률이 현저하게 낮은 이유도 비교적 균일한 재분극 억제 작용으로 일부 설명되고 있다.
QTpe는 심실의 통벽성(transmural) 재분극 시간을 반영하며 측정에 QRS파가 포함되지 않아 심실 탈분극의 영향을 덜 받을 뿐 아니라 심박수나 자율신경계 영향을 덜 받기 때문에 심실 재분극의 정확한 평가에 유용하게 쓸 수 있는 지표로 알려져 있다[27-29]. Amiodarone군에서 QTpe 분산이 다른 약제군보다 작은 점은 통벽성 회귀(reentry)가 발생할 가능성이 적을 것임을 시사하며, 이는 amiodarone이 다른 약제보다 심실성 부정맥 유발작용이 적은 것과 연관이 있을 것으로 생각된다.
본 연구의 제한점으로 첫째, 대상 환자의 수가 적은 편이고 둘째, 신호평균심전도(signal-averaged ECG)를 함께 시행하지 못하였는데, 표준 12유도 심전도와 함께 분석하였다면 결과 분석의 정밀성에 도움이 되었을 것이다. 셋째, 심방세동에 대하여 항부정맥제를 병합 요법하는 환자는 제외되었는데, 향후 병합 요법을 하는 환자에 대한 연구도 필요하다고 생각된다.
결론적으로 amiodarone은 심방세동 환자에서 flecainide나 propafenone에 비해 심방과 심실의 전도 억제작용이 약하나 심방에 대한 선택성이 더 크며, 심실의 재분극 억제 작용이 강하지만 비교적 균일하게 작용함을 알 수 있었다. 이와 같은 전기생리 작용의 차이는 심방세동 환자에서 amiodarone이 보여주는 우월한 효과와 안전성에 기여할 것으로 생각되었고, 향후 보다 더 우수한 항부정맥제의 개발에 참고가 될 것으로 기대된다.