대전 지역에서 급성 A형 간염의 유전자형에 따른 임상 특성 고찰
Clinical Differences According to Genotype in Acute Viral Hepatitis A in Daejeon, Korea
Article information
Abstract
목적:
B형 간염이나 C형 간염 등은 유전자형에 따른 차이가 알려져 있지만, 국내에서 증가하는 IIIA 유전자형과 기존의 IA 유전자형에 의한 간염의 차이가 거의 알려진 바 없다. 따라서 대전 지역에서 발생한 급성 A형 간염의 유전자형에 따른 차이를 알고자 한다.
방법:
2009년 11월부터 2010년 6월까지 급성 A형 간염으로 진단되면서 유전자형이 확인된 81명의 환자를 대상으로 임상적 소견들과 검사실 소견들을 전향적으로 연구하였다.
결과:
평균 나이는 32.6 ± 7.4세이며, 평균 입원 기간은 7.7 ± 2.4일이었다. 직업은 서비스직, 사무직 그리고 교육직이 가장 많았다. 유전자형 간의 급성 간염에 따른 증상들의 종류는 별다른 차이가 없었다. 유전자형에 따른 증상의 빈도는 IIIA 유전자형에서 구토와 설사가, IA 유전자형에서는 복통과 피부 반점이 상대적으로 많았다. 검사실 소견에서는 IIIA 유전자형에서 헤모글로빈의 평균, CRP 평균, AST 최대 수치 평균은 상대적으로 유의하게 높았다. 그리고 AST와 ALT 및 총 빌리루빈 최대 수치들과 INR의 수치가 IIIA 유전자형에서 상대적으로 높게 분포하는 경향을 보였다.
결론:
대전 지역에서 유행하는 급성 A형 간염에서 IIIA 유전자형에 따른 급성 간염은 기존의 IA 유전자형과 차이가 있을 것으로 보이며, 다기관 연구를 통한 심도 깊은 연구가 필요하겠다.
Trans Abstract
Background/Aims:
Acute viral hepatitis A is a major health problem in Korea and the influx of genotype IIIA is thought to be one reason. We examined the differences in the clinical characteristics and laboratory findings of genotypes IA and IIIA in Daejeon.
Methods:
From November 2009 to June 2010, 81 patients positive for IgM anti-HAV were enrolled prospectively. The hepatitis A was genotyped using real-time polymerase chain reaction. The clinical characteristics and laboratory results were compared on the basis of genotype.
Results:
The mean patient age was 32.6 ± 7.4 years. The mean hospitalization was 7.7 ± 2.4 days. The patient occupation varied. Clinically, vomiting and diarrhea were relatively more prevalent in genotype IIIA than in IA. Abdominal pain and skin spots were relatively more prevalent in genotype IA than in IIIA. The hemoglobin, peak aspartate aminotransferase (AST) level, and C-reactive protein were statistically higher in genotype IIIA than in IA. The distributions of the peak AST, alanine aminotransferase (ALT) and total bilirubin values tended to be perched in genotype IIIA than in IA. The international normalized ratio (INR) tended to be slightly prolonged in genotype IIIA than in IA.
Conclusions:
Recently, genotype IIIA of acute viral hepatitis A has become prevalent in Daejeon. Hepatitis A genotype IIIA probably causes worse laboratory abnormalities than genotype IA. (Korean J Med 2011;80:553-561)
서 론
급성 A형 간염은 전세계적으로 유행하는 전염성 질환 중 하나이다[1]. 소아는 대부분 불현성 감염을 보이고, 성인은 주로 젊은 층에서 피로감, 구역, 구토, 근육통 등의 상기도 감염 유사 증상을 약 80%에서 보이며 합병증 없이 대부분 회복되지만[2,3], 드물게 만성 간염이나 전격성 간염으로 진행하기도 한다[4,5]. 국내에서는 1996년부터 집단 발병이 보고되었고[6], 2002년부터 그 수가 급속히 발병률이 증가하여 현재는 급성 바이러스간염의 원인의 대부분을 차지하는데[7], 위생환경과 사회경제적 수준의 향상으로 젊은 연령층에서 A형 간염 항체 양성률이 감소하면서 현증 A형 간염이 증가한 것으로 이를 설명할 수 있다[8]. 유전자형을 살펴볼 때 A형 간염의 7개의 유전자형 중에서 I유전자형의 아형인 IA 유전자형만이 국내에서 2000년 초까지 보고되었고[9], 2004년부터 2008년까지 IA와 IIIA 유전자형이 공존하던 중[10], 2009년에는 95%까지 IIIA 유전자형이 확인된다는 보고가 있다[11]. 이것은 과거에 IA 유전자형이 A형 간염을 유발하였으나, 외부에서 유입된 IIIA 유전자형이 IA 유전자형과 공존하다가, 최근에는 IIIA 유전자형으로 인해 급성 A형 간염 발병률이 급격히 늘어나는 것으로 보고 있다[10]. 그런데 바이러스성 간염들 중 B형 간염은 HBeAg의 혈청 전환율, precore/core region의 돌연변이, 간질환의 중증 정도, 인터페론(interferon) 치료 반응이 유전자형에 따라 차이가 있는 것으로 보이고, C형 간염은 2와 3 유전자형, 1과 4 유전자형에 따라 치료 반응에 차이를 보인다[12,13]. 하지만 A형 간염의 경우, 나이, 과도한 음주, 동반된 만성 B형 간염 등이 심한 간염을 일으킬 수 있는 인자들로서 알려졌을 뿐이며[14], 2000년대 초반에는 IA 유전자형이 서해안 지역과 대도시에서 유행하였으나[3] IIIA 유전자형이 전국적인 발병을 일으키는 것으로 보이는 현재의 임상 환경에서[11,15], 급성 A형 간염 환자들은 혈청 IgM 혹은 PCR에서 진단받고 대부분 대증적 치료를 받을 뿐, 유전자형에 따른 임상적 차이에 대해 접근을 시도한 연구는 거의 없다. 따라서 본 연구에서는 대전 지역에서 급성 A형 간염으로 내원한 환자들의 유전자형을 확인하고 유전자형에 따른 차이를 알아보고자 시행하였다.
대상 및 방법
2009년 11월부터 2010년 6월까지 IgM anti-HAV가 양성인 A형 간염 환자 110명을 대상으로 동의를 얻어 전향적으로 연구하였다. 이들 중 유전자형이 확인된 81명을 대상으로 성별, 나이, 주거지, 역학, 입원 전의 전구 증상과 퇴원할 때까지의 증상 등은 설문지 및 임상 관찰로 확인하고, 입원 기간, 검사실 자료, 간 영상학적 검사 등은 입원 기간 동안 작성한 의무 기록을 이용하였다. 급성 A형 간염의 진단은 IgM anti-HAV (ADVIA Centaur CP Immunoassay System, Siemens, Munich, Deutsch)이 양성인 것으로 정의하였으며 급성 A형 간염에 대한 유전자형(Real-Time PCR Cycler Thermal Block, Exicycler 96, Bioneer, Daejeon, Korea)을 확인하였다. 그리고 B형 간염과 C형 간염은 각각 HBsAg (ADVIA Centaur CP Immunoassay System), anti-HBsAb (ADVIA Centaur CP Immunoassay System), anti-HCV (ADVIA Centaur CP Immunoassay System)를 확인하였다.
통계는 SPSS (version 18.0, SPSS Inc., Chicago, IL, USA)를 이용하여 연속변수의 수치는 평균 ± 표준편차로 표시하였고, 연속변수의 비교에는 independent t test를 이용하였다. 그리고 모든 분석에서 p 값이 0.05 미만인 것을 유의한 것으로 정의하였다.
결 과
환자의 특징
총 81명의 환자들 중 남자는 51명, 여자는 30명이었고, 평균 나이는 32.6 ± 7.4 (17-50)이었다. 10대 2명, 20대 24명, 30대 40명, 40대 14명, 50대 1명이었다. 환자들의 평균 입원 기간은 7.7 ± 2.4일이었으며, 합병증 없이 모두 회복하였다. 직업은 서비스직 18명(22.2%), 사무직 12명(14.8%), 교육직 11명(13.8%), 무직 9명(1.1%), 학생 8명(9.9%)의 순서로 흔하였으며, 요리사, 연구, 건설, 관리, 금융, 기계설비, 의료관련, 스포츠, 예술, 연예, 전기공학, 기술공학 그리고 종교 등이 있었다. 내원 당시 다른 동반 질환으로는 심방 세동 1명(1.2%), 고혈압 2명(2.5%), 고지혈증 1명(1.2%), 폐렴 1명(1.2%), 지방간 5명(6.2%), 통풍 1명(1.2%), 당뇨 1명(1.2%)이었다. 만성 B형 간염 4명, 만성 C형 간염 1명이었으며, 급성 A형 간염과 연관되어 간기능이 악화되지 않았다(Table 1). 모든 환자들은 급성 A형 간염에 대한 예방 접종을 받은 적이 없었다. 그리고 내원 당시 급성 담도염이 동반된 1명이 있었으며, 응급으로 내시경적 췌담도술을 시행 받고 합병증 없이 호전되었다.
지역 분포
직장에 따른 생활권을 중심으로 분류하였을 때, 대전 서구 30명(37%), 대전 유성구 16명(20%)으로 대부분을 차지하였으며 대전 대덕구, 중구, 동구, 충남 공주시, 충남 계룡시, 충남 아산시, 충남 청주시, 충남 금산군, 충남 부여군, 충남 서산군, 충남 청원군, 전북 군산시 그리고 서울이 있었다.
발생 시기는 유전자형에 상관없이 2009년 11월 3명(5%), 12월 14명(17%)이었다. 그리고 2010년 1월 8명(10%), 2월 5명(6%), 3월 10명(12%), 4월 10명(12%), 5월 21명(26%), 6월 10명(12%)이었다.
임상양상
급성 A형 간염 환자들에게 나타난 증상들은 황달(59%), 식욕 부진(97%), 메스꺼움(93%), 구토(75%), 설사(26%), 짙어진 소변 색깔(95%), 발열(96%), 무력감(96%), 복통(68%), 관절통(70%), 피부 반점(20%) 등으로 식욕 부진, 메스꺼움, 짙어진 소변 색깔, 발열, 무력감 등이 가장 흔한 증상이었다. 유전자형에 따른 증상의 빈도를 살펴볼 때, IIIA 유전자형은 발열(98.3%), 식욕 부진(96.7%), 무력감(96.7%), 메스꺼움(95.0%), 짙어진 소변 색깔(93.3%) 등의 빈도를 보이며 구토와 설사가 IA 유전자형에 비해 차지하는 비율이 상대적으로 높았다. IA 유전자형은 식욕 부진(100%), 짙어진 소견 색깔(100%), 무력감(95.2%), 발열(90.5%), 복통(92.5%) 등의 빈도를 보이며 복통과 피부 반점이 IIIA 유전자형에 비해 차지하는 비율이 상대적으로 높았다(Table 2).
검사실 소견
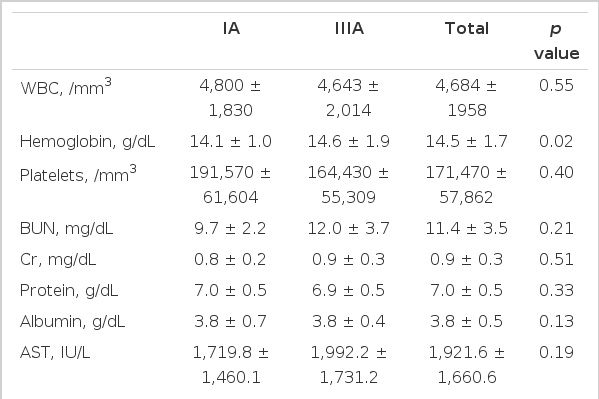
입원 당시 혈액 검사들의 평균 수치는 백혈구 4,684 ± 1,958 (1,090-10,380)/mm3, 림프구 1,522 ± 1,241 (211-6,598)/mm3 혹은 30 ± 13 (6-70)%, 혈색소(hemoglobin, Hb) 14.5 ± 1.7 (8.8-18.7) g/dL, 혈소판(platelet) 171,470 ± 57,862 (32,000-326,000)/mm3, 혈중 요소 질소(blood urea nitrogen, BUN) 11.4 ± 3.5 (5-26) mg/dL, 크레아티닌(creatinine, Cr) 0.87 ± 0.26 (0.6-2.6) mg/dL, 혈중 총단백질(total protein) 7.0 ± 0.5 (5.4-8.2) g/dL, 혈중 알부민(albumin) 3.88 ± 0.5 (2.8-6.1) g/dL, 혈중 아스파르테이트 아미노전이효소(aspartate aminotransferase, AST) 1921.6 ± 1660.6 (11-6946) IU/L, 혈중 알라닌 아미노전이효소(alanin aminotransferase, ALT) 2177.5 ± 1611.4 (91-6539) IU/L, 알칼리성 인산분해효소(alkaline phosphatase, ALP) 179.6 ± 79.7 (41-371) IU/L, 감마-글루타밀전이효소(gamma(γ)-glutamyl transferase, GGT) 352.3 ± 205.6 (10-957) IU/L, 총 빌리루빈(total bilirubin) 3.2 ± 2.6 (0.5-14.9) mg/dL, 젖산탈수소효소(lactate dehydrogenase, LDH) 2159.9 ± 1776.5 (338-8234) IU/L이었다. 그리고 AST 최고값의 평균은 2828.8 ± 2297.7 (98-10236), ALT 최고값의 평균은 2825.3 ± 1507.8 (312-6539) IU/L, ALP 최고값의 평균은 215.5 ± 85.1 (9-499) IU/L, GGT 최고값의 평균은 254.3 ± 275.5 (9-921) IU/L, 총 빌리루빈 최고값의 평균은 5.6 ± 3.4 (0.9-17.7) mg/dL이었다. 그 밖에 프로트롬빈 시간(prothrombin time, PT)의 국제 정상화 비율(internal normalized ratio, INR) 1.27 ± 0.27 (0.92-2.28), C 반응성 단백 시험(C-reactive protein, CRP) 1.9 ± 1.6 (0.26-7.26) mg/dL이었다(Table 3).
나이, 백혈구 수, 혈소판, 혈중 요소, 크레아티닌, 혈중 총 단백질, 혈중 알부민, AST, ALT, ALP, GGT, 총 빌리루빈 등은 유전자형에 따른 차이를 보이지 않았으나, 헤모글로빈의 평균은 각각 정상 범위 내에서 유의한 차이를 보였다(Table 3). 그리고 ALT 최대 수치 평균, ALP 최대 수치 평균, 총 빌리루빈 최대 수치 평균, INR 평균 및 입원 기간 평균은 유의한 차이를 보이지 않았으나, AST 최대 수치 평균과 CRP 평균은 유의한 차이를 보였다(Table 3). AST 최대 수치, ALT 최대 수치, 총 빌리루빈 최대 수치 그리고 INR를 유전자형에 따른 분포를 살펴보았을 때, IIIA 유전자형에서 수치들이 더 높게 분포하는 경향을 보였다(Fig. 1).
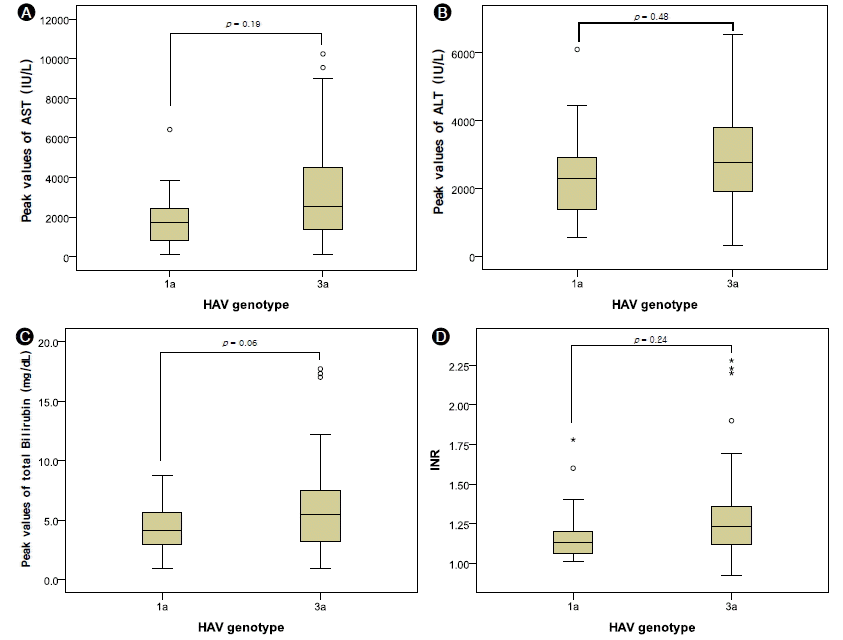
The distributions of the laboratory values in genotypes IA and IIIA: (A) peak aspartate aminotransferase level, (B) peak alanine aminotransferase level, (C) peak total bilirubin, (D) peak international normalized ratio. In the box-plot, the box comprises 50% of the data. The thick vertical line indicates the median and the inner and outer fences show the interquartile ranges. Asterisks are outlying values and circles extreme outliers. The p values are described in each box. AST, aspartate aminotransferase; ALT, alanine aminotransferase; INR, internal normalized ratio.
간초음파 혹은 복부 전산화 단층 촬영에서 급성 간염 소견은 25명, 지방간 소견은 7명, 특이 사항이 없는 경우가 16명이었고 나머지 33명은 검사를 하지 않았다.
81명의 대상자 중 10명은 IgM anti-HAV이 입원 당시에는 음성으로 나왔으나, 약 3일 뒤에 재검한 IgM anti-HAV가 양성이었으며 이들 중 9명은 IIIA 유전자형이었고, 1명은 IA 유전자형이었다. IgM anti-HAV가 입원 당시 음성이었다가 3일 후 다시 검사하여 양성이 나온 경우는 다른 조건들의 유의한 차이를 발견할 수 없었다.
고 찰
A형 간염 바이러스는 크기가 27-28 nm인 non-enveloped positive strand RNA 바이러스이며 Picornaviridae과 Hepatovirus 속에 속한다[16]. 7개의 유전자형을 가진 A형 간염 바이러스들 중 I, II, III, IV 네 가지 유전자형이 사람에서 발견되는데[17], 전세계적으로 널리 퍼진 I유전자형의 아형인 IA 유전자형은 주로 북아메리카, 유럽, 중국, 일본과 태국 등에서 발견되며[17], IIIA 유전자형은 인도, 스리랑카, 네팔, 말레이시아와 미국에서 발견된다[18]. 이들 유전자형 간의 염기 서열 차이는 15-20% 내외이고, 아유전자형 간의 염기 서열 차이는 7.5% 미만이면서 염기 서열의 변화가 거의 없어 A형 간염의 유입에 관한 조사에 도움이 된다[17]. 국내에서 2001년까지는 A형 간염에 의한 집단 감염의 바이러스 염기 서열 분석에서 모두 IA 유전자형이었지만[9,19], 최근의 집단 발병 사례들에서는 IIIA 유전자형이 많아 외국에서 유입된 A형 간염 바이러스에 의한 것으로 보고 있다[10,20].
A형 간염의 유병률은 경제적인 상태와 연관된 위생 환경이 영향을 미친다고 한다[16,21]. 국내에서는 경제발전에 따른 주거 환경으로 인해 1990년대를 기준으로 자연 면역에 따른 항체 보유율 젊은 층에서 낮아지는 경향을 보이고[22,23], 이것은 1996년부터 급성 A형 간염의 집단 발병 사례들이 보고되는 현상과 높은 관련성을 보이며, 발병 사례의 급격한 증가로 인해 2000년부터 현재까지 법정 전염병으로 지정되어 있다[6,7,24,25]. 발생 지역은 2003년에는 경인, 충남 및 호남지역의 서해안 지방인 것으로 알려졌으나, 2006년의 조사에서는 내륙으로 확산되는 경향을 보였다[15]. 이는 2000년 초에 IA 유전자형만 발견되었다가 최근에는 IIIA 유전자형의 비중이 높아지는 것을 고려할 때[9-11,19,20,26], IA 유전자형이 서해안 지역과 대도시에 유행을 일으켰지만, 현재는 IIIA 유전자형이 전국적 유행을 일으키는 것으로 추정된다.
A형 간염의 전염 방식은 사람 간의 접촉이나 오염된 음료와 음식을 섭취하는 과정인 분변-경구 경로이며[16], 드물게 수혈을 통해 감염되기도 한다[27]. A형 간염의 잠복기는 15-50일이므로 감염 사실을 알기 전에 전파가 된다. 또한 대부분의 환자들이 회와 같은 어패류나 끓인 물 혹은 정수된 물을 섭취한 것을 기억하지 못하며, 주변 사람의 여행력을 일일이 확인할 수 없으므로 결과적으로 전파 경로를 구체적으로 알 수 없으며 본 연구에서도 같은 상황이었다.
A형 간염의 진단은 대개 혈청에서 A형 간염 바이러스 혈증에 따라 생성된 IgM을 확인하는 것이다[28]. 바이러스 혈증은 분변으로 전파된다고 하여 분변에서 A형 간염 바이러스의 RNA를 검출하는 방법이 있지만, 검체의 채취와 보관 및 방법이 번거롭고 어렵다. 또한 감염 초기에 A형 간염에 대한 IgG의 역가가 상대적으로 높으면 IgM이 검출이 되지 않아 가음성이 나오기도 하며 대략 3일 뒤에 다시 검사하여 IgM이 양성임을 확인하기도 한다[29,30]. 하지만 현재는 역전사-중화효소 연쇄반응법(revert transcription polymerase chain reaction, RT-PCR)을 이용하면 IgM이 음성이 나오더라도 A형 간염을 진단할 수 있다[31].
환자들은 급성 A형 간염에 따른 증상으로 피로감, 구역, 구토, 근육통 등의 상기도 감염 증상을 주로 호소하지만, 이러한 증상들은 대개 1-2주 안에 호전된다[3]. 본 연구에서는 유전자형에 따른 입원 기간은 차이가 없었다. 그리고 전구 증상을 포함한 임상 증상들의 종류는 차이가 없었으며, 각각의 임상 증상들의 빈도의 차이는 크게 두드러지지 않았다. 또한 검사실 소견 평균값의 대부분은 유전자형 간에 유의한 차이를 보이지 않았으며, 차이가 있더라도 정상 범위이거나 수치가 낮아 의미가 없을 것으로 보인다. 또한 AST 최대 수치들의 평균값이 유전자형에 따라 유의한 차이를 보이지만, IA 유전자형의 수가 적어 단정하기는 어려울 것으로 본다. 그리고 AST, ALT, 총 빌리루빈 등의 최대 수치의 분포와 INR의 수치 분포가 IIIA 유전자형에서 좀 더 높게 분포하는 경향은 급성 A형 간염에서 IIIA 유전자형이 IA 유전자형보다 간염을 더 심하게 일으키는 것 같다는 의문을 갖게 한다.
급성 A형 간염으로 입원하였을 때 혈소판 감소증이 있는 경우 증상이 더 심하고 회복 기간이 더 길다는 보고가 있다[32]. 본 연구에서는 150,000/mm3 미만을 혈소판 감소증이 있다고 정의하였을 때, 아유전자형에 관계없이 혈소판 감소증이 있는 29명(36%)과 혈소판 감소증이 없는 52명(64%) 간에 입원 기간은 유의한 차이를 보이지 않았다. 하지만, 혈소판 감소증이 있는 29명 중 IIIA 유전자형(24명, 83%)의 비중이 IA 유전자형(5명, 17%)보다 높았으며, 유의한 차이는 없더라도 혈소판 감소증에 상관없이 IIIA 유전자형에서 혈소판 평균 수치가 다소 낮았으므로 IIIA 유전자형이 더 심한 간염을 일으킬 수 있다는 것과 연관 지어 볼 수도 있다.
급성 A형 간염으로 인한 합병증으로 일부에서 전격성 간부전이나 지속성 또는 재발성 간염, 담즙 정체성 간염, 급성 신부전, 급성 췌장염, 급성 담낭염 등이 발생하기도 하는데, 최근에는 이 합병증들이 이전과 달리 조금 증가하는 것으로 보이므로[3], 현재 유행하는 IIIA 유전자형과 연관된 것인지에 대해 추가적인 연구가 필요하겠다. 본 연구에서는 급성 A형 간염에 따른 합병증이 발생하지 않고 모두 호전되어 사회로 복귀하였고, 퇴원 후 약 3주 뒤에 전화 문의나 외래 방문을 통해서 간염의 재발이나 합병증이 없는 것을 확인하여 유전자형에 따른 합병증 여부와 빈도의 차이를 확인할 수 없었다.
A형 간염 바이러스는 대부분의 성인에게 현증 간염을 일으키므로 사회 활동을 방해하여 사회 경제적 손실을 일으킨다. 면역 글로불린을 사용하면 증상을 감소시키고 유병 기간을 단축시킬 수 있지만[33], 감염 후에 사용할 수 있는 효과적인 치료제는 없다. IIIA 유전자형에 의한 급성 간염이 크게 증가하였으나, 현재 사회 활동을 하는 세대의 항체 양성률이 매우 낮아 사회 경제적 손실이 발생하게 된다. 따라서 A형 간염 백신을 통해 예방하는 것이 중요하며, 이 백신만으로 모든 종류의 유전자형에 대한 예방을 할 수 있다[34]. 또한 A형 간염이 중복될 경우 예후가 좋지 않을 수 있는 고령의 노인과 음주, B형 간염과 C형 간염을 포함한 만성 간질환 등의 환자와[3] 감염에 취약한 혈우병 환자 및 노출이 잦은 의료인에게도 적극 고려할 필요가 있다.
본 연구에서는 대상자들이 50세 이하이고 기저 질환을 거의 갖고 있지 않으며 급성 간염에 따른 급성 신부전이나 전격성 간염 등과 합병증은 없었기 때문에 급성 A형 간염에 따른 경과나 합병증에 영향을 줄 수 있는 다른 요인들을 확인할 수 없었다. 또한 IA 유전자형의 수가 IIIA 유전자형에 비해 상대적으로 적은 것도 단점으로 지적될 수 있다. 하지만, 급성 A형 간염으로 입원한 환자들을 대상으로 유전자형에 따른 차이가 있는지 알아보고자 시행한 본 연구에서 임상 경과에서는 유전자형에 따라 두드러진 차이를 보이지 않지만, AST, ALT, 총 빌리루빈 등의 최대 수치 및 INR의 수치가 IIIA 유전자형에서 높게 분포하는 경향을 주목할 필요가 있다. 외국에서 유입된 IIIA 유전자형은 기존의 IA 유전자형 간에 차이가 있을 것으로 보이므로, 다기관 연구를 통해 유전자형과 임상 상태와 검사실 소견에 대한 심도 깊은 연구가 필요할 것으로 본다.