서 론
과민성장증후군(Irritable bowel syndrome, IBS)은 기질적인 이상 없이 배변 습관의 변화를 동반한 복통 및 복부 불편감을 특징으로 하는 기능성 위장관 질환이다[1-3]. 이는 가장 흔한 위장관 질환 중의 하나로 그 유병률은 미국 인구에서 10-22%, 아시아 인구에서 5-10%로 보고되고 있다[2]. IBS 환자들은 장 증상으로 인해 일상생활에서 불편을 많이 겪을 뿐 아니라 질병이 다른 기질적 질환을 제외한 후 진단되고 질병 자체를 입증할 수 있는 생체징후가 없어 IBS라는 진단에 대해 만족하지 않거나 이해가 부족한 경우가 종종 있다. 또한 증상이 악화와 호전을 반복하고 효과적인 약물 치료가 없어 치료에 만족하지 못하고 지속적으로 의료 기관을 이용하여 높은 사회 경제적 비용을 발생시키는데[3], 이는 일부 질병의 원인과 병태생리의 불명확성에 기인한다. 제한적이지만 과민성장증후군의 원인 및 병태생리에 대해서 다양한 가설이 제시되고 연구가 진행되어 왔다. 본 고찰에서는 국내에서 최근까지 보고된 IBS의 발생기전에 관한 연구를 정리하고, 최근 중요한 병태생리의 하나로 알려진 뇌-장관 상호작용 및 유전 관련 자료에 관한 연구결과와 함께 IBS의 진단체계를 고찰하고자 하였다.
병태생리
내장 과민성(visceral hypersensitivity)
이제까지 가장 잘 알려진 병태생리의 하나로 바로스타트를 이용한 풍선확장법 연구에 의하면 IBS 환자의 상당수가 풍선 확장 시 정상인에 비해 적은 부피나 압력에서 불편감을 느낀다고 알려져 있다. 즉, 자극에 대한 직장의 내장 민감도가 증가해 있는 내장 과민성(hypersensitivity)이 특징으로, 좌측대장 혹은 직장의 통증에 대한 감각 역치가 의미있게 낮아져 있다. 국내에서도 활발한 연구가 진행되어 있는데(Table 1), 내장 과민성은 과민성장증후군의 아형에 따라 달리 나타나는데, 주로 설사우세형에서 나타나는 것으로 알려져 있으나[4-11], 변비형 아형에서도 보고된 바 있다[8]. 내장 과민성은 과민성장증후군의 모든 환자에서 나타나는 것은 아니고 대체적으로 약 반수정도 나타나는데, 남녀 간 성 차이에 따라 달라서 여성에서 직장 확장 시 불편감 역치가 유의하게 낮았다는 연구가 있으나 아직까지 국내 자료는 미흡한 실정이다. 내장 과민성의 유발인자로서 심리적 스트레스, 장관의 염증 등이 알려진 인자이다. 과민성장증후군에서 위 장관을 조절하는 자율신경계는 감정상태, 우울증이나 불안증에 의해 영향을 받는다고 알려져 있다. 직장 풍선을 확장하는 동안 과민성장증후군 환자에서 β-adrenergic receptor 민감도를 측정한 결과, 대조군과 유의한 차이가 있었고 우울 증상 정도와 유의한 상관관계가 있었다[5].
뇌-장관 상호작용(brain-gut interaction)
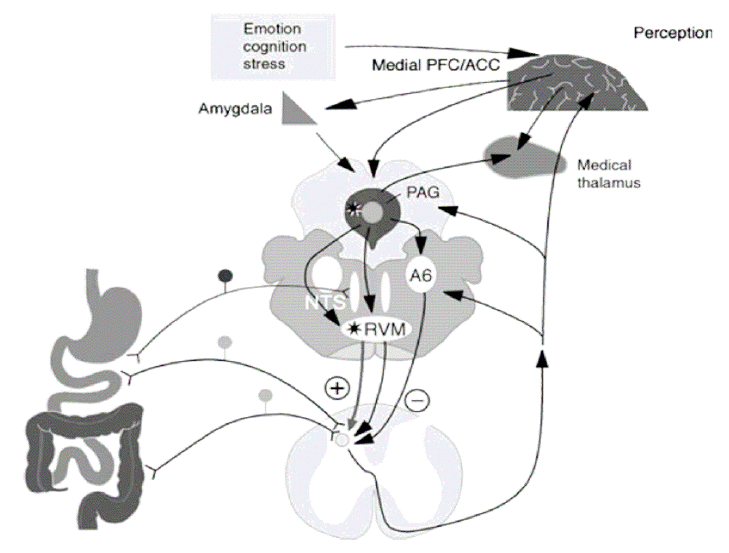
뇌-장관 상호작용은 건강한 사람들과 환자 모두에서 중요한 작용을 한다. 이는 건강한 사람들에서 장내 면역 체계를 조절하며 신체적 혹은 심리적인 상태에 따라 위장관 운동을 조화롭게 조절하는 역할을 한다[12]. 위 장관은 구심성 신경인 구심성 척수신경과 구심성 미주신경의 이중 신경 구조를 통해 중추신경계로 신호을 전달하고, 이러한 신경의 전달은 원심성 신호전달 체계를 통해 위 장관의 운동기능이나 장내 면역체계 등에 변화를 일으켜 결과적으로 다양한 기능성 위장관 질환을 유발한다.
위 장관은 자체적인 신경 체계를 통해 자율적으로 기본적인 위장관 운동기능, 분비기능 및 혈류 등을 조절하는 신경 조절 시스템을 유지한다[12]. 개체 내에서 항상성 유지를 위해 위장관 신경계는 중추 신경계와도 지속적인 상호 신호 전달 체계를 유지하며, 구심성 신경섬유가 내장 감각을 중추신경계로 전달하고 이에 따라 감정, 통증, 면역 반응 등이 나타나게 되면서 항상성을 유지하게 된다[12]. 또한 반대로 감정 상태의 변화나 환경의 변화를 시작으로 뇌 피질-변연계에서 위 장관으로 하행성 신호를 보내어 위 장관 증상을 유발하기도 한다. 과민성장증후군에서는 이러한 신경 체계 조절의 이상, 장 운동성의 변화, 내장 감각의 감각능의 항진이 특징이다[12-14]. 이러한 신경 연결망에 주로 작용하는 대표적인 신경전달 물질이 세로토닌(serotonin, 5-hydroxytryptamine, 5-HT)으로, 위 장관에 주로 작용하는 5-HT 수용체는 5-HT3, 5-HT4 수용체 등이다. 이외에도 CCK antagonist, opioid agonist, NK antagonist 등 여러 신경전달 물질이 관여하며 이를 표적으로 하는 약제들이 치료에 점차 사용되고 있다(Fig. 1) [15].
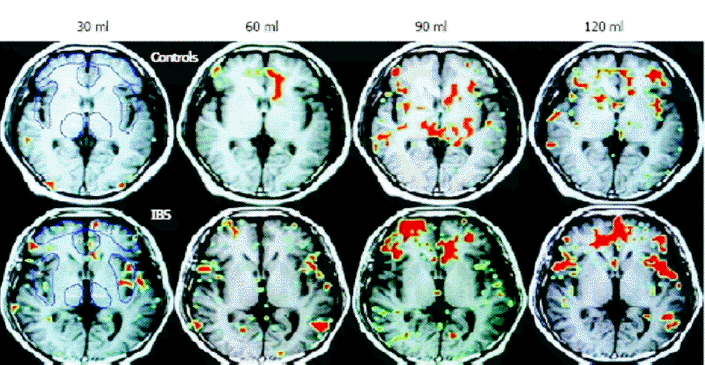
최근 들어 과민성장증후군의 병태생리 중 부적절한 뇌-장관 상호작용과 관련하여 자기공명촬영술이나 기능성 뇌 자기공명 영상(functional brain MRI)에 대한 연구들이 많이 시행되고 있다. 그중 기능성 뇌 자기공명 영상은 국소적인 뇌 혈류의 변화를 측정하는 데 유용한 도구로, 국소적인 대사 작용의 변화를 반영할 수 있어 내장 자극에 의한 국소적인 뇌 혈류의 변화를 측정하는데에 여러 연구에서 사용되었다[13,14]. 이들 연구에서는 내장 감각의 항진을 과민성 장증후군의 주된 병태생리로 생각하여 장에 가해지는 자극에 따라 발생하는 뇌 신호가 과민성장증후군 환자와 정상인에서 차이를 보일 것이라고 생각하였다. 이들은 직장에 풍선을 이용하여 순응도(compliance)를 측정하는 방법으로 장관을 자극하고, 이에 따라 뇌에서 발생하는 신호를 감지하여 그 정도를 정상인과 비교하였다[13,14]. 과민성장증후군 환자에서 직장 자극에 대하여 통증을 감지하는 부분인 anterior cingulate, prefrontal insular cortex, thalamus 모두에서 대조군에 비해 신호가 증가되는 것을 관찰할 수 있었고, 특히 anterior cingulated cortex에서 대조군에 비해 높은 신호증강이 발생하였다[13]. Yuan 등[14]의 연구에 의하면 120 mL의 풍선 확장 자극에 의해 대조군에 비해 과민성장증후군 환자의 anterior cingulate, prefrontal insular cortex, thalamus 모두에서 뚜렷한 신호 증가를 보였다. 이들은 모두 통증성 자극과 비 통증성 자극에 대하여 정상인에 비하여 뇌의 통증을 감지하는 부분에서의 신호가 항진되어 있는 것을 확인하였다(Fig. 2) [14].
감염 후 과민성장증후군(post-infectious irritable bowel syndrome)
내장과민성은 과민성장증후군의 잘 알려진 병태생리로 점막 구심성 신경에 대한 말초성 감작과 외상수용체의 활성화가 중요한 인자이다. 점막 내 저 등급 염증으로 장에 분포하는 구심성 신경말단이 활성화되어 내장 과민성을 유발할 수 있는데, 감염 후 과민성장증후군은 이전에는 과민성장증후군이 없던 환자들에서 위장관 감염이 있은 후에 갑자기 과민성장증후군이 발생하는 것을 의미한다. 현재까지의 보고들에 의하면 급성 위장염을 겪은 환자들 중 3.6%에서 31.6%까지 감염 후 과민성장증후군이 발생하는 것으로 보인다[16]. 또 최근 메타분석에 의하면 급성 위장염을 겪은 환자들에서는 과민성장증후군이 발생할 확률이 7배 정도 높다[17]. 급성 감염 후 염증이 소실된 후에 발생하는 감염 후 과민성장증후군의 위험인자로는 설사의 기간, 여성 및 건강 염려증 등과 같은 정신 신경학적 요인 등이 알려져 있다. 국내에서도 급성 이질, 급성 장염, Clostridium difficile 감염 이후 발병한 감염 후 과민성장증후군이 보고되었고, 여성, 급성 염증기에 세균이 배양되거나 장염의 중증도가 심할수록 감염 후 과민성장증후군이 호발하였다[18-21]. 과민성장증후군 환자의 대장 전 층 조직검사에서 장근 신경총 및 근육층에 비만세포의 침윤이 관찰되었는데, 급성 이질 후 발생한 감염 후 과민성장증후군 환자의 대장내시경 생검 조직에서 5-HT를 포함한 Enterochromaffin (EC) cells, PYY를 포함한 EC cells, 점막 내 상피세포, CD3 림프구, CD8 림프구 및 비만세포 등이 대조군에 비해 유의하게 증가한 것을 보고하였다[22].
유전적 요인
과민성장증후군의 발생 원인으로 고려되는 것 중, 유전적인 요소에 대한 연구가 최근에 많이 진행되고 있다. 많은 연구들에서 과민성장증후군 환자의 가족 내에서 유병률이 더 높음을 확인하였고, 한 연구에서는 나이, 성별, 사회적 지위 등을 모두 짝지은 대조군에 비해 과민성장증후군 환자에서 뚜렷한 가족력이 있음을 확인하였으며(2% vs. 33%) [25], 또 다른 연구에서는 배우자의 친척들에 비하여 환자와 혈연 관계가 있는 친척에서 유병률이 유의하게 높았다(7% vs. 17%) [26]. 일란성 쌍둥이 연구는 환경과 유전의 영향을 비교하는 고전적인 방법으로서, 1998년과 2001년에 각각 이루어진 연구에서 이란성 쌍둥이에 비교하여 일란성 쌍둥이에서 과민성장증후군의 일치율이 더 높은 것을 확인하였다[27,28]. Morris 등[27]에 의하면 이란성 쌍둥이보다 일란성 쌍둥이에서 같은 위장관 증상을 가질 확률이 높았으며(33.3% vs. 13.3%), Levy 등[28]에 의해 이루어진 연구에서도 일란성 쌍둥이에서 일치율이 유의하게 높았다(17.2% vs. 8.4%). 이 연구에서는 그 어머니가 과민성장증후군을 가진 경우와 그렇지 않은 경우를 비교하였고, 일란성 쌍둥이와 이란성 쌍둥이 모두에서 어머니가 과민성장증후군을 가진 경우가 더 높은 발생률(일란성 쌍둥이, 17.1% vs. 6.7%; 이란성 쌍둥이, 15.2% vs. 6.7%)을 보여, 유전적인 요소 외에 양육 등 환경적인 요소가 발생에 함께 작용한다는 점을 시사했다. 이러한 유전적인 요소들과 관련하여 최근까지 밝혀진 과민성장증후군의 발현과 관련된 유전자에는 serotonin transporter, 5-HT2A receptor, norepinephrine transporter, IL-10 등이 있으며 여러 연구들에 의해 이와 관련된 유전적 다형성이 밝혀져 있다[29].
국내 자료를 살펴보면, Park 등[30]은 뇌-장관 상호작용에 영향을 줄 수 있는 내인성 물질로 cholecystokinin (CCK)의 유전적 다형성이 과민성장증후군과 연관된다고 보고하였다. CCK1 receptor intron 1 779 T > C polymorphic type은 변비 우세형 및 혼합형 과민성장증후군에서 유의하게 흔히 관찰되어 교차비가 2.43 (95% 신뢰구간 1.01-5.86)이었다.
진 단
과민성장증후군은 유사한 증상을 유발할 수 있는 대장암이나 염증성 장질환과 같은 기질적 질환을 배제한 후 특징적인 증상에 기반하여 진단한다. 직장출혈, 체중감소, 빈혈, 50세 이상의 고령에서 증상이 시작되었을 때, 혹은 대장암이나 염증성 장질환 등의 가족력이 있을 때에는 기질적 질환의 동반 여부를 확인해야 하나 진단의 민감도나 특이도는 낮다. 또한 기질적 질환의 동반 여부를 확인하기 위해 진단 당시에 여러 가지 생화학적 검사나 내시경, 소장내 세균과증식을 확인하기 위한 수소호기검사 등이 이루어지고 있으나 현재까지 선별 검사로 그 유용성이 인정된 것은 일반혈액검사와 C 반응 단백 정도이다[32].
과민성장증후군은 진단을 위한 생물학적 표지자가 없기 때문에 기질적 질환을 배제한 후 특징적인 증상에 근거하여 기준을 만들어 진단과정을 표준화하려는 노력이 이루어져 왔으며 대표적인 진단 기준으로 manning 기준, 로마 I, II, III 기준이 있다(Table 2) [1].
로마 기준은 1988년 다국적 실행위원회(multinational working team committee)가 로마에서 열린 국제소화기병학회에서 기능성 위장관 질환의 진단기준을 만들었기 때문에 붙여진 이름이다. 지난 22년간 총 3차례의 개정이 있었으며, 로마 III 기준이 가장 최근인 2006년에 발표되었다. 개정된 로마기준은 주로는 증상의 회상 기간(recall time)이 지난 12개월에서 최근 3개월간의 증상을 질문함으로써 그 신뢰도를 높이고자 하였으며, 새로 개정된 로마기준 III를 이용한 연구가 보고되고 있다. 국내에서 로마기준 II와 III를 동시에 실시한 인구기반 연구를 살펴보면, 같은 연구자가 동일한 방법으로 15세 이상 성인 남녀 1,009명을 대상으로 로마기준 II와 III에 해당하는 전화설문을 실시한 결과, 로마기준 II를 적용한 IBS 유병률은 남자 6.4%, 여자 9.6%였으나 성별에 따른 통계적인 차이는 없었고, 로마기준 III에 의해서는 여성이 11.0%, 남성이 7.0%로, 로마기준 III를 적용하면 로마기준 II에 비해 유병률이 높고 유의하게 여성에서 호발했다(p= 0.025) [33,34].
저자들은 이전의 연구에 비해 로마기준 III를 적용한 최근 연구에서 IBS가 여성에서 뚜렷하게 호발하는 것이 여성에서 직업의 변화와 연관될 수 있다고 제시하였는데, 실제로 가정주부의 비율이 줄고(64.5% vs. 57.4%) 대신 직장생활을 하는 여성 인구가 7.1%로 증가하였다. 그러나 이는 진단기준의 변화로 인한 것인지 사회인구학적 특징에 변화에 의한 것인지 확실하지 않고, 국내외에서 로마기준 III에 대한 타당성(validation)에 대한 검증 자료는 매우 제한적이다.
결 론
과민성장증후군은 흔한 기능성 위장관 질환으로 그 원인과 병태생리가 아직까지 명확하게 밝혀지지 않았다. 현재까지 중요하게 생각되는 병태생리로는 내장 과민성, 뇌-장관 상호작용, 감염 후 과민성장증후군에서 관찰된 저등급 염증 혹은 미생물 환경 변화과 연관된 면역 이상반응, 유전 소인 등이 있으며 국내에서도 이에 대한 활발한 연구가 진행되어 왔다.
과민성장증후군은 환자의 증상 호소에 근거하여 진단하는 기능성 위장관 질환으로서 뚜렷한 생체 징후 없이 진단이 이루어지므로 이를 표준화하기 위한 노력이 지속되어 왔다. 2006년 로마 III가 개정된 이래로 이는 임상에서 실제로 적용되고 있으며, 다양한 연구를 근간으로 로마기준 III의 제한점에 대해서도 논의가 시작되고 있다. 향후 지속적인 연구를 통한 과민성장증후군의 병태생리에 대한 이해는 합리적인 진단과 치료의 근거가 될 것으로 기대한다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






