Paroxetine 복용 후 발생한 항이뇨호르몬 분비이상 증후군 1예
A case of syndrome of inappropriate secretion of antidiuretic hormone associated with paroxetine
Article information
Abstract
저자들은 우울증으로 paroxetine을 투여받은 후 전신 쇠약감과 저나트륨혈증이 발생한 환자에서 SIADH를 진단한 증례를 경험하여 국내 최초로 보고하는 바이다.
Trans Abstract
Paroxetine is a well‐known selective serotonin reuptake inhibitor, and has been reported to be advantageous for chronic pain control. Paroxetine is increasingly used for various types of chronic pain because of its safety; however, hyponatremia, or syndrome of inappropriate secretion of antidiuretic hormone (SIADH) associated with paroxetine, has been reported. This complication is relatively rare, but some patients have presented with severe neurological symptoms. Here, we report the first case of SIADH associated. (Korean J Med 79:710-713, 2010)
서 론
Paroxetine (Seroxat®, Paxil®)은 1992년에 최초로 소개된 약제로 신경 말단에서 세로토닌(serotonin)의 재흡수를 억제하여 항우울 작용을 나타낸다. 부작용과 독성이 비교적 적어 임상에서 흔히 사용되는 약제로 만성적인 통증을 치료하는 효과도 있어 최근 사용 빈도가 증가하는 추세이다1).
최근 해외에서 paroxetine에 의한 저나트륨혈증 및 SIADH의 발생이 보고되고 있으며2-4), 특히 고령의 환자에서 투여할 경우, 의식저하를 동반한 심각한 부작용이 있을 수 있어5,6) 주의를 요하나 아직까지 국내에서 이와 같은 합병증이 보고된 적은 없다.
저자들은 정신과에서 우울증 및 만성 통증으로 paroxetine을 투여받은 후, 전신 무기력증이 발생하여 내원한 환자가 SIADH로 진단된 증례를 경험하고 이를 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 강〇〇, 여자, 68세
주 소: 전신 무력감과 구토
현병력: 우울증으로 정신과 외래치료를 받던 환자가 내원 1주일 전부터 발생한 전신 무력감과 구토가 반복되어 응급실에 내원하였다. 환자는 방문 3주일 전에 주요 우울증으로 진단되어 본원 정신과에서 paroxetine 25 mg, alprazolam 1.5 mg을 투약받고 있던 상태였으며, 내원 1주 전부터 전신 무력감, 식욕 저하, 소화불량, 불면증 등이 발생하였다.
과거력: 12년 전 갑상샘저하증으로 진단받고 투약하다 내원 6개월 전부터 중지하였고, 10년 전부터 고혈압으로 진단되어 항고혈압제 Olmesartan 20 mg을 복용하였으나, 1개월 전부터 스스로 복용을 중지하였다.
신체검사 소견: 내원 당시 혈압 110/70 mmHg, 맥박 90회/분, 호흡수 20회/분, 체온 36.5℃였다. 신체검사에서 만성병색을 보였으며, 혀는 경한 정도의 탈수 소견이 있었으나, 피부감촉은 정상이었다. 흉부 청진상 호흡음은 정상이었고, 심잡음은 없었으며, 간, 비장, 신장 및 기타 복부에 촉지되는 종괴는 없었으며, 복수도 없었다. 두부에 이상소견은 없었으며, 경정맥 확장 소견은 관찰되지 않았다. 신경학적 검사에서 질문에 대한 반응이 감소된 소견이 관찰되었다.
검사실 소견: 말초혈액 백혈구는 5,300/mm3 (호중구 71%), 혈색소는 14.0 g/dL, 헤마토크릿치는 39.4%, 혈소판은 196,000 /mm3이었고, 동맥혈액가스검사는 pH 7.530, pCO2 24.1 mmHg, HCO3 19.9 mmol/L, pO2 73.3 mmHg이었다. 혈청 생화학 검사에서 BUN 7.9 mg/dL, Creatinine 0.89 mg/dL, total protein/albumin 6.4/3.9 g/dL, total bilirubin 1.98 mg/dL, AST/ ALT 26/19 IU/L, Na/K/Cl 103/4.0/66 mEq/L, uric acid 2.5 mg/dL, osmolality 215 mOsm/kg, glucose 98 mg/dL, LDH 360 IU/L, CPK 128 IU/L, 단순 요검사는 정상 소견이었고, 요화학검사에서 Uosm 361 mOsm/kg, urine Na 29 mEq/L, urine Cl 51 mEq/L로 측정되었다.
방사선학적 검사 소견: 흉부 X-선 검사에서 특이소견 관찰되지 않았다.
경과: 입원 초기, 저나트륨혈증의 원인이 환자의 우울증에서 기인된 식사량 감소로 진단하여, 정신과 처방약제를 투약하면서 식염수를 투여하며 치료하였다. 그러나 지속적인 수액 치료에도 불구하고, 혈중 나트륨 수치가 개선되지 않고, 환자의 반응상태가 개선되지 않아 저나트륨혈증의 원인에 대해 다시 접근하기로 하였다.
우선 혈액량 정상의 저장성 저나트륨혈증의 원인을 감별하기 위해 모든 약제를 중단하고, 갑상선 기능검사와 부신피질 자극호르몬 자극검사를 시행하였다. 갑상선 기능은 정상이었으며(TSH 1.01 mIU/L, Free T4 1.64 ng/dL), 급속 부신피질 자극검사는 cosyntropin 250 μg을 정맥으로 투여하였을 때, 혈청 알도스테론 반응은 정상이었으나, 혈청 코티솔 수치가 60분에 11.81 μg/dL로 자극되는 소견이 관찰되었다. 자세한 문진 결과, 환자는 스테로이드 계열의 소염 진통제를 복용한 과거력이 없었고, 혈청 ACTH 농도가 36.72 pg/mL (정상치: 0~71 pg/mL)으로 정상 소견을 보여, 뇌하수체 원인의 이차성 부신피질 기능저하증에 의한 저나트륨증을 감별하기 위해 안장(sella) MRI를 시행하였다. 안장 MRI에서는 우측 뇌하수체에 7 mm 정도로 약하게 조영 감소 소견이 있어 안장에 발생한 미세샘종이 의심되었다(그림 1). 그러나 확진을 위해 복합 뇌하수체 자극검사(combined pituitary stimulation test)를 시행한 결과 정상 소견이었다(표 1).
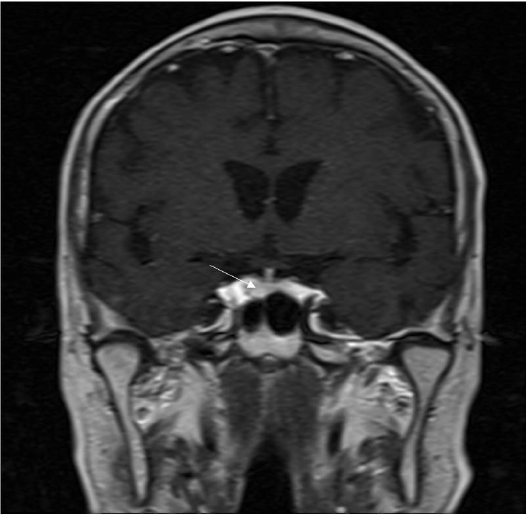
Coronal T1-weighted image shows a pituitary gland that was not enlarged. Coronal T1-weighted image obtained after intravenous bolus injection of contrast material led us to suspect a 7 mm mass with decreased enhancement of the pituitary gland (white arrow).
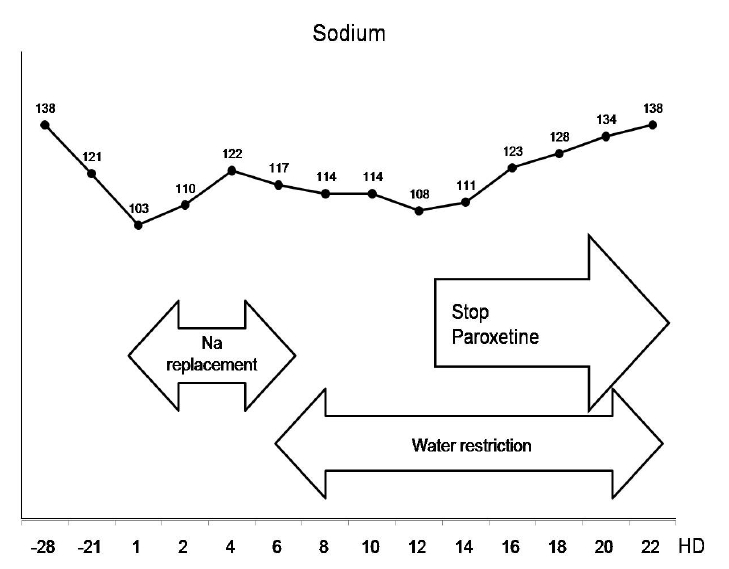
이상과 같은 배제 진단 과정에 의해 증례는 SIADH로 진단되었으며, 원인으로 입원 초기에 환자에게 투약 중이던 paroxetine이 의심되었다. 환자는 저나트륨증의 원인으로 진단된 paroxetine을 중지하고, 하루 500 mL 이하로 수분 섭취를 제한하는 동시에 loop diuretics를 함께 사용하면서 혈청 나트륨 농도가 138 mg/dL까지 회복되어 퇴원하였다(그림 2).
고 찰
본 증례는 68세의 고령 환자에서 항우울제인 paroxetine을 투여한 후 SIADH가 발생하여 치료한 증례이다.
SIADH는 세포 외액이 저장성임에도 불구하고, 지속적으로 항이뇨호르몬이 분비되어 저나트륨 혈증이 나타나는 질환으로 혈장 삼투질 농도의 저하와 소변 삼투질 농도의 증가를 특징으로 한다7). 최근 항우울제로 이용되는 paroxetine에 의한 SIADH 발생이 해외에서 보고되고 있으나 이와 관련된 국내보고는 아직까지 없는 실정이다.
Paroxetine은 주로 주요 우울증, 강박증, 외상 후 스트레스 장애, 공황장애, 산후 우울증 등의 정신과 질환의 치료제로 잘 알려져 있으며8-13), 부작용과 독성이 비교적 적고 효과가 강력하여 임상에서 흔히 사용된다. 또한 통증 조절 효과도 있어 특히 만성적인 통증에 효과적으로 알려져 있다1). 그러나 기타 삼환계 항우울제(Tricyclic antidepressant)와 비교하여 SIADH를 유발하는 빈도가 더 높은 것으로 알려져 있고14), 고령의 환자에서 이뇨제와 함께 투여할 경우, 심각한 저나트륨혈증을 일으켜서 사망률이 증가하기도 한다5,6).
Paroxetine에 의한 SIADH의 발생 이유로 아직까지 뚜렷하게 밝혀진 사실은 없다. 다만 기존 보고에 의하면 이러한 현상이 고령의 환자에서 주로 발생하는데15), 고령에서는 젊은 사람에 비해 신장의 최대 희석능 및 농축능이 저하되어 있고15,16), 기저 항이뇨호르몬의 수준이 증가해 있으며17), 특히 외부 삼투압의 변화에 대한 항이뇨호르몬 분비 반응이 증가해 있어18), 약제 투여에 의한 SIADH의 발생 위험이 젊은 층에 비해 높을 것으로 생각되고 있다.
본 증례는 Paroxetine 투여 후 3주 만에 저나트륨혈증이 발생하였다. 문헌에 보고된 저나트륨혈증의 발생시점은 paroxetine 투여 후 평균 13.5일경으로 알려져 있고, 79%의 환자가 투여 3주경에 발생하므로14), paroxetine 투여 후 최소 한 달 동안은 혈청 나트륨치를 주기적으로 모니터해야 할 것으로 생각된다. 문헌보고에 의하면 고령 환자에서는 특히 갑작스러운 투약 용량의 증가2), 낮은 체질량지수 및 기저 혈청 나트륨의 농도가 paroxetine에 의한 SIADH 발생 위험을 높이는 인자로 알려져 있다19).
치료는 원인되는 약제를 중단하고 수분투여를 제한하면 호전되는 것으로 알려져 있으며, 신경학적 증상을 동반한 경우 고장성 식염수의 주입 또는 Furosemide 투여가 필요하다20). 다만 Thiazide 계열의 이뇨제는 고령 환자에서 저나트륨혈증을 더욱 악화시킬 수 있어6), 투여하지 않는 것이 좋을 것으로 판단된다.
결론적으로, 항우울제 paroxetine 투여는 특히 고령 환자에서 SIADH에 의한 심각한 저나트륨혈증을 일으킬 수 있으므로, 본 약제 투여 시, 혈청 전해질의 주기적인 검사가 반드시 필요할 것으로 사료된다.