유전자형 1형 만성 C형 간염 환자에서 혈청 인터페론감마유도단백질-10의 의미
The clinical significance of interferon inducible protein-10 in patients having chronic hepatitis C with genotype I
Article information
Abstract
목적:
최근 1형 만성 C형 간염 환자에서 CXC 케모카인 중 하나인 IP-10의 치료 전 혈중 농도가 지속적 바이러스 반응을 예측할 수 있는 주요한 인자일 수 있다는 보고들이 있었다. 이에 본 연구에서는 국내의 1형 만성 C형 간염 환자에서 페그인터페론과 리바비린 병용 투여 시 T 림프구 특이성 케모카인인 IP-10의 혈중 농도 변화와 이들과 여러 바이러스 반응들 간의 연관성을 알아보고자 하였다.
방법:
유전자형 1형 만성 C형 간염으로 진단받고 초 치료로써 페그인터페론과 리바비린 병용 치료를 받은 환자 36명을 대상으로 진행하였다. 보관되어 있는 환자 혈청을 이용하여 치료 시작 1개월 전과 1개월 후의 IP-10 수치를 각각 측정하였으며, 치료 전 IP-10 수치와 여러 바이러스 반응과의 관계 및 치료 전과 치료 후의 IP-10 수치 변화와 여러 바이러스 반응과의 관계에 대하여 연구하였다.
결과:
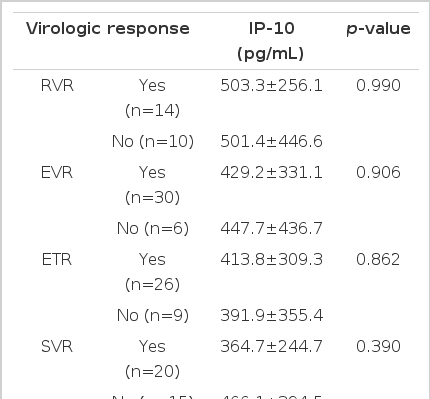
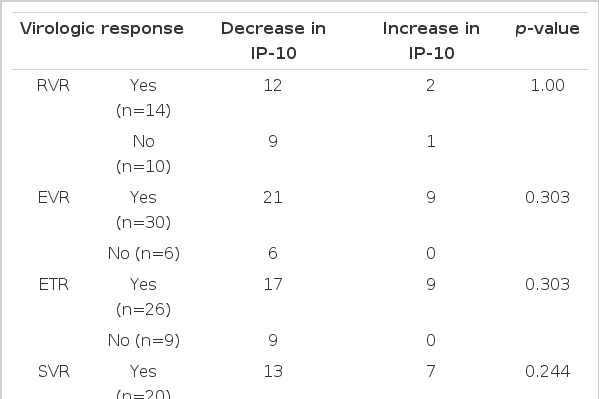
환자의 나이는 평균 53.5±10세이고, 21명(58%)이 남자였으며, 치료 전 HCV RNA의 평균은 5.7±0.9 log10 IU/mL이었고, IP-10 정량 결과는 평균 432.2±343.7 pg/mL이었다. 치료 전 환자의 IP-10 정량 값과 HCV RNA 정량 값은 양의 상관관계를 나타내었으나, 통계적으로는 유의하지 않았다. 치료 전 환자의 IP-10의 평균값은 432.2±343.7 pg/mL이었고, 치료 1개월 후의 IP-10의 평균값은 306.5±246.1 pg/mL로 그 감소 정도는 유의하였다(p=0.033). 여러 바이러스 반응과 치료 전 IP-10치의 관계에 대한 분석에서 바이러스 반응 유무에 따른 치료 전 IP-10 값에는 유의한 차이를 발견할 수 없었다. 각각의 바이러스 반응을 보인 군과 그렇지 않은 군에서 치료 전과 치료 후의 IP-10의 변화를 확인해 본 결과 바이러스 반응의 유무에 관계없이 전반적으로 치료 후 IP-10 값은 감소하는 모습이었으나 대체로 통계적으로 유의한 수준은 아니었다.
결론:
치료 전 IP-10 수치와 치료 한 달 전과 한 달 후의 IP-10 수치의 변화는 지속적 바이러스 반응의 예측인자는 아니었다. 하지만 더 큰 규모의 연구를 통하여 IP-10 수치와 바이러스 반응과의 관계를 규명하는 것이 필요하겠다.
Trans Abstract
Background/Aims:
Recent studies have shown that serum interferon γ-inducible protein-10 (IP-10) concentration decreased afterpegylated interferon and ribavirin therapy, and was associated with a sustained virologic response (SVR). The aim of this study wasto investigate the clinical significance of the pretreatment IP-10 level and change in serum IP-10 level between 1 month before andafter treatment and its association with various virologic responses in patients having chronic hepatitis C (CHC) with genotype 1undergoing pegylated interferon and ribavirin therapy.
Methods:
Thirty-six patients having CHC with genotype I undergoing pegylated interferon and ribavirin therapy who had availablestored sera 1 month before and after treatment were enrolled retrospectively. Serum IP-10 levels were measured by ELISA.Serum HCV RNA was measured by RT-PCR (detection limit<50 IU/mL).
Results:
The mean age of patients (n=36; 21 men) was 53.5 years, and the mean of pretreatment HCV RNA levels was 5.7 log10IU/mL. The serum IP-10 level at 1 month after treatment significantly decreased from 432.2 to 306.5 pg/mL (p=0.033). The rate ofrapid virologic response (RVR), early virologic response (EVR), end-of-treatment response (ETR), and SVR were 58%, 83%, 74%,and 57%, respectively. No significant difference in pretreatment IP-10 levels was observed between the patients with (RVR, EVR,ETR, and SVR) and without various virologic responses (p>0.05). The change in serum IP-10 between 1 month before and aftertreatment had no clinical meaning based on various virologic responses (p>0.05).
Conclusions:
The level of pretreatment IP-10 and change in IP-10 level between 1 month before and after treatment were not predictivefactors of a SVR. Additional large-scale studies to determine the SVR-predicting role of serum IP-10 levels in patients withCHC are needed. (Korean J Med 79:652-660, 2010)
서 론
C형 간염 바이러스(HCV) 감염자는 전 세계적으로 약 1억 7천만 명으로 추산되며 국내에서는 전 인구의 약 1% 내외로 알려져 있다1-3). 초기 감염 후 약 55~85%에서 만성 간염으로 지속되며, 이 중 약 5~20%의 환자는 간경변증으로 진행하고, 그 후 1년에 약 1~2%에서 간세포암종이 발생할 수 있는 주요한 간 질환이다4). 현재의 만성 C형 간염의 표준 치료는 페그인터페론과 리바비린의 병용 치료이며, 지속적 바이러스 반응률은 54~61% 정도로 알려져 있으나 이 효과도 HCV의 유전자형에 따라 차이가 있어 유전자형 2, 3형은 약 80% 정도의 환자에서 지속적 바이러스 반응을 얻을 수 있지만 유전자형 1형인 경우에는 단지 50% 정도의 환자에서만 지속적 바이러스 반응을 얻을 수 있다4-7).
만성 C형 간염의 항 바이러스 치료에서 이러한 치료 실패에 관한 분자생물학적 배경은 잘 이해되고 있지 못하지만 여러 임상적 또는 실험실적 연구에서 치료 실패가 바이러스 요인과 숙주 요인을 포함하는 여러 인자와 관계가 있다고 보고하고 있다8,9). 바이러스 인자 측면에서는 치료 전 혈청 HCV 농도와 HCV 유전자형이 주요한 지속적 바이러스 반응의 예측인자라는 것이 잘 알려져 있다10,11). 인터페론은 항바이러스 기전과 함께 면역조절 기능을 함께 가지므로 지속적 바이러스 반응을 성취하는데 있어 바이러스적 요인만큼이나 숙주의 면역 요인도 중요하게 작용할 것으로 예측되지만 이에 대해서는 상대적으로 잘 알려져 있지 못한 실정이다. 이러한 숙주 면역능에 대한 보고를 살펴 보면 여러 사이토카인, Tumor necrosis factor (TNF)-α12), Interleukin (IL)-1β13), IL-1014)의 혈중 농도의 증가가 만성 C형 간염 치료에서 나쁜 치료 반응과 연관된다는 보고들이 있어 왔다.
케모카인은 작은 분자량의 화학주성을 가진 사이토카인으로서 면역세포를 염증구역으로 유도하는 역할을 한다. 이들 중 인터페론감마유도단백질-10 (IP-10/CXCL10), 인터페론감마유도단백구활성물질(Mig/CXCL9), 인터페론유도T-cell화학주성인자(I-TAC/CXCL11) 등은 만성 C형 간염 환자에서 혈중과 간내에서 농도가 증가되어 있다고 알려져 만성 C형 간염의 염증 발생에 관여할 것으로 추정되어 왔다15). 최근 IP-10이 1형 만성 C형 간염 환자의 혈중 및 간내에서 증가되어 있고16), 페그인터페론과 리바비린으로 치료하는 경우 감소하며 바이러스 반응을 보이는 환자에서 이러한 감소가 뚜렷하게 나타나 치료 전 IP-10의 혈중 농도가 지속적 바이러스 반응을 예측할 수 있는 중요한 인자일 수 있다는 보고들이 있었다16-18). 하지만 국내에서는 IP-10의 임상적 유용성에 관한 연구가 없어, 국내의 1형 만성 C형 간염 환자에서 페그인터페론과 리바비린 병용 투여 시 T 림프구 특이성 케모카인인 IP-10의 혈중 농도 변화와 이들과 여러 바이러스 반응들 간의 연관성을 알아보고자 하였다.
대상 및 방법
1. 대상
2003년 9월부터 2007년 12월까지 고려대학교 구로병원 간센터에서 유전자형 1형 만성 C형 간염으로 진단받고 초치료로서 페그인터페론과 리바비린 병용 치료를 받은 후에 추적관찰 중인 환자를 대상으로 후향적으로 연구하였다.
환자의 선정 기준은 치료 전 HCV RNA가 양성이며 치료 전 6개월 내에 2회 이상 혈청 ALT치가 정상 상한치 이상으로 측정되면서, B형 간염이나 간세포암종을 동반하지 않고 만성 음주자(일일 80 g 이상)가 아닌 57명 중, 혈청의 보관에 동의하였고, 치료 전과 치료 후 1개월의 혈청이 모두 보관되어 있는 36명의 환자를 대상으로 연구를 진행하였다.
2. 치료
대상 환자 중 31명은 주 1회 페그인터페론 α-2a (Pegasys®, F. Hoffmann-La Roche, Ltd., Basel, Switzerland) 180 μg과 리바비린 1,000 또는 1,200 mg (75 kg 기준)을 매일 투여 받았고, 5명은 주 1회 페그인터페론 α-2b (PegIntron®, Shering Plough Corp., Kenilworth, NJ, USA) 1.5 μg/kg와 리바비린 1,000 또는 1,200 mg (75 kg 기준)을 매일 투여 받았다4). 치료는 48주간 이루어졌으며, 치료 12주째에 HCV RNA 정량 검사를 시행하여, 조기 바이러스 반응을 달성하지 못한 경우에는 치료를 조기에 종결하였다.
3. 바이러스 및 혈액 검사
혈액 검사와 생화학 검사는 치료 전과 치료 후 첫 달에는 2주 간격, 그 이후로는 1~3개월 간격으로 시행하였다.
혈중 HCV RNA 농도는 COBAS Amplicor HCV Test (Roche Diagnostics, NJ, USA, detection limit <50 IU/mL)를 이용한 reverse transcriptase PCR로 측정하였으며 치료 전과 치료 후 각각 4주, 12주, 48주, 치료 종료 후 24주째 측정하였다.
4. 치료 반응의 정의
치료 4주 후의 HCV RNA가 검출 한계 이하로 감소한 경우를 신속 바이러스 반응(rapid virologic response, RVR)으로, 치료 12주 후의 HCV RNA가 기저치보다 2 log 이상 감소하는 것을 조기 바이러스 반응(early virologic response, EVR)으로, 치료 48주 후의 HCV RNA가 검출 한계 이하로 감소한 경우를 치료 종료 반응(end of treatment response, ETR)으로, 치료 종료 24주 후의 HCV RNA가 검출 한계 이하로 감소한 경우를 지속적 바이러스 반응(sustained virologic response, SVR)으로 정의하였다.
5. IP-10 수치의 측정
IP-10 수치의 측정은 환자의 동의를 받고 보관 중인 환자의 혈청을 이용하여 시판되고 있는 효소면역측정 키트(Quantikine®; R&D Systems, Minneapolis, MN, USA)로 제조 회사의 설명서에 따라 치료 전과 치료 1개월 후에 측정하였다.
6. 통계
통계 분석은 SPSS 12.0 (Chicago, IL, USA)을 이용하였다. 연속형 자료는 평균±표준편차를 이용하였고, 범주형 자료는 빈도(백분율)를 이용하여 요약하였다. 연속 변수의 비교는 paired-t test와 student t test를 이용하였고, 범주 변수의 비교는 Fisher’s exaxt test를 이용하였으며 IP-10과 HCV RNA를 비롯한 변량과의 연관 관계는 pearson’s 상관계수로 분석하였고, 다변량 분석은 회귀분석을 이용하였다. p 값은 0.05 미만인 경우를 통계적으로 유의하다고 정의하였다.
결 과
1. 대상 환자의 치료 전 임상적 특성
환자의 나이는 평균 53.5±10세이고, 21명(58%)이 남자였으며 치료 전 혈청 ALT치의 평균은 96.8±79.6 IU/L이었고, 8명(22%)이 대상성 간경변증이었다. 치료 전 HCV RNA의 평균은 5.7±0.9 log10 IU/mL이었고, IP-10 정량 결과는 평균 432.2±343.7 pg/mL이었다(표 1).
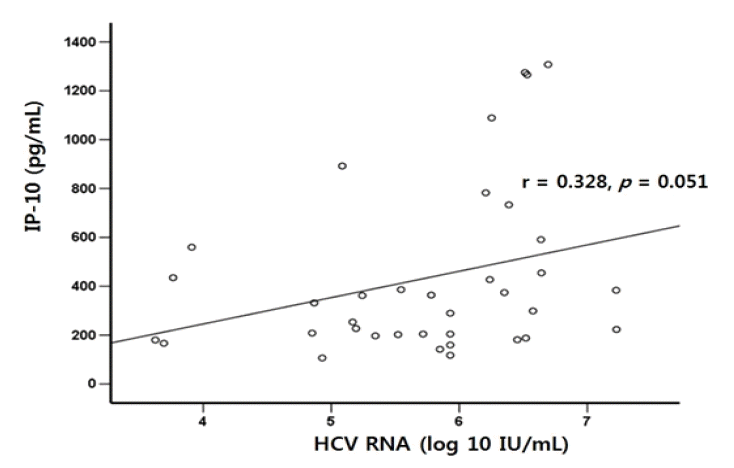
치료 전 환자의 IP-10 정량 값과 HCV RNA 정량 값 사이의 관계를 확인하였을 때, IP-10 정량 값은 통계적으로 유의한 수준은 아니었으나 HCV RNA가 높은 환자에서 상대적으로 높은 경향을 보였다(r=0.328, p=0.051) (그림 1). 치료 전 IP-10 수치는 치료 전 혈청 AST, ALT와 유의한 양의 상관관계를 보였으며 알부민과는 음의 상관관계를 보였으나(r=0.533, p=0.001; r=0.449, p=0.006; r=-0.453, p=0.006) 빌리루빈, 간경변증 유무, 백혈구, 헤모글로빈, 혈소판 수와는 유의한 상관관계를 보이지 않았다. 치료 전 조직검사를 시행한 8명의 환자의 염증 또는 섬유화 정도와 치료 전 IP-10 수치와의 상관관계 분석에서도 유의한 관련을 찾을 수 없었다.
2. 치료 후 대상 환자의 임상경과
치료 후 4주에 신속 바이러스 반응을 확인한 24명 중 14명(58%)이 신속 바이러스 반응을 보였고, 전체 36명 중 조기 바이러스 반응을 보인 환자는 30명(83%)이었으며 신속 바이러스 반응을 보인 환자는 모두 조기 바이러스 반응을 보였다. 조기 바이러스 반응을 보이지 않아 12주째에 치료를 중단한 환자 6명 외에 치료를 조기에 중단한 환자는 모두 4명이었다. 1명은 12주째에 타 병원으로 전원하였고, 1명은 전신 쇄약감의 부작용으로 12주째에 치료를 중단하였으며, 1명은 정상 상한치의 10배 이상 ALT 수치의 상승이 지속되어 12주째에 치료를 중단하였고, 1명은 24주째에 경제적인 문제로 치료를 중단하였다. 24주 치료를 유지한 환자는 치료 종결 후 24주까지 지속 바이러스반응을 보였다. 타 병원으로 전원한 1명을 제외한 3명은 치료 종료 반응과 지속적 바이러스 반응의 분석에까지 포함하였으며 부작용에 의해 치료를 중단한 환자는 치료 실패로 분류하였다. 치료 종료 반응을 보인 환자는 26명(74%)이었고, 지속적 바이러스 반응을 보인 환자는 20명(57%)이었다. 지속적 바이러스 반응에 영향을 미치는 유의한 인자는 치료 전 HCV RNA 값(5.4 log10 IU/mL vs. 6.1 log10 IU/mL, p=0.016), 신속 바이러스 반응 유무(93% vs. 11%, p<0.001), 조기 바이러스 반응 유무였으며(67% vs. 0%, p=0.003), 다변량 분석에도 의미있는 인자는 신속 바이러스 반응 유무뿐이었다(위험도 63.9, 95% CI 3.102~1316.7)
3. 치료 후 IP-10 수치의 변화와 치료 반응과의 관계
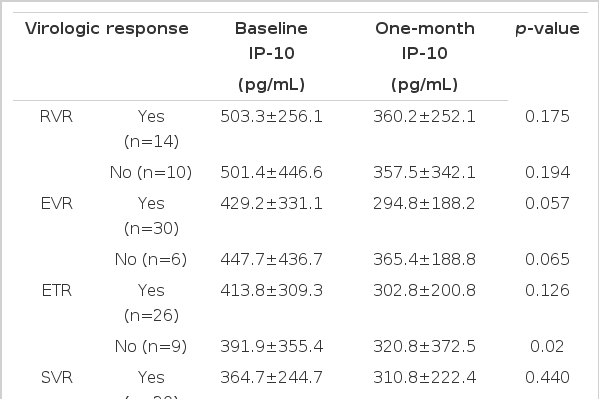
치료 후 일부에서(9명) IP-10의 증가가 관찰되었으나 대부분의 환자에서 IP-10은 감소되었고(그림 2), 치료 전 환자의 IP-10의 평균값은 432.2±343.7 pg/mL이었고, 치료 1개월 후의 IP-10의 평균값은 306.5±246.1 pg/mL로 그 감소 정도는 유의하였다(p=0.033, 그림 3). 여러 바이러스 반응과 치료 전 IP-10치의 관계에 대한 분석에서 바이러스 반응 유무에 따른 치료 전 IP-10 값에는 유의한 차이를 발견할 수 없었다(표 2, 그림 4). 치료 후 IP-10의 감소 유무도 치료 후 바이러스 반응에 영향을 미치지 않았으나 치료 종료반응은 IP-10치가 치료 후 증가한 환자에서 오히려 높은 경향이 나타났다(표 3). 각각의 바이러스 반응을 보인 군과 그렇지 않은 군에서 치료 전과 치료 후의 IP-10의 변화를 확인해 본 결과 바이러스 반응의 유무에 관계없이 전반적으로 치료 후 IP-10 값은 감소하는 모습이었으나 통계적으로 유의한 수준은 아니었으며 치료 종료 반응이 없는 군에서만 치료 후 IP-10 값이 유의하게 감소하였다(표 4, 그림 4).
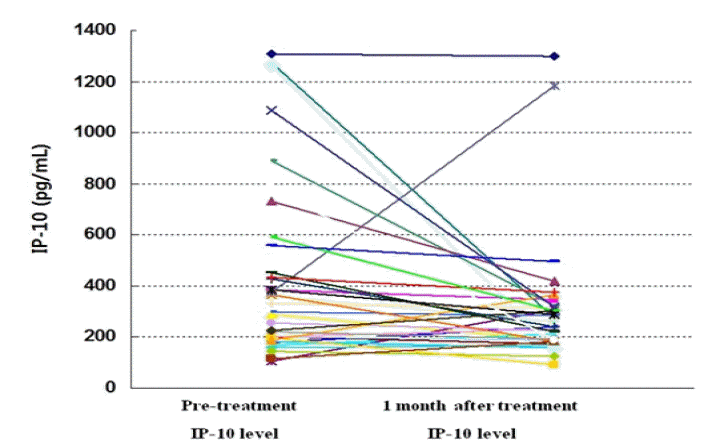
The changes in IP-10 level from pretreatment to 1 month after treatment in individual patients.
P-10, interferon γ inducible protein 10.
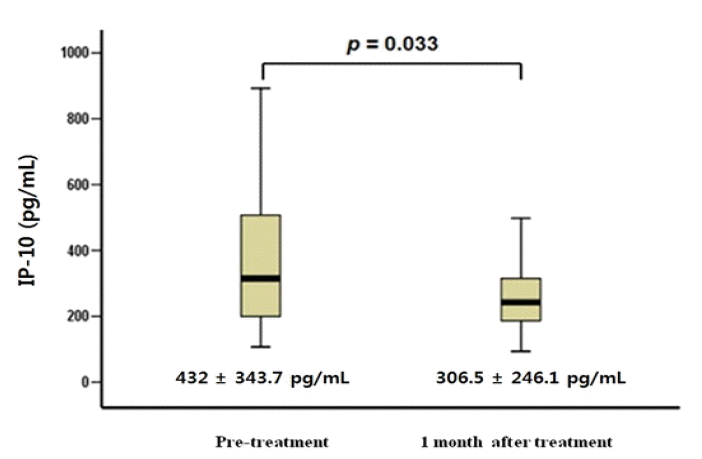
The comparison of IP-10 level between prtreatment and 1 month after treatment.
P-10, interferon γ inducible protein 10.
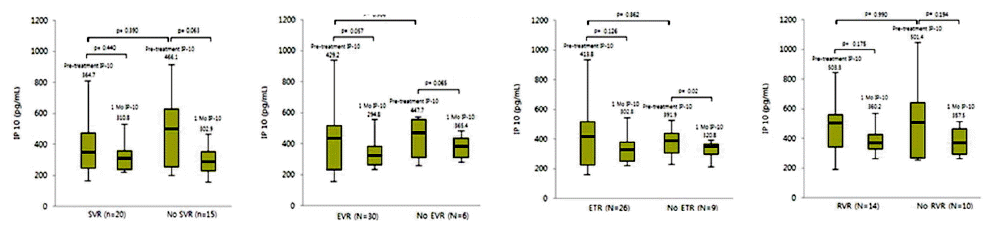
The comparison of IP-10 level between pretreatment and 1 month after treatment based on various virologic responses. IP-10, interferon γ inducible protein 10; RVR, repid virologic response; EVR, early virologic response; ETR, end of treatment response; SVR, sustained virologic response.
4. 치료 약제의 차이에 따른 바이러스 반응의 차이 및 IP-10 값의 관계
페그인터페론 α-2a를 투여 받은 31명과 페그인터페론 α-2b를 투여 받은 5명에서 바이러스 반응을 보인 빈도를 비교한 결과 전반적으로 페그인터페론 α-2b를 투여 받은 군에서 바이러스 반응이 더 높게 나타났으나, 통계적으로 유의한 차이를 보이지는 않았다. 치료 전 IP-10 값은 페그인터페론 α-2b를 투여 받은 군에서 통계적으로 유의하게 높게 나타났으나, 치료 시작 한 달 후의 IP-10 값과 치료 전과 치료 한 달 후 IP-10값의 변화는 유의한 차이를 나타내지 않았다(표 5).
고 찰
만성 C형 간염의 치료 목표는 HCV RNA를 억제하여 HCV 감염에 의한 간경변증, 간세포암종과 같은 합병증의 발생을 막는 것으로써, 치료 종료 시점으로부터 24주 후에 HCV RNA가 검출되지 않는 지속적 바이러스 반응을 보일 때 1차적 치료 목표를 이룬 것으로 간주한다4). 지속적 바이러스 반응에 영향을 주는 인자로 나이, 성별, 바이러스의 유전자형, 치료 전 혈청 ALT 수치 및 HCV RNA 수치, 체질량 지수 등이 있으나, 가장 중요한 것은 HCV RNA 유전자형으로서 1형인 경우에는 지속적 바이러스 반응률이 떨어지며, 표준 치료로는 페그인터페론과 리바비린의 48주 병용요법이 추천되고 있다19). 한편, 치료 후 지속적 바이러스 반응에 대한 예측인자로서 숙주의 면역능에 대한 연구는 상대적으로 적은데, 최근 여러 연구에서 CXC 케모카인 중 하나인 IP-10이 1형 만성 C형 간염 환자에서 상승되어 있고16), 치료 전 IP-10의 혈중 농도가 만성 C형 간염 환자에서 지속적 바이러스 반응의 예측인자라는 보고가 있었다20).
본 연구는 페그인터페론과 리바비린의 병합 요법을 받은 한국인 만성 C형 간염 유전자형 1형 환자에서 치료 전 IP-10의 수치가 치료 반응의 예측인자가 될 수 있는가를 살펴보기 위하여 신속 바이러스 반응, 조기 바이러스 반응, 치료 종료 반응, 지속적 바이러스 반응이 나타난 환자와 나타나지 않은 환자의 치료 전 IP-10과 치료 후의 IP-10의 변화를 비교하였다. Diago 등의 연구에 따르면 만성 C형 간염 유전자형 1형 환자에서 지속적 바이러스 반응의 예측인자를 조사한 결과, HCV RNA 수치와 함께 치료 전 IP-10 수치가 예측인자로서 의의를 가진다고 보고하였다17). 하지만 이번 연구에서는 치료 전 IP-10 수치가 여러 바이러스 반응을 보인 환자 군과 바이러스 반응을 보이지 않은 환자 군에서 통계적으로 유의한 차이를 나타내지 못했다. 그렇지만 지속적 바이러스 반응을 보인 군에서는 치료 전 IP-10 수치가 364.7±244.7 pg/mL로 지속적 바이러스 반응을 보이지 않은 군의 466.1±394.5 pg/mL보다 낮게 나타났다. 이는 Diago 등이 보고한 지속 바이러스 반응을 보인 환자와 보이지 않은 환자의 치료 전 평균 IP-10 수치 332 pg/mL와 476 pg/mL과 비교할 때 거의 유사한 정도를 보이고 있어, 이번 연구 결과로 치료 전 IP-10 수치와 지속적 바이러스 반응이 관계가 없다고 결론짓기는 어려우며 앞으로 좀 더 많은 환자를 대상으로 하는 연구가 이루어져야 할 것으로 생각된다. 만성 C형 간염 환자에서 치료 전 증가된 IP-10이 치료 실패에 영향을 주는 이유는 확실하지는 않으나, T 림프구의 모집 및 이로 인한 면역 압박(immune pressure)이 면역 압박을 벗어 나는 능력을 가진 다양한 변이 바이러스의 생성을 초래하여 치료 실패를 일으킨다는 가설이 제기되고 있다17). 하지만 생체 내에서 이러한 변화가 일어나는지에 대해서는 더 연구가 필요하다.
치료 후 IP-10의 변화에 대한 보고를 살펴보면, 지속적 바이러스 반응을 보인 환자 군에서는 치료 전과 치료 후의 IP-10 수치가 유의하게 감소하지만, 지속적 바이러스 반응을 보이지 않은 환자 군에서는 유의한 감소를 나타내지 않는다고 보고되고 있다17). 본 연구에서는 여러 바이러스 반응 여부에 따라 구분하여 확인한 IP-10의 치료 전과 치료 후의 변화에서 여러 바이러스 반응 각각이 나타난 환자와 나타나지 않은 환자 간의 치료 1개월 후의 IP-10의 변화는 공히 감소하는 양상을 보이지만, 치료 종료 반응이 없는 환자를 제외하고는 통계적으로 유의한 차이를 보이지 않았다.
이전의 연구들에서는 치료 후에 IP-10 수치가 감소하는지 여부에 따른 치료 반응을 분석한 경우는 없었다. 따라서 본 연구에서는 치료 전과 치료 후 IP-10의 감소 여부에 따라 치료 반응을 살펴보았는데, IP-10이 감소한 군에서 신속 바이러스 반응, 조기 바이러스 반응, 치료 종료반응, 지속 바이러스 반응 정도는 높지 않게 나타나서 치료 전과 치료 후 IP-10의 감소 여부로 치료 반응을 예측하기는 어려운 것으로 나타났다. 하지만, 전체 환자의 치료 전 IP-10 수치는 다른 연구에서와 같이 치료 후에 의미있게 감소하였으며, 이는 바이러스 반응 여부와는 상관없이 페그인터페론과 리바비린으로 치료를 시작하면 IP-10의 수치가 감소함을 의미한다.
치료 전 IP-10과 HCV RNA 수치는 유의한 양의 상관관계를 가진다고 보고되고 있으며18), 본 연구에서는 치료 전 IP-10은 치료 전 HCV RNA와 양의 관련성의 경향을 보였다. 이러한 관련성으로 치료 후 IP-10이 감소하는 기전이 설명되고 있는데, N55A와 같은 C형 간염 바이러스의 단백질이 IP-10 유전자의 발현을 유도하여 만성 C형 간염 환자에서 IP-10 수치가 증가하게 되고 21), 이에 따라 치료 후 HCV RNA가 감소하게 되면 유도 단백의 발현이 감소되고 IP-10 수치가 떨어지는 것으로 보고 있다. 따라서 치료 시작 한 달 후보다 더 이후에 IP-10 수치를 검사한다면 바이러스 반응을 보인 군과 보이지 않은 군에서의 치료 전과 치료 후의 IP-10 수치의 유의한 변화를 확인할 수 있을 것으로 생각된다.
본 연구에서 치료 전 IP-10의 수치는 albumin 수치와 음의 상관관계를 보임에도 불구하고 간경변증 유무에 따른 차이는 보이지 않았다. 이전의 연구를 보면 조직학적으로 진행된 섬유화를 동반한 환자에서 치료 전 IP-10의 수치가 유의하게 높다고 보고하고 있다17). 본 연구에서도 간경변증 유무에 따른 치료 전 IP-10의 수치는 550±406 vs. 366±280으로 수치적인 차이는 보였으나 통계적인 차이를 보이지는 못하였다(p=0.150). 이는 대상 환자가 적고 조직검사가 아닌 임상적인 간경변증 유무에 따른 분류를 시행함에 따라 통계적인 차이를 증명하지 못한 것으로 보인다.
만성 C형 간염의 치료에 사용되는 페그인터페론 제제는 현재 두 가지이다. 본 연구에서는 치료제로 사용된 페그인터페론 α-2a와 α-2b를 모두 대상으로 하였다. 두 약제의 효과가 비슷하다는 IDEAL 연구22) 이후 페그인터페론 α-2a의 효과가 우월하다는 연구가 최근 발표 되고 있어23,24), 두 약제를 사용한 환자들 간의 바이러스 반응과 IP-10의 수치를 비교하였으나 본 연구에서는 특별한 차이를 발견할 수 없었다. 이러한 치료제에 따른 IP-10의 의의에 대해서는 추후 후속 연구가 이루어져야 할 것으로 보인다.
IP-10에 대한 연구는 주로 유전자형 1형에 대해 주로 이루어져 왔고 그외 유전자형에서 IP-10이 가지는 임상적 의의에 대해서는 발표된 바가 없다. 다만 유전자형 1형 103명과 함께 그외 유전자형 34명을 포함하여 IP-10의 의의를 본 연구에서 유전자형 1형 이외에서 IP-10의 임상적 의의를 분석하진 못했지만 유전자형 1형에서 유의하게 기저 IP-10의 수치가 높다고 보고하고 있어17) 인터페론에 대한 반응이 상대적으로 좋은 1형 이외의 만성 C형 간염에서 IP-10의 의의는 상당히 제한 될 것으로 생각된다.
이번 연구는 환자 수가 많지 않고, 후향적 연구라는 점이 제한점이라고 할 수 있으나, 숙주 면역능에 있어서는 뚜렷한 치료 반응 예측인자가 없는 만성 C형 간염에서 치료 전 HCV RNA가 치료 전 IP-10과 관련된 경향을 보이고, 전체 환자에서 치료 후의 IP-10 수치가 치료 전과 비교하여 유의하게 감소한다는 것은 향후 IP-10이 치료 반응 예측인자가 될 수 있는가에 대한 더 많은 연구가 필요하다는 것을 보여준다.
결론적으로 페그인터페론과 리바비린의 병합 요법을 받은 한국인 만성 C형 간염 유전자형 1형 환자에서 치료 전 IP-10 수치 및 치료 전과 치료 후의 IP-10 수치의 변화는 지속적 바이러스 반응을 포함한 여러 바이러스 반응을 예측할 수 없었다. 향후 치료 전 IP-10 값 또는 치료 전과 치료 후의 IP-10 수치의 변화가 치료 반응 예측인자가 될 수 있는가에 대한 더 많은 환자를 대상으로 한 연구가 필요하겠다.