혈관신생과 세포치료
Angiogenesis and cell therapy
Article information
Trans Abstract
All cells in human body receive oxygen and nutrients and remove metabolic wastes through the vascular network. New vessel formation in a human body is significantly decreased in adults compared with fetus. New vessel formation is a critical process in pathogenesis, thus, it is a therapeutic target in several diseases, such as cancer, diabetic retinopathy, myocardial infarction and cerebral ischemia. Angiogenesis initiates through the interaction of several factors. For the increment of angiogenesis, new vessel promoting factors, such as vascular endothelial growth factor, or their genes have been directly injected to patients in the past. However, in recent studies, direct injection of cells promoting blood flow to patients has been attempted. In this paper, I will focus on cell therapy and its application in promoting blood flow in patients with impaired vessel such as myocardial infarction, cerebral ischemia and limb ischemia. (Korean J Med 79:630-634, 2010)
서 론
우리 몸의 모든 세포는 혈관에서 산소와 영양분을 공급받고 노폐물이 제거되기 때문에 미세혈관이 그물망처럼 퍼져있다. 체내에서의 혈관 신생은 태아기에 비해 성인이 되면서 크게 줄어들지만, 성인에서의 혈관 신생은 많은 질환에서 병의 진행과 치료에 중요한 역할을 한다. 예를 들면 암(cancer)이나 당뇨성 망막증의 경우에는 혈관 생성 억제가1,2), 반대로 심근경색이나 뇌경색의 경우에는 혈관 생성 증가가 필요하다3,4). 혈관 생성은 여러 인자들이 서로 밀접하게 연관되어 혈관내피세포의 증식을 촉진하거나 억제하면서 일어난다. 이전에는 혈관 신생 치료의 목적으로 vascular endothelial growth factor (VEGF)를 비롯한 혈관신생 촉진인자를 직접 주사하거나 이와 관련된 유전자를 투여하는 방법이 시행되었으나5,6), 최근에는 혈관 생성에 관련된 세포를 직접 투여하는 방법들이 시도되고 있다7,8). 본문에서는 심근경색, 뇌경색, 하지 허혈 등과 같이 혈관신생 부족으로 문제가 발생하는 환자를 대상으로 혈류량을 촉진시키고자 하는 방법 중 세포 치료에 초점을 맞추어 알아보고자 한다.
1. 혈관신생(Angiogenesis)과 혈관형성(Vasculogenesis)
새로운 혈관은 혈관신생(angiogenesis)과 혈관형성(vasculogenesis)의 두 가지 경로로 만들어진다(그림 1)9). 혈관신생은 기존의 혈관으로부터 혈관을 구성하는 세포가 발아(sprouting)되고 증식하여 새로운 맥관(vessel)을 형성하는 과정을 의미하며, 상처 치유, 여성의 배란 및 월경에 주된 기전으로 작용한다10). 이와는 달리 혈관형성(vasculogenesis)은 혈관내피전구세포(endothelial progenitor cell, EPC)로부터 혈관내피세포(vascular endothelial cell)가 분화되어 혈관 망상구조(primary vascular plexus)를 형성하는 과정이다11). 주로 발생 초기 과정에서 일어나지만 성인에서도 혈관형성 과정으로 새로운 혈관이 만들어진다12,13).
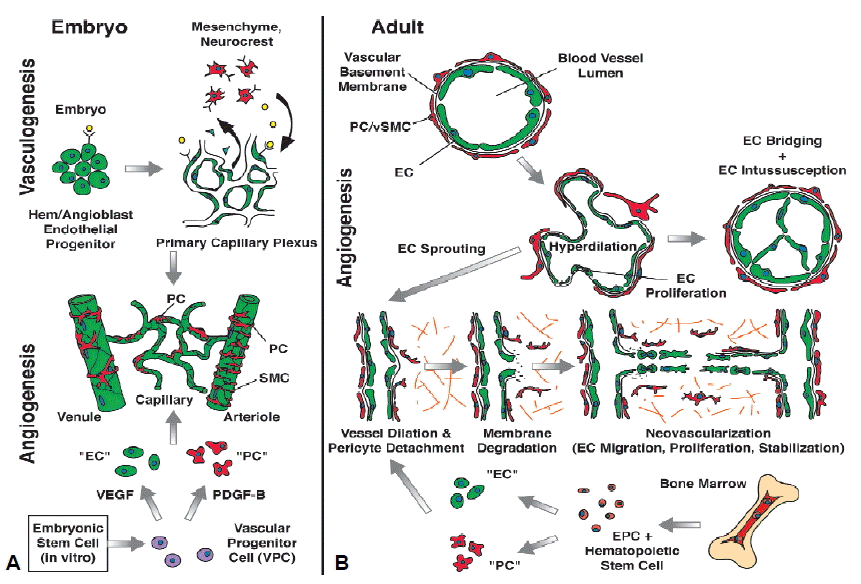
Vasculogenesis (A) and angiogenesis (B). In the embryo, endothelial cells (ECs) develop from angioblast and hemangioblasts, while pericytes (PCs)/smooth muscle cells (SMCs) are derived from mesenchymal stem cells and or neurocrest cells. ECs first assemble into a simple capillary network (vasculogenesis). Vessels then sprout (angiogenesis) (A). New vessels are formed from existing blood vessels. When vessels form new sprouts, the vascular basement membrane is first degraded. This is accompanies by EC proliferation and migration toward an angiogenic stimulus. ECs adhere to each other, form a lumen and become encircled by basement membrane with recruited PCs. ECs and PCs can be recruited from bone marrow, especially in tumor angiogenesis (B). Adopted from Bergers et al.9).
2. 혈관모세포(Hemangioblast)
태아에서의 혈관생성은 혈관모세포(hemangioblast)에서 조혈모세포(hematopoietic stem cell)와 혈관전구세포인 angioblast가 분화되어 만들며, 혈도(blood island)로부터 시작된다. 혈도들이 서로 융합되면서 혈도 주변에 위치한 세포가 혈관내피세포로 분화되어 원시혈관총(primary vascular plexus)을 형성하고, 혈도 중앙의 세포는 혈액세포로 분화된다14). 이와 같이 혈관과 혈액을 만드는 세포는 같은 모세포로부터 분화되기 때문에 EPC는 세포 표면에 CD34, CD117, CD133 등과 같은 조혈모세포 표면 항원과 Flk-1/KDR, Tie-2 등과 같은 혈관내피세포 항원이 공통적으로 발현된다13,15). 조혈모세포는 분화됨에 따라 이들 표면 항원의 발현이 상실되는 반면, 혈관내피세포에서는 지속적으로 발현된다.
3. 망막에서의 혈관 생성
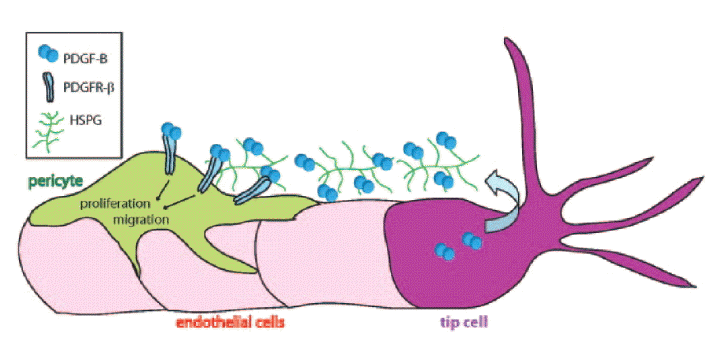
망막은 우리 몸에서 혈관신생과정을 관찰하기 가장 용이한 장기로, 망막을 이용한 혈관신생 연구가 활발하게 진행되고 있다. 망막에서의 혈관신생에 관한 몇 가지 흥미로운 결과 중 하나는 혈관이 형성될 때 혈관내피세포가 단독으로 증식되는 것이 아니라 neuroglial cell인 astrocyte가 먼저 자라나 astrocyte-plexus를 형성하고, 혈관내피세포가 만들어진 astrocyte-plexus 위로 층을 이루면서 증식한다는 것이다(그림 2A)16). 이와 같이 혈관생성과 신경세포의 형성이 서로간의 상호작용에 의하여 이루어진다는 사실은 이미 여러 연구에서 발표된 바 있다17-19). 또 다른 하나는 tip cell에 의해 혈관내피세포의 증식이 조절된다는 사실이다. Tip cell은 혈관이 자랄 때, 증식되는 혈관내피세포의 끝부분에 있는 특화된 혈관내피세포로(그림 3)20), 다른 혈관내피세포(stalk cell)가 VEGF 자극에 대해 증식되는 것과는 달리 VEGF 자극에도 세포 수가 증가되지 않는다. 또, tip cell은 자라는 혈관 방향으로 길게 뻗은 다수의 filopodia가 있는 운동성이 있는 세포로(그림 2B, 3)16,20) tip cell의 이동을 유도하는 물질(attractant)과 저해하는 물질(repellent)에 반응하면서 혈관이 자라나가는 방향을 결정하고, stalk cell의 증식을 조절한다21,22).
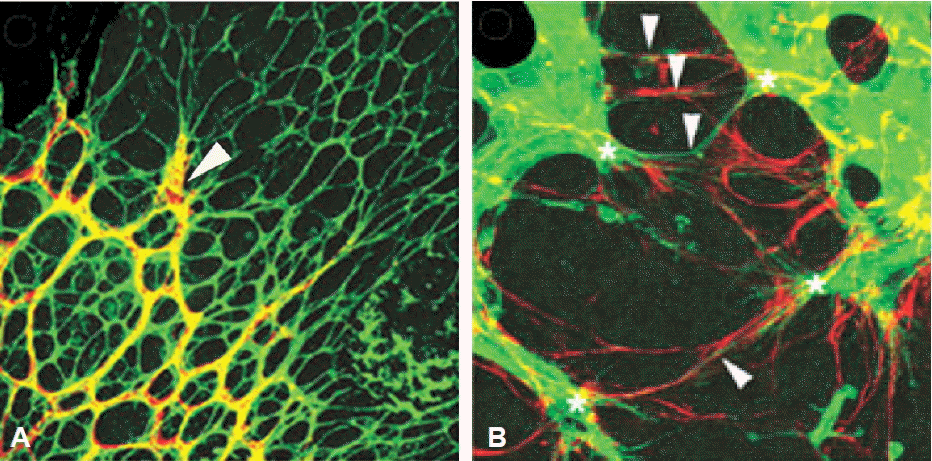
Astrocyte-vascular relationship in retinal vascularization. Retinal blood vessels (arrow, yellow) are developed along a pre-existing astrocyte-plexus (green) (A). Filopodial processes (arrow, green) from growing retinal vessels are in register with astrocytic-processes (red) (B). Adopted from Gariano et al.16).
4. 혈관내피전구세포를 이용한 세포치료
혈관생성은 혈관내피세포를 비롯한 여러 종류의 세포가 관여하는 과정으로, 정상적으로 허혈 상태가 되면 기존의 혈관에서 collateral vessel이 자라나 허혈 부위에 혈액을 공급하게 된다. Collateral vessel이 자라기 위해서는 허혈 부위에 대식세포(macrophage)나 중성백혈구(neutrophile)가 이동하여 tunnel을 먼저 만들고, 이 공간으로 혈관내피세포뿐 아니라 혈관평활근(vascular smooth muscle)과 혈관주위세포(pericyte)가 자라나 완전한 혈관을 형성한다23-25). 치료적인 관점에서 혈관내피세포는 이미 분화된 세포로, 이 세포를 이용하여 혈관 생성 효과를 기대하기는 어렵기 때문에 혈관내피세포로 분화될 수 있는 기원세포를 밝히는 것이 무엇보다 중요하다. 1994년 Asahara 등13)이 골수 단핵구(monocyte) 중 CD34 양성세포를 분리하여 배양하면 혈관내피세포로 분화시킬 수 있다고 보고하면서, 성인에서도 EPC가 존재하는 것을 알게 되었다. 이후로 EPC를 중심으로 한 연구들이 활발하게 진행되었지만 실험실에서의 결과와는 달리 여러 가지 표면 항원으로 분리한 EPC를 이용한 임상 연구들은 기대에 못 미치는 결과를 보이고 있다. 이에 따라 EPC를 분리하거나 배양하여 사용하는 방법 대신 골수세포 전체를 이용하거나, 혈액이나 골수에서 단핵구를 추출하여 하지 허혈이나 심근경색 치료에 이용하고자 하는 방법들이 시도되고 있다7,26).
5. 골수 혹은 혈액 내의 단핵구를 이용한 세포치료
전체 골수세포를 이용한 혈관신생치료는 2002년 일본의 TACT study 그룹이 하지 허혈 환자를 대상으로 시행하여 긍정적인 결과를 보고하였다7). 하지 허혈 환자에서 자가 골수를 추출하여 단핵구를 분리한 뒤 허혈 근육에 직접 주사하였으며, 치료 후 ABI, 경피산소분압, 안정 시 동통 및 보행거리 등이 모두 유의하게 호전되었다. 골수 이외에 말초혈액의 단핵구를 이용한 임상시험에서도 혈관 생성 촉진 효과가 나타나26) 골수 혹은 혈액 내에 존재하는 특정 단핵구 세포 군이 EPC일 가능성을 시사하고 있다. 하지만 투여된 세포가 직접 혈관내피세포로 분화하는지 혹은 사이토카인들(cytokines)을 분비하여 혈관내피세포의 증식을 촉진시키는지 아직 확실하지 않다27,28). 산발적으로 진행되고 있는 세포치료를 임상에 적용하기 위해서는 투여된 골수나 말초혈액 단핵구 중 혈관 생성에 관여하는 특정 세포 군을 분리하려는 노력과 혈관 생성을 촉진시키는 기전을 파악하는 것이 무엇보다 중요하다.
6. Myeloid-derived suppressor cells
혈관신생에 관련된다고 보고된 여러 단핵구 분획 중 myeloid-derived suppressor cells (MDSCs)은 악성종양이 발생한 쥐의 골수와 비장에서 증가되는 세포로, 암 발생과정에서 혈관 신생에 관여된다는 연구 결과가 발표되면서 관심이 증가되고 있다29). MDSCs는 세포 표면에 Gr1과 CD11b를 공동으로 발현하는 세포로, 혈관생성뿐 아니라, 종양 내에서 T 림프구의 증식을 억제하여 종양세포가 면역 반응에 의해 파괴되는 것을 방해한다30,31). 그러나 이 세포군 역시 호중구, 수지상 세포(dendritic cell), 단핵구 그리고 초기 골수성 전구세포(myeloid progenitor cell) 등 다양한 세포로 구성되어 있어, 전체 MDSCs 분획 중 혈관재생에 관여하는 특정세포를 규명하는 일이 필요하다.
저자는 C57BL/6 마우스에서 대퇴동맥(femoral artery)을 절제하면 수술 후 혈류량이 급격히 감소하였다가, 10~14일 경에는 혈관의 재생이 일어나 정상의 40%까지 혈류량이 회복되는 것을 확인하였다32). 혈류량 회복시기에 허혈 근육 내의 MDSCs 수가 수술 전보다 10배 이상 증가하였다가 정상범위 내로 회복되어, MDSCs가 혈관신생과 관련이 있음을 알 수 있었다. 또, 허혈 근육에서 채집한 MDSCs를 C57BL/6 마우스의 허혈 근육에 다시 주사하면 대퇴동맥 절제술만을 시행한 대조군에 비해 유의한 수준의 혈류량 증가(정상의 60%)가 일어나, 수술 후 MDSCs 투여가 혈관생성을 촉진시키는 것을 확인하였다. MDSCs이 혈관내피세포로 직접 분화되는지 확인하기 위해 허혈 근육에서 분리한 MDSCs를 VEGF가 포함된 배양액을 사용하여 배양했을 때, 배양된 세포들이 산발적으로 증식되는 것이 아니라 망막에서의 혈관 생성과 같은 모양으로 GFAP 양성인 astrocyte-plexus가 형성되고 형성된 astrocyte-plexus 위로 isolectin 양성인 혈관 내피세포가 층을 이루면서 방향성을 가지고 일정하게 자라는 모양이 관찰되어, MDSCs이 직접 혈관내피세포로 분화될 수 있는 EPC임을 확인하였다. 아직 마우스를 대상으로 한 초기단계의 동물 실험이긴 하지만, MDSCs이 혈관내피세포의 생성뿐 아니라 혈류재생에 직접적으로 관여한다는 이 연구결과는 임상에서 심근 경색, 뇌경색, 그리고 하지 허혈 등의 환자를 대상으로 한 세포 치료를 한 단계 발전시킬 수 계기가 될 것으로 생각한다.
결 론
혈관생성은 여러 인자들이 서로 밀접하게 연관되어 혈관내피세포의 증식을 촉진시키거나 억제하면서 일어난다. 이전에는 혈관신생 치료의 목적으로 VEGF를 비롯한 혈관신생 촉진인자를 직접 주사하거나 이와 관련된 유전자를 투여하는 방법이 시행되었으나, 허혈 부위는 이미 혈관신생자극이 충분히 이루어지고 있는 상태이므로 유전자나 혈관신생 촉진인자의 주입으로 혈관신생자극을 추가적으로 강화시키기 어렵고, 주입된 단백질이나 유전자의 효과가 지속적이지 못하다는 단점이 있어 최근에는 혈관생성에 관련된 세포를 직접 투여하는 방법이 시도되고 있다. 하지만 혈관생성과 관련된 세포 치료를 시행하여 일관적인 임상효과를 얻기 위해서는 단핵구 세포 중 혈관생성에 관련된 특정 세포 군을 분리하고 확인하는 일이 무엇보다 시급하다.