담관암에 있어서 분자생물학적 측면과 종양표지자들의 역할
Molecular pathogenesis and the role of tumor markers in cholangiocarcinoma
Article information
Trans Abstract
Cholangiocarcinoma is a devastating cancer originating from the epithelial cell lining of the bile duct, whose prognosis is poor due to suboptimal response to therapy despite the fact that the incidence is increasing. Hence surgery still remains the only curative treatment option for cholangiocarcinoma. Recent investigations into the underlying biochemical and molecular mechanisms in biliary carcinogenesis and tumor growth, may illuminate new therapeutic modalities and suggest some new serum and bile markers that could be useful for the diagnosis of cholangiocarcinoma. In this review, we discuss the molecular mechanisms of pathogenesis in cholangiocarcinoma and the role of new tumor makers for the diagnosis of cholangiocarcinoma. (Korean J Med 79:597-604, 2010)
서 론
담관암은 담관을 싸고 있는 담관 상피세포에서 발생하는 암으로 전체 소화기 악성암의 3% 정도를 차지한다1). 지금까지 수술 이외의 효과적인 치료 방법이 없으며, 예후는 매우 불량한 것으로 알려져 있다. 드물기는 하지만 원발성 간담도계 악성종양 중에 두 번째로 흔하며, 최근 전세계적으로 발생률과 사망률이 증가하고 있다2,3).
대부분의 담관암은 진단 당시 상당히 진행되어 발견되는 경우가 많고, 고식적인 치료로는 생존기간이 단지 3~6개월 정도이다4,5). 새로운 치료 방법이 시도되고 있지만, 아직까지 생존기간의 의미있는 증가는 보고되지 못하고 있다6). 현재 담관암의 유일한 근치적 치료 방법은 수술이므로 조기 진단이 무엇보다도 중요하다. 담관암의 진단은 임상적, 생화학적, 그리고 영상학적 검사에 의해 이루어지지만7), 최신의 고도로 발달한 영상학적 진단방법으로도 설명할 수 없는 담관 협착이나 조기 악성 변화는 알기 어렵다8).
최근 담관암에 대한 연구는 분자생물학적 발생기전에 관심이 집중되고 있고, 새로운 기전이 밝혀지고 있다6,9). 이러한 연구 결과들을 토대로 조기 진단을 위한 다양한 종양표지자들이 제시되고 있다10). 따라서 본 특집에서는 담관암의 분자생물학적 발생 기전에 대해 알아보고, 현재 사용중인 종양표지자의 역할에 덧붙여 새로운 발생기전에 따라 향후 기대되는 여러 가지 표지자에 대해 알아보았다.
분자생물학적 병리기전
담관 상피세포의 악성 종양세포로의 전환은 대부분 만성적인 답즙 정체와 염증 상황에서 발생한다. 담관암의 위험인자로 알려지는 것은 간내 담석, 간내 기생충 감염, 원발성 경화성 담관염, Caroli 증후군, 담관 낭종 등이 있다. 이러한 질환들은 지속적인 염증과 기계적 손상, 담즙 정체를 일으킨다. 이런 상황에서 발생한 cytokine 및 활성 산소 등에 의해 발생한 세포들의 손상은 지속적인 세포의 자극과 세포의 세대교체의 증가를 유발하고, 결국 유전자 손상이 축적된 환경을 만든다. 이러한 환경에서 항상성과 세포성장을 유지하기 위하여 담관 상피세포는 복구와 증식 사이의 균형을 유지해야만 한다11). 그러나 결국 유전자 손상과 지속적인 성장 자극이 축적되어 담관 상피세포의 악성세포로의 전환이 진행된다. 이런 악성세포는 성장 억제 신호를 차단하고 세포자멸사회피, 무제한 복제, 지속적인 혈관 신생 등의 특징을 지니면서 결국 전이의 능력을 가지게 된다12). 따라서 만성 염증과 담즙 정체가 담관암 발생에 결정적인 역할을 한다고 말할 수 있다.
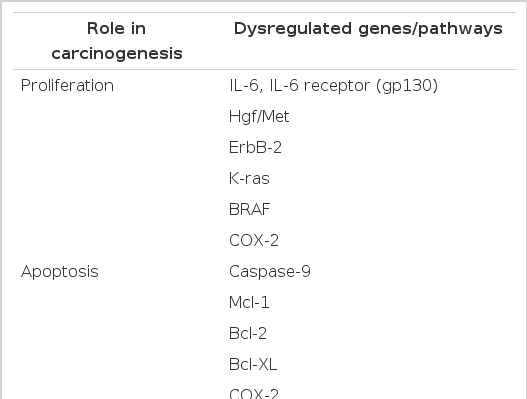
담관암 발생의 여러 단계를 보면 담관암 발생에 자발적인 성장 신호, 성장 억제 신호의 소실, 세포자멸사의 회피, 혈관 신생, 주변 침윤과 전이로 나누어 질 수 있으며 그와 관련된 유전자는 표 1과 같다.
1. 자율 증식 신호전달(Autonomous proliferation signaling)
정상적인 담관 상피세포는 표면에 수용체를 통해 외부에서 성장 신호를 받지만, 담관암은 조절되지 않는 분열촉진물질(mitogen)의 생성이나 새포 내 신호전달체계의 다양한 구성 성분이나 수용체의 활성에 의해 스스로 성장신호를 생성할 수 있다. 이런 세포의 자율 증식에 관여하는 인자로 interleukin(IL)-6와 그 수용체인 gp130, hepatocyte growth factor (HGF), c-met, epidermal growth factor (EGF), c-erb-2, cyclooxygenase-2(COX-2), k-ras 등이 있다11,13).
IL-6는 정상 담관 상피세포나 담관암세포에서 모두 강력한 분열촉진물질로 알려져 있다14,15). 담관암세포에서 높은 수준으로 IL-6가 생성되며, 담관암 환자의 혈청에서 IL-6가 상승되어 있다. 이런 IL-6는 담관암 환자에서 또 다른 염증성 cytokine을 증가시키고, IL-6의 수용체인 gp130의 과발현을 유도한다15). 또한 담관암 세포에서 IL-6는 담관암세포의 성장에 중요한 p44/p42와 p38 mitogen-activated protein kinases(MAPKs)의 활성화에 기여한다16).
HGF 또한 담관 상피세포의 증식에 기여하며, 수용체인 c-met 발현을 촉진한다. 염증상태에서는 주변의 성상세포(stellate cell)에 의해 생긴 HGF에 의해 증식이 일어나지만 담관암세포에서는 자체적으로 생성하여 정상적인 성장 조절을 회피한다17).
정상 담관 상피세포와 염증상태세포, 암세포에서도 모두 EGF receptor (EGFR)가 발현한다. 그러나 담관암세포에서는 EGFR 동종체로 알려진 c-erb-2 종양 유전자가 EGFR과 이합체를 형성하여 제어를 벗어난 성장신호를 생성한다. 암조직을 면역화학 염색하였을 때 악성화된 세포에서 c-erb-2의 과발현을 확인할 수 있고18), 또한 c-erb-2가 과발현된 동물모델에서 담낭암이 빠르게 발병하는 연구 결과가 있었는데 이는 담도계암의 발암기전에 있어서 c-erb-2의 중요한 역할을 시사한다19). 한편 EGFR은 COX-2의 발현 증가에 관여하는 것으로 알려져 있다20).
COX-2는 정상적인 경로에서 주로 활성화되는 COX-1과는 달리 어떤 병적인 상태에서 다양한 cytokine과 분열촉진물질에 의해 유발된다21). COX-2는 담관암세포에서는 보이나 정상 담관 상피세포에서는 보이지 않고, 선택적으로 COX-2를 차단하였을 때 암세포의 성장이 감소하였다22).
K-ras 돌연변이는 담관암 환자들의 21~100%까지 관찰되는데, 이처럼 돌연변이의 빈도가 다양하게 보고되는 것은 k-ras 돌연변이가 간외 담관암의 중요한 발암기전이기 때문에 담관암의 해부학적 위치가 반영된 결과일 수 있으며 서로 다른 병발원인에 의한 영향일 수도 있다23).
2. 성장억제 신호전달의 소실
성장억제 신호는 세포증식을 조절하는 매우 중요한 기전이다. transforming growth factor-β (TGF-β)의 활성은 세포주기의 진행을 억제하여 증식을 완만하게 하는데, 이러한 조절의 중요한 역학을 하는 것이 p53 유전자이다. 종양 억제 유전자인 p53은 두 가지 중요한 기능을 가지는데, 이는 세포 주기를 멈추는 것과 bcl-2 단백질의 발현을 억제하여 항세포자멸사 효과를 막는 것이다. 여러 연구에서 간내 담관암의 20~80%에서 p53의 돌연변이가 관찰된다고 보고하고 있다11). p53 유전자는 과오돌연변이(missense mutation)나 mdm-2와 같은 p53 유전자 억제물질에 의해 기능이 변환되는데, p53 유전자의 기능손실로 인해 세포주기가 멈추지 않고 진행되고 세포자멸사 억제단백질이 증가하게 된다. p53 외에도 세포 성장의 제어에는 p16INK4a, p21waf1/cip1, p27kip1, DCP4/Smad4, mdm-2, telomerase 등이 관여하고 있다24).
3. 세포자멸사의 회피(Evasion)
돌연변이나 변종 세포가 축적되지 못하도록 하여 정상조직 발달과 세포증식에 필수적인 요소가 세포자멸사이다. 세포자멸사는 미토콘드리아에서 cytochrome C가 유리되거나 CD95/Fas/TRAIL/TNF 수용체들이 활성화되었을 때 caspase라는 단백효소들에 의해 시작된다. 이런 세포자멸사의 보호작용이 소실되면 성장이 잘 되는 세포들만 선택되어 암이 발병하게 된다25).
정상 담관 상피세포에는 Fas 수용체가 존재하며 외부의 Fas ligand에 반응하여 세포자멸사가 유발된다. 담관암 세포에도 Fas 수용체가 존재하나 세포자멸사 신호에 반응이 떨어져 결국 발현이 감소하는데 이 기전의 초기에 FLIP (flice 1)이 상향 조절되고 procaspase 8의 활성이 억제되어 Fas 수용체/Fas ligand 신호체계가 약화된다26). 세포 내 과량의 nitric oxide(NO)로 많은 산화스트레스를 받고 있는 담관 상피세포는 caspase-3와 caspase-9를 억제하여, 더욱 세포자멸사에 저항하게 된다27).
한편, COX-2도 세포자멸사에 관여하는데 cytokine, 분열촉진물질, 담즙 등에 의해 증가된 COX-2는 mcl-1이라는 억제 단백질을 증가시켜 Fas ligand를 통한 세포자멸사를 억제한다. 또한 담즙산과 염증성 매개물들도 mcl-1을 상향조절하여 세포자멸사를 억제한다28).
4. 신생 혈관 생성(Angiogenesis)
암세포의 성장 속도는 매우 빠르고 정상적인 혈관의 공급을 넘어서 성장하기 때문에 충분한 혈액 공급을 위해 빠른 신생 혈관 생성이 필요하다. 그러므로, 담관암에서도 신생혈관을 생성 유지하기 위해 vascular endothelial growth factor(VEGF)가 증가하는데, 실제로 19예의 간내 담관암을 대상으로 한 연구에서 모두 VEGF 단백질과 mRNA가 종양의 괴사된 부위나 저산소 부위에서 높게 관찰되었다29). 담관암에서의 VEGF 증가는 TGF-β 자극에 의한 것으로 생각되며, 암세포와 주위의 중간엽 세포(mesenchymal cell)에서 더욱 발현이 증가한다11).
5. 전이 또는 세포간 부착의 소실(Loss of cellular adherence)
담도계암은 침윤성이 높은 암이다. 세포간 상호작용 또는 세포와 세포외 기질의 상호작용이 소실되어야 침윤이 발생한다. 전이는 E-cadherin과 같은 부착분자(adhesion molecule)와 세포외 단백분해효소의 변이를 통해 전이가 가능한데, 담관암에서는 E-cadherin, β-catenin, α-catenin의 발현이 감소되어 세포간 부착이 약화된다고 알려져 있다11). 또한 담관암에서 matrix metalloproteinasese (MMP)의 많은 증가가 보고되었고30), 세포 이동과 종양의 침윤을 증가에 관여하는 aspartyl β-hydroxylase의 과발현도 담관암에서 관찰되고 있다31). β-catenin 감소 조절과 관련있는 c-met 유전자와 c-erbB-2 등도 전이와 관련이 있으며, 또한 교원조직 성장 인자 중에 하나인 WISP1v도 담관 암세포의 림프선과 신경조직 침윤에 관련이 높은 것으로 보고되고 있다13).
종양표지자의 역할
담관암 발생의 분자생물학적 기전에 대해 하나씩 밝혀지면서 여러 가지 종양표지자들이 새로이 제시되고 사용되고 있다. 현재 사용중인 종양표지자의 역할과 새롭게 제시되고 있는 표지자에 대해 알아보았다.
1. 혈청 종양표지자
혈청을 이용한 표지자는 얻기 쉽고 비용이 저렴하므로 매우 매력적이다.
1) Carbohydrate 19-9 (CA19-9)
현재 가장 많이 사용하는 혈청 표지자이다. 하지만 약 7% 해당하는 Lewis-antigen 음성인 사람들에게는 사용할 수 없다. 322명의 담도계 질환을 가진 환자를 비교한 연구에서 담관암을 가진 환자의 74%에서 CA19-9의 상승(>37 U/mL)이 관찰되었다32). 하지만 췌장암, 위암, 원발성 담즙성 경화증에서도 상승할 수 있으며, 흡연자나 양성 질환으로 담도염이 있거나 담즙 정체가 있어도 상승할 수 있다. CA 19-9의 위양성과 빌리루빈과 CA19-9과 관계에 대한 연구에서 빌리루빈 수치는 CA19-9 수치에 유의한 영향을 주었으며 담즙 배액 후에 빌리루빈 수치와 더불어 CA19-9 수치도 44% 감소하였다33). 여러 연구에서 CA19-9의 진단의 정확도는 기준과 대상에 따라 많은 차이를 보인다34).
최근에는 이런 CA19-9을 대체하거나 보완해줄 수 있는 혈청 표지자를 찾기 위한 많은 연구가 진행되고 있다. 즉, CA50, CA242, CA195와 pancreatic cancer associated antigen 2(DU-PAN-2) 등이 연구되었으나 진단적 정확도에서 만족할만한 결과를 보이지 않았다34).
2) IL-6
담관암 발생에 중요한 cytokine인 IL-6를 표지자로 사용하자는 의견은 1998년부터 계속적으로 제기되었다35). 최근 26명의 담관암 환자와 26명의 간암, 그리고 23명의 건강한 성인을 대상으로 한 연구에서 혈청 IL-6를 25.8 pg/mL를 cut-off 기준으로 하였을 때 민감도 73%, 특이도 92%, 양성예측도 83%, 음성예측도 87%로 보고하였다. IL-6의 정도와 담관암의 양에 비례한다고 하였고, 광역학치료(photodynamic therapy) 후 의미있게 감소함이 보고되었다36). 매우 고무적인 내용이지만, 간암이나, 양성 담관 질환, 전이성 질환에서도 상승할 수 있어 특이도에 한계가 있다.
3) Trypsinogen-2
췌장의 선포세포(acinar cell)에서 분비하는 단백질 분해효소인 trypsinogen-2는 급성 췌장염에서 증가한다. 따라서 췌장암이나 다른 소화기암의 종양표지자로서의 가능성에 대한 연구가 진행되어 왔다37). 최근 원발성 경화성 담관염 환자에서 trypsinogen-2를 이용하여 담관암 동반 유무를 비교한 연구에서 높은 정확도를 보여주었고, CA19-9과 달리 trypsinogen-2와 빌리루빈과 관련성이 없어 담즙정체에 영향을 받지 않는 표지자의 가능성을 보여주었다38). 향후 추가적인 연구가 필요하나 기대되는 표지자이다.
4) Mucin
Mucin은 많은 기관의 상피세포에서 만드는 단백질로 점막 표면을 보호하고 막 단백질(transmembrane protein)로서 역할을 한다39). 최근 다양한 암에 대해 mucin을 이용한 종양표지자 연구가 진행되고 있다. 대부분의 담관암이 mucin을 생성하는 악성 선암으로 MUC5AC의 비정상적인 발현을 나타내는 경우 나쁜 예후와 연관성이 있다. 또한 MUC1과 MUC5AC는 간암에서는 생성되지 않으므로 감별진단에 도움이 된다. 혈청의 MUC5AC가 담관암에서도 증가하므로, 이를 이용하여 169명의 담관암 환자와 120명의 대조군의 혈청 MUC5AC로 측정하였을 때 민감도 71.01% 특이도 90%를 보였고, 평균 생존기간이 높은 혈청 MUC5AC가 158일, 낮은 혈청 MUC5AC가 297일로 높을수록 나쁜 예후로 보여 혈청 MUC5AC가 진단과 예후를 판단하는 데 가치가 있었다40). 또한, 담즙의 MUC4와 혈청의 MUC5AC 이용한 검사에서 높은 특이도와 나쁜 예후와 관련성을 보여주었다41).
2. 담즙 표지자
담즙은 담관암을 진단하는데 있어 또 하나의 검체로 연구되어 왔다. 담즙이 혈청보다 더 종양에 가깝고 담관을 통해서 나오므로 담관암에서 생성된 물질이 더 많이 포함되어 있을 가능성이 있다. 하지만 담즙의 채취를 위해서는 다소 침습적인 방법이 필요하므로 선별검사로는 한계가 있다.
1) Insulin-like growth factor 1 (IGF1)
담관암 조직에서도 암의 발생, 성장, 전이와 관련된 IGF1과 VEGF가 발현하는데, 이를 담도 폐쇄로 ERCP를 시행한 환자의 담즙에서 측정하였을 때 IGF1은 췌장암이나 양성 담관 질환에 비해 간외 담관암에서 15~20배 정도 높았으나 VEGF는 큰 차이를 보이지 않았다43). 이 연구는 담도 폐쇄가 있을 때 ERCP를 시행 후 얻은 담즙으로 췌장암이나 다른 암과 간외 담도암을 구별하는 데 담즙 IGF가 높은 정확도를 나타냄을 보여주었다. 또한 최근 담관암에서 IGF-binding protein 5 유전자가 상승 조절되었다는 보고가 있어 IGF가 담관암의 생장에 깊게 관여함을 보여준다43).
2) Pancreatic elastase-3B
Pancreatic elastase-3B는 여러 세포외 기질 단백질을 가수분해하는 효소로 기본적으로 pancreatic elastase-1과 동일하다. 혈청에서 pancreatic elastase-1은 췌장암에서 나타나고 CA19-9 혹은 CEA와 함께 췌장암의 조기 진단을 위한 표지자로 제시되고 있다34). 담도 폐쇄가 있는 환자의 답즙에서 pancreatic elastase의 효소 활성도와 췌장액의 담관 역류를 보정하기 위한 pancreatic elastase/amylase ratio를 측정하여 악성과 양성 담관 협착을 비교한 결과, 민감도 82%, 특이도 89%를 보였다. 또한 담관암 조직에서 pancreatic elastase-3B의 mRNA를 확인하여 담관암의 표지자로 제시한 바 있다44).
3) Minichromosome maintenance 5 (MCM5)
MCM 복제 단백질은 이형성의 표지자로 자궁경부암과 방광암의 진단에 사용되고 있다. 최근 담관 폐쇄를 보인 102명에 대해 전향적으로 ERCP를 시행하여 모은 답즙 검체에서 MCM5를 측정하여 brush cytology와 비교하였을 때 더 높은 민감도(66 vs. 20%)와 비슷한 양성예측도(97% vs. 100%)를 보였다45). 이는 담즙 MCM5이 일반적인 cytology보다 더 민감한 표지자일 가능성을 보여주었으며, 추가적인 연구가 필요하다.
3. 분자생물학적 표지자(Molecular markers)
담관암 진단에 있어서 기존의 조직 검사나 담즙에서의 세포진 검사는 특이도가 매우 높으나 민감도가 낮은 것이 문제이다. 그러나 악성화되는 과정의 분자수준의 변화를 검사한다면 민감도와 정확도를 모두 높일 가능성이 있으므로 최근 이런 분자 표지자에 대한 연구가 이루어지고 있다.
1) K-ras and p53 유전자 돌연변이
K-ras oncogene과 p53 tumor suppressor 유전자가 가장 자주 검사되는 항목이다. 외과적으로 제거한 조직에서 k-ras 돌연변이는 20~100% 정도로 발견된다37). 이런 k-ras 돌연변이는 담관암 발생 중에 자주 그리고 초기에 일어나므로 선별검사의 표지자로 좋은 후보자이다. 그러나, 여러 양성 혹은 악성 담췌관 질환과 전이성 암, 림프종에서 k-ras 유전자 돌연변이를 담즙이나 췌장액에서 측정하였을 때 진단율이 췌장암에 비해 담관암은 두드러지게 낮았다46). 다른 여러 연구에서도 k-ras 분석은 기존의 세포병리학 검사보다 민감도와 특이도 면에서 만족스럽지 않았다37). 또한 k-ras 돌연변이는 몇몇 연구에서는 양성질환 및 담도 폐쇄를 일으키는 전이암이나 림프종에서도 발견되었다. 원발성 답즙성 경화증 환자를 대상으로 시행한 전향적 연구에서, 환자의 30%에서 k-ras 돌연변이가 있었지만, 32개월의 추적 관찰 결과에서 단지 4명의 담관암과 2명의 이형성증의 발생을 보여, 표지자로서 한계를 보였다47).
p53 tumor suppressor 유전자는 DNA 회복, 세포자멸사와 상피세포의 항상성을 유지하는 역할을 한다. p53 돌연변이는 인간의 악성암에서 밝혀진 유전자 이상 중에서 가장 흔한 것으로 담관암 환자의 수술 조직에서 30~37%에서 관찰된다. 혈청에서 p53의 항체를 담관암, 췌장암, 양성질환에서 측정하였을 때 15%, 28%, 3%에서 각각 발견되었다. 특이도는 96%로 훌륭하지만 민감도는 21%로 실망스러운 수준이다48). 대부분의 연구에서 p53은 k-ras보다 담관암에서 발견율이 낮았으나, 둘을 같이 사용하여 검사할 경우 특이도는 영향이 없으나 민감도가 68~80% 정도로 증가하였다49).
2) p16INK4a/p14ARF
p16INK4a 유전자는 cyclin D1과 상호작용을 억제하는 cyclin-depenent protein을 하향 조절하는 작용을 하는 것으로 이를 불활성화 하면 부적절한 세포 주기가 진행되어 암발생에 관여한다. 이런 p16INK4a 촉진유전자 메틸화가 암발생의 매우 초기에 자주 발생하므로 선별 검사의 방법으로 관심을 가지게 되었다. p14ARF는 p53의 acting upstream에 의해서 G1 정지를 유발하는 기능과 p53과 독립적으로 세포주기를 조절하는 역할을 한다50).
41명의 담관암 환자의 조직에서 p16INK4a 촉진유전자 메틸화가 83%에서 발견되었고, ERCP에 통해 얻은 담즙에서 p16INK4a와 p14ARF 촉진유전자의 메틸화를 측정한 결과, 담관암에 대한 민감도는 각각 53%와 46%를 보였고, 특이도는 94%와 97%를 보였다51).
결 론
최근 담관암의 발생에 대한 많은 연구로 분자생물학적 발생 기전에 관여하는 여러 유전자와 단백질에 대해 밝혀지고 있고, 이런 기전을 바탕으로 많은 종양표지자들이 제시되고 있다. 하지만 실제로 임상적으로 사용하기 위해서는 더 많은 연구가 필요하다. 또한 답즙의 IGF1이나 elastase, mucin 같이 결과가 좋을 것으로 생각되는 표지자들이 있지만 이는 어떻게 하면 답즙을 덜 침습적인 방법으로 얻을 수 있는지를 고민해야 할 것으로 생각한다. 앞으로 더 많은 연구를 통해서 선별검사로도 사용할 수 있는 민감도와 특이도를 가진 종양표지자를 찾도록 해야 할 것이다.