서 론
비소세포폐암은 폐암의 80~85%를 차지하고 있으며1) 전세계적으로도 여전히 암 관련 사망률 통계에서 1위를 차지하고 있는 암이다. 미국에서는 2007년에 1,611,000명이 비소세포폐암으로 사망하였고2), 국내에서도 2006년에 암으로 인한 사망 원인 중 1위가 비소세포폐암이다. 폐암은 대부분 조기 발견이 힘들고 발견 당시 이미 진행성인 경우가 많아 고식적 항암화학요법이 발달해 왔다. 현재 진행성 비소세포폐암의 표준 1차 항암화학요법은 platinum을 기반으로 한 gemcitabine, docetaxel, vinorebine 혹은 irinotecan과의 병용요법이다3). 그러나 진행성 비소세포폐암 환자에서 현재 가장 효과적인 것으로 검증된 이러한 2제 복합화학요법을 시행하여도 1차 항암요법에 대한 반응 기간이 짧아서 치료 이후 평균 4~6개월 후에는 질병이 진행하게 된다. 따라서 대다수의 환자들이 치료 실패를 경험하여 구제 요법이 필요하게 되었다. Docetaxel은 표준 1차 치료에 반응이 없었던 비소세포폐암 환자들에게서 2차 항암요법으로 투여하였을 때 보존적인 치료와 비교하여 생존율에 있어 의미있는 향상을 보였으며(median survival 7.5 months vs. 4.6 months)4), vinorelbine이나 ifosfamide와 비교한 연구에서도 생존율에 있어서 더 나은 결과를 보여 그 효과가 입증됨으로써5) 진행성 비소세포폐암에서 platinum을 기반으로 한 표준 1차 치료에 실패한 경우 2차 항암요법으로 인정되었다. 최근 비소세포폐암에서 EGFR tyrosine kinase의 체세포 돌연변이가 발견되면서 분자표적치료가 주목받기 시작하였고, 이러한 분자표적치료가 이전의 세포독성 항암치료와 비교하여 부작용은 덜하고 동등한 효과를 보인다는 연구 결과들이 발표됨에 따라 2차 항암요법으로 인정되었으며 이 중 대표적인 것으로 EGFR tyrosine kinase inhibitor (EGFR TKIs)인 gefitinib과 erlotinib이 있다. IDEAL2 연구에서는 이전에 platinum을 기반으로 한 항암화학요법에 실패한 환자들을 대상으로 구제요법으로 gefitinib을 투여하였을 때 10%의 관해율과 8.4개월의 중앙생존기간을 보고하였으며6), INTEREST 연구에서는 이전 치료에 실패한 비소세포폐암 환자들에서 gefitinib을 사용하였을 때 docetaxel과 비교하여 생존율에 있어 동등한 효과를 보임을 발표하였다7). 또한 최근 연구에서 다표적 항엽산 제제인 pemetrexed는 이전 치료에 반응이 없었던 비소세포폐암 환자들에게 투여하였을 때 위약군과 비교하여 의미있는 생존율의 향상을 보였으며, docetaxel과 비교한 3상 연구에서도 동등한 효과를 보이면서 보다 나은 안정성을 가지고 있는 것으로 보고되면서 비소세포폐암의 2차 항암요법으로 인정되었다8). 현재까지 2차 항암요법으로 인정된 표준화된 치료제로는 docetaxel, EGFR TKIs, pemetrexed가 있으며 그 중 EGFR TKIs와 pemetrexed는 비소세포폐암, 특히 선암에서 효과가 우월한 것으로 나타나고 있으나 2차 이상의 항암치료에서 pemetrexed와 EGFR TKIs를 직접 비교한 연구는 부족한 현실이다. 최근 비소세포폐암 환자들에서 약제 선택 시 고려될 수 있는 EGFR 유전자변이, K-ras 유전자변이, TS-1의 발현 등의 분자유전학적 예측인자들에 관한 많은 연구들이 진행되고 있기는 하지만 이러한 분석은 충분한 조직의 확보가 선행되어야 한다는 제약이 있으며 검사 방법에 있어서도 논란이 있어 두 약제의 임상 효과 및 효과에 영향을 미치는 임상적 특징에 대한 비교 분석이 필요하다. 따라서 본 연구는 비소세포폐암의 2차 이상의 항암 화학 요법에서 EGFR TKIs와 pemetrexed의 임상적인 특징에 따른 치료 성적을 비교함으로써 구제치료의 선택에 도움을 주고자 하였다.
대상 및 방법
1. 대상
2002년 2월부터 2009년 8월까지 부천 순천향대학교병원 혈액종양내과에서 비소세포폐암을 진단받은 환자들 중 편평상피암을 제외한 선암과 대세포암 환자들을 대상으로 하였으며 이들 중 gefitinib이나 erlotinib 및 pemetrexed로 치료받은 환자를 의무기록을 통해 후향적으로 조사하였다. 대상 환자는 18세 이상이었으며 수술적 치료가 불가능한 병기인 IIIB와 IV였고, 이들 중 뇌전이가 있었던 환자들도 포함되었다. 또한 환자들은 모두 platinum을 기초로 한 1차 항암요법 이후 실패하여 2차 이상의 항암 치료를 받는 경우였다.
2. 치료효과의 판정 및 용어 정의
Gefitinib군은 일 1회 250 mg, erlotinib군은 일 1회 150 mg을 복용하였고, pemetrexed군은 체포면적당 500 mg을 3주마다 주사 투여하였다. 약물 복용은 진행성 병변을 보이거나, 심한 부작용이 나타난 경우, 환자의 전신상태가 약물을 투여할 수 없을 정도로 악화되거나 환자가 거부할 시에는 중단되었다. Gefitinib과 erlotinib 군에서는 치료 효과를 판정하기 위해 투약 약 1개월 후 흉부 단순촬영과 흉부 전산화단층촬영을 시행하였고, 투약 후 2, 3개월 간격 또는 병의 진행이 의심될 때마다 흉부 단순촬영, 흉부 전산화단층촬영과 병변이 포함된 타 부위 CT 및 필요 시 전신 골주사 검사를 시행하였으며 간독성 확인을 위해 투약 시작 약 1주일 후에 간기능 평가를 시행하였다. 비흡연자는 일생 동안 흡연을 하지 않은 군으로 정의하였고, 흡연자는 과거 또는 현재 흡연자를 모두 포함하였다. 치료 반응과의 연관성 분석에서 항암 치료를 받은 차수는 2차 항암치료를 받은 환자군과 3차 이상의 항암치료를 받은 환자군으로 구분하였고, ECOG scale은 0~1인 환자군과 2~3인 환자군으로 나누어 치료 반응을 평가하였다. 치료 반응을 평가하기 위해 pemetrexed 투여 2, 3회마다 또는 병의 진행이 의심될 때마다 흉부 단순촬영, 흉부 전산화단층촬영과 병변이 포함된 타 부위 전산화단층촬영, 자기공명영상 및 필요 시 전신 골주사 검사를 시행하였다. 치료 반응 평가는 Response Evaluation Criteria in Solid Tumor (RECIST) 기준에 준하여 판정하였으며, 중앙관찰기간은 치료 개시 시점부터 마지막 자료 분석 시점까지로 정의하였다. 또한 치료 반응 평가 시 질병 조절율(disease control rate, DCR)은 병이 진행하지 않으면서 완전관해, 부분관해, 안정성 질환 중 어느 하나로 지속되는 경우로 하였고, 무진행 생존기간(progression free survival, PFS)은 치료 시작일로부터 질환의 진행일 또는 질환으로 인한 사망일까지로 정의하였으며 항암치료 중 발생하는 독성 판정은 매 주기마다 NCI-CTC (National Cancer Institute-Common Toxicity Criteria) version 3.0에 따라 평가하였다.
결 과
1. 환자군 특성
2002년 2월부터 2009년 8월까지 진행성 비소세포폐암 환자 중 편평상피세포암을 제외한 총 61명이 연구에 참여하였다. 그 중 erlotinib군이 18명(29.5%), gefitinib군은 18명(29.5%), pemetrexed군은 25명(41%)이었으며 치료군 사이에는 서로 중복되는 환자들이 존재하였고, 중앙관찰기간은 36개월(7~97개월)이었으며, 각 군별 중앙투여기간은 erlotinib군은 2.0개월(1~9.5개월), gefitinib군은 2.7개월(0.7~10개월), pemetrexed군은 1.9개월(0.5~23개월)이었다. 전체 환자의 중앙나이는 63세(35~77세)였고, 남자가 29명(47.5%), 여자가 32명(52.5%)이었으며 전체 환자 중 사망이 확인된 경우는 40명(65%)이었다. 비흡연자가 41명(67.2%)이었고, 선암이 57명(93.4%)으로 환자의 대부분을 차지하였으며, 병기는 IIIb가 6명(9.8%), IV가 55명으로 환자의 90% 이상이 원발 장기의 전이를 동반한 환자였다. 또한 EGFR TKIs나 pemetrexed를 2차 요법으로 투여 받은 환자는 21명(34.4%), 3차 요법으로 투여받은 환자는 28명(45.9%)이었고, 4차 이상의 치료로 투여받은 환자도 12명으로 전체 환자의 19.7%를 차지하여 여러 번 항암치료에 실패한 환자들이 다수 포함되었다. 치료 시작 전 각 군의 연령, 성별, 흡연력, 병기, 조직학적 소견, 항암요법의 횟수 및 전신상태를 포함한 전체적인 환자의 특징은 유사하였다(표 1).
2. 치료반응
전체 환자 총 61명 중 치료 반응을 평가하기 전에 사망한 pemetrexed로 치료하였던 2명을 제외한 나머지 59명의 환자에서 치료 반응의 평가가 가능하였다. Pemetrexed로 치료를 받다가 사망한 2명은 모두 감염과 관련된 합병증으로 사망하였으나 치료와의 연관성은 분명하지 않았다. 전체적인 치료 반응율은 18명에서 부분관해를 보여 30.5%의 반응율을 보였고, 질병 조절율은 66.1% (39명)였다. 세 군의 치료반응을 비교해 보면 erlotinib군의 치료 반응율은 33.3% (6명), 질병 조절율은 61.1% (11명)였고, gefitinib군의 치료 반응율은 38.9%(7명), 질병 조절율은 66.6% (12명)였으며 pemetrexed군의 치료 반응율은 21.7% (5명), 질병 조절율은 60.8% (14명)로 세 군 간의 치료 반응율(p=0.473) 및 질병 조절율(p=0.917)에 통계학적 차이는 없었다. 치료군을 재설정하여 EGFR TKIs군과 pemetrexed군으로 나누어 치료 반응을 비교해 보았을 때에도 두 군 간의 치료 반응율(p=0.242) 및 질병 조절율에(p=0.515) 있어서 통계학적으로 유의한 차이는 없었다(표 2).
3. 치료 반응에 영향을 미치는 인자
전체 치료군에서 성별에 따른 반응율을 살펴보면 남성의 경우 반응율은 37.9%였으며 여성의 경우 21.9%를 보였으나 통계학적으로 유의한 차이는 없었다(p=0.261). 병기에 따라서도 stage IIIB인 경우 16.7%, stage IV의 경우 30.9%로 반응율에 있어 통계학적으로 유의한 차이는 없었다(p=0.660).
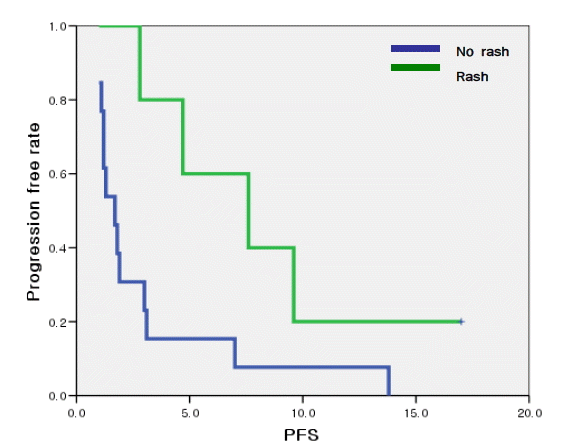
전체 치료군을 EGFR TKI군과 pemetrexed 두 군으로 나누어 양 군 간에 치료 반응에 영향을 미치는 인자들을 분석해 보았을 때 EGFR TKI군에서는 치료에 대한 반응율에 있어서 나이, 흡연력, 병기에 따른 차이가 없었으나, 여성에서 52.8%로 남성과 비교하였을 때 통계학적으로 유의하게 반응율이 높았고(p=0.047), pemetrexed군에서는 나이, 흡연력, 병기, 성별이 반응율에 통계학적으로 의미있는 영향을 미치지 못했다(표 3). EGFR TKI군의 반응율과 발진과의 관계를 비교하였을 때 발진이 있는 군에서의 치료 반응률은 66.7%로 발진이 없는 군에서의 치료 반응율보다 높은 경향을 보였으나 통계학적으로 유의한 차이는 없었다(p=0.078). 질병 조절율에 있어서도 발진이 있는 군에서 100%, 발진이 없는 군에서는 56.7%로 발진이 있는 군에서 질병 조절율이 더 높은 경향을 보였으나 통계학적으로 유의한 차이는 없었고(p=0.068), 피부 발진의 심한 정도와 치료 반응율에 있어서도 유의한 상관관계를 보이지 않았다(p=0.535).
4. 치료독성
치료독성은 전체 61명의 환자에서 모두 평가 가능하였으며 치료독성으로 인해 치료를 포기하는 환자는 없었다. 혈액학적 독성을 비교해 보았을 때 erlotinib군은 11.1% (2명)의 환자에서 2단계 백혈구 감소증을 보였으며, pemetrexed군은 8.0% (2명)의 환자에서 2단계 백혈구 감소증을 보였고, 그 중 한 명에서는 3단계 혈소판 감소증을 동반하였다. 비혈액학적 독성 중의 하나인 피부 발진은 전체 61명의 환자 중 11.5% (7명)에서 나타났다. 그 중 erlotinib군은 27.8% (5명), gefitinib군은 5.6% (1명), pemetrexed군은 4.0% (1명)에서 피부발진을 보여 erlotinib군에서 피부발진의 발생율이 의미있게 높았다(p=0.035). 피부발진의 정도를 보면 erlotinib군은 총 5명 중 1단계 피부발진이 1명, 2단계 피부발진이 4명 있었으며, gefitinib군과 pemetrexed군은 각각 한 명의 환자에서 1단계의 피부발진을 보였다. 전체 환자에서 치료독성을 보았을 때 pemetrexed를 복용한 환자 중 단 한 명의 환자에서 3단계 혈소판 감소증이 나타난 것을 제외하고는 혈액학적, 비혈액학적 독성 모두에서 1-2단계의 가벼운 독성만을 보였다(표 4).
5. 무진행 생존기간
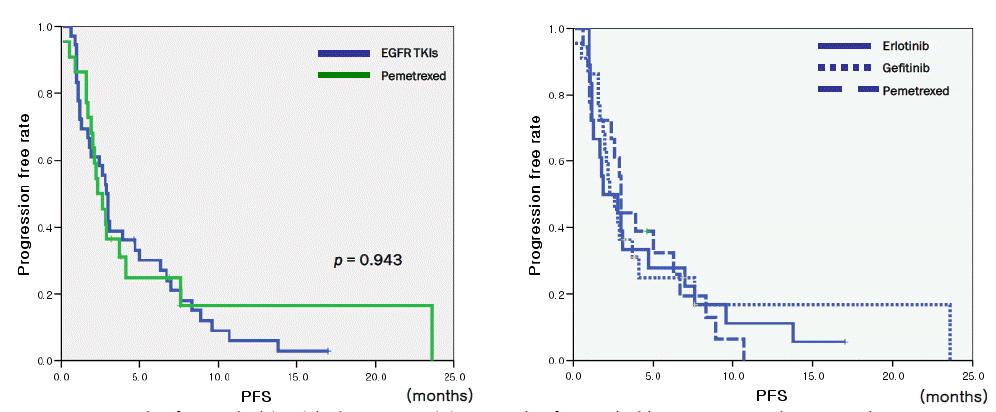
무진행 생존기간의 중앙값을 비교해 보았을 때 erlotinib군에서 1.9개월(95% CI, 0.00~3.97), gefitinib군에서 3개월(95% CI, 2.79~3.20), pemetrexed군에서 2.3개월(95% CI, 1.49~3.10)로 통계학적으로 유의한 차이가 없었고(p=0.996), EGFR TKIs군과 pemetrexed군으로 다시 나누어 비교하였을 때에도 무진행 생존기간의 중앙값은 EGFR TKIs군에서 2.9개월(95% CI, 2.43~3.37)로 pemetrexed군과 비교하여 의미있는 차이가 없었다(p=0.943) (그림 1).
고 찰
폐암은 발견 당시 이미 진행성인 경우가 많고, 재발을 잘하여 주로 고식적인 항암요법이 발달해 왔다. 현재 진행성 비소세포폐암에서 1차 항암치료는 platinum을 기반으로 하는 2제 복합항암요법이다. 그러나 이러한 2제 복합항암요법은 질병의 진행까지의 기간이 4~6개월 정도로 저조하고9,10), 대부분의 환자에서 다시 진행하여 추가적인 항암치료가 필요하게 된다. 이러한 이유로 보다 효과적이면서도 독성이 적은 치료가 절실히 필요하여 비소세포폐암에 대한 항암요법은 지속적으로 발전하고 있다. 최근 암이 발생하고 진행하는데 관련된 여러 가지 분자생물학적 인자가 알려지기 시작하면서 같은 항암제라 할지라도 암이 가지는 분자생물학적 특성에 따라서 치료반응이 다를 수 있다는 연구 결과들이 나오면서 ‘개별화된 항암치료’의 개념이 대두되고 있다. 이러한 개념을 바탕으로 EGFR TKI에 대한 연구에서는 선암, 아시아인, 여성, 비흡연자에서 효과적이라는 것이 밝혀졌으며11,12), EGFR의 돌연변이가 있고, K-ras 돌연변이가 없을 때 EGFR TKI에 대한 반응율이 좋다는 보고들이 나오고 있어13-15) 앞으로 추가적인 치료반응과 관련된 분자생물학적인 예후인자들이 밝혀질 것으로 기대되고 있다. Pemetrexed는 선암에서 반응이 우월한 것으로 알려져 있으며 항암제 감수성에 대한 유전자 발현율의 차이를 관찰한 한 연구에서는 TS-1, DHFR, CARFT의 유전자 발현 정도와 치료 효과 사이에 상관관계가 있다고 보고하였다16). 이러한 분자생물학적인 인자들에 대한 연구가 진행성 비소세포폐암의 예후를 향상시킬 것으로 기대되고 있지만, 현재 EGFR TKI의 반응에 영향을 주는 것으로 알려진 EGFR의 돌연변이, EGFR 유전자 복제 수와 EGFR의 면역조직화학적 발현 등에 대해서 아직까지 논란이 있다. 이러한 EGFR에 관한 분자생물학적 이상 소견은 같은 폐암일지라도 환자의 특성에 따라서 각기 서로 다른 다양한 분자생물학적인 기전이 작용한다는 것을 시사하며 이것은 폐암의 치료에 있어서 보다 효과적이고 다양한 선택을 할 수 있는 가능성을 열어 주었지만 아직까지는 임상에서 쉽게 이용하기가 어려운 실정이며 그 검사 방법에 있어서도 표준화된 자료가 부족하다. 따라서 본 연구에서는 비소세포폐암에서 2차 이상의 항암요법으로 많이 사용되고 있는 EGFR TKI와 pemetrexed의 임상적인 특징에 따른 효과를 비교 연구하였다. 본 연구에 포함된 환자들은 대부분 원발 부위의 전이가 동반된 4기 환자들이었고, 모두 2차 이상의 항암요법으로 치료를 받는 환자들이었으며 전체 환자 중 3차 이상의 항암요법으로 치료받는 환자가 65.6%로 다른 항암치료에 반응이 좋지 않았던 경우가 상당부분 포함되었다. 전체 환자 중 93%가 선암이었고, 여성이 52.5%, 비흡연군이 67%를 차지하였다. 본 연구에서는 erlotinib, gefitinib 및 pemetrexed 세 군 간에 반응율, 생존기간 및 무진행 생존기간에 있어서 통계적으로 유의한 차이는 없었고, EGFR TKI와 pemetrexed 두 군으로 나누어 비교하였을 때에도 반응율, 생존기간 및 무진행 생존기간에 있어서 의미있는 차이를 보이지 않았다. 그러나 다른 항암치료에 실패한 치료가 어려웠던 환자들을 대상으로 하였음에도 불구하고 전체 치료 반응율이 29.5%, 질병 조절율이 63.9%로 높았으며, EGFR TKI와 pemetrexed 두 군으로 나누어 비교하여도 치료 반응율이 각각 36.1%, 20%, 질병 조절율이 각각 63.9%, 64%로 높았다는 점은 1차 표준 항암요법에 반응이 좋지 않았던 비소세포폐암에서 2차 이상의 치료로 EGFR TKIs와 pemetrexed가 중요한 치료제가 될 수 있음을 시사하였다.
EGFR TKIs군에서 치료 반응에 있어서 조직형이나 흡연 여부, 성별에 따라 차이가 있을 것으로 생각하였으나 여성에서 치료 반응율이 의미있게 높았던 것을 제외하고는 유의한 차이를 보이지 않았는데 흡연력에 따라 차이를 보이지 않은 것은 본 연구에 포함된 환자들을 흡연군과 비흡연군으로 구분하여 반응율을 비교할 때 한 번이라도 흡연을 한 경험이 있는 환자들을 흡연군에 포함시켰고, 현재의 흡연자뿐만 아니라 과거 흡연자까지 흡연군에 포함시켰기 때문에 상대적으로 가벼운 흡연자까지 모두 흡연군으로 구분한 것이 영향을 미쳤을 가능성이 있다. 또한 본 연구에서는 선암 이외에 다른 조직형이 거의 없었기 때문에 조직형에 따른 치료반응에 대한 통계학적인 분석 자체가 불가능하였다는 한계가 있었다. Pemetrexed에서는 반응율에 의미있게 영향을 미치는 인자는 없었다. 최근 여러 연구에서 pemetrexed가 선암에서 우월한 효과를 보인다고 보고하고 있지만 본 연구는 비편평세포폐암 환자를 대상으로 하였고, pemetrexed를 복용한 총 25명의 환자 중 24명이 선암이었으며, 대세포암은 1명에 불과하여 조직형에 따른 비교 자체가 어려워 이와 같은 사실을 확인하기는 어려웠다. EGFR TKI의 대표적인 부작용으로는 피부 발진, 설사, 식욕 감퇴, 구내염, 골수 억제 등이 있고 가끔 간질성 폐렴을 유발하는 것으로 알려져 있다17,18). 최근 Pérez-Soler 등의 연구11)에서는 erlotinib 투여군에 있어서 발진이 심하게 생긴 군일수록 생존기간이 의미있게 연장되는 됨을 보고하였고, Mohamed 등,18)은 비소세포 폐암에서 gefitinib 복용에 의해 피부발진이 발생하는 경우 생존율이 더 좋다고 보고하였다. 본 연구에서는 EGFR TKI를 투여받은 환자 중 16.6%의 환자에서 피부발진이 나타났고 이러한 피부발진이 있었던 환자군에서 발진이 발생하지 않은 환자군보다 치료반응율이 더 높은 경향을 보였으나 통계학적으로 유의한 차이는 없었다. 질병 조절율에 있어서도 피부발진의 유무에 따른 통계학적으로 유의한 차이는 없었으나 erlotinib군에서 무진행 생존기간의 중앙값이 발진이 발생한 환자에서 유의하게 더 길었다. 본 연구에서는 이제까지 보고된 것과 마찬가지로 피부발진이 치료 반응과 어느 정도 연관성이 있음을 알 수 있었으나 부작용이 발생한 환자의 절대수가 적어, 통계학적으로 유의한 차이를 보이기 어려웠을 것으로 생각된다. 특히 gefitinib군에서는 총 18명 중 단 한 명에서만 피부 발진이 발생하여 발진의 유무와 치료 반응율 및 생존율, 질병의 진행까지의 기간과의 상관관계를 파악하는 것이 어려웠다. 그러나 18명의 환자들 중 5명에서 피부발진이 발생하여 상대적으로 피부발진의 발생율이 다른 치료군에 비해 통계학적으로 의미있게 높게 나타난 erlotinib군에서 발진이 있었던 환자들이 무진행 생존기간이 길게 나타난 것은 주목할만한 결과라고 할 수 있다. 이는 대규모 연구를 시행할 경우보다 의미있는 결과를 얻을 가능성이 있음을 보여주는 것으로 앞으로 피부발진과 반응율 및 생존기간과의 상관관계에 대한 많은 연구가 필요할 것이다. 본 연구에서는 단 한 명에서 3단계의 혈소판 감소증이 나타난 것을 제외하고는 혈액학적, 비혈액학적 독성에 있어서 1, 2단계의 비교적 경도의 항암독성만을 나타냈으며, 그 빈도도 적었고, 항암치료의 독성으로 인해 치료를 중단하는 경우는 없었다. 항암독성이 심하지 않았던 점은 본 연구 참여자 대부분이 이미 여러 번 항암치료에 실패하였던 치료가 어려웠던 환자라는 것을 감안할 때 환자의 치료 순응도를 높일 수 있는 중요한 이점으로 생각된다. 본 연구는 이미 여러 차례 항암치료를 받은 환자들을 대상으로 하여 치료군 간에 중복되는 환자들이 있어 각각의 치료군에 따른 생존율을 평가하는데 있어 제한 점이 있다. 그러나 EGFR TKI와 pemetrexed가 이전 치료에 반응이 없었던 환자들에서도 좋은 치료 반응율과 질병 조절율을 보였다는 점과 다른 항암치료와 비교하여 부작용이 적었다는 점에서 의미가 있으며, 통계학적으로는 유의한 차이는 보이지 못하였지만 EGFR TKI 군에서 pemetrexed군보다 치료 반응율이 좋은 경향을 보인 것은 본 연구에 포함된 환자들 중 과반수 이상이 여성, 비흡연자, 아시아인으로 이런 환자들에서 최근 EGFR TKI 치료가 효과적이다19)라는 결과와 일치한다는 점에서 의미가 있다. 하지만 본 연구는 의무기록을 통해 후향적으로 조사했고, 대상 환자수가 많지 않았으며 치료군 간에 중복되는 환자들이 있어 각각의 치료 성적을 절대적으로 비교하기 어렵다는 점에서 제한점이 있다. 최근 platinum을 기반으로 한 표준 1차 항암요법에 반응을 보이지 않았던 진행성 비소세포폐암 환자 중 비흡연자이면서 선암인 환자들을 대상으로 하여 pemetrexed와 gefitinib의 임상 효과를 비교하는 대규모 전향적인 연구가 진행되고 있다20). 이러한 연구는 대부분의 진행성 비소세포폐암 환자들이 표준 1차 항암요법 이후 결국 진행하여 구제 요법이 필요하다는 점을 고려할 때 효과적인 항암제 선택에 도움을 줄 수 있을 것으로 생각된다. 따라서 향후 EGKR TKIs 및 pemetrexed군의 치료 효과 및 치료 효과에 영향을 미치는 다양한 임상적 예후인자들 및 분자생물학적인 인자들에 대한 보다 많은 대규모 전향적 비교 연구가 필요할 것이다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






