불명열 에이즈 환자에서 발생한 파종성 조류형 결핵균 감염 1예
Disseminated Mycobacterium avium complex infection in a patient with AIDS and fever of unknown origin
Article information
Abstract
우리나라에서 에이즈환자의 기회감염증은 칸디다증, 결핵과 주폐포자충 폐렴이 가장 흔하며 그 중 결핵이 가장 위중한 기회감염이나, 최근에는 국내에서도 결핵 유병률의 감소와 더불어 비결핵 항산균 감염이 점차 증가하고 있다. 따라서 항산균 양성 환자에서 결핵과 비결핵 항산균의 감별이 중요하다. 최근에는 real-time PCR법이 개발되어 기존의 중합효소 연쇄 반응법보다 빠르고 결핵균과 비결핵 항산균을 함께 검출하여 감별할 수 있다.
저자들은 에이즈 환자에서 복강내 임파절 조직검사와 real-time PCR법을 통해 확진된 파종성 결핵균 감염 환자를 화학 요법으로 치료하였기에 이를 보고하는 바이다.
Trans Abstract
Since the first AIDS case was reported in 1985, the number of patients with AIDS and infectious complications has been increasing in Korea. Mycobacterium avium complex (MAC) infection is a common opportunistic infection in patients with AIDS, especially those with lower CD4+T cell counts. Although MAC is a common systemic bacterialinfection in developed countries, few cases have been reported among AIDS patients in Korea. MAC infection is rare in an immunocompetent person, but is an important cause of morbidity and mortality in patients with AIDS. MAC infection is typically associated with the degree of immunosuppression, duration of HIV infection, and low CD4+T cell counts. Here we report a case of disseminated MAC infection in an AIDS patient with fever, mesenteric lymph node enlargement, and pancytopenia. (Korean J Med 79:210-214, 2010)
서 론
HIV 환자의 기회감염증은 외인성 병원체 또는 환자 자신이 잠복 감염 상태로 가지고 있는 내인성 병원체에 의해서 발생한다. 따라서 국내 HIV 감염인의 기회감염은 외국과는 다른 양상을 보인다1-3). 미국 및 다른 선진국에서 에이즈 환자의 기회 감염증은 조류형 결핵균(Mycobacterium avium complex, MAC) 감염과 주폐포자충 폐렴(Pneumocystis carinii pneumonia, PCP)이 가장 흔한 반면, 국내 에이즈 환자의 기회감염증은 칸디다증, 결핵과 주폐포자충 폐렴이 가장 흔하며 결핵은 주폐포자충 폐렴과 더불어 주요한 사망원인 중 하나이다1,2,4,5). 국내에서 병리검사상 육아종이 발견되는 경우 마이코박테리아 중에서는 대개 결핵을 먼저 의심하게 된다3). 그러나 이런 경우 국내에서 유병률은 낮지만 진행된 AIDS 환자의 경우는 비정형 결핵균과의 감별이 필요하다.
저자들은 에이즈 환자에서 복강내 임파절 조직검사를 통해 확진된 파종성 조류형 결핵균감염 1예를 문헌고찰과 함께 보고하는 바이다.
증 례
44세 남자가 2008년 10월 보건소에서 시행한 검사상, HIV 항체 양성 소견 보여 본원 감염내과 외래 치료 중으로, 내원 2주 전부터 미열 지속되고 간헐적인 설사와 전신 쇠약감 등을 호소하여 입원하였다. 환자는 10여 년 전 동성애 경험이 있고, 3년 전부터 3차례의 대상포진, 1년 전 칸디다 식도염의 과거력이 있으며, 내원 당시 시행한 검사에서 백혈구 2,600/mm3, CD4 양성 세포 개수 15/mm3, HIV RNA 206,172 copies/μL로, 이에 zidovudine, lamivudine, lopinavir/ritonavir로 고활성 항바이러스 요법(HAART)을 시작하여 유지 중이었다.
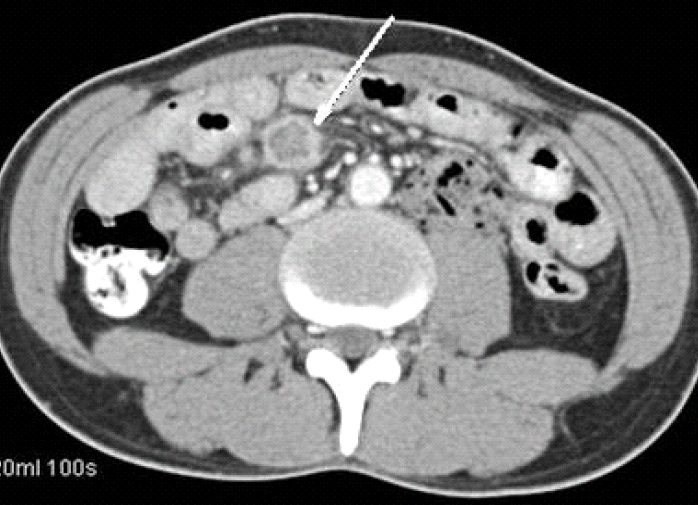
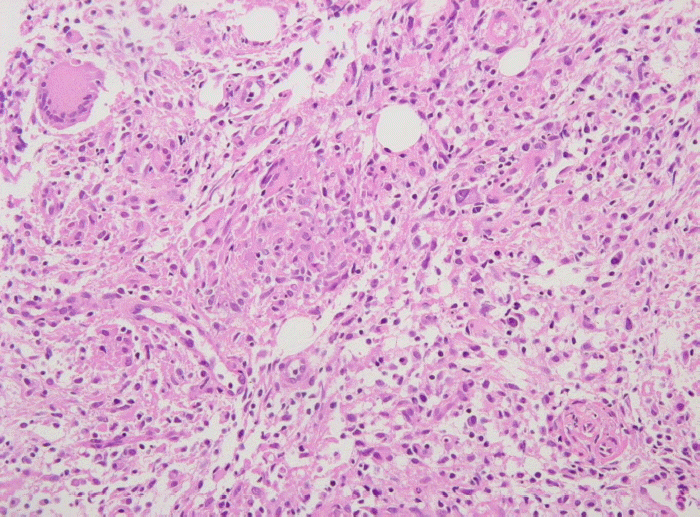
내원 당시 생체징후는 혈압 110/80 mmHg, 맥박수 80회/분, 호흡수 20회/분, 체온 38.0℃였고, 신체 검진에서 의식은 명료하였고, 만성 병색 소견에, 창백한 결막 소견을 보였다. 목에 촉진되는 종괴 소견은 없었다. 흉부 청진상 호흡음은 깨끗하였고, 심잡음은 들리지 않았으며, 복부 검진상 정상장음이었으며, 촉지되는 종괴나 간 비대, 비장 비대 등의 소견은 없었다. 일반 혈액검사에서 백혈구 2,600/mm3 (호중구 46.0%, 림프구 38.0%), 헤모글로빈 7.6 g/dL, 혈색소 22.0%, 혈소판 187,000/mm3으로 범혈구 감소증 소견을 보였고, 혈청철은 129 ug/dL, ferritin 882.6 ng/dL, UIBC 77 ug/dL, transferrin saturation 62.6%였다. 생화학검사에서 AST/ALT 14/10 IU/L, 총 빌리루빈 0.5 mg/dL, 혈액요소질소/크레아티닌 7/0.9 mg/dL, 총 단백 6.3 g/dL, 알부민 3.1 g/dL, ALP 197 mg/dL이었다. 말초혈액 도말 소견상 정구성 정색소성 빈혈, 백혈구 감소증, 호중구 감소증으로 만성 질환에 의한 빈혈 소견을 보였다. 흉부 방사선 및 복부 단순촬영상 특이소견은 없었다. 환자 내원 당시 시행한 복부 전산화단층촬영상 소장의 장간혈관 주변으로 2개의 괴사된 림프절이 관찰되었으며, 내원 2일째 초음파를 이용하여 복강내 림프절 세침흡인 조직검사를 시행하였다(그림 1). 조직 검사상, Ziehl Neelsen 염색에서 다수의 acid fast bacilli가 만성육아종성 염증소견과 함께 관찰되어 결핵이 의심되었다(그림 2, 3).
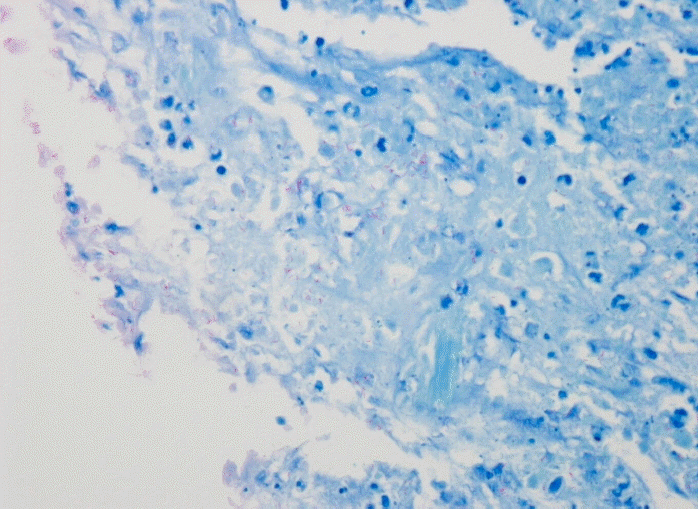
Numerous acid-fast bacteria were noted on Ziehl-Neelsen stain in mesenteric lymph node biopsy (×1,000).
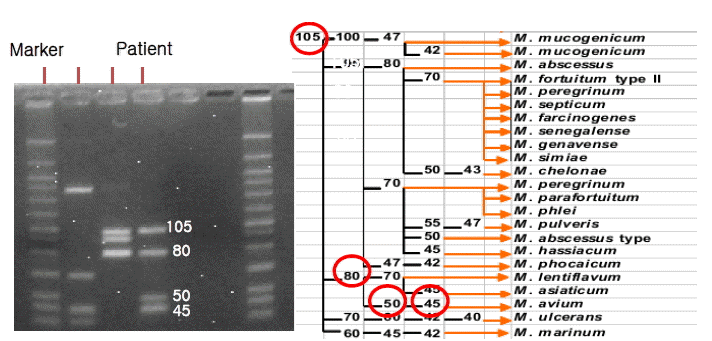
그러나 함께 시행한 결핵균 중합 효소 연쇄반응에서 마이코박테리아를 나타내는 rpoB gene은 검출되었으나 결핵균에 특이적인 IS6110 gene은 음성으로 비정형 마이코박테리아가 의심되었으며, 조직 배양 검사와 Mycobacteria other than tubercle(MOTT) identification test를 시행하였다(그림 4). 조직 배양에서 마이코박테리아가 동정되었고, MOTT identification test에서 검출된 rpoB gene DNA를 제한 효소 처리하여 조류형 결핵균으로 확진하였다. 환자는 HAART 중 zidovudine이 약제 유발성 빈혈의 원인으로 생각되어 didanosine으로 변경하였고, clarithomycin 1,000 mg/일, ethambutol 1,200 mg/일, rifabutin 150 mg 이틀에 한 번으로 복용하였다. 현재 외래 추적관찰 중으로 CD4 양성 세포는 15개에서 148개로 증가하였고, HIV RNA titer는 206,172 copies/mL에서 95 copies/mL까지 감소 소견을 보이고, 조류형 결핵균 감염과 관련되었던 전신상태 증상들도 호전된 상태로 외래 추적관찰 중이다.
고 찰
인체 면역부전 바이러스에 감염된 환자는 점차로 CD4 양성 T 세포가 감소하면서 면역 저하 및 이로 인한 기회감염 증, 악성 종양 및 신경계 증상이 발현하는 것이 특징이다1,2). 이러한 기회감염 중 선진국에서 가장 흔한 전신성 세균 감염 질환이 조류형 결핵균 감염으로 미국, 케냐, 핀란드 등은 성인의 7~12% 양성으로 높으나 우리나라를 포함하여 결핵의 유병률이 높은 개발도상국에서는 드물고 결핵이 가장 흔하고 중요한 기회감염의 하나이다1-3).
이는 이 지역은 결핵의 발생율이 높기 때문에 비정형 결핵균에 상대적으로 부분 면역이 생겨 조류형 결핵균 감염이 적게 발생한다고 설명하기도 한다8).
우리나라에서 에이즈 환자의 기회감염증은 칸디다증, 결핵과 주폐포자충 폐렴이 가장 흔하며 결핵은 주폐포자충 폐렴과 더불어 주요한 사망원인 중 하나이다1,2). 최근에는 국내에서도 결핵 유병율의 감소와 더불어 비결핵 항산균(nontuberculous mycobacteria, NTM)이 점차 증가하고 있다10). 따라서 과거에는 항산균 양성이면 대부분 결핵으로 간주하였으나 최근 비결핵 항산균이 증가하고 있어 이를 감별할 필요가 있다9). Mycobacteria는 약 70여 종이 있으며 이중 일부는 폐, 피부와 연조직 감염, 림프절 감염, 파종성 산재성 감염을 일으키고 있어 정확한 동정이 요구되고 있다11). 서울의 한 종합병원의 경우 분리되는 전체 항산균 중 9.1%가 비결핵 항산균일 정도로 이제는 환자에서 분리되는 항산균 도말 양성 검체를 결핵이라고 더 이상 간주할 수 없는 상황이다11). 결핵의 진단에는 보편적으로 항산균 도말 검사와 배양 검사를 이용해 왔다. 기존의 전통적인 항산균 도말 검사는 신속하고 간편하다는 장점이 있으나 민감도와 특이도가 떨어진다는 단점이 있고, 배양검사는 결핵 진단의 표준법으로 가장 정확한 방법이지만 시간이 오래 걸린다는 단점이 있다. 마이코박테리아 배양 배지는 크게 액체 배지와 고체 배지로 구분되는데, 특히 고체 배지의 경우 검출 시간이 길고 액체 배지에 비해 민감도가 낮다. 그에 비해 액체 배지는 검출 시간이 빠르고 검출률이 높으며, 장비를 이용하여 더 편리하게 우수한 성과를 얻을 수 있어 최근 액체 배지의 사용이 증가하면서 결핵균 동정에 시간이 단축되고 검출률은 증가하였다. 이와 더불어 최근 면역과 분자 진단 기술이 발달하여 이를 이용한 결핵의 진단법들이 많이 개발되었다13). 그 중에서 핵산을 증폭시키는 기술 중의 하나인 중합효소 연쇄 반응(polymerase chain reaction, PCR)을 이용하여 검체에서 직접 결핵균을 검출하는 방법은 신속하면서 민감도가 높아서 널리 이용되고 있다. 표준화된 방법을 사용하여 객관적인 결과를 제공할 수 있으며 호흡기 검체뿐 아니라 다양한 검체에서 민감도가 높은 것으로 알려져 있다. 최근에는 real- time PCR법이 개발되어 기존의 중합효소 연쇄 반응법보다 빠르며 amplicon 오염율이 적고, 정량이 가능하여 감염질환의 진단에 이용되고 있다9,12,18,19). Real-time PCR법은 결핵균에 특이적인 IS6110 gene 유전자 부위에 특이적인 시동체에 의해PCR 반응물이 형성이 되고 동시에 각 유전자에 특이 적인 probe가 분해되면서 형성된 형광을 real-time PCR로 측정하는 것이다. 따라서 결핵균과 비결핵항산균을 함께 검출 할 수 있다9).
후천성 면역 결핍증 환자에서 CD4 양성 T 세포수가 μL 당 50개 미만일 경우, 조류형 결핵균 감염은 가장 흔한 기회 감염인 동시에 발생 위험이 증가하므로 화학적 예방 요법을 권고하고 있다14,15). 최근 우리나라도 후천성 면역 결핍증 환자의 수가 증가하고 감염기간이 늘어나면서 기회감염의 유병률도 증가하고 있다. 따라서 조류형 결핵균 감염의 예방이 필요할 것으로 사료된다.
조류형 결핵균은 호흡기나 위장관 검체에서 분리되면 상재균으로 판단하고 파종성 감염이 의심되는 경우에는 혈액배양검사같은 적절한 배양검사를 시행해야 한다6). 본 증례에서는 혈액 배양검사는 음성이었으나 환자가 발열 및 설사, 전신 쇠약감 등을 호소하고 복강내 림프절 조직배양검사에서 조류형 결핵균이 배양되어 파종성 조류형 결핵균 감염으로 진단하였다. 파종성 조류형 결핵균의 치료는 2009년 미국질병관리본부 권고 사항에 따르면 clarithromycin과 ethambutol 병합 치료를 권고하고 있고, 일반적인 결핵 치료의 근간이 되는 isoniazid와 pyrazinamide는 조류형 결핵균 감염에는 효과가 없다8,16). 만일 clarithromycin 단독 치료를 하는 경우 clarithromycin 내성균 발생시에는 재발의 가능성이 있기 때문이며, 따라서 최근 치료에서는 이차 약제로 ethambutol, 삼차약제로 clofazimine, rifabutin, rifampin, ciprofloxacin, amikacin 중에 한 가지를 더 선택하여 3제 병합요법을 사용하기도 한다7,8).
HAART 약제 중 단백분해효소 억제제로 saquinavir, ritonavir와 indinavir 등이 있는데, 이들은 rifampin과 rifabutin 같은 rifamycin 계열 약물들과 상호 작용을 일으킨다20).
Rifamycin 제제는 간의 P450 시토크롬 산화효소를 감소시켜 단백분해효소 억제제의 대사를 증가시키고 결국 치료 농도 아래로 감소시킨다20). 게다가 단백분해효소 억제제는 rifamycin 제제의 대사를 감소시켜 혈중 농도 및 약독성을 증가시킨다20). 따라서 조류형 결핵균 예방을 위해 rifabutin을 indinavir과 함께 사용시, rifabutin 용량을 반으로 줄이거나 clarithromycin과 azithromycin을 함께 사용하도록 권고된다20). 그리고 ART 치료 시작 후 3개월 이상 CD4 양성 T세포의 개수가 μL당 100개 이상이면 일차적인 조류형 결핵균 감염 예방을 중단할 수 있으나, CD4 양성 T 세포의 개수가 100개 미만으로 감소한다면, 재발이 흔하기 때문에 다시 화학적 예방 치료를 시작해야 한다8).
결론적으로, 인간 면역부전 바이러스 감염 환자에서 기회 감염 중 결핵 이외의 비정형 결핵균 감염도 고려해서 조기 진단이 이루어지도록 해야 할 것이다.