 |
 |
| Korean J Med > Volume 94(2); 2019 > Article |
|
요약
방법
본 연구에서는 2004년 1월부터 2014년 7월까지 단일 기관에서 심방세동과 말기 콩팥병을 진단받은 총 256명의 환자 중 와파린(n = 53)이나 항혈전제(n = 105)를 투여받는 CHA2DS2-VASc 점수 1점 이상의 158명(나이, 63.7 ± 12.2세; 남성, n = 103)이 본 연구에 포함되었다.
결과
총 추적 조사 기간 동안(31.0 ± 29.4개월), 10건의 혈전색전 사건과 29건의 주요 출혈 사건이 발생하였다. 혈전색전 사건의 발생은 와파린군과 항혈전제군 사이에 유의한 차이를 보이지 않았다(1.9%와 8.6%, p = 0.166). 주요 출혈 사건의 발생은 항혈전제군보다 와파린군에서 유의하게 높은 발생률을 보였다(32.1%와 11.4%, p = 0.002). 와파린의 사용은 주요 출혈 사건 발생을 증가시키는 주요한 위험인자였으나 (HR, 3.44; 95% CI, 1.60-7.36; p = 0.001) 혈전색전 사건의 발생의 감소와는 통계적으로 유의한 관계를 보이지 않았다 (HR, 0.34; 95% CI, 0.04-2.70; p = 0.306).
Abstract
Background/Aims
The optimal strategy for anticoagulation treatment in patients with atrial fibrillation (AF) and end-stage renal disease (ESRD) has not been established. We evaluated the efficacy and bleeding risk of warfarin and antiplatelet agents in patients with AF and ESRD.
Methods
We retrospectively reviewed the medical records of 256 patients with AF and ESRD and included 158 patients (age, 63.7 ± 12.2 years; male sex, n = 103) with a CHA2DS2-VASc score ≥ 1 who were taking warfarin (n = 53) or an antiplatelet agent (n = 105).
Results
During the follow-up period (31.0 ± 29.4 months), 10 ischemic events and 29 major bleeding events occurred. The thromboembolic event rate did not significantly differ between the warfarin and antiplatelet groups (1.9% and 8.6%, respectively; p= 0.166). However, the rate of major bleeding events was significantly higher in the warfarin group than it was in the antiplatelet group (32.1% and 11.4%, respectively; p= 0.002). Cox’s regression analysis indicated that warfarin was related to an increased risk of major bleeding events (hazard ratio [HR], 3.44; 95% confidence interval [CI], 1.60-7.36; p= 0.001). Conversely, warfarin was not related to a decreased risk of thromboembolic events (HR, 0.34; 95% CI, 0.04-2.70; p= 0.306).
심방세동은 가장 흔히 발생하는 부정맥 질환 중 하나로 뇌졸중을 비롯한 혈전색전증 발병의 위험요소로 잘 알려져 있다[1,2]. 심방세동의 발병률은 정상 건강인에 비하여 말기 콩팥병 환자에서 수배 높게 나타나며[3], 이러한 말기 콩팥병 환자들에게서는 심방세동이 발병한다면 정상 신기능을 가진 환자에 비하여 심혈관계 사건 발생 위험을 더욱 증가시킨다[4,5].
와파린은 심방세동 환자들에서 혈전색전증을 예방하는 항응고제로 널리 사용되고 있으나[6], 심방세동과 말기 콩팥병이 동반된 환자에서는 와파린 치료의 이점이 아직 확실히 정립되지 못하였다. 과거 여러 관찰 연구에 따르면, 말기 콩팥병을 가진 심방세동 환자에서 와파린의 사용이 뇌졸중 예방과 출혈의 위험에 대해서 상충하는 결과를 보고해왔다[4,7-10]. 더욱이, 심방세동과 말기 콩팥병이 동반된 환자에서 와파린이나 항혈소판제의 효능과 안전성을 비교한 무작위 대조시험 또한 아직 발표된 연구가 없다. 이러한 배경에서 본 저자들은 심방세동과 말기 콩팥병이 동반된 환자에서 와파린과 항혈소판제의 혈전색전증 발병 예방의 효과와 출혈 위험과 관련된 안전성을 비교하여 평가하고자 하였다.
본 연구에서는 2004년 1월부터 2014년 7월까지 단일 기관에서 심방세동과 말기 콩팥병 환자들의 의료 기록을 후향적으로 검토하였다. 연구 포함 기준은 1) 심방세동과 말기 콩팥병을 진단받고 신대체 요법을 시행하고 있고, 2) 혈전색전증 예방을 위한 항응고제 혹은 항혈전제를 투약받는 경우이다. 연구 제외 기준은 1) CHA2DS2-VASc score가 0이거나, 2) 경과 관찰 기간이 30일 이하이거나, 3) 단기간 지속적 신대체요법(continuous renal replacement therapy)만 시행한 경우이거나, 4) 경과 관찰 기간 중 신장 이식을 받았거나, 5) 항혈전 약물을 투약하지 않은 경우이다. 이와 같은 연구 포함 및 제외 기준에 따라, 연구 기간 동안 심방세동과 말기 콩팥병을 진단받은 총 256명의 환자들 가운데 158명(나이, 63.7 ± 12.2세; 남성, n = 103)이 본 연구에 포함되었다. 기관심사위원회가 연구 계획서를 승인하였으며, 후향적 연구이기 때문에 연구 대상자들에 대한 동의와 핵심 사건 위원회의 구성은 면제되었다.
연구 기간 동안 환자들의 나이, 성별, 신대체 요법 방법, 항혈전 치료법에 대한 의료 기록을 후향적으로 검토하였다. 혈전색전증의 발병의 위험도를 위한한 CHA2DS2-VASc 점수(심부전, 고혈압, 진성 당뇨병, 혈관병, 나이 65세에서 74세 사이, 여성 범주에 각각 1점을, 그리고 나이 75세 이상이거나 이전에 뇌졸중이나 일과성 뇌허혈 발작이 있었던 범주에 2점을 부여) [11]와 출혈 합병증의 위험을 평가하기 위한 HAS-BLED 점수(비조절성 고혈압, 신장이나 간의 비정상적인 기능, 뇌졸중, 이전의 출혈 경험이나 소인, 불안정한 international normalized ratio [INR], 나이 65세 이상, 수반하는 약물, 알코올 남용에 각각 1점을 부여)가 각각 산출되었다[12]. 연구 대상자는 항혈전 예방 약물 종류에 따라 와파린과 항혈소판 치료군으로 분류되었는데, 항혈소판 치료군은 아스피린 또는 클로피도그렐을 사용하고 있는 환자군으로 정의되었다. 전체 치료 기간 대비 목표 INR 수치를 유지하는 시간의 비율(time in therapeutic range, TTR)은 로즈마달의 선형보간법을 이용하여 산출하였다[13]. INR 수치는 각각의 외래병동과 응급실 방문, 입원 기간 동안 측정되었으며, 모든 INR 수치 검사는 같은 연구실에서 수행되었다.
연구 참여자들은 심방세동과 말기 콩팥병이 진단된 첫 진단일부터 2015년 1월까지 추적 관찰되었다. 평균 추적 관찰기간은 31.0 ± 29.4개월이었으며, 환자들의 혈전색전증 발병과 주요 출혈 사건의 발생을 관찰하였다. 혈전색전증은 허혈성뇌졸중, 일과성뇌허혈발작, 신장경색, 허혈성대장염으로 정의하였고, 주요 출혈 사건은 중추신경계 출혈, 소화관 출혈이나 적혈구 2단위 이상의 수혈이 요구되는 출혈로 정의하였다. 추적 기간 동안 총 사망률 발생률도 2차적 평가로 추가적으로 수집되었다.
정규분포를 이루는 연속형 변수는 평균 및 표준편차값을 보고하였고 Student t-test를 사용하여 비교하였다. 범주형 변수는 숫자와 퍼센트로 보고하였고 카이제곱 검사와 피셔 추출 방법을 사용하여 비교하였다. 혈전색전 사건 및 주요 출혈 사건의 위험은 Cox 회귀 분석을 통해서 추정하였으며 위험도 및 95% 신뢰구간을 보고하였다. 통합 사건(composite endpoint)은 혈전색전 사건 및 주요 출혈 사건을 합하여 정의하였다. 다변량 Cox 회귀 분석은 단변량 분석에서 p-value가 0.1 미만인 변수를 포함하였다. 카플란 메이어 커브 분석 방법을 사용하여 와파린군과 항혈소판군의 사건 자유 기간을 로그랭크 테스트를 통하여 비교하였다. p값은 0.05 미만인 경우를 통계적으로 유의하다고 정의하였으며 모든 통계 분석은 SPSS version 18 (SPSS Inc., Chicago, IL, USA) 혹은 STATA (version 14; StataCorp, College Station, TX, USA)를 이용하여 수행되었다.
와파린과 항혈소판제를 사용한 환자군 사이에는 나이, 성별, 신대체 요법의 유형, 혹은 CHA2DS2-VASc나 HAS-BLED 수치의 유의미한 차이가 없었다(Table 1). 발작성 심방세동, 혈관 질환 이력, 말초동맥 질환은 와파린군에 비하여 항혈소판제군에서 유의미하게 높은 빈도로 동반되어 있었으며, 반대로 뇌졸중에 대한 과거 이력은 항혈소판제군보다 와파린군에서 높은 빈도로 동반되어 있었다. 관찰 조사 기간 동안 와파린군의 INR 평균은 2.0 ± 0.8이었고, TTR의 평균은 24.9 ± 19.3%였다. 항혈소판제군에서는 55명의 환자가 아스피린, 4명의 환자는 클로피도그렐을 투약하였으며, 나머지 46명의 환자는 아스피린과 클로피도그렐 두 가지 약제를 동시에 투여받았다.
추적 조사 기간 동안, 항혈소판제군의 환자중 9명(8.6%)과 와파린군의 환자중 1명(1.9%)에게서 혈전색전증이 발병되었다(허혈성뇌졸중 8명, 일과성뇌허혈발작 1명, 허혈대장염 1명 발병). 혈전색전증 발병 정도는 양 군 간에 유의미한 차이를 보이지 않았다. 양 군의 CHA2DS2-VASc score는 1-6점 사이로 분포하고 있었으며, CHA2DS2-VASc score에 따른 혈전색전증의 발생 빈도는 와파린군에서는 CHA2DS2-VASc score 5점에서 1건(14.3%)이 발생하였고, 항혈소판제군에서는 CHA2DS2-VASc score 3점, 4점에서 각 4건(16%, 15.4%)이 발생하였다(Fig. 1). CHA2DS2-VASc score 0점이거나 1점인 경우에 혈전색전증은 항혈소판제, 와파린군 모두에서 발생하지 않았다.
반면에, 주요 출혈 사건은 전체 환자 중 29명의 환자에게서 발견되었는데(8명의 두개강내 출혈, 17명의 소화관 출혈, 4명은 수혈을 요하는 기타 출혈) 항혈소판제군에서 12명(11.4%), 와파린군에서 17명의 환자(32.1%)에서 발생하였고, 항혈소판제군보다 와파린군에서 유의미하게 높았다(p= 0.002). 주요 출혈 사건이 발생된 와파린군 환자들의 출혈 발생 시점 INR은 2.9 ± 1.6, TTR은 26.7 ± 17.4%였고, 혈전색전증이 발생한 환자에서 당시 INR는 0.85, TTR은 0%였다.
Kaplan-Meier 분석에서 주요 출혈 사건 발생률은 항혈소판제군이 와파린군과 비교하여 유의미하게 낮았다(p< 0.001). 반대로, 두 군 간의 혈전색전증 발병률은 차이가 없었다(p= 0.210) (Fig. 2). 다변량 Cox 회귀 분석에서는 심근경색의 과거력이 혈전색전증 발병에 있어서 독립적인 위험인자였으며(hazard ratio [HR], 6.99; 95% confidence interval [CI], 1.24-39.33; p= 0.027), 주요 출혈 사건 발생에 있어서는 와파린 사용(HR, 3.44; 95% CI, 1.60-7.36; p= 0.001)이 독립적인 위험인자였다(Table 2). 혈전색전증과 출혈 사건의 통합 사건의 경우, 나이(HR, 1.04; 95% CI, 1.01-1.07; p= 0.008) 및 와파린 사용(HR, 2.37; 95% CI, 1.24–4.51; p= 0.009)이 독립적인 위험인자였다(Table 3).
추적 조사 기간 동안 40명의 환자에서 사망 사건이 발생하였다(패혈증쇼크 16명, 급성심근경색 6명, 급성심정지 5명, 기타 다른 요인 13명). 사망률은 와파린군과 항혈소판제군 사이에서 유의미한 차이가 없었다(각각 28.3%, 23.8%; p= 0.540). 단변량 Cox 회귀 분석에서는 나이, 당뇨병, 심근경색의 과거력이 사망 사건 발생의 위험요소로 나타났다. 이와는 반대로, 혈전색전증과 주요 출혈 사건의 발생은 사망 사건의 발생과 통계적으로 유의한 관련이 없었다(Table 4). 다변량 분석에서는 나이(HR, 1.04; 95% CI, 1.01-1.07; p= 0.023)와 심근경색의 과거력(HR, 3.43; 95% CI, 1.02-11.54; p= 0.047)이 사망 사건의 발생에 독립적인 위험요소로 나타났다. 와파린 사용은 사망 사건의 발생(HR, 1.57; 95% CI, 0.82-3.00; p= 0.172)과 유의미한 관련이 없었다.
본 후향적 관찰 연구에서는 심방세동과 말기 콩팥병이 동반된 환자에서 혈전색전증의 예방과 이와 관련된 출혈의 위험에 대한 와파린과 항혈소판제의 효능을 비교 평가하였다. 본 연구 결과에서는 와파린 사용이 항혈소판제 사용과 비교하여 출혈 위험이 3배 더 높았으나, 혈전색전증의 예방 효과는 양 군 간에 유의한 차이를 보이지 않았다. 따라서 본 연구는 심방세동과 말기 콩팥병 환자에 있어서 와파린 치료법의 효과와 안전성을 뒷받침 해주지 못한다. 하지만 혈전색전증, 출혈 발병 그리고 와파린 또는 항혈소판제 사용은 전 원인 사망률과는 유의미한 관련이 없는 결과를 보여주었다.
와파린은 혈전색전증 예방을 위해서 심방세동 진단을 받은 환자에게 널리 사용되고 있는 항응고 약물이다[6]. 그러나 심방세동과 말기 콩팥병이 동반된 환자들에게는 와파린의 효능과 안전성은 아직 확립되지 않았다. 예를 들어 Olesen 등[4]에 의한 연구에 따르면, 와파린의 투약이 신대체 요법이 요구되는 심방세동 환자 가운데 뇌졸중이나 기타 혈전색전증의 위험을 줄일 수 있다는 결과를 보였다. 또한 이러한 말기 콩팥병과 심방세동이 동반된 한자에서는 와파린 사용에 비하여 항혈소판제인 아스피린 사용이 출혈 위험을 증가시키는 것과 관련이 있다고 관찰하였다. 반면에 Wizemann 등[10]은 기존에 심방세동이 있던 혈액투석 환자들에게 와파린을 사용하는 것이 나이 많은 환자들의 뇌졸중 위험을 증가시키는 것과 관련이 있다고 보고하였다. 그 연구에서는 와파린을 사용하였을 때 74세 이상 환자들에게서 뇌졸중의 발생이 젊은 환자들에 비하여 높은 결과를 보여주었다. 또한 Shah 등[9]은 투석 중인 65세 이상 심방세동 환자들에게 와파린을 사용하는 것이 뇌졸중 위험을 줄이지 못할뿐더러, 출혈 발병 위험이 44% 높아지는 결과를 보고하였다. 본 연구에서는 와파린 사용이 심방세동과 말기 콩팥병이 동반된 환자들에게 출혈 발병 위험을 증가시켰으며, 이는 과거의 일련의 연구들의 결과를 뒷받침함과 동시에 이러한 출혈 및 혈전색전증 사건이 환자의 사망 사건과는 관련이 없다는 추가적인 결과를 제시할 수 있었다.
심방세동과 말기 콩팥병 환자들에 있어서 항응고제 사용에 대한 현재 가이드라인은 확실히 정립되지 못하였다[14-16]. 2014년에 발표된 미국 심장학회 치료지침은 심방세동과 CHA2DS2-VASc 점수 1 이상의 환자들에게 와파린을 사용할 것을 권장하고 있으며, CHA2DS2-VASc 점수 2 이상이고 말기 콩팥병 환자들에게는 경구 항응고를 위한 와파린 처방을 고려할 수 있는 정도로 권고 수준을 낮추어 제안하고 있다[14]. 이와는 반대로, The Kidney Disease: Improving Global Outcomes (KDIGO) 진료 지침은 심방세동과 말기 콩팥병 환자들의 뇌졸중 1차 예방을 위한 통상적인 항응고제를 투여하지 않아야 하고, 항응고제를 오직 2차적인 예방에만 사용할 것을 추천하고 있으며, 만일 항응고제를 투여할 시에는 모든 투석 환자들에서 주의 깊은 모니터링이 필요하다고 제안하고 있다[15]. 캐나다 심방세동학회 진료 지침 역시 심방세동과 말기 콩팥병 환자들에 있어서 뇌졸중 1차 예방을 위한 통상적인 항응고제를 투여하지 않을 것을 권고한다[16]. 그러나 이러한 가이드라인은 무작위 비교 연구의 증거가 부족하기 때문에 항응고제 투여에 대한 진료 지침을 명확히 제안하지는 못하고 있는 실정이다.
말기 콩팥병 환자들에서는 여러 가지 요인들이 출혈과 허혈 경향성에 영향을 미친다. 말기 콩팥병 환자들은 단백질 C 활성과 조직 유형 플라스미노겐 활성제를 저하되고, 플라스미노겐활성화인자억제제-1가 증가되어 이로 인하여 혈전색전증의 발생의 위험이 증가될 수 있다[17]. 또한 지질단백질에 의한 플라스민 억제제는 이러한 환자에서 혈전색전증 발병 위험을 증가시키는데 영향을 미친다[17-19]. 다른 한편으로는 저하된 아데노신 2인산 활성과 당단백질IIb/IIIa의 의존성 활성화 결합 활동 이상 같은 혈소판 기능 부전은 말기 콩팥병 환자에 있어서 출혈 경향을 증가시키는 잠재적 기여자로서 잘 알려져 있으며, 혈액 투석시 요독증 물질, 조혈호르몬 결핍, 헤파린을 사용하는 것 역시 이 집단의 출혈 경향을 촉진시킬 수 있다[5,18,19]. 이러한 여러 기전들에 의하여, 말기 콩팥병 환자들에서 정상적인 신장 기능을 하는 환자들보다 혈전색전증과 출혈 발병 위험 모두 높아지게 된다. 이에 더하여 와파린은 대부분 간에 의하여 대사작용이 이루어진다고 알려져 있지만, 신장 기능의 감소로 인해서도 와파린의 체내 제거율이 감소되어서 와파린의 혈중 농도가 상승하여 출혈의 위험성을 높일 수 있다[20]. 또한 치료적 범위의 와파린 혈중농도는 비교적 좁은 편이고, 특히 신장 기능 저하가 있는 환자들에서는 치료 범위 내의 와파린 혈중농도의 조절이 더욱 어렵고 외부요인에 의한 변화폭이 크다고 알려져 있다[21]. 이런 점에 비추어 보아, 와파린은 말기 콩팥병 환자들에게 낮은 투여량으로 시작하여 INR 레벨에 근거하여 점진적으로 그 양을 늘리는 식의 투약방식을 사용해야 할 것이다.
발작성이나 지속적 심방세동 모두 혈전색전증 발생의 위험이 증가되고, 그 위험의 정도는 발작적, 지속적 심방세동에서 비슷한 정도로 증가되는 것으로 알려져 있다[22]. 최근의 연구는 항혈소판제를 발작성 심방세동 환자에서 지속적 심방세동 환자들보다 자주 사용하는 경향을 보였다[23]. 본 연구에서도 항혈소판제군에서 발작성 심방세동의 과거력이 와파린군보다 유의미하게 큰 결과를 보여 이러한 경향을 다시 한 번 확인할 수 있었다. 혈관 질환과 말초동맥 질환의 과거력은 와파린군보다 항혈소판제군에서 더 높은 빈도를 보였으며, 이전의 뇌졸중 이력이 있는 환자에서는 항혈소판제군보다 와파린군에서 높은 빈도를 보였다. 이러한 추세는 혈관 질환과 말초동맥 질환이 있는 경우 2차 예방 전략으로써 항혈소판제를 사용하고, 뇌졸중 이력을 가진 환자들에게 와파린을 사용하는 것을 반영한 결과로 생각된다. 이러한 결과로 비추어 보았을 때 실제 임상에서 심방세동과 말기 콩팥병 환자에 있어서 항응고제 사용 전략은 환자들의 임상적 특성에 굉장히 의존적임을 보여준다.
본 연구에서는 통계적인 유의성은 보이지 못하였으나 혈전색전증의 발생 빈도가 항혈소판제에서 9건(8.3%), 와파린군에서 1건(1.6%)으로 관찰되었다. 또한 혈전색전증은 양 군에서 CHA2DS2-VASc 점수가 0 혹은 1점인 경우에는 발생하지 않고, 3점 이상인 환자에서만 발생하였다. 이는 현재 진료지침이 명확하게 정립되지 않아, CHA2DS2-VASc score가 높더라도 환자들의 임상적 특성에 따른 임상의의 판단으로 항혈소판제만을 유지하였기 때문에 혈전색전증이 발생하였을 수 있다. 따라서 말기 콩팥병과 심방세동이 동반되어 있는 환자에서 혈전색전증의 예방을 위해서는 CHA2DS2-VASc 점수가 3 이상인 환자의 경우 항혈소판항제 사용하는 것이 혈전색전증의 위험성과 관련이 있음을 조심스럽게 생각해 볼 수 있겠지만, 본 연구의 제한적 숫자로 인하여 이러한 관련성을 명확하게 확인하기 어렵다. 추후 다수의 환자를 대상으로 CHA2DS2-VASc 점수에 따른 각 군의 연구가 필요할 것이다.
심방세동 환자에서 혈전색전증 및 주요 출혈 사건이 전체 사망률에 영향을 미치고, 항응고제를 투약하는 것이 전체 사망의 위험성을 감소시킬 수 있다고 알려져 있다[24]. 하지만 본 연구에서는 혈전색전증, 주요 출혈사건 및 와파린의 사용이 사망의 위험성과는 독립적인 연관성을 보이지 않았다. 말기 콩팥병 환자의 경우 2013년 미국 보건원의 보고에 따르면 전체 사망률의 38.7%가 부정맥 혹은 급성 돌연사로 사망하였고, 투석의 중단이 16.4%, 패혈증이 7.9% 순서로 높은 빈도를 보였다[25]. 반면에 혈전색전증의 사건 중 하나인 뇌경색 및 출혈 사건은 2.9%로 비교적 작은 부분을 차지하였다. 따라서 혈전색전증 및 주요 출혈 사건은 말기 콩팥병과 심방세동이 동반된 환자에서 유병과 사망에 주요한 영향을 미치는 요인일 수 있으나 전체 사망에 미치는 영향은 비교적 낮을 수 있으며, 이는 말기 콩팥병 환자의 특성을 반영하는 결과로 생각할 수 있겠다.
본 연구의 제한점으로는 회고 관찰 연구로써, 미측정 교란 요인들에 기인하는 바이어스의 발생 가능성이 있다는 것이다. 연구에 포함된 환자 수는 비교적 적고 혈전색전증 및 주요 출혈 사건의 발생 빈도 또한 낮아 본 연구 결과는 신중하게 해석되어야 한다. 특히 혈전색전증의 경우 와파린군에서 1건(1.9%), 항혈소판제군에서 9건(8.6%)이 발생하였으나 사건의 발생 빈도가 낮아 통계적 방법으로 비교하는데 제한점이 있다. 또한 와파린군 환자 중 67%의 환자가 항혈소판제를 복합 투여하고 있어 혈전색전증 및 주요 출혈 사건에 와파린의 단독 효과를 본 논문에서는 확인할 수 없다. 또한 항혈소판제군에서도 아스피린, 클로피도그렐 두 가지 약제가 사용되었기 때문에 본 연구의 항혈소판제군은 균일한 환자군이 아니며 아스피린 혹은 클로피도그렐의 단독 효과를 확인하기 어렵다. 신대체 요법을 받고 있는 환자의 경우 투석에 의하여 INR이 영향을 받을 수 있는데 후향적 연구인 본 연구의 특성상 INR의 정확한 측정 시점에 대한 정보가 없으며, 후향적 연구인 본 연구의 특성상 INR의 정확한 측정 시점에 대한 정보를 얻는데 제한이 있다. 본 연구 대상에서 와파린의 혈중 농도의 조절이 효과적이지 않았고(TTR, 24.9 ± 19.3%) 이러한 결과가 출혈 및 색전 사건의 발생에 영향을 미쳤을 수 있으나, 이러한 낮은 TTR의 결과는 신장 기능이 저하된 환자들의 INR 제어가 어렵다는 것을 보여준다. 이러한 결과는 말기 콩팥병 환자들에 있어서 와파린을 사용하는 것이 혈전색전증 예방에 효과적이지 않고 출혈 위험을 높인다는 본 연구의 결과를 뒷받침 해주는 근거로 생각할 수 있을 것이다.
결론적으로, 와파린 사용은 항혈전제 사용과 비교해보았을 때 심방세동과 말기 콩팥병 환자들에게서 출혈 사건의 위험을 증가시켰다. 하지만 본 연구에서 비교적 작은 연구 대상자의 숫자와 낮은 임상적 사건의 발생률 때문에 본 결과를 단정짓기는 어려우며, 추가적인 다수의 환자를 대상으로 한 잘 설계된 무작위 연구가 필요할 것이다.
REFERENCES
1. Hart RG, Halperin JL. Atrial fibrillation and thromboembolism: a decade of progress in stroke prevention. Ann Intern Med 1999;131:688–695.


2. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham study. Stroke 1991;22:983–988.


3. Das M, Aronow WS, McClung JA, Belkin RN. Increased prevalence of coronary artery disease, silent myocardial ischemia, complex ventricular arrhythmias, atrial fibrillation, left ventricular hypertrophy, mitral annular calcium, and aortic valve calcium in patients with chronic renal insufficiency. Cardiol Rev 2006;14:14–17.


4. Olesen JB, Lip GY, Kamper AL, et al. Stroke and bleeding in atrial fibrillation with chronic kidney disease. N Engl J Med 2012;367:625–635.


5. Reinecke H, Brand E, Mesters R, et al. Dilemmas in the management of atrial fibrillation in chronic kidney disease. J Am Soc Nephrol 2009;20:705–711.


7. Carrero JJ, Evans M, Szummer K, et al. Warfarin, kidney dysfunction, and outcomes following acute myocardial infarction in patients with atrial fibrillation. JAMA 2014;311:919–928.


8. Chen JJ, Lin LY, Yang YH, Hwang JJ, Chen PC, Lin JL. Anti-platelet or anti-coagulant agent for the prevention of ischemic stroke in patients with end-stage renal disease and atrial fibrillation-A nation-wide database analyses. Int J Cardiol 2014;177:1008–1011.


9. Shah M, Avgil Tsadok M, Jackevicius CA, et al. Warfarin use and the risk for stroke and bleeding in patients with atrial fibrillation undergoing dialysis. Circulation 2014;129:1196–1203.


10. Wizemann V, Tong L, Satayathum S, et al. Atrial fibrillation in hemodialysis patients: clinical features and associations with anticoagulant therapy. Kidney Int 2010;77:1098–1106.


11. Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro heart survey on atrial fibrillation. Chest 2010;137:263–272.


12. Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro heart survey. Chest 2010;138:1093–1100.


13. Rosendaal FR, Cannegieter SC, van der Meer FJ, Briët E. A method to determine the optimal intensity of oral anticoagulant therapy. Thromb Haemost 1993;69:236–239.


14. January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association task force on practice guidelines and the Heart Rhythm Society. Circulation 2014;130:e199–e267.


15. Herzog CA, Asinger RW, Berger AK, et al. Cardiovascular disease in chronic kidney disease. A clinical update from kidney disease: improving global outcomes (KDIGO). Kidney Int 2011;80:572–586.


16. Verma A, Cairns JA, Mitchell LB, et al. 2014 focused update of the Canadian Cardiovascular Society guidelines for the management of atrial fibrillation. Can J Cardiol 2014;30:1114–1130.


17. Tomura S, Nakamura Y, Doi M, et al. Fibrinogen, coagulation factor VII, tissue plasminogen activator, plasminogen activator inhibitor-1, and lipid as cardiovascular risk factors in chronic hemodialysis and continuous ambulatory peritoneal dialysis patients. Am J Kidney Dis 1996;27:848–854.


18. Marinigh R, Lane DA, Lip GY. Severe renal impairment and stroke prevention in atrial fibrillation: implications for thromboprophylaxis and bleeding risk. J Am Coll Cardiol 2011;57:1339–1348.


19. Thet Z, Vilayur E. Atrial fibrillation and warfarin use in haemodialysis patients: an individualized holistic approach is important in stroke prevention. Nephrology (Carlton) 2013;18:331–339.


20. Limdi NA, Limdi MA, Cavallari L, et al. Warfarin dosing in patients with impaired kidney function. Am J Kidney Dis 2010;56:823–831.



21. Limdi NA, Beasley TM, Baird MF, et al. Kidney function influences warfarin responsiveness and hemorrhagic complications. J Am Soc Nephrol 2009;20:912–921.



22. Friberg L, Hammar N, Rosenqvist M. Stroke in paroxysmal atrial fibrillation: report from the Stockholm Cohort of Atrial Fibrillation. Eur Heart J 2010;31:967–975.


23. Hsu JC, Chan PS, Tang F, Maddox TM, Marcus GM. Differences in anticoagulant therapy prescription in patients with paroxysmal versus persistent atrial fibrillation. Am J Med 2015;128:e1–e654.

24. Fauchier L, Villejoubert O, Clementy N, et al. Causes of death and influencing factors in patients with atrial fibrillation. Am J Med 2016;129:1278–1287.


25. National Institute of Health, et al. Kidney disease statistics for the United States [Internet]. Maryland (USA): National institute of Health, 2014. , c2018 [cited 2018 Jun 25]. Available from: https://www.niddk.nih.gov/health-information/health-statistics/kidney-disease
Thromboembolic (A) and major bleeding (B) event-free survival according to the Kaplan-Meier method.
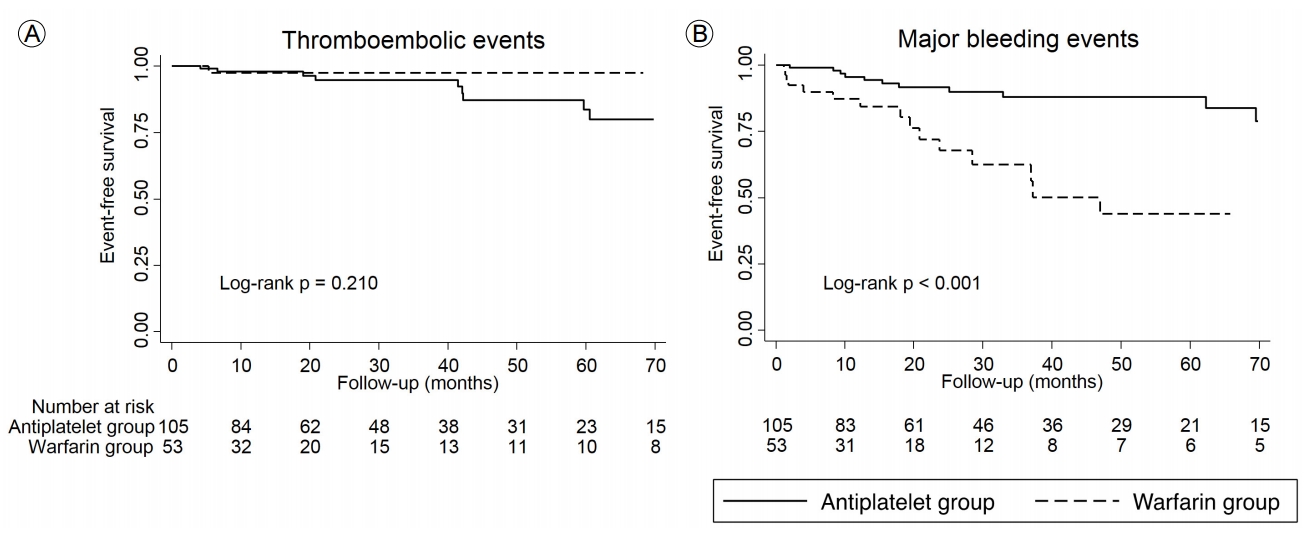
Figure 2.
Table 1.
Baseline characteristics and clinical outcomes
Table 2.
Cox’s regression analysis of factors affecting thromboembolic events and major bleeding events
|
Thromboembolic events |
Major bleeding events |
|||||||
|---|---|---|---|---|---|---|---|---|
|
Univariate |
Multivariate |
Univariate |
Multivariate |
|||||
| HR (95% CI) | p-value | HR (95% CI) | p-value | HR (95% CI) | p-value | HR (95% CI) | p-value | |
| Age | 1.06 (1.00-1.13) | 0.039 | 1.04 (0.98-1.12) | 0.210 | 1.02 (0.99-1.05) | 0.197 | ||
| Female | 0.83 (0.21-3.20) | 0.784 | 2.42 (1.15-5.07) | 0.019 | 2.01 (0.95-4.25) | 0.069 | ||
| Paroxysmal AF | 0.39 (0.08-1.82) | 0.230 | 0.86 (0.39-1.86) | 0.692 | ||||
| Heart failure | 1.04 (0.27-4.04) | 0.960 | 0.37 (0.13-1.07) | 0.067 | 0.55 (0.19-1.65) | 0.289 | ||
| Diabetes mellitus | 3.56 (0.91-13.91) | 0.067 | 2.04 (0.47-8.92) | 0.345 | 0.67 (0.30-1.48) | 0.319 | ||
| Previous stroke/TIA | 1.39 (0.29-6.58) | 0.677 | 1.81 (0.80-4.08) | 0.156 | ||||
| Previous myocardial infarctiona | 14.19 (2.86-70.45) | 0.001 | 6.99 (1.24-39.33) | 0.027 | ||||
| Warfarin use | 0.29 (0.04-2.29) | 0.240 | 0.34 (0.04-2.70) | 0.306 | 4.03 (1.91-8.49) | < 0.001 | 3.44 (1.60-7.36) | 0.001 |
Table 3.
Cox’s regression analysis of factors affecting composite outcome
|
Composite endpoint |
||||
|---|---|---|---|---|
|
Univariate |
Multivariate |
|||
| HR (95% CI) | p-value | HR (95% CI) | p-value | |
| Agea | 1.03 (1.01-1.06) | 0.031 | 1.04 (1.01-1.07) | 0.008 |
| Female | 1.91 (1.01-3.61) | 0.045 | 1.74 (0.91-3.31) | 0.095 |
| Paroxysmal AF | 0.71 (0.35-1.40) | 0.320 | ||
| Heart failure | 0.48 (0.21-1.11) | 0.086 | 0.53 (0.23-1.24) | 0.124 |
| Diabetes mellitus | 1.02 (0.54-1.95) | 0.941 | ||
| Previous stroke/TIA | 1.30 (0.91-1.87) | 0.152 | ||
| Previous myocardial infarction | 2.55 (0.61-10.70) | 0.200 | ||
| Warfarin use | 2.51 (1.33-4.74) | 0.004 | 2.37 (1.24-4.51) | 0.009 |
Table 4.
Cox’s regression analysis of factors affecting all-cause mortality
|
All-cause mortality |
||||
|---|---|---|---|---|
|
Univariate |
Multivariate |
|||
| HR (95% CI) | p-value | HR (95% CI) | p-value | |
| Age | 1.05 (1.02-1.08) | 0.002 | 1.04 (1.01-1.07)a | 0.023 |
| Female | 1.05 (0.55-2.00) | 0.890 | ||
| Paroxysmal AF | 0.88 (0.46-1.69) | 0.695 | ||
| Heart failure | 1.51 (0.79-2.88) | 0.210 | ||
| Diabetes mellitus | 2.25 (1.19-4.25) | 0.013 | 1.55 (0.78-3.09) | 0.211 |
| Previous stroke/TIA | 0.96 (0.40-2.29) | 0.925 | ||
| Previous myocardial infarction | 4.77 (1.43-15.88) | 0.011 | 3.43 (1.02-11.54) | 0.047 |
| Warfarin use | 1.49 (0.78-2.83) | 0.092 | 1.57 (0.82-3.00) | 0.172 |
| Thromboembolic events | 1.25 (0.38-4.10) | 0.709 | ||
| Major bleeding events | 0.82 (0.38-1.79) | 0.620 | ||



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




