žĄú Ž°†
ŽĻĄŽßĆžĚÄ ž†ú2Ūėē ŽčĻŽá®Ž≥Ď, Í≥†Ūėąžēē, žč¨žě•Ž≥Ď, ŽáĆž°łž§Ď ŽďĪžĚĄ žú†ŽįúŪē† žąė žěąÍ≥† ž°įÍłį žā¨ŽßĚÍ≥ľ ŽįÄž†ĎŪēú ÍīÄŽ†®žĚī žěąžúľŽ©į[1] Í≥®ÍīÄž†ąžóľ, žąėŽ©īŽ¨īŪėłŪĚ°ž¶Ě, ŽčīžĄĚž¶Ě, žßÄŽį©ÍįĄ Í∑łŽ¶¨Í≥† žĚľŽ∂Ä žēĒÍ≥ľžĚė žóįÍīÄžĄĪžĚī Ž≥īÍ≥†ŽźėÍ≥† žěąŽč§. ŽĻĄŽßĆŪēėŽ©ī ŽĆÄžā¨ž†Ā žĚīžÉĀžĚī žěė žīąŽěėŽźėÍ≥† Í∑łŽ°ú žĚłŪēú Ūē©Ž≥Ďž¶ĚžĚī ŽŹôŽįėŽź† žúĄŪóėžĚī ŽÜíŽč§ŽäĒ Í≤ɞ̥ žĚėŽĮłŪēúŽč§. žčĚžäĶÍīÄžĚė Ž≥ÄŪôĒžôÄ žč†ž≤ī ŪôúŽŹôŽüČžĚė Ž∂Äž°ĪžúľŽ°ú ŽĻĄŽßĆŪēú ŪôėžěźŽäĒ ž†źžį® ž¶ĚÍįÄŪēėžó¨ 1997ŽÖĄ žĄłÍ≥ĄŽ≥īÍĪīÍłįÍĶ¨žóźžĄúŽäĒ ŽĻĄŽßƞ̥ ž†Ą žĄłÍ≥Ąž†ĀžúľŽ°ú Žß§žöį ž§ĎžöĒŪēú Ž≥īÍĪī Ž¨łž†úŽ°ú Í∑úž†ēŪēėžėÄŽč§[2]. žöįŽ¶¨ŽāėŽĚľžĚė Í≤Ĺžöį 2016ŽÖĄ ÍĶ≠ŽĮľÍĪīÍįēžėĀžĖĎž°įžā¨žóź ŽĒįŽ•īŽ©ī ž≤īžßąŽüČžßÄžąė(body mass index, BMI) 25 kg/m2 žĚīžÉĀžĚė ŽĻĄŽßĆ žú†Ž≥ĎŽ•†žĚÄ Žā®žěź 42.3%, žó¨žěź 26.4%Ž°ú 1998ŽÖĄ ž°įžā¨ ŽčĻžčúžĚė Žā®žěź 26.2%, žó¨žěź 25.1%žôÄ ŽĻĄÍĶźŪēėžėĞ̥ ŽēĆ Íĺłž§ÄŪēėÍ≤Ć ž¶ĚÍįÄŪēėÍ≥† žěąŽč§. žöįŽ¶¨ŽāėŽĚľŽäĒ žĶúÍ∑ľ Žď§žĖī ŽĻĄŽßĆ žĚłÍĶ¨ÍįÄ ÍłČÍ≤©ŪēėÍ≤Ć ž¶ĚÍįÄŽźėÍ≥† žěąžúľŽ©į, ŽĻĄŽßĆžúľŽ°ú žĚłŪēėžó¨ ŽįúžÉĚ ÍįÄŽä•Ūēú Ž≥īÍĪīŪēôž†Ā ŽįŹ žā¨ŪöĆÍ≤Ĺž†úž†Ā Ž¨łž†úŽď§žĚī ŽćĒžöĪ žĽ§žßÄÍ≥† žěąŽč§[2-4].
ŽĻĄŽßĆžĚė žĻėŽ£Ć Žį©Ž≤ēžúľŽ°úŽäĒ žčĚžā¨ žöĒŽ≤ē, žöīŽŹô žöĒŽ≤ē, ŪĖČŽŹô žöĒŽ≤ē ŽďĪžĚė žÉĚŪôúžäĶÍīÄ ÍĶźž†ē Žį©Ž≤ēÍ≥ľ žēĹŽ¨ľ žĻėŽ£Ć, žąėžą†ž†Ā žĻėŽ£Ć ŽďĪžĚī žěąŽč§. ŽĻĄŽßĆžĚė ŽįúŽ≥Ď žöĒžĚłžĚī Žč§žĖĎŪēėÍ≥† ÍįúžĚłžĚė žÉĚŪôúžĖĎžčĚÍ≥ľ Ž™©ŪĎúŪēėŽäĒ ž≤īž§Ď ÍįźŽüČ ž†ēŽŹĄžóź ŽĒįŽĚľ žĻėŽ£Ć Žį©žčĚ ŽėźŪēú Žč§žĖĎŪēėžßÄŽßĆ ÍłįŽ≥łž†ĀžúľŽ°ú žÉĚŪôúžäĶÍīÄ ÍĶźž†ēžĚī žöįžĄ†ŽźėžĖīžēľ žēąž†ĄŪēú ž≤īž§Ď ÍįźžÜĆžôÄ ž≤īž§Ď žú†žßÄÍįÄ ÍįÄŽä•ŪēėŽč§. ŪēėžßÄŽßĆ žÉĚŪôúžäĶÍīĞ̥ ÍĶźž†ēŪēėŽäĒ žĚľžĚī žČĹžßÄ žēäÍ≥†, žčĚžā¨ žöĒŽ≤ē, žöīŽŹô žöĒŽ≤ēŽßĆžúľŽ°ú ž≤īž§ĎžĚĄ ÍįźŽüČŪēėŽäĒ ŽćįŽäĒ ŪēúÍ≥ĄÍįÄ žěąŽč§. ŽėźŪēú ŽĻĄŽßĆžĚė ž†ēŽŹĄÍįÄ žč¨ŪēėÍĪįŽāė ŽĻĄŽßĆžóź ÍīÄŽ†®Žźú žßąŪôėžĚė žúĄŪóėžĚī ŽÜížĚÄ Í≤ĹžöįžóźŽäĒ žēĹŽ¨ľ žöĒŽ≤ē, žąėžą† žöĒŽ≤ē ŽďĪžĚė ž†ĀÍ∑Ļž†ĀžĚł žĻėŽ£ĆÍįÄ ŪēĄžöĒŪēėŽč§[5,6].
ž≤īž§ĎžĚĄ 5-10% ÍįźžÜĆžčúŪā§Ž©ī žč¨ŪėąÍīÄÍ≥Ą žúĄŪóėžöĒžÜĆ ŽįŹ ŽčĻŽá®Ž≥Ď ŽįúžÉĚžĚė žúĄŪóėžĚĄ ÍįźžÜĆžčúŪā¨ žąė žěąžĖī ž≤īž§Ď ÍįźžÜĆžĚė žĚľŽįėž†ĀžĚł žõźžĻôžúľŽ°ú 10% ž†ēŽŹĄžĚė ž≤īž§Ď ÍįźžÜĆŽ•ľ ŽĻĄŽßĆ žĻėŽ£ĆžĚė Ž™©ŪĎúŽ°ú Í∂Ćžú†ŪēėÍ≥† žěąŽč§. žčĚžā¨ žöĒŽ≤ē, žöīŽŹô žöĒŽ≤ē ŽďĪžĚė ŽĻĄžēĹŽ¨ľ žöĒŽ≤ēžóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† 3-6ÍįúžõĒ Ží§žóź Íłįž°ī ž≤īž§ĎžĚė 10%ÍįÄ ÍįźžÜĆŽźėžßÄ žēäžúľŽ©ī žēĹŽ¨ľ žĻėŽ£ĆŽ•ľ Í≥†Ž†§Ūēī Ž≥ľ žąė žěąŽč§. žēĹŽ¨ľ žĻėŽ£ĆŽäĒ žēĹŽ¨ľžóźŽßĆ žĚėž°īŪēėžėĞ̥ ŽēĆÍįÄ žēĄŽčĆ žčĚžā¨ ž°įž†ą, žöīŽŹô žöĒŽ≤ē ŽďĪžĚė žÉĚŪôúžäĶÍīÄ ÍĶźž†ēžĚĄ Ūē®ÍĽė žčúŪĖČŪē† ŽēĆ žĶúŽĆÄŪēúžĚė Ūö®Í≥ľŽ•ľ ÍĪįŽĎė žąė žěąŽč§[7].
ž≤īž§ĎžĚī ž§ĄžĖīŽď§Ž©ī ÍłįžīąŽĆÄžā¨ŽüČžĚī ÍįźžÜĆŪēėŽĮÄŽ°ú ÍįźŽüČŽźú ž≤īž§ĎžĚĄ žú†žßÄŪēėÍłį žúĄŪēīžĄúŽäĒ žßÄžÜ枆ĀžúľŽ°ú žóźŽĄąžßÄ žĄ≠ž∑®ŽüȞ̥ ž§ĄžĚīÍĪįŽāė žóźŽĄąžßÄ žÜĆŽ™®ŽüȞ̥ ŽäėŽ¶¨ŽäĒ Žį©žčĚžĚė žÉĚŪôúžĚĄ žú†žßÄŪēīžēľ ŪēúŽč§. ŽėźŪēú ž≤īž§ĎžĚī ÍįźŽüČŽźėŽ©ī Í∑łžóź ŽĆÄŪēú žÉĚŽ¶¨ž†Ā ŽįėžĚĎžúľŽ°ú žčĚžöēžĚī žÉĀžäĻŪēėÍ≤Ć ŽźėÍ≥† Í∑ľžú°žĚė žóźŽĄąžßÄ Ūö®žú®žĚī žė¨ŽĚľÍįÄžĄú ž∂ĒÍįÄž†ĀžĚł ž≤īž§Ď ÍįźŽüČžĚīŽāė ÍįźŽüČŽźú ž≤īž§Ď žú†žßÄÍįÄ žĖīŽ†§žõĆžßÄÍ≤Ć ŽźúŽč§[8,9]. ž≤īž§ĎžĚĄ ÍįźŽüČŪēėŽäĒ Í≤ÉŽŹĄ žĖīŽ†ĶžßÄŽßĆ žč§ž†úŽ°úŽäĒ ÍįźŽüČŽźú ž≤īž§ĎžĚĄ žú†žßÄŪēėŽäĒ Í≤ÉžĚī ŽćĒ žĖīŽ†§žõĆ žßÄžÜ枆ĀžúľŽ°ú žĻėŽ£ĆŽ•ľ Ūēėžó¨ŽŹĄ 6ÍįúžõĒ ž†ēŽŹĄÍįÄ žßÄŽāėŽ©ī ŽćĒ žĚīžÉĀžĚė ž≤īž§Ď ÍįźŽüČžĚī žóÜÍĪįŽāė žė§Ū칎†§ Žč§žčú ž¶ĚÍįÄŪē† žąė žěąŽč§[10]. ŽĻĄŽßĆ žĻėŽ£Ćž†úŽ•ľ žā¨žö©Ūēú ž≤īž§Ď ÍįźŽüȞ󟎏Ą žēĹž†úŽ•ľ ž§ĎŽč®ŪēėžėĞ̥ ŽēĆ ŽĻ†Ž•ł ž≤īž§ĎžĚė žě¨ž¶ĚÍįÄÍįÄ ŽįúžÉĚŪē† žąė žěąžĖī Žč®ÍłįÍįĄ žēĹŽ¨ľžóź žĚėŪēú ž≤īž§Ď ÍįźžÜĆŽäĒ ŽįĒŽěĆžßĀŪēėžßÄ žēäŽč§.
Í∑łŽŹôžēą ŽßéžĚÄ ŽĻĄŽßĆ žĻėŽ£Ćž†úÍįÄ ÍįúŽįúŽźėžĖī žôĒžúľŽāė žēĹŽ¨ľžĚė Ūö®Í≥ľÍįÄ Ž∂Äž°ĪŪēėÍĪįŽāė žč¨ÍįĀŪēú Ž∂ÄžěĎžö©žúľŽ°ú žĚłŪēėžó¨ žě•ÍłįÍįĄ žā¨žö©žĚī žĚłž†ēŽźú žēĹŽ¨ľžĚÄ Ž≥ĄŽ°ú ŽßéžßÄ žēäŽč§. ž≤īž§Ď ÍįźŽüȞ̥ žúĄŪēú Ūē≠ž†ēžč†Ž≥ĎžēĹŽ¨ľ, žĚīŽá®ž†ú ŽďĪžĚė Žā®žö©žĚī Ž¨łž†úÍįÄ ŽźėžĖīžôĒÍ≥†, ÍĶźÍįźžč†Í≤ĹŪĚ•Ž∂Ąž†úžĚł phentermineÍ≥ľ žĄłŽ°úŪ܆ŽčĆÍ≥Ą žēĹŽ¨ľžĚł fenfluraminežĚė Ž≥ĶŪē©ž†úÍįÄ ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľŽäĒ ŽõįžĖīŽā¨žúľŽāė žč¨žě•ŪĆźŽßČžóź Ž∂ÄžěĎžö©žĚĄ žĚľžúľŪā§Í≤Ć ŽźėžĖī 1997ŽÖĄ žā¨žö©žĚī ÍłąžßÄŽźú ŽįĒÍįÄ žěąŽč§[11]. ŽėźŪēú canabinoid-1 žąėžö©ž≤ī ÍłłŪē≠ž†úžĚł rimonabantŽäĒ žěźžāī ž∂©ŽŹôžĚė Ž∂ÄžěĎžö©žúľŽ°ú žčúŪĆźžĚī ž∑®žÜĆŽźėžóąžúľŽ©į, žó¨Žü¨ ŽĻĄŽßĆ žĻėŽ£Ćž†úŽ°ú ÍįúŽįúŽźú žēŎ吏Ěī Ž∂ÄžěĎžö© ŽįŹ ŽĻĄŽßĆ žĻėŽ£Ć Ūö®Í≥ľ Ž∂Äž°ĪžúľŽ°ú žĚłŪēėžó¨ ÍįúŽįúžĚī ž§ĎŽč®ŽźėÍĪįŽāė žā¨žö©žĚī ž§ĎŽč®ŽźėžóąŽč§. ŽĻĄÍĶźž†Ā žēąž†ĄŪēú žēĹž†úŽ°ú žēĆŽ†§ž°ĆŽćė sibutramineŽŹĄ žč¨ŪėąÍīÄžßąŪôė Í≥†žúĄŪóėÍĶįžóźžĄú žā¨žö©ŪēėŽäĒ Í≤Ĺžöį žč¨ŪėąÍīÄÍ≥Ą Ž∂ÄžěĎžö©žĚī ŽÜížēĄžßÄŽäĒ Í≤ÉžúľŽ°ú ŽāėŪÉÄŽāė 2010ŽÖĄžóź žā¨žö©žĚī ž§ĎžßÄŽźėžĖī ŪėĄžě¨ŽäĒ žā¨žö©žĚī Ž∂ąÍįÄŽä•ŪēėŽč§[12].
ŽĮłÍĶ≠ÍĶ≠Ž¶ĹŽ≥īÍĪīžõźžóźžĄúŽäĒ BMIÍįÄ 30 kg/m2 žĚīžÉĀžĚł Í≤Ĺžöį, ŪėĻžĚÄ 27 kg/m2 žĚīžÉĀžĚīŽ©īžĄú žč¨ŪėąÍīÄÍ≥Ą žßąŪôė Í≥†žúĄŪóėÍĶį(Í≥†Ūėąžēē, ŽčĻŽá®Ž≥Ď, žĚīžÉĀžßÄžßąŪėąž¶Ě)žĚīŽāė žąėŽ©īŽ¨īŪėłŪĚ°ž¶ĚžĚī ŽŹôŽįėŽźú Í≤Ĺžöį žēĹŽ¨ľ žöĒŽ≤ēžĚĄ žčúŽŹĄŪē† Í≤ɞ̥ Í∂ĆÍ≥†ŪēėÍ≥† žěąŽč§. žēĄžčúžēĄ-ŪÉúŪŹČžĖĎ ŽĻĄŽßĆ žĻėŽ£Ć žßÄžĻ®žóźžĄú BMIÍįÄ 25 kg/m2 žĚīžÉĀžĚł Í≤Ĺžöį, ŪėĻžĚÄ 23 kg/m2 žĚīžÉĀžĚīŽ©īžĄú žúĄžôÄ ÍįôžĚÄ žč¨ŪėąÍīÄÍ≥Ą Í≥†žúĄŪóėžĚł Í≤Ĺžöį žēĹŽ¨ľ žĻėŽ£ĆŽ•ľ Í≥†Ž†§Ūē† Í≤ɞ̥ ž†úžēąŪēėžėÄÍ≥†, ŽĆÄŪēúŽĻĄŽßĆŪēôŪöĆŽäĒ BMI 25 kg/m2 žĚīžÉĀžĚł ŪôėžěźžóźžĄú ŽĻĄžēĹŽ¨ľ žĻėŽ£ĆŽ°ú ž≤īž§Ď ÍįźŽüČžóź žč§ŪĆ®Ūēú Í≤Ĺžöį žēĹŽ¨ľ ž≤ėŽį©žĚĄ Í≥†Ž†§Ūē† Í≤ɞ̥ Í∂ĆÍ≥†ŪēúŽč§[13].
Ž≥ł Ž°†
ŪėĄžě¨ ÍĶ≠ŽāīžóźžĄú žě•ÍłįÍįĄ žā¨žö© ŪóąÍįÄŽ•ľ ŽįõžĚÄ ŽĻĄŽßĆ žĻėŽ£Ćž†úŽ°úŽäĒ orlistat, lorcaserin (Belviq¬ģ; Arena Pharmaceuticals, San Diego, CA, USA), naltrexone-bupropion Ž≥ĎŪē©ž†ú(Contrave¬ģ; Nalpropion Pharmaceuticals, La Jolla, CA, USA), liraglutide (Saxenda¬ģ; Novo Nordisk, Plainsboro, NJ, USA)ÍįÄ žěąŽč§. ÍĶ≠ŽāīžóźžĄúŽäĒ žā¨žö©ŽźėÍ≥† žěąžßÄ žēäžßÄŽßĆ 2012ŽÖĄžóź ŽĮłÍĶ≠žóźžĄú phentermine/topiramate Ž≥ĎŪē©ž†ú(Qsymia¬ģ; Vivus, Campbell, CA, USA)ÍįÄ ŽĮłÍĶ≠žčĚŪíąžĚėžēĹÍĶ≠žóźžĄú žäĻžĚłžĚĄ ŽįõžēĄ ŽĻĄŽßĆ žĻėŽ£Ćžóź žā¨žö©ŽźėÍ≥† žěąŽč§. ŪėĄžě¨ÍĻĆžßÄ ÍĶ≠ŽāīžóźžĄú žā¨žö© ÍįÄŽä•Ūēú ŽĮłÍĶ≠žčĚŪíąžĚėžēĹÍĶ≠ žäĻžĚł ŽĻĄŽßĆ žĻėŽ£Ćž†úŽäĒ ŪĎú 1Í≥ľ ÍįôŽč§. žó¨ÍłįžĄúŽäĒ ÍĶ≠ŽāīžóźžĄú ŪėĄžě¨ žě•ÍłįÍįĄ žā¨žö© ŪóąÍįÄŽ•ľ ŽįõžĚÄ žēĹŽ¨ľžĚĄ ž§Ďžč¨žúľŽ°ú Í≥†žįįŪēėÍ≥†žěź ŪēúŽč§.
Orlistat
OrlistatŽäĒ Žßźžīąžóź žěĎžö©ŪēėŽäĒ ŽĻĄŽßĆ žĻėŽ£Ćž†úŽ°úžĄú 2001ŽÖĄ ž∂úžčúŽźėžĖī žßÄÍłąÍĻĆžßÄ žēąž†ĄžĄĪžĚī žěÖž¶ĚŽźú žēĹž†úžĚīŽč§. OrlistatŽäĒ žúĄžôÄ žÜĆžě•žĚė ž†źŽßȞ󟞥ú Ž¶¨ŪĆĆžēĄž†ú(lipase)Ž•ľ žĖĶž†úŪēėžó¨ ž§ĎžĄĪžßÄŽį©žĚī žßÄŽį©žāįžúľŽ°ú Ž∂ĄŪēīŽźėžĖī žě•ÍīÄ ŽāīŽ°ú ŪĚ°žąėŽźėŽäĒ Í≤ɞ̥ žį®Žč®Ūē®žúľŽ°úžć® ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľŽ•ľ ŽāėŪÉÄŽāłŽč§[7,14]. OrlistatŽäĒ žě•ÍīÄŽāī ž§ĎžĄĪžßÄŽį©žĚė ŪĚ°žąėŽ•ľ žēĹ 30% ž†ēŽŹĄ žĖĶž†úŪēėžó¨ žßÄŽį© ž†úŪēú žčĚžā¨Ž≥īŽč§ ŽćĒ ŽßéžĚÄ ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľÍįÄ ŽāėŪÉÄŽāėŽ©į žó¨Žü¨ ÍįÄžßÄ ŽĆÄžā¨ žÉĀŪÉúŽ•ľ ÍįúžĄ†ŪēėŽäĒŽćį ŽŹĄžõÄžĚī ŽźúŽč§[15,16].
OrlistatŽ•ľ žĚīžö©Ūēú žě•ÍłįÍįĄ žóįÍĶ¨žĚł xenical in the prevention of diabetes in obese subjects žóįÍĶ¨žóź ŽĒįŽ•īŽ©ī 1ŽÖĄÍįĄ Ž≥Ķžö©ŪēėžėĞ̥ ŽēĆ Íłįž†Äž≤īž§Ď ŽĆÄŽĻĄ ž≤īž§Ď ÍįźžÜĆžú®žĚī žúĄžēĹÍĶįžóź ŽĻĄŪēėžó¨ žēĹ 5% ŽÜížĚÄ ŽĻĄžú®žĚĄ Ž≥īžėÄÍ≥†(11% ÍįźžÜĆ vs. 6% ÍįźžÜĆ) 4ŽÖĄÍįĄ Ž≥Ķžö©ŪēėžėĞ̥ Žēƞ󟎏Ą žúĄžēĹÍĶįžóź ŽĻĄŪēėžó¨ žú†žĚėŪēú ž≤īž§Ď ÍįźžÜĆÍįÄ žú†žßÄŽźėžóąŽč§(6.9% ÍįźžÜĆ vs. 4.1% ÍįźžÜĆ). ŽėźŪēú 4ŽÖĄÍįĄ Ž≥Ķžö©ŪēėžėĞ̥ ŽēĆ ŽāīŽčĻŽä•žě•žē†žóźžĄú ŽčĻŽá®Ž≥ĎžúľŽ°úžĚė žßĄŪĖČ ŽėźŪēú 37% ÍįźžÜĆŪēėžėÄŽč§[17]. 30Íįú žúĄžēĹŽĆÄž°į žóįÍĶ¨Ž•ľ Ž©ĒŪÉÄŽ∂ĄžĄĚŪēú Í≤įÍ≥ľžóźžĄúŽŹĄ orlistatŽ•ľ 1ŽÖĄ žĚīžÉĀ Ž≥Ķžö©ŪēėžėĞ̥ ŽēĆ žúĄžēĹÍĶįžóź ŽĻĄŪēėžó¨ 5% žĚīžÉĀ ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľŽ•ľ Ž≥īžĚł ŽĻĄžú®žĚÄ 21%, 10% žĚīžÉĀžĚė ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľŽ•ľ Ž≥īžĚł ŽĻĄžú®žĚÄ 12% ŽćĒ ŽßéžēėžúľŽ©į, žĚłžäźŽ¶įž†ÄŪē≠žĄĪžĚė ÍįúžĄ†, ŪėąŽčĻ ÍįźžÜĆ ŽįŹ ž†ÄŽįÄŽŹĄžßĎ讎įĪ žĹúŽ†ąžä§ŪÖĆŽ°§ ÍįźžÜĆ ŽįŹ žąėž∂ēÍłįŪėąžēē ÍįźžÜĆ, žĚīžôĄ Íłį Ūėąžēē ÍįźžÜĆžĚė Ūö®Í≥ľŽ•ľ Ž≥īžėÄŽč§[18].
OrlistatžĚė Ž≥Ķžö©žóź ŽĒįŽ•ł Ž∂ÄžěĎžö©žĚÄ ž†Ąžč†ž†ĀžĚł Ž∂ÄžěĎžö©žĚÄ žóÜÍ≥† ŽĆÄÍįú žě•ÍīÄ Žāīžóź ÍĶ≠ŪēúŽźúŽč§. 2ŽÖĄÍįĄžĚė Ž≥Ķžö© ž§Ďžóź ŽĆÄžÉĀžěźžĚė 20% žĚīžÉĀžóźžĄú ŪėłžÜĆŪēú Ž∂ÄžěĎžö©žúľŽ°úŽäĒ ŽĆÄŽ≥Äžč§Íłą, žįĒŽĀĒ žßÄŽį©Ž≥Ä(oily spotting), žßÄŽį©Ž≥Ä(fatty stool)žĚī žěąžúľŽ©į, žĻėŽ£Ć ž§ĎŽč®žú®žĚÄ žĻėŽ£ĆÍĶį 8.8%, žúĄžēĹÍĶį 5.0%Ž°ú žēĆŽ†§žßÄÍ≥† žěąŽč§[19].
Lorcaserin (Belviq¬ģ)
LorcaserinžĚÄ žčĚžöē ž°įž†ą ž§Ďž∂ĒžĚł žčúžÉĀŪēėŽ∂Äžóź ž°īžě¨ŪēėŽäĒ žĄłŽ°úŪ܆ŽčĆžąėžö©ž≤ī 5-hydroxytryptamine (5-HT) 2C žąėžö©ž≤īžóź žĄ†ŪÉĚž†ĀžúľŽ°ú žěĎžö©ŪēėŽäĒ žēĹŽ¨ľŽ°ú ŪíčžēĄŪéłŪĚĎžÉČžÜĆŽ∂Äžč†Í≤ČžßąžěźÍ∑ĻŪėłŽ•īŽ™¨(proopiomelanocortin, POMC) ŽČīŽüį žčúžä§ŪÖúžĚĄ ŪôúžĄĪŪôĒžčúžľúžĄú žčĚžöēžĚĄ žĖĶž†úŪēėÍ≥† ž≤īž§Ď ÍįźžÜĆŽ•ľ žĚľžúľŪā§ŽäĒ žĄłŽ°úŪ܆ŽčĆžĄĪ žēĹŽ¨ľžĚīŽč§[20]. ŽĮłÍĶ≠žčĚŪíąžĚėžēĹÍĶ≠žóźžĄú 2012ŽÖĄ žě•Íłį ž≤ėŽį© ÍįÄŽä•Ūēú ŽĻĄŽßĆ žĻėŽ£Ćž†úŽ°ú žäĻžĚłŪēėžėÄÍ≥† žöįŽ¶¨ŽāėŽĚľ žčĚŪíąžĚėžēĹŪíąžēąž†Ąž≤ėžóźžĄúŽäĒ 2015ŽÖĄ žäĻžĚłŪēėžėÄŽč§. žėąž†ĄžóźŽŹĄ žĚīŽü¨Ūēú žąėžö©ž≤īžóź žěĎžö©ŪēėŽäĒ žēĹž†ú(fenfluramine, dexfenfluramine)ÍįÄ žěąžóąŽč§. žöįžąėŪēú ž≤īž§Ď ÍįźžÜĆ Ūö®Í≥ľÍįÄ žěąžóąžßÄŽßĆ 5-HT2B žąėžö©ž≤īžóźŽŹĄ žěĎžö©ŪēėŽäĒ ŽĻĄžĄ†ŪÉĚž†Ā žēĹž†úŽď§Ž°úžĄú žč¨žě•ŪĆźŽßČ žßąŪôė ŽįúžÉĚÍ≥ľžĚė ÍīÄŽ†®žĄĪ ŽēĆŽ¨łžóź žčúžě•žóźžĄú žā¨ŽĚľžßÄÍ≤Ć ŽźėžóąŽč§[21].
2010ŽÖĄžóź ŽįúŪĎúŽźú Behavioral Modification and Lorcaserin for Overweight and Obesity Management (BLOOM) žóįÍĶ¨ŽäĒ 3,182Ž™ÖžĚė ŽĻĄŽßĆ ŪėĻžĚÄ Í≥ľž≤īž§ĎžĚĄ ÍįĞߥ žā¨Žěƞ̥ ŽĆÄžÉĀžúľŽ°ú 52ž£ľ ŽŹôžēą žÉĚŪôúžäĶÍīÄ ÍĶźž†ēÍ≥ľ Ūē®ÍĽė lorcaserin 10 mg ŽįŹ žúĄžēŞ̥ Ūą¨žó¨Ūēėžó¨ lorcaserinžĚė ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľŽ•ľ ž°įžā¨Ūēú žĚīž§ĎŽßĻÍ≤Ä ŽĆÄž°įÍĶį žóįÍĶ¨žĚīŽč§. žĚī žóįÍĶ¨žóźžĄú lorcaserin Ūą¨žó¨ÍĶįžĚÄ 5.8 kg, žúĄžēĹ Ūą¨žó¨ÍĶįžĚÄ 2.2 kgžĚė ž≤īž§Ď ÍįźžÜĆŽ•ľ Ž≥īžėÄŽč§[22]. BMI 30 kg/m2 žĚīžÉĀžĚė ŽĻĄŽßĆž¶Ě Ūôėžěź ŽėźŽäĒ BMIÍįÄ 27 kg/m2 žĚīžÉĀžĚīŽ©īžĄú Í≥†žúĄŪóėÍĶįžĚł ŪôėžěźŽ•ľ ŪŹ¨Ūē®Ūēú ŽĆÄÍ∑úŽ™®žĚė Behavioral Modification and Lorcaserin Second Study for Obesity Management žóįÍĶ¨žóźžĄúŽäĒ ŽĆÄžÉĀ ŪôėžěźŽď§žĚĄ žčĚžā¨ žöĒŽ≤ēÍ≥ľ žöīŽŹô žöĒŽ≤ēžóź ž∂ĒÍįÄŪēėžó¨ lorcaserin 10 mg ŪēėŽ£® 2ŪöĆ, 10 mg ŪēėŽ£® 1ŪöĆ Í∑łŽ¶¨Í≥† žúĄžēĹÍĶį, 3ÍĶįžúľŽ°ú Ž¨īžěĎžúĄ Žįįž†ēŪēėžó¨ 1ŽÖĄÍįĄ ŽĻĄÍĶźŪēú žóįÍĶ¨ Í≤įÍ≥ľ, 5% žĚīžÉĀžĚė ž≤īž§Ď ÍįźžÜĆŽ•ľ Ž≥īžĚł ŪôėžěźŽď§žĚė ŽĻĄžú®žĚÄ ÍįĀÍįĀ 47.2%, 40.2%, 25%Ž°ú lorcaserinÍĶįžóźžĄú žúĄžēĹÍĶįŽ≥īŽč§ žĚėŽĮł žěąÍ≤Ć ŽÜížēėŽč§(p< 0.001). ŽėźŪēú 10% žĚīžÉĀ ž≤īž§Ď ÍįźžÜĆŽ•ľ Ž≥īžĚł ŪôėžěźžĚė ŽĻĄžú®ŽŹĄ ÍįĀÍįĀ 22.6%, 17.4%, 9.7%Ž°ú lorcaserinÍĶįžóźžĄú žúĄžēĹÍĶįŽ≥īŽč§ žú†žĚėŪēėÍ≤Ć ŽÜížēėŽč§[23]. ŪēúŪéł 604Ž™ÖžĚė ŽĻĄŽßĆŪēú ž†ú2Ūėē ŽčĻŽá®Ž≥Ď ŪôėžěźŽßƞ̥ ŽĆÄžÉĀžúľŽ°ú 1ŽÖĄÍįĄ lorcaserin 10 mgžĚĄ ŪēėŽ£® 1ŪöĆ, ŪėĻžĚÄ 2ŪöĆ Ūą¨žó¨Ūēú BLOOM in Diabetes Mellitus (DM) žóįÍĶ¨žóźžĄúŽäĒ 5% žĚīžÉĀžĚė ž≤īž§Ď ÍįźŽüČžóź žĄĪÍ≥ĶŪēú ŪôėžěźžĚė ŽĻĄžú®žĚī ÍįĀÍįĀ 44.7%, 37.5%Ž°ú žúĄžēĹÍĶį 16.1%žóź ŽĻĄŪēėžó¨ žú†žĚėŪēėÍ≤Ć ŽÜížēėžúľŽ©į ŪėąŽčĻžĚė ÍįúžĄ† Ūö®Í≥ľŽŹĄ ÍīÄžįįŽźėžóąŽč§[24].
2018ŽÖĄ 12,000Ž™ÖžĚė ŽŹôŽß•Í≤ĹŪôĒžĄĪ žč¨ŪėąÍīÄžßąŪôė ŽėźŽäĒ Ž≥ĶžąėžĚė žč¨ŪėąÍīÄ žúĄŪóėžĚłžěźŽ•ľ ÍįĞߥ ŽĻĄŽßĆ(BMI 30 kg/m2 žĚīžÉĀ) ŽėźŽäĒ Í≥ľž≤īž§Ď(27 kg/m2 žĚīžÉĀ)žĚł ŪôėžěźŽď§ ŽĆÄžÉĀžúľŽ°ú lorcaserinžĚė Ūö®Í≥ľžôÄ žč¨ŪėąÍīÄ žēąž†ēžĄĪžóź ŽĆÄŪēú Cardiovascular and Metabolic Effects of Lorcaserin in Overweight and Obese Patients-Thrombolysis in Myocardial Infarction 61 žóįÍĶ¨ Í≤įÍ≥ľÍįÄ ŽįúŪĎúŽźėžóąŽč§. ŽĆÄžÉĀžěźŽď§žĚĄ lorcaserin 10 mg 1žĚľ 2ŪöĆ Ūą¨žó¨ÍĶįÍ≥ľ žúĄžēĹÍĶįžúľŽ°ú Ž¨īžěĎžúĄŽ°ú Žįįž†ēŪēėžó¨ 3.3ŽÖĄÍįĄ ž∂Ēž†ĀŪēú Í≤įÍ≥ľ žčúŪóė žčúžěĎ 1ŽÖĄ ŪõĄÍĻĆžßÄ 5% žĚīžÉĀžĚė ž≤īž§Ď ÍįźžÜĆÍįÄ žěąžóąŽćė ŽĻĄžú®žĚÄ lorcaserinÍĶįžĚī žúĄžēĹÍĶįžóź ŽĻĄŪēėžó¨ ŽÜížēėžúľŽ©į(38.7% vs. 17.4%) ŪėąžēēÍ≥ľ žč¨Žįēžąė, žßÄžßą žąėžĻė, ŪėąŽčĻ žąėžĻė ŽďĪžĚė žč¨ŪėąÍīÄ ŽĆÄžā¨žĚłžěźžĚė ÍįúžĄ† Ūö®Í≥ľŽŹĄ žúĄžēĹÍĶįžóź ŽĻĄŪēėžó¨ lorcaserinÍĶįžĚī žöįžąėŪēėžėÄŽč§. 3.3ŽÖĄžĚė ž∂Ēž†Ā ÍłįÍįĄ ŽŹôžēą ž£ľžöĒ žč¨ŪėąÍīÄžßąŪôė(major adverse cardiovascular events, MACE; žč¨ŪėąÍīÄ žā¨ŽßĚ, ŽĻĄžĻėŽ™Ö žč¨Í∑ľÍ≤ĹžÉČ, ŽĻĄžĻėŽ™Ö ŽáĆž°łž§Ď)žĚė žóįÍįĄ ŽįúžÉĚŽ•†žĚÄ žúĄžēĹÍĶįžóźžĄú 2.1%, lorcasrinÍĶįžóźžĄú 2.0%Ž°ú ŽĻĄžä∑ŪēėžėÄÍ≥†, MACE, Ž∂ąžēąž†ē ŪėϞ訞¶Ěžóź žĚėŪēú žěÖžõź, žč¨Ž∂Äž†Ą, ŪėąŪĖČžě¨ÍĪīžą†žĚė žóįÍįĄ ŽįúžÉĚŽ•†žĚÄ žúĄžēĹÍĶįžóźžĄú 4.2%, lorcaserinÍĶįžóźžĄú 4.1%Ž°ú žú†žĚėŪēú žį®žĚīÍįÄ žóÜžóąŽč§[25]. ŽĮłÍĶ≠žčĚŪíąžĚėžēĹÍĶ≠žĚė lorcaserin žā¨žö© ž†ĀžĚĎž¶ĚžĚÄ BMI 30 kg/m2 žĚīžÉĀžĚīÍĪįŽāė, BMI 27 kg/m2 žĚīžÉĀžĚīŽ©īžĄú Í≥†Ūėąžēē, ž†ú2Ūėē ŽčĻŽá®Ž≥Ď, žĚīžÉĀžßÄžßąŪėąž¶ĚÍ≥ľ ÍįôžĚÄ ŽĻĄŽßĆ ÍīÄŽ†® ŽĆÄžā¨žĚīžÉĀžĚī žěąŽäĒ Í≤ĹžöįžĚīŽč§.
Naltrexone-bupropion Ž≥ĎŪē©ž†ú(Contrave¬ģ)
Naltrexone-bupropionžĚÄ ŽĎź ÍįÄžßÄ Žč§Ž•ł Íłįž†ĄžĚė žēĹž†úÍįÄ Ž≥ĶŪē©Žźú Í≤ÉžúľŽ°ú naltrexonežĚÄ ŽßąžēĹ ž§ĎŽŹÖ ŽįŹ žēĆžĹĒžė¨ ž§ĎŽŹÖ žĻėŽ£Ćž†úžĚīŽ©į bupropionžĚÄ Ūē≠žöįžöłž†úžĚīŽ©į Íłąžóį žĻėŽ£ĆžóźŽŹĄ žďįžĚīŽäĒ žēĹŽ¨ľžĚīŽč§. BupropionžĚÄ dopamineÍ≥ľ norepinephrinežĚė žě¨ŪĚ°žąėŽ•ľ žĖĶž†úŪēėŽäĒ Ūē≠žöįžöłž†úŽ°úžĄú žčúžÉĀŪēėŽ∂Ä POMC ŽČīŽüįžóźžĄúžĚė žěĎžö©žĚĄ ŪÜĶŪēėžó¨ žĚĆžčĚ žĄ≠ž∑®ŽüȞ̥ ÍįźžÜĆžčúŪā§Í≥†, žóźŽĄąžßÄ žÜĆŽĻĄŽ•ľ ž¶ĚÍįÄžčúžľú ž≤īž§Ď ÍįźžÜĆŽ•ľ žú†ŽŹĄŪēúŽč§. ŪēėžßÄŽßĆ POMCŽäĒ ŽāīžĚłžĄĪ opioidžóź žĚėŪēėžó¨ žěźÍįÄ žĖĶž†úŽźėžĖī bupropionžĚė žčĚžöē žĖĶž†ú Ūö®Í≥ľÍįÄ ŽĖ®žĖīžßÄŽäĒŽćį, opioid ÍłłŪē≠ž†úžĚł naltrexoneÍ≥ľ Ž≥ĎŪē©Ūēėžó¨ bupropionžóź žĚėŪēú POMC ŪôúžĄĪŪôĒŽ•ľ ž¶ĚÍįÄžčúžľú žčĚžöē žĖĶž†ú Ūö®Í≥ľŽ•ľ ÍįēŪôĒžčúŪā¨ žąė žěąŽč§[26]. 2014ŽÖĄ 9žõĒ ŽĮłÍĶ≠žčĚŪíąžĚėžēĹÍĶ≠žóźžĄú 6ÍįúžõĒ žĚīžÉĀžĚė žě•Íłį žā¨žö©žĚī ÍįÄŽä•Ūēú ŽĻĄŽßĆ žĻėŽ£Ćž†úŽ°ú žäĻžĚłŪēėžėÄÍ≥† žöįŽ¶¨ŽāėŽĚľ žčĚŪíąžĚėžēĹŪíąžēąž†Ąž≤ėŽäĒ 2016ŽÖĄ 5žõĒžóź žäĻžĚłŪēėžėÄŽč§.
ŽĻĄŽßĆŪēú ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú 56ž£ľ ŽŹôžēą žßĄŪĖČžĚī ŽźėžóąŽćė Contrave Obesity Research-I (COR-I) žóįÍĶ¨žóźžĄú naltrexone/bupropion 32 mg/360 mg Ūą¨žó¨ÍĶįžóźžĄúŽäĒ 6.1%žĚė ž≤īž§Ď ÍįźžÜĆŽ•ľ Ž≥īžėÄžúľŽ©į naltrexone/bupropion 16 mg/360 mg Ūą¨žó¨ÍĶįžóźžĄúŽäĒ 5.0%žĚė ž≤īž§Ď ÍįźžÜĆŽ•ľ Ž≥īžó¨ žúĄžēĹÍĶį(1.3%)žóź ŽĻĄŪēėžó¨ žú†žĚėŪēú ÍįúžĄ†žĚĄ Ž≥īžėÄŽč§. ŽėźŪēú ž≤īž§Ď 5% žĚīžÉĀ ÍįźŽüČžóź žĄĪÍ≥ĶŪēú ŽĻĄžú®žĚÄ naltrexone/bupropion 32 mg/360 mg Ūą¨žó¨ÍĶįžóźžĄú 48%, naltrexone/bupropion 16 mg/360 mg Ūą¨žó¨ÍĶįžóźžĄúŽäĒ 39%Ž°ú žúĄžēĹÍĶį(17%)žóź ŽĻĄŪēėžó¨ žú†žĚėŪēėÍ≤Ć ŽÜíÍ≤Ć ŽāėŪÉÄŽā¨Žč§[27]. 1,496Ž™ÖžĚė BMI 30 kg/m2 žĚīžÉĀžĚė ŽĻĄŽßĆž¶Ě Ūôėžěź ŽėźŽäĒ BMIÍįÄ 27 kg/m2 žĚīžÉĀžĚīŽ©īžĄú Í≥†žúĄŪóėÍĶįžĚł ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú žßĄŪĖČŪēú COR-II žóįÍĶ¨žóźžĄúŽŹĄ naltrexone/bupropion 32 mg/360 mg Ž≥ĶŪē©ž†úŽäĒ žúĄžēĹÍĶįžóź ŽĻĄŪēėžó¨ žú†žĚėŪēú ž≤īž§Ď ÍįźŽüČŽ•†žĚĄ Ž≥īžėÄÍ≥†(-6.4% vs. -1.2%), 5% žĚīžÉĀ ž≤īž§Ď ÍįźŽüČ žĄĪÍ≥ĶŽ•† ŽėźŪēú žúĄžēĹÍĶįžóź ŽĻĄŪēėžó¨ žú†žĚėŪēėÍ≤Ć ŽÜížēėžúľŽ©į(50.5% vs. 17.1%) ŽėźŪēú žč¨ŪėąÍīÄ ŽĆÄžā¨ žßÄŪĎúÍįÄ žú†žĚėŪēėÍ≤Ć ÍįúžĄ†ŽźėŽäĒ Ūö®Í≥ľÍįÄ ŽāėŪÉÄŽā¨Žč§[28]. Í∑ł žôłžóź Ž™®Žď† COR žěĄžÉĀžóįÍĶ¨žóźžĄú žßÄžßą ŽįŹ žĚłžäźŽ¶į ž†ÄŪē≠žĄĪ ÍįúžĄ† Ūö®Í≥ľŽ•ľ Ž≥īžėÄŽč§[27-30]. ŽėźŪēú žúĄžēĹÍĶįÍ≥ľ ŽĻĄÍĶźŪēėžó¨ Ž≥ĶŪē©ž†ú Ž≥Ķžö©ÍĶįžóźžĄú žčĚžöē ÍįźžÜĆ, ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľŽßĆžĚī žēĄŽčąŽĚľ ŽįįŽ∂ÄŽ•ł žÉĀŪÉúžóźžĄúŽŹĄ žĚĆžč̞̥ žĄ≠ž∑®ŪēėŽäĒ žčĚŪÉźžĚĄ ÍįźžÜĆžčúŪā§ŽäĒ Ūö®Í≥ľÍįÄ žěąžĚĆžĚī ÍīÄžįįŽźėžóąŽč§[27].
Ž∂ÄžěĎžö©žúľŽ°úŽäĒ žė§žč¨, ÍĶ¨Ū܆, Ž≥ÄŽĻĄ, ŽĎźŪÜĶ, ŪėĄÍłįž¶Ě, Ž∂ąŽ©īž¶Ě, žĄ§žā¨ ŽįŹ žěźžāī žúĄŪóėžĄĪžĚė ž¶ĚÍįÄ ÍįÄŽä•žĄĪžĚī žěąŽč§. žė§žč¨Í≥ľ ÍĶ¨Ū܆ŽäĒ ž£ľŽźú Ž∂ÄžěĎžö©žúľŽ°ú Ž≥īÍ≥†ŽźėÍ≥† žěąžúľŽ©į, žĚīŽü¨Ūēú Ž∂ÄžěĎžö©žĚĄ žėąŽį©ŪēėŽ†§Ž©ī žĄúžĄúŪěą žēĹž†ú žö©ŽüȞ̥ ž¶ĚÍįÄŪēėŽäĒ Í≤ÉžĚī ž∂Ēž≤úŽźúŽč§. ÍłąÍłįž¶ĚžúľŽ°úŽäĒ ŽįúžěĎ, žĄ≠žčĚžě•žē†, ŽßąžēĹžĄĪ žßĄŪÜĶž†ú žā¨žö©, monoamine oxidase (MAO) žĖĶž†úž†ú žā¨žö©, ž°įž†ąŽźėžßÄ žēäŽäĒ Í≥†Ūėąžēē ŽďĪžĚī žěąŽč§. 18žĄł ŽĮłŽßĆžóź ŽĆÄŪēīžĄúŽäĒ Ūö®Í≥ľ ŽįŹ žēąž†ēžĄĪžóź ŽĆÄŪēú žěźŽ£ĆÍįÄ žóÜÍ≥†, žč¨ŪėąÍīÄžßąŪôėžĚė žĚīŪôėžú®Í≥ľ žā¨ŽßĚŽ•†žóź ŽĆÄŪēú žėĀŪĖ•žĚÄ žēĄžßĀ žěÖž¶ĚŽźėžßÄ žēäžĚÄ žÉĀŪÉúžĚīŽč§.
Liraglutide (Saxenda¬ģ)
LiraglutideŽäĒ glucagon-like peptide-1 (GLP-1) žąėžö©ž≤īžóź žěĎžö©ŪēėŽäĒ žēĹŽ¨ľŽ°ú žĚīŽĮł ž†ú2Ūėē ŽčĻŽá®Ž≥Ď žĻėŽ£Ćž†úŽ°ú žďįžĚīÍ≥† žěąŽč§. GLP-1žĚÄ žčĚžöēžĚĄ žÉĚŽ¶¨ž†ĀžúľŽ°ú ž°įž†ąŪēėŽäĒ žĚłžěźŽ°ú, ŪŹ¨ŽßĆÍįźžĚĄ ŽÜížĚīÍ≥† žĚĆžčĚ žĄ≠ž∑®Ž•ľ ÍįźžÜĆžčúŪā®Žč§. LiraglutideŽäĒ žčúžÉĀŪēėŽ∂Ä ŽāīžĚė arcuate nucleusžĚė GLP-1 receptorsžóź Í≤įŪē©Ūēėžó¨ žßĀž†Ďž†ĀžúľŽ°ú POMC/cocaine- and amphetamine-regulated transcript ŽČīŽ°†žĚĄ ŪôúžĄĪŪôĒžčúŪā®Žč§. žĚīŽäĒ ŪŹ¨ŽßĆÍįźžĚĄ žīȞߥžčúŪā§Ž©į ŽŹôžčúžóź Í≥ĶŽ≥ĶÍįźžĚĄ žú†ŽįúŪēėŽäĒ NPY/AgRP ŽČīŽ°†žĚĄ žĖĶž†úžčúŪā§ŽäĒ žěĎžö©ŽŹĄ Ūē®ÍĽė ŪēúŽč§. Í≤įÍ≥ľž†ĀžúľŽ°ú liraglutideŽäĒ žčĚžöē žĖĶž†úŽ•ľ ŪÜĶŪēėžó¨ žĚĆžčĚ žĄ≠ž∑®Ž•ľ ÍįźžÜĆžčúžľú ž≤īž§Ď ÍįźžÜĆ Ūö®Í≥ľŽ•ľ Ž≥īžĚīÍ≤Ć ŽźúŽč§.
Liraglutide (Saxenda¬ģ)ŽäĒ 2014ŽÖĄ 12žõĒžóź ŽĮłÍĶ≠žčĚŪíąžĚėžēĹÍĶ≠žúľŽ°úŽ∂ÄŪĄį ž≤īž§Ď ÍįźŽüȞ̥ žúĄŪēú ž≤ėŽį©žĚī žäĻžĚłŽźėžóąžúľŽ©į 2018ŽÖĄ 3žõĒ ÍĶ≠ŽāīžóźžĄú ž∂úžčúÍįÄ ŽźėžóąŽč§. ŽčĻŽá®Ž≥ĎžúľŽ°ú žĻėŽ£Ćž†úŽ°ú ÍįúŽįúŽźú liraglutide (Victoza¬ģ)ŽäĒ 1.2 mg, 1.8 mg ž†úŪėēžĚłŽćį ŽįėŪēėžó¨, ŽĻĄŽßĆ žĻėŽ£Ć Ž™©ž†ĀžúľŽ°ú žā¨žö©ŽźėŽäĒ Saxenda¬ģŽäĒ liraglutide 3 mg ž£ľžā¨ ž†úŪėēžúľŽ°ú 1žĚľ 1ŪöĆ ŪĒľŪēėžßÄŽį©žúľŽ°ú Ūą¨žó¨ŪēúŽč§. žčúžěĎ žö©ŽüČžĚÄ ŪēėŽ£® 1ŪöĆ 0.6 mgžĚīŽ©į, 1ž£ľžĚľ ŽßąŽč§ 0.6 mgžĒ© ž¶ĚŽüČŪēėžó¨ ŪôėžěźžóźÍ≤Ć ÍįÄžě• ž†Āž†ąŪēú žö©ŽüȞ̥ žā¨žö©ŪēėŽ©į ŪēėŽ£® žĶúŽĆÄ žö©ŽüČžĚÄ 3.0 mgžĚīŽč§.
Liraglutide 3.0 mgžĚė ŽĻĄŽßĆ žĻėŽ£Ćž†ú ŪóąÍįÄ žěĄžÉĀžĚł Satiety and Clinical Adiposity-Liraglutide (SCALE) žóįÍĶ¨ŽäĒ ŽčĻŽá®Ž≥ĎžĚī žóÜŽäĒ Í≥ľž≤īž§Ď ŽėźŽäĒ ŽĻĄŽßƞ̳ Ūôėžěź, ž†ĄŽč®Í≥Ą ŽčĻŽá®Ž≥Ď, ŽčĻŽá®Ž≥Ď, Í≥†Ūėąžēē, žĚīžÉĀžßÄžßąŪėąž¶Ě ŽėźŽäĒ žč¨ÍįĀŪēú ŪŹźžáĄžĄĪžąėŽ©īŽ¨īŪėłŪĚ°ž¶ĚžÉĀ ŽďĪžĚė ŽŹôŽįė žßąŪôėžĚĄ ÍįĞߥ Í≥ľž≤īž§Ď, ŽĻĄŽßĆ ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú žßĄŪĖČŪēú žīĚ 4ÍįúžĚė žěĄžÉĀžúľŽ°ú ÍĶ¨žĄĪŽźėžóąŽč§[31-34]. 2015ŽÖĄ ŽįúŪĎúŽźú SCALE Obesity and Prediabetes žóįÍĶ¨ŽäĒ ŽčĻŽá®Ž≥ĎžĚī žóÜžúľŽ©īžĄú BMIÍįÄ 30 kg/m2 žĚīžÉĀžĚė ŽĻĄŽßĆž¶Ě Ūôėžěź ŽėźŽäĒ BMIÍįÄ 27 kg/m2 žĚīžÉĀžĚīŽ©īžĄú Í≥†Ūėąžēē ŽėźŽäĒ žĚīžÉĀžßÄžßąŪėąž¶ĚžĚī ŽŹôŽįėŽźú 3,731Ž™ÖžĚė ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú 56ž£ľÍįĄ žßĄŪĖČŽźú žĚīž§ĎŽßĻÍ≤Ä žóįÍĶ¨žĚīŽč§[31]. Liraglutide Ūą¨žó¨ÍĶįžĚÄ ŪŹČÍ∑† 8.4 kgžĚė ž≤īž§Ď ÍįźžÜĆÍįÄ ÍīÄžįįŽźėžĖī žúĄžēĹÍĶį(2.8 kg ÍįźŽüČ)žóź ŽĻĄŪēėžó¨ žú†žĚėŪēú Ūö®Í≥ľŽ•ľ Ž≥īžėÄžúľŽ©į, ž≤īž§ĎžĚĄ 5% žĚīžÉĀ ÍįźŽüČŪēú ŽĻĄžú®ŽŹĄ liraglutide Ūą¨žó¨ÍĶįžĚī ŽćĒ žöįžõĒŪēėžėÄžúľŽ©į(63.2% vs. 27.1%), 10% žĚīžÉĀ ÍįźŽüČŪēú ŽĻĄžú®ŽŹĄ liraglutide Ūą¨žó¨ÍĶįžĚī 33.1%, žúĄžēĹÍĶįžĚī 10.6%Ž°ú žĚėŽĮł žěąÍ≤Ć žöįžõĒŪēú ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľÍįÄ ŽāėŪÉÄŽāú Í≤ÉžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽč§[31].
Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results žóįÍĶ¨ŽäĒ 1.8 mgžĚė liraglutideŽ°ú ŽčĻŽá®Ž≥Ď ŪôėžěźžóźžĄú žč¨ŪėąÍīÄ žėĀŪĖ•žóź ŽĆÄŪēėžó¨ ŪŹČÍįÄŪēú žóįÍĶ¨žĚīŽč§[35]. 9,340Ž™ÖžĚė ŽčĻŽá®Ž≥Ď ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú liraglutideÍĶįÍ≥ľ žúĄžēĹÍĶįžúľŽ°ú žěĄžĚė Žįįž†ēŪēėžó¨ žč¨ŪėąÍīÄžßąŪôėžĚīŽāė žč¨Í∑ľÍ≤ĹžÉČ, ŽáĆÍ≤ĹžÉČžúľŽ°ú žĚłŪēú ž≤ę Ž≤ąžßł žā¨ŽßĚžĚī žĚľžĖīŽāėŽäĒ žčúÍįĄžĚĄ Ž∂ĄžĄĚŪēėžėÄŽč§. ŪŹČÍ∑† 3.8ŽÖĄžĚė ž∂Ēž†Ā ÍłįÍįĄ ŽŹôžēą žč¨ŪėąÍīÄžßąŪôė, žč¨Í∑ľÍ≤ĹžÉČ, ŽáĆÍ≤ĹžÉČžóź žĚėŪēú žā¨ŽßĚžĚÄ liraglutideÍĶįžóźžĄú žú†žĚėŪēėÍ≤Ć ž†ĀžóąÍ≥†(13% vs. 14.9%) žč¨ŪėąÍīÄžßąŪôėžóź žĚėŪēú žā¨ŽßĚŽŹĄ liraglutideÍĶįžóźžĄú žú†žĚėŪēėÍ≤Ć ž†ĀžóąŽč§(4.7% vs. 6.0%) [35].
ž£ľžöĒ Ž∂ÄžěĎžö©žúľŽ°úŽäĒ žė§žč¨žĚī žěąžúľŽ©į žĚīŽäĒ 0.6 mg Ūą¨žēĹ žĚīŪõĄ ž≤ę 3.0 mgžĚĄ Ūą¨žēĹŪēėŽäĒ žčúž†źžĚł 4ž£ľ ŪõĄžóź žĶúŽĆÄžĻėŽ°ú Ž≥īÍ≥† žěąžúľŽ©į žĚīŪõĄ ž†źžį® ÍįźžÜĆŽźėŽäĒ Í≤ÉžúľŽ°ú Ž≥īÍ≥†ŽźėÍ≥† žěąŽč§. Í∑ł žôł Ž∂ÄžěĎžö©žúľŽ°úŽäĒ žĄ§žā¨, Ž≥ÄŽĻĄ, žčĚžöēž†ÄŪēėÍįÄ ŪĚĒŪēėÍ≥†, ž∑Ćžě•žóľžĚė žúĄŪóėžĄĪŽŹĄ ž†úÍłįŽźėÍ≥† žěąŽč§. ŽėźŪēú Žß•ŽįēžĚī žÉĀžäĻŪē† žąė žěąžĖī žßÄžÜ枆ĀžúľŽ°ú ŽāėŪÉÄŽāėŽäĒ Í≤Ĺžöį žēĹŽ¨ľ ž§ĎŽč®žĚī ŪēĄžöĒŪē† žąėŽŹĄ žěąŽč§. ŪēúŪéł ŽĮłÍĶ≠žčĚŪíąžĚėžēĹÍĶ≠žĚÄ Saxenda¬ģŽ•ľ 16ž£ľ ŽŹôžēą Ūą¨žó¨ŪēėžėÄŽäĒŽćįŽŹĄ ž≤īž§ĎžĚī 4% žĚīžÉĀ ž§ĄžßÄ žēäžúľŽ©ī žēĹŽ¨ľ Ūą¨žó¨Ž•ľ ž§ĎŽč®ŪēėŽŹĄŽ°Ě Í∂ĆÍ≥†ŪēėžėÄŽč§.
Phentermine/topiramate (Qsymia¬ģ)
Qsymia¬ģŽäĒ Íłįž°īžĚė Žč®Íłį žčĚžöē žĖĶž†úž†úžĚł phentermineÍ≥ľ žč†Í≤Ĺ žĻėŽ£Ćž†úžĚł topiramate žßÄžÜćŪėē Ž≥ĶŪē©ž†úžĚīŽč§. 2012ŽÖĄ ŽĮłÍĶ≠žčĚŪíąžĚėžēĹÍĶ≠žóźžĄú žäĻžĚłŽźú Qsymia¬ģŽäĒ ŪėĄžě¨ ÍĶ≠Žāīžóź Žď§žĖīžôÄ žěąžßÄŽäĒ žēäžßÄŽßĆ ÍĶ¨žĄĪ žēĹŽ¨ľžĚł phentermineÍ≥ľ topiramateŽäĒ ÍįĀÍįĀ ÍĶ≠ŽāīžóźžĄúŽŹĄ žā¨žö© ÍįÄŽä•ŪēėŽč§. PhenterminežĚÄ žčúžÉĀŪēėŽ∂Ğ󟞥ú epinephrine Ž∂ĄŽĻĄŽ•ľ ž¶ĚÍįÄžčúžľú žčĚžöēžĚĄ žĖĶž†úŪēėŽäĒ žēĹžúľŽ°ú ŽĻĄŽßĆ žĻėŽ£ĆžĚė Žč®Íłį žā¨žö©žúľŽ°ú ŪóąÍįÄŽźú žēĹžĚīÍ≥†, topiramateŽäĒ ÍįĄžßą žĻėŽ£Ć ŽįŹ Ū鳎ϟŪÜĶžĚė žėąŽį©žóź žā¨žö©ŽźėŽäĒ žēĹŽ¨ľžĚīŽčą ž†ēŪôēžĚł Íłįž†ĄžĚÄ ŽįĚŪėÄžßÄžßÄ žēäžēėžßÄŽßĆ ŪŹ¨ŽßĆÍįź ž¶ĚÍįÄ, žóźŽĄąžßÄ žÜĆŽĻĄŽüČ ž¶ĚÍįÄ, žóīŽüČ žĄ≠ž∑® ÍįźžÜĆ, ŽĮłÍįĀ žĚīžÉĀžĚĄ žĚľžúľžľú ž≤īž§Ď ÍįźžÜĆ Ūö®Í≥ľÍįÄ žěąŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§.
Í≥ľž≤īž§Ď ŽįŹ ŽĻĄŽßĆ ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú Ūēú CONQUER žóįÍĶ¨ŽäĒ 2,487Ž™ÖžĚė BMI 27-45 kg/m2žĚīŽ©īžĄú 2Íįú žĚīžÉĀžĚė ŽĆÄžā¨žĄĪ žßąŪôė(Í≥†Ūėąžēē, žĚīžÉĀžßÄžßąŪėąž¶Ě, ŽčĻŽá®Ž≥Ď ŽėźŽäĒ ŽčĻŽá®ž†ĄŽč®Í≥Ą, ŽĻĄŽßĆ)žĚĄ ÍįÄžßÄÍ≥† žěąŽäĒ ŪôėžěźŽď§žĚĄ 2 : 1 : 2žĚė ŽĻĄžú®Ž°ú žúĄžēĹÍĶį, žĚľžĚľ 1ŪöĆžĚė phentermine (7.5 mg)/topiramate (46.0 mg), phentermine (15.0 mg)/topiramate (92.0 mg)Ž°ú Ž¨īžěĎžúĄ Žįįž†ēŪēėžó¨ žßĄŪĖČŪēėžėÄŽč§. 56ž£ľžĚė žóįÍĶ¨ žĘÖŽ£Ć žčúž†źžóźžĄú žúĄžēĹÍĶįžóź ŽĻĄŪēėžó¨ Ž≥ĶŪē©ž†ú Ž≥Ķžö©ÍĶįžóźžĄú ŽćĒ ŪĀį ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľÍįÄ ŽāėŪÉÄŽā¨Í≥†(-1.4 kg vs. -8.1 kg vs. -10.2 kg), 5% žĚīžÉĀžĚė ž≤īž§Ď ÍįźŽüȞ̥ žĚīŽ£¨ ŪôėžěźžĚė ŽĻĄžú®ŽŹĄ žúĄžēĹÍĶįžóź ŽĻĄŪēėžó¨ Ž≥ĶŪē©ž†ú Ž≥Ķžö©ÍĶįžóźžĄú žú†žĚėŪēėÍ≤Ć ŽÜížēėžúľŽ©į(21% vs. 62% vs. 70%) žĚīŽäĒ 10% žĚīžÉĀžĚė ž≤īž§Ď ÍįźŽüȞ̥ žĚīŽ£¨ ŪôėžěźžĚė ŽĻĄžú®žóźžĄúŽŹĄ ÍįôžĚÄ Í≤įÍ≥ľŽ•ľ Ž≥īžėÄŽč§(7% vs. 37% vs. 48%) [36]. BMI 35 kg/m2 žĚīžÉĀžĚė Í≥†ŽŹĄ ŽĻĄŽßĆ ŪôėžěźžóźžĄú 56ž£ľ ŽŹôžēą žúĄžēĹ, phentermine 3.75 mg/topiramate 23.0 mg, phentermine 15.0 mg/topiramate 92.0 mgžúľŽ°ú Ž¨īžěĎžúĄ Žįįž†ēŪēú controlled-release phentermine/topiramate in severely obese adults: a randomized controlled trial žóįÍĶ¨žóźžĄú Íłįž†Äž≤īž§Ď ŽĆÄŽĻĄ ž≤īž§Ď ÍįźŽüČŽ•†žĚÄ žúĄžēĹÍĶį 1.6%, ž†Äžö©ŽüČÍĶį 5.1%, Í≥†žö©ŽüČÍĶį 10.9%Ž°ú Ž≥ĶŪē©ž†ú žā¨žö©ÍĶįžóźžĄú žú†žĚėŪēėÍ≤Ć ŽÜížēėŽč§. 5% žĚīžÉĀžĚė ž≤īž§Ď ÍįźŽüȞ̥ Ž≥īžĚł ŽĻĄžú®ŽŹĄ žúĄžēĹÍĶįžóź ŽĻĄŪēėžó¨ Ž≥ĶŪē©ž†ú žā¨žö©ÍĶįžóźžĄú ŽÜíÍ≤Ć ŽāėŪÉÄŽā¨žúľŽ©į(17.3% vs. 44.9% vs. 66.7%) žúĄžēĹÍĶįžóź ŽĻĄŪēėžó¨ Ū󹎶¨ŽĎėŽ†ą, Ūėąžēē, ŪėąŽčĻ žąėžĻė, ž§ĎžĄĪžßÄŽį©, žßÄžßą žąėžĻė ŽďĪžóźžĄú ÍįúžĄ† Ūö®Í≥ľÍįÄ ŽāėŪÉÄŽā¨Žč§[37].
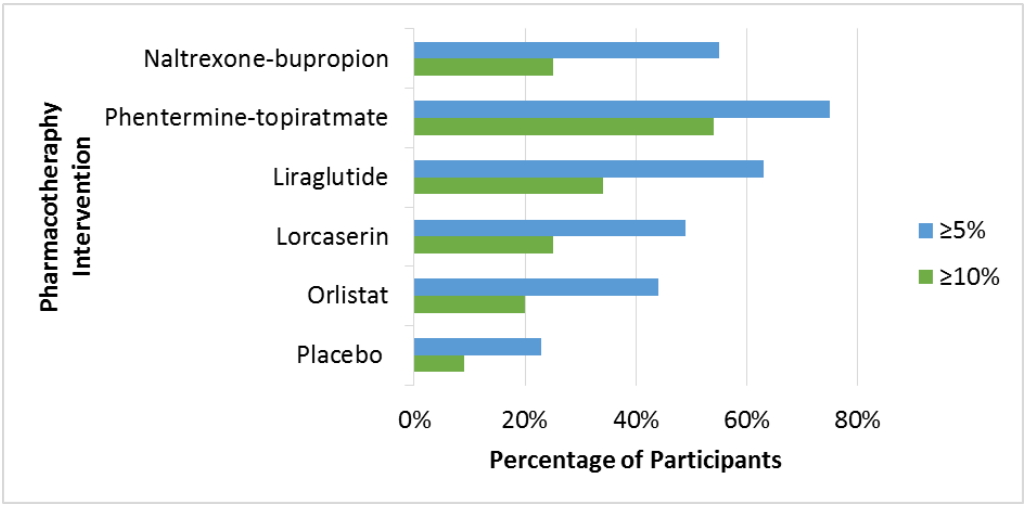
Phentermine/topiramate Ž≥ĶŪē©ž†úŽäĒ žßÄÍłąÍĻĆžßÄ žāīŪéīŽ≥ł žēĹž†úŽď§ ž§Ďžóź ÍįÄžě• ÍįēŽ†•Ūēú ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľÍįÄ Ž≥īžĚīŽäĒ ŽįėŽ©ī(Fig. 1) Ž∂ÄžěĎžö© ŽįúžÉĚ ŽĻĄžú®žĚī žÉĀŽĆÄž†ĀžúľŽ°ú ŽÜíÍ≤Ć ŽāėŪÉÄŽāúŽč§. ŪĚĒŪēú Ž∂ÄžěĎžö©žúľŽ°úŽäĒ žěÖŽßąŽ¶Ą, ÍįźÍįĀžĚīžÉĀ, Ž≥ÄŽĻĄ, Ž∂ąŽ©ī ŽďĪžĚī žěąŽč§. ŽĮłÍĶ≠žčĚŪíąžĚėžēĹÍĶ≠žóźžĄúŽäĒ 12ž£ľ žā¨žö© ŪõĄ žĶúžÜĆ 3%žĚė ž≤īž§ĎžĚī ÍįźžÜĆŽźėžßÄ žēäžúľŽ©ī žā¨žö©žĚĄ ž§ĎŽč®ŪēėÍĪįŽāė žēĹž†úžĚė žö©ŽüȞ̥ ž¶ĚŽüČŪēėŽŹĄŽ°Ě Í∂ĆÍ≥†ŪēėžėÄÍ≥†, žö©ŽüČ ž¶ĚÍįÄ ŪõĄ 12ž£ľ ŪõĄžóźŽŹĄ žĶúžÜĆ 5%žĚė ž≤īž§Ď ÍįźžÜĆÍįÄ žóÜžúľŽ©ī ž†źžį®ž†ĀžúľŽ°ú žēĹž†úŽ•ľ ž§ĎŽč®ŪēėŽŹĄŽ°Ě Í∂ĆÍ≥†ŪēėžėÄŽč§.
ŽĮłŽěėžĚė žēĹŽ¨ľŽď§
žĶúÍ∑ľÍĻĆžßÄŽŹĄ ŽĻĄŽßƞ̥ žĻėŽ£ĆŪēėÍłį žúĄŪēú žēĹž†ú ÍįúŽįúžĚÄ žßÄžÜ掟ėÍ≥† žěąžúľŽ©į ŪėĄžě¨ 2žÉĀ, 3žÉĀ žčúŪóė Žč®Í≥Ąžóź žěąŽäĒ žēĹž†ú Ž™á ÍįÄžßÄŽ•ľ žÜĆÍįúŪēėÍ≤†Žč§. TesofensinežĚÄ serotonin, nonadrenaline, dopaminežĚė žě¨ŪĚ°žąėŽ•ľ žĖĶž†úŪēėŽäĒ žēĹŽ¨ľŽ°úžĄú ŽĻĄŽßĆ žĻėŽ£Ćž†úŽ°ú ÍįúŽįúŽźėžĖī žěĄžÉĀžčúŪóėž§ĎžĚīŽč§. 2008ŽÖĄ ŽįúŪĎúŽźú Ž¨īžěĎžúĄ žĚīž§ĎŽßĻÍ≤Ä 2žÉĀ žěĄžÉĀžčúŪóėžóźžĄú 203Ž™ÖžĚė ŽĻĄŽßĆ ŪôėžěźŽď§žĚĄ ŽĆÄžÉĀžúľŽ°ú tesofensine 0.25 mg, 0.5 mg, 1.0 mg Ž≥Ķžö©ÍĶįÍ≥ľ žúĄžēĹÍĶįžúľŽ°ú ŽāėŽąĄžĖī 24ž£ľÍįĄ ÍīÄžįįŪēú Í≤įÍ≥ľ žúĄžēĹÍĶįÍ≥ľ ŽĻĄÍĶźŪēėžó¨ tesofensine Ž≥Ķžö©ÍĶįžóźžĄú ŽćĒ ŽßéžĚÄ ž≤īž§Ď ÍįźŽüČŽ•†žĚĄ Ž≥īžėÄŽč§(-4.5% vs. -9.2% vs. -10.6% vs. 2.0%) [38].
SemaglutideŽäĒ GLP-1 žąėžö©ž≤īžóź žěĎžö©ŪēėŽäĒ žēĹŽ¨ľŽ°ú 2017ŽÖĄ ŽĮłÍĶ≠žčĚŪíąžĚėžēĹÍĶ≠žóźžĄú ŽčĻŽá®Ž≥Ď žĻėŽ£Ćž†úŽ°ú žäĻžĚłŽźėžóąÍ≥† ž£ľžā¨ž†úžôÄ Í≤ĹÍĶ¨žö© žēĹž†ú ŽĎź ÍįÄžßÄŽ°ú žā¨žö©žĚī ÍįÄŽä•ŪēėŽč§. 2018ŽÖĄ ŽįúŪĎúŽźú Ž¨īžěĎžúĄ žĚīž§ĎŽßĻÍ≤Ä 2žÉĀ žěĄžÉĀžčúŪóėžóźžĄú BMI 30 kg/m2 žĚīžÉĀžĚł 957Ž™ÖžĚė ŽĻĄŽßĆ ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú semaglutide ž£ľžā¨ÍĶį(0.05 mg, 0.1 mg, 0.2 mg, 0.3 mg, 0.4 mg)Í≥ľ liraglutide ž£ľžā¨ÍĶį(0.6 mgžúľŽ°ú žčúžěĎŪēėžó¨ 3 mgÍĻĆžßÄ ž¶ĚŽüČ) Í∑łŽ¶¨Í≥† žúĄžēĹÍĶįžúľŽ°ú ŽāėŽąĄžĖī 52ž£ľ Ží§žóź ŽĻĄÍĶź Ž∂ĄžĄĚŪēėžėÄŽč§. Ž™®Žď† žö©ŽüČžĚė semaglutide ž£ľžā¨ÍĶįžĚÄ žúĄžēĹÍĶįÍ≥ľ ŽĻĄÍĶźŪēėžó¨ žĚėŽĮł žěąÍ≤Ć žöįžõĒŪēú ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľŽ•ľ Ž≥īžėÄÍ≥† 0.2 mg žĚīžÉĀžĚė semaglutide ž£ľžā¨ÍĶįžĚÄ liraglutide ž£ľžā¨ÍĶįÍ≥ľ ŽĻĄÍĶźŪēėžėĞ̥ ŽēĆ ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľÍįÄ ŽćĒ žöįžõĒŪēú Í≤įÍ≥ľŽ•ľ Ž≥īžėÄŽč§[39]. ŽĆÄŪĎúž†ĀžĚł Ž∂ÄžěĎžö©žĚÄ Žč§Ž•ł GLP-1 žąėžö©ž≤ī žēĹŽ¨ľÍ≥ľ Žßąžį¨ÍįÄžßÄŽ°ú žÜĆŪôĒŽ∂ąŽüČÍ≥ľ žė§žč¨žúľŽ°ú žēĆŽ†§ž†ł žěąŽč§.
SetmelanotideŽäĒ žčĚžöē ž°įž†ąžóź ÍīÄžó¨ŪēėŽäĒ žčúžÉĀŪēėŽ∂ÄžĚė Žį©žč§ŪēĶ(paraventrigular nucleus)Í≥ľ žôłžł° žčúžÉĀŪēėŽ∂Ğ󟞥ú melatocortin 4 (MC4) žąėžö©ž≤īžóź žĄ†ŪÉĚž†ĀžúľŽ°ú Í≤įŪē©Ūēėžó¨ ŪôúžĄĪŪôĒŽ•ľ žčúŪā§Ž©īžĄú žčĚžöē ž°įž†ąžĚĄ ŪēėŽäĒ žēĹŽ¨ľžĚīŽč§[40]. SetmelatnotideŽäĒ žčĚžöēžĚĄ ÍįźžÜĆžčúŪā§ŽäĒ Í≤É žôłžóźŽŹĄ žóźŽĄąžßÄ žÜĆŽĻĄŽ•ľ ž¶ĚÍįÄžčúŪā§ŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąžßÄŽßĆ žēĄžßĀ ŽĆÄÍ∑úŽ™® žěĄžÉĀžčúŪóėžĚī žßĄŪĖČŽźėžßÄ žēäžēĄ ž∂ĒŪõĄ ŽßéžĚÄ žóįÍĶ¨ÍįÄ ŪēĄžöĒŪē† Í≤ÉžúľŽ°ú Ž≥īžĚłŽč§.
Í≤į Ž°†
ŽĻĄŽßĆžĚÄ žó¨Žü¨ ŽčĻŽá®Ž≥Ď, Í≥†Ūėąžēē, žč¨ŪėąÍīÄžßąŪôėÍ≥ľ ÍįôžĚÄ ŽĆÄžā¨žĄĪ žßąŪôėŽŅźŽßĆ žēĄŽčąŽĚľ žěźÍ∂ĀŽāīŽßČžēĒ, žú†Žį©žēĒ, ž†ĄŽ¶ĹžĄ†žēĒ, ŽĆÄžě•žēĒÍ≥ľ ÍįôžĚÄ žēĒ ŽįúžÉĚÍ≥ľŽŹĄ ÍīÄÍ≥ĄÍįÄ žěąŽč§. ŽĻĄŽßĆžĚÄ ž†Ą žĄłÍ≥Ąž†ĀžúľŽ°ú ž¶ĚÍįÄŪēėÍ≥† žěąžúľŽ©į ŽĻĄŽßĆ žĻėŽ£ĆžĚė Ž™©ž†ĀžĚÄ Žč®žąúŪěą ž≤īž§Ď ÍįźŽüČžóźŽßĆ žěąŽäĒ Í≤ÉžĚī žēĄŽčąŽĚľ ŽĻĄŽßĆÍ≥ľ ÍīÄŽ†®Žźú žßąŪôėžĚė ŽįúžÉ̞̥ žėąŽį©ŪēėŽäĒ Í≤ɞ󟎏Ą žěąŽč§. ŽĻĄŽßĆžĚė ÍłįŽ≥łž†ĀžĚł žĻėŽ£ĆŽäĒ žčĚžā¨ žöĒŽ≤ēÍ≥ľ žöīŽŹô žöĒŽ≤ē ŽďĪžĚė žÉĚŪôúžäĶÍīÄ ÍĶźž†ēžĚīžßÄŽßĆ Íłįž°īžĚė žÉĚŪôú žöĒŽ≤ēžúľŽ°ú ž∂©Ž∂ĄŪēú ž≤īž§Ď ÍįźžÜĆ Ūö®Í≥ľŽ•ľ Ž≥īÍłį žĖīŽ†§žõĆ ž†Āž†ąŪēú ŽĻĄŽßĆ žēĹŽ¨ľ žĻėŽ£ĆÍįÄ ŪēĄžöĒŪēėŽč§. žĚīžÉĀž†ĀžĚł ŽĻĄŽßĆ žĻėŽ£Ć žēĹž†úŽäĒ Ž∂ÄžěĎžö©žĚÄ ž†ĀžúľŽ©į ž≤īž§Ď ÍįźŽüČ Ūö®Í≥ľÍįÄ žĘčÍ≥† ŽėźŪēú ž≤īž§Ď ÍįźŽüȞ̥ žě•ÍłįÍįĄ žú†žßÄŪē† žąė žěąŽäĒ Í≤ÉžĚīžßÄŽßĆ ŪėĄžě¨ žēąž†ĄŪēėÍ≥† Ūö®Í≥ľž†ĀžĚł ŽĻĄŽßĆ žĻėŽ£Ć žēĹž†úÍįÄ ŽßéžßÄ žēäÍłį ŽēĆŽ¨łžóź žÉąŽ°úžöī ŽĻĄŽßĆ žĻėŽ£Ćž†úžĚė ÍįúŽįúžóź ŽĆÄŪēú žöĒÍĶ¨ÍįÄ ŪĀ¨Žč§. ŽĮłÍĶ≠žčĚŪíąžĚė žēĹÍĶ≠žóźžĄú žě•Íłįž†ĀžúľŽ°ú žā¨žö© ÍįÄŽä•Ūēú ŽĻĄŽßĆ žĻėŽ£Ćž†úŽ°ú orlistat, lorcaserin, phentermine/topiramate, naltrexone/bupropion, liraglutideŽ•ľ žäĻžĚłŪēėžėÄžúľŽ©į, žĚī žēĹž†úŽď§žóź ŽĆÄŪēīžĄú žāīŪéīŽ≥īžēėŽč§. žĚīŽü¨Ūēú žÉąŽ°úžöī ŽĻĄŽßĆ žēĹž†úŽď§žĚÄ ž≤īž§Ď ÍįźŽüČŽŅźŽßĆ žēĄŽčąŽĚľ ŽĆÄžā¨žĄĪ žßąŪôėžĚė ÍīÄŽ¶¨žóźŽŹĄ ŽŹĄžõÄžĚī ŽźėŽäĒ Í≤ÉžúľŽ°ú Ž≥īÍ≥†ŽźėžóąžúľŽāė žě•ÍłįÍįĄ žā¨žö©ŪēėŽäĒ Í≤Ĺžöį ŽĮłžĻėÍ≤Ć Žź† žč¨ŪėąÍīÄÍ≥Ąžóź ŽĆÄŪēú Ūö®Í≥ľ ŽįŹ žēąž†ĄžĄĪžóź ŽĆÄŪēīžĄúŽäĒ ž∂ĒÍįÄž†ĀžĚł Í≤įÍ≥ľŽ•ľ ŪēĄžöĒŽ°ú ŪēėÍ≤†Žč§.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






