서 론
타카야수동맥염(Takayasu arteritis)은 대형 혈관을 침범하여 육아종(granuloma)을 형성하는 혈관염이다. 이 질환은 주로 대동맥과 그 주요 분지들을 침범하며, 폐동맥 및 관상동맥을 침범하기도 하는데, 이를 통하여 해당 동맥의 협착, 폐색 및 동맥류를 일으킬 수 있다[1]. 이 질환은 20-30대의 젊은 여성에서 주로 호발하며, 연간 인구 백만 명당 1.2-2.6명에서 발생하는 것으로 보고되고 있다. 전 세계적으로 발생한다고 보고되나, 미국이나 유럽에 비하여 일본, 인도, 한국 등의 동양권에서 보다 높은 발병률을 보인다[2]. 타카야수동맥염 환자는 다양한 전신적 증상 및 국소적인 동맥염의 증상 및 징후를 나타낸다. 전신 증상으로는 피로감, 발열, 체중감소, 식욕부진, 근골격계 증상 등이 있고 혈관 침범 수개월 이전부터 발생할 수 있다. 또한 타카야수동맥염은 중추신경계, 심혈관계 및 사지의 허혈(ischemia)에 의한 다양한 임상 양상과 폐동맥고혈압, 대동맥파열과 같은 치명적인 합병증이 동반이 되기도 한다[3]. 이로 인하여 상당수의 환자에서 고혈압도 나타나고, 대동맥판막질환, 허혈성심질환, 심부전, 심근경색과 같은 심혈관계의 합병증은 타카야수동맥염 환자들의 흔한 사망 원인으로 알려져 있다[3,4].
타카야수동맥염은 초기 증상이 대부분 매우 비특이적이기 때문에 조기 진단이 어렵고, 허혈 등의 증상이 생길 정도로 혈관 변형이 상당히 진행된 뒤에야 진단되는 경우가 많아 치료에 어려움이 따른다. 또한 타카야수동맥염은 드문 질환으로, 현재까지 이 질환의 치료와 관련하여 활발한 연구가 진행되고 있지 못한 상황이다. 타카야수동맥염에서 혈관의 폐쇄를 유발하는 혈관염을 조기에 진단하여 치료한다면 비가역적인 혈관 병변으로 진행하는 것을 막고 향후 발생 가능한 합병증을 예방할 수 있다. 이에 본 종설에서는 타카야수동맥염의 최신 진료 및 치료 동향에 대하여 정리하고자 하며, 특히 타카야수동맥염의 질병 활성도의 평가를 위한 새로운 측정 도구 및 비침습적인 영상 기법 그리고 타카야수동맥염의 치료 현황 중 생물학적 제제에 대한 새로운 정보와 향후 연구 방향에 초점을 맞추어 정리하고자 한다.
본 론
진단
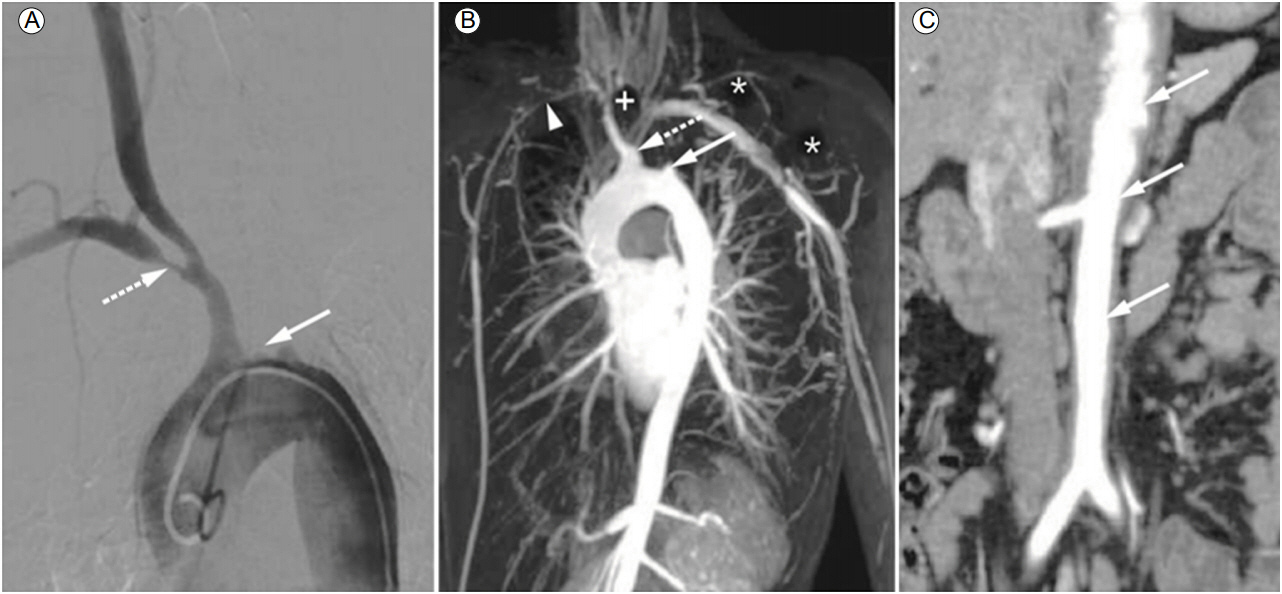
타카야수동맥염의 진단 방법으로는 1990년 미국류마티스학회(American College of Rheumatology, ACR)에서 제시한 분류기준이 가장 널리 알려져 있으며[5], 대부분의 환자에서 동맥의 확장이나 협착을 확인하기 위하여 방사선학적 검사를 시행한다. 혈관조영술을 비롯한 영상학적 검사에서 나타나는 타카야수동맥염의 특징적인 소견으로는 대동맥과 주요 분지, 근위 상하지 대혈관의 불규칙한 혈관벽, 협착, 협착 후 확장(poststenotic dilatation), 동맥류 형성, 폐쇄, 이로 인한 측부동맥(collateral artery) 형성 소견 등이 있다(Fig. 1).
분류기준
1990년 ACR에서 제시한 분류기준에 따르면, 1) 40세 이전 발병, 2) 사지의 파행(claudication), 3) 위팔동맥(brachial artery)의 맥박 감소, 4) 10 mmHg 이상의 좌우 사지 혈압 차이, 5) 대동맥이나 쇄골하동맥의 잡음, 6) 혈관조영술의 이상 소견(동맥경화증, 섬유근형성 이상 등이 원인이 아닌 경우) 중에서 3개 이상을 만족하는 경우 타카야수동맥염(예민도 90.5%, 특이도 97.8%)으로 진단할 수 있다. 1994년에 Chapel Hill Consensus Conference (CHCC)에서는 침범하는 혈관의 크기에 따라 혈관염을 분류할 것을 제안하였고, 2012년에 개정된 CHCC 명명법에 의하면, 타카야수동맥염은 대혈관 혈관염에 해당된다[6]. 타카야수동맥염의 다른 분류기준으로는 일본에서 사용되고 있는 Ishikawa 분류기준이 있다[7]. 하지만 현재까지 제시된 분류기준들은 실제 임상에서 거대세포동맥염이나 동맥경화증, 이외 다른 대동맥 질환, IgG4 관련 질환 등과 타카야수동맥염을 감별하는 것에 한계가 있으며[8,9], 이미 질병이 진행되어 혈관의 협착이 발생한 후에야 진단을 내리게 되는 문제점이 있다. 이러한 여러 문제점을 극복하기 위하여, 모든 혈관염에 대한 새로운 분류기준을 제시하고자 Diagnostic and Classification in Vasculitis Study 연구 계획이 국제적인 협력 하에 진행 중이다[10].
질병 활성도
질병 활성도를 측정하는 새로운 방법
Birmingham Vasculitis Activity Score (BVAS)는 소혈관 및 중간 크기 혈관염에서 여러 장기 시스템 별로 활동성 동맥염의 증거를 평가하는 검증된 도구로서[11], anti-neutrophil cytoplasmic antibody (ANCA) 연관 혈관염의 임상연구에서 많이 사용되며, 타카야수동맥염 연구에서도 치료 결과의 평가도구로 사용될 수 있다[12]. 하지만 소혈관 혈관염과 대혈관혈관염이 침범하는 장기가 다르므로, BVAS를 이용하여 타카야수동맥염의 질병 활성도를 측정하면, 불필요한 장기를 평가하게 되면서, 오히려 심혈관계 양상에 대하여 과소평가되는 문제가 있다.
최근 제안된 Indian Takayasu Clinical Activity Score (ITAS2010)는 타카야수동맥염에서 질병 활성도를 측정하는 점수 체계이다[13]. ITAS2010은 전신적인 증상(발열, 피로감 등)의 항목보다 대혈관과 직접적으로 관련이 있는 항목(협착, 파행 등)에 더 높은 점수를 매기도록 하여, 심혈관계 증상/징후에 대하여 상세히 탐지할 수 있도록 하였다. 또한 ITAS2010은 지난 3개월 내에 새로 발생하거나 악화된 임상 양상에만 점수를 매기도록 하고 있으며, 영상 소견에서 혈관의 폐쇄에 대한 증거가 있을 시에는 이를 반영하여 점수를 매기도록 하였다. 다만, 초기 평가 시에는 임상 양상이 이전부터 지속되었다는 기록이 있지 않는 한 관찰되는 모든 항목에 점수를 매기도록 하였다[14]. ITAS2010은 physician’s global assessment와 비교하여 더 좋은 평가자 간 일치도(inter-rater agreement) (0.97 vs. 0.82)를 보이나, 수렴 타당성(convergent validity)은 초기 평가 시에는 더 낮았고, 후속 방문 시에 호전되었다. 활동성과 비활동성질환을 분류하는 ITAS2010의 cut-off 점수로 4점이 제시되었고, ITAS2010에 erythrocyte sedimentation rate (ESR), C-reactive protein (CRP)의 상승 정도에 따라 추가로 1-3점을 더한 ITAS2010-A도 제안되었다[13]. 또한 임상적 관해 시에도 혈관영상의 소견에 따라 ITAS2010 항목 점수가 존재할 수 있으므로 타카야수동맥염에서 활동성과 손상(damage)을 감별하는데 근본적이 어려움이 있다.
바이오마커(Biomarkers)
타카야수동맥염의 활성도 측정을 위하여 흔히 사용이 되는 가용한 검사로는 적혈구침강속도(ESR)와 C반응단백(CRP)이 있다. 하지만 이러한 급성반응단백은 실제 대혈관의 염증을 온전히 반영하지 못하며, 질병 활성도가 높은 환자의 30%에서 급성반응단백 수치가 정상으로 나타나고, 임상적으로 관해 상태인 환자들의 거의 절반에서 그 수치가 상승되어 있다는 보고도 있다[1]. 또한 일부 연구에서 급성반응단백과 임상 증상이 정상인 환자의 60%에서 방사선학적인 진행 소견이 관찰되며, 44%에서는 수술 병리 소견에서 혈관의 염증 반응이 관찰된다는 보고도 있어 현재 임상에서 일반적으로 이용하는 타카야수동맥염의 질병 활성도 평가 방법에는 한계가 있는 것으로 보인다[1,15].
최근 혈청 pentraxin3 (PTX3)이 타카야수동맥염의 질병 활성도를 반영하는 바이오마커로 제시되었다. PTX3 수치가 1 ng/mL보다 클 경우(area under the curve [AUC] 0.919, 95% confidence interval [CI] 0.847-0.991) ESR과 CRP의 정상 범위 한계값(threshold)과 비교하여 활동성과 비활동성을 더 정확하게 감별할 수 있었다[16]. 또한 human leukocyte antigen (HLA)-class Ib subfamily에 속하는 HLA-E는 염증세포나 내피세포의 표면 분자로 발현이 되고, 체액에 수용성 형태(soluble form; sHLA-E)로 존재하는데[17], 최근 sHLA-E가 타카야수동맥염의 질병 활성도를 반영하는 것으로 보고되었다[18,19]. 또한 혈청 sHLA-E의 cut-off level 21.9 pg/mL에서 타카야수동맥염의 활성화 상태와 비활성화 상태를 구별할 수 있었다(예민도 82.6%, 특이도 77.8%, AUC 0.81 [95% CI 0.66-0.95]) [18]. 하지만, 아직까지는 이러한 바이오마커에 대한 데이터를 유효한 것으로 확신하기 위해서는 추가적인 검증 연구(validation study)가 더 진행이 되어야 할 것으로 보인다.
영상학적인 방법
최근 상기 언급한 한계를 극복하고자 타카야수동맥염의 질병 활성도를 영상학적인 방법으로 평가하고자 하는 연구들이 많이 진행되고 있다. Computed tomography (CT), magnetic resonance imaging (MRI), 초음파(ultrasonography)에 대해서도 많은 연구가 진행되었으나, 이들 영상 검사들을 통하여 보여지는 혈관의 변화가 실질적인 염증을 반영하는지에 대해서는 아직까지 논란이 많다. CT는 구조적인 혈관의 해부학적인 특징을 잘 보여주지만, 질병의 조기 활성도를 평가하는 데에는 어려움이 있으며[20], 자기공명 혈관 영상기법(magnetic resonance angiography)은 혈관벽의 비후와 부종 소견을 보여주지만, 질병 활성도나 급성반응단백과의 연관성이 낮고, 장기적으로 추적 관찰을 하는데 제한적인 역할만 수행하는 것으로 보고된 바 있다[21].
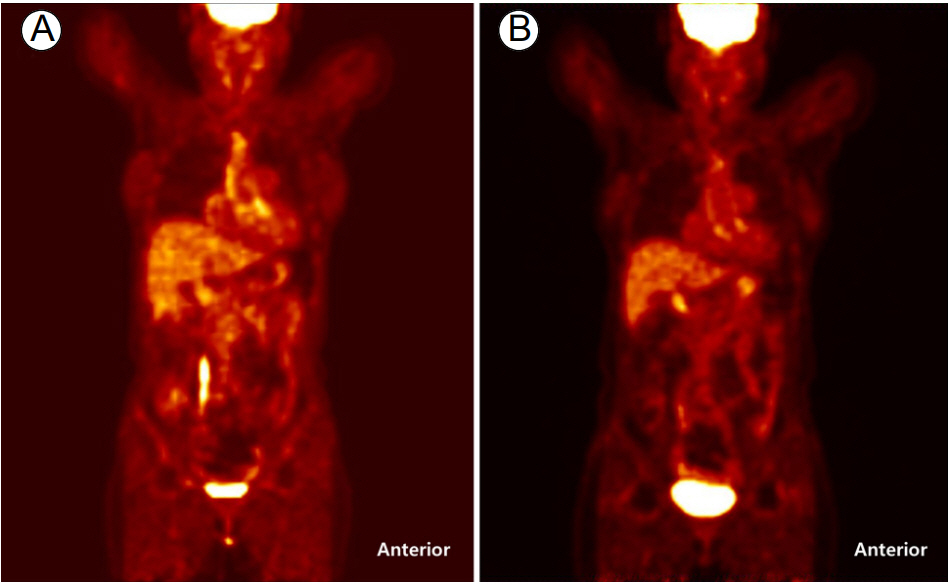
18F-fluorodeoxyglucose-positron emission tomography (18F-FDG-PET)는 높은 대사 활동을 보이는 조직을 찾아내는 영상 검사로, 초기 혈관의 염증을 가장 잘 반영하는 것으로 알려져 있다[22]. 18F-FDG-PET는 타카야수동맥염 환자의 임상적 질병 활성도의 변화를 잘 반영하고, 염증 표지자(ESR, CRP)들과도 유의한 연관성을 보였다[23]. 또한, 질병의 재발뿐만 아니라 면역억제제 치료 이후 혈관 염증의 감소도 잘 반영하여(Fig. 2), FDG-PET가 타카야수동맥염 환자의 질병활성도 평가에 유용한 도구가 될 수 있을 것으로 보고되었다[22-24]. FDG-PET의 6개 연구에 대한 메타분석 결과, FDG-PET의 예민도와 특이도가 각각 70.1%와 77.2%로 중등도의 diagnostic value를 나타냈다[25]. 또한 대혈관 혈관염 환자 30명에서 시행된 전문가 조사(expert panel study) 결과, 18F-FDG-PET를 추가하였을 때 진단의 정확성이 54.1%에서 70.5%로 유의하게 상승하였고, 치료 방향에도 중요한 영향을 미치는 것으로 보고되었다[26].
치료
내과적 치료
글루코코르티코이드(glucocorticoid)와 고식적인 면역억제제(conventional immunosuppressive agents)
타카야수동맥염의 치료와 관련하여 무작위 대조 연구(randomized control trial)가 시행된 바가 없어 여러 치료 시도를 지지하는 확정적인 근거는 없는 것이 현실이나, 동맥염은 대부분 만성적이고 재발하는 경우가 많기 때문에 글루코코르티코이드와 면역억제제를 포함한 면역억제 치료가 필요하다[27]. 글루코코르티코이드 치료는 약 60%의 타카야수동맥염 환자에서 임상적 관해(clinical remission)에 이르게 하였으나, 해당 환자들 중 대부분은 글루코코르티코이드의 용량을 줄이거나 중단하면 재발이 흔하게 발생하는 것으로 보고되고 있다[1,28]. 따라서 스테로이드의 부작용을 줄이고, 진행하는 혈관의 염증을 조절하기 위해서는 대부분의 환자에서 2차 면역억제제 치료가 필요하다[29,30]. 몇몇 개방형 연구(open label study) 결과 methotrexate나 azathioprine이 질병의 관해를 유도하고, 새로운 혈관 병변의 발생을 막을 수 있다고 보고되었고[27,31], 이 두 약제는 현재 글루코코르티코이드를 감량하기 위한(steroid-sparing) 약제로 가장 많이 사용되고 있다. Mycophenolate mofetil과 관련하여서는 서로 상반되는 결과들이 보고가 되었는데[32,33], cyclophosphamide는 글루코코르티코이드의 용량을 줄이는데 유용하나, cyclophosphamide의 독성 및 불임과 관련된 합병증 등으로 인하여 생명을 위협하는 상황이나 다른 면역억제제에 잘 반응하지 않는 경우에만 주로 사용한다[30].
앞에서도 언급하였듯이, 타카야수동맥염 치료의 근거가 부족하여 치료제의 용량 및 치료의 기간과 관련해서는 명확한 권고안은 없는 상황이나, European League Against Rheumatism (EULAR) 2009 가이드라인에서는 대형동맥의 혈관염의 초기치료로 prednisolone 1 mg/kg/day (최대 60 mg/day) 투여할 것을 제안하고 있다[27]. 또한, methotrexate를 15-25 mg/kg의 용량으로 병용을 하거나, 또는 azathioprine을 하루 최대 2 mg/kg까지 투여하는 것도 가능하다.
TNF 억제제(tumor necrosis factor inhibitor)
TNF 억제제(TNF inhibitor)는 타카야수동맥염에서 가장 먼저 시도된 생물학적 제제이다. 종양괴사인자(TNFα)는 육아종 형성에 중요한 cytokine이며[5], 내피세포의 활성화에도 중요한 역할을 하는 것으로 보고되었다[36]. 또한 타카야수동맥염 환자의 말초 단핵구에서는 정상인과 비교하여 TNFα의 messenger ribonucleic acid (mRNA)의 발현이 증가되어 있고[37], TNFα를 생성하는 T세포 수의 증가가 타카야수동맥염의 질병 활성도와 관련이 있다는 결과가 보고되어[38], 타카야수동맥염에서 TNFα가 매력적인 치료 표적으로 제시되고 있다. 여러 후향적 관찰 연구 결과에서도, TNF 억제제는 대부분의 불응성 타카야수동맥염 환자에서 효과적이라고 보고되었다[32,39-41]. 최근 불응성 타카야수동맥염 환자 120명에서 TNF 억제제를 투여한 관찰 연구의 요약 내용이 발표가 되었는데, 환자 중 infliximab이 80% 정도로 대부분을 차지하였으며, 나머지는 etanercept나 adalimumab이었다[42]. TNF 억제제의 용량 및 투여 간격은 연구마다 다양하였는데, infliximab의 경우, 3-5 mg/kg의 용량으로 4-8주 간격으로 투여를 하였고, etanercept는 25 mg 용량으로 주 2회 투여, adalimumab의 경우 류마티스관절염에서 사용되는 방법(40 mg을 2주마다 투여)으로 투여가 되었다[32,39,41-43]. 해당 연구 결과, 전반적인 TNF 억제제의 반응률(response rate)이 80%였고, 40% 이상에서 글루코코르티코이드를 줄이거나 중단할 수 있었다. 그러나 환자 중 37%에서 재발이 흔하게 발생하였고, 재발하는 환자의 절반 가량에서 TNF 억제제의 용량 또는 빈도를 늘리거나, 다른 TNF 억제제로 변경하여야 하였다[44]. TNF 억제제는 다른 면역억제제에 불응성인 타카야수동맥염 환자에게는 효과적이라고 보고되었으나, 타카야수동맥염으로 새로 진단된 환자에서의 효능에 대해서는 아직 보고된 바가 거의 없다. 타카야수동맥염이 새로 진단된 5명의 환자에게 TNF 억제제를 open label로 infliximab + methotrexate (n = 2) vs. adalimumab + methotrexate (n = 2) vs. adalimumab 단독(n = 1) 그룹으로 나누어 투여한 연구 결과에서 모든 환자에서 임상적 및 혈청학적 관해(clinical and serological remmision)에 도달하였으나[45], TNF 억제제를 타카야수동맥염의 치료 초기에 사용해야 할지에 대해서는 추가적인 연구가 필요한 상황이다. 또한, 타카야수동맥염 환자에서 TNF 억제제의 용량이나 투여 간격 등과 관련하여 명확한 치료 권고안이 없는 상황으로, TNF 억제제의 효능을 정확하게 평가하고 적절한 치료 가이드라인을 제시하기 위해서는 추가적으로 무작위 대조 연구가 필요하다고 사료된다.
Tocilizumab
타카야수동맥염 환자에서 혈중 interleukin-6 (IL-6) 수치가 상승되어 있고, 이것이 질병 활성도와 관련이 있다는 것이 보고되었으며, 타카야수동맥염 환자의 혈관 병변에서 IL-6의 발현이 증가되어 있는 소견도 확인되었다[46,47]. IL-6가 타카야수동맥염의 병인에 중요한 역할을 하므로, 생물학적 치료제 중 tocilizumab이 타카야수동맥염 치료에 유망한 약제로 제시되고 있다. 여러 문헌에서 재발하거나 불응성인 타카야수동맥염 환자에서 tocilizumab 치료에 대한 보고가 이루어졌는데[48,49], 대부분의 환자들은 tocilizumab을 8 mg/kg 용량으로 4주 간격으로 투여를 하였고, 나머지 환자들은 4 mg/kg 4주 간격 또는 8 mg/kg 3주 간격으로 투여하였다. Tocilizumab을 투여한 44명의 타카야수동맥염 환자에 대한 후향적 연구에서 환자들은 tocilizumab을 투여받은 지 3개월 후에 질병 활성도가 유의하게 감소하였고, 6개월째에는 스테로이드 용량을 하루 10 mg 용량(중앙값)으로 감량할 수 있었다[50]. 최근에는 타카야수동맥염이 재발한 환자들에서 tocilizumab에 대한 무작위 배정, 이중-눈가림, 위약-대조, 제3상 임상시험(randomized, double-blind, placebo-controlled, phase 3 trial)이 시행되었다[51]. 이 연구에서 환자들은 재발이 일어났던 시점의 용량의 적어도 두 배 이상의 경구 글루코코르티코이드를 투여하여 관해에 도달하면, 피하 tocilizumab 162 mg 또는 위약으로 무작위 배정(1:1)받아 치료를 진행하였고, 글루코코르티코이드는 4주째부터 매주 10%씩 감량하여 최소 하루 0.1 mg/kg까지 감량을 하도록 하였다. 치료의향대상군(intention-to treat population)에서 재발이 발생할 때까지 걸리는 시간을 primary endpoint로 계획하였는데, 이 때는 tocilizumab 그룹과 위약 그룹 간에 유의한 차이는 관찰되지 않았으나, 민감도 분석으로 시행한 연구계획순응군 분석(per-protocol analysis) 결과에서는 tocilizumab이 placebo group과 비교하여 재발하는데 걸리는 시간이 유의하게 더 길었던 것으로 보고되었다[51]. Tocilizumab 치료가 불응성 타카야수동맥염에 효과적인 것으로 보고되었으나, 타카야수동맥염이 새로 진단되어 고식적인 면역억제제나 TNF 억제제의 경험이 없이 tocilizumab을 투여한 환자에 대한 데이터는 매우 제한적인 상황이다[52-54].
Abatacept
Abatacept는 cytotoxic T-lymphocyte-associated antigen-4의 세포 외 domain을 면역글로불린 G1의 Fc 부위에 결합시킨 수용성 단백질로, CD80/86과 결합하여 T세포의 활성화를 억제한다[55]. 타카야수동맥염은 육아종을 형성하는 혈관염이므로 T세포가 병태 생리에 중요한데, abatacept는 이러한 T세포 활성화를 억제하기 때문에 타카야수동맥염에서 효과를 보일 것이라는 근거를 가지고, 최근 abatacept에 대한 무작위 배정, 이중-눈가림 임상시험이 진행되었다[56]. 이 연구에서는 새로 진단되거나 불응성인 타카야수동맥염 환자들에게 abatacept와 글루코코르티코이드를 함께 투여하였고, 12주째에는, 관해에 도달한 환자들을 대상으로 abatacept와 위약으로 무작위 배정을 하여 조기 종료의 기준을 만족하는 환자를 제외하고는 12개월까지 유지하도록 하였다. Prednisone 용량은 12주째부터 20 mg/day로 줄였고, 용량을 계속 줄여 28주째부터는 중단하도록 하였는데, 연구 결과 abatacept와 글루코코르티코이드 병합 치료가 글루코코르티코이드 단독 치료와 비교하여 재발 없는 생존기간(relapse-free survival)에서 우월하지 않았다[56].
Rituximab
타카야수동맥염은 주로 T세포 매개 질환으로 고려되지만, B세포 항상성의 조절 장애가 타카야수동맥염의 병태 생리에 관여한다고 보고되었으며[57], 타카야수동맥염 환자들의 대동맥 조직의 면역 조직 화학적 분석 결과, T세포뿐 아니라 B세포가 동맥 외막(adventitia) 염증의 가장 주요한 세포 중 하나인 것으로 보고되었다[57,58]. 이러한 데이터에 기반하여 anti-CD20 단클론성 항체인 rituximab을 타카야수동맥염 치료제로 시도하였으며[57,59,60], 그 결과 임상적 관해뿐 아니라 새로 생성된 형질모세포(plasmablast)의 확장(expansion)을 억제하는 것으로 확인 되었다[59]. 그러나 rituximab의 장기 추적 결과는 아직 제한적인 상황으로, 역시 이와 관련하여 무작위 대조 연구가 추후 시행될 필요가 있다.
향후 치료법에 대한 연구의 방향
향후 타카야수동맥염의 유망한 치료 타겟으로 IL-12와 IL-1과 같은 cytokine과 rho kinase (ROCK)와 NOTCH 등의 molecular target이 제시되었다.
타카야수동맥염의 병리 기전으로 Th1/IL-12/IFNγ와 Th17/IL-23/IL-17의 경로가 중요하다고 제시되었고[55], 전장유전체 상관성 분석(genome-wide association study)을 통하여 타카야수동맥염의 질병 감수성 유전자(susceptibility gene)로 IL-12-B 유전자가 식별된 점 등을 감안하면[61], IL-12와 IL-23이 타카야수동맥염의 병인에 기여할 것으로 고려할 수 있다. IL-12/23p40의 단클론 항체인 ustekinumab이 타카야수동맥염 치료에 효과적일 수 있을 것으로 기대하여 최근 불응성 타카야수동맥염 환자 3명에게 ustekinumab 40 mg의 용량으로(0일, 28일) 투여를 한 연구가 진행되었다[62]. 그 결과, 염증 수치는 감소하였고 ustekinumab의 이상 반응은 없었으나, MRI로 평가한 혈관벽의 염증에는 유의한 호전이 관찰되지 않았다. 이는 ustekinumab의 적은 투여 용량 및 짧은 사용기간 등에서 온 결과로 추정되며[55], 타카야수동맥염에서 ustekinumab의 역할에 대하여 정확하게 평가하기 위해서는 추후 임상연구가 더 진행이 되어야할 것으로 보인다.
타카야수동맥염에서 혈중 IL-1 수치가 증가되어 있으므로, IL-1을 억제하는 것도 치료 선택이 될 수 있다[47]. 그러나 불응성 거대세포동맥염에서 IL-1 억제가 효과적이었다는 증례 보고가 일부 있고[55], 현재까지는 타카야수동맥염 환자에서 연구 결과가 발표된 적은 없다.
Cytokine을 억제하는 것뿐 아니라, 이상세포 신호(cell signaling) 및 세포간 상호 작용 경로(cell-cell interaction pathway)에 중요한 역할을 하는 분자(예를 들면, ROCK와 NOTCH)를 타겟으로 하는 것 역시 향후 치료의 옵션으로 고려될 수 있을 것이다[63,64]. ROCK pathway와 NOTCH 수용체의 유전자 발현 모두 거대세포동맥염 환자의 측두동맥 조직에서 증가되어 있는 것이 확인되었으며, ROCK는 Th17 분화, 혈관 리모델링, 염증세포 동원에 중요한 역할을 하는 것으로 알려져 있다[64]. 또한, 실험쥐 모델에서 NOTCH를 억제하여 Th17의 효과적인 downregulation과 Th1 반응의 억제, 혈관 병변에 T세포 침윤을 억제할 수 있었다는 결과가 보고되었다[63]. 이에 따라 이러한 신호 경로를 조절하고 IL-17을 억제하는 것이 타카야수동맥염에서 잠재적 치료 방법으로 고려될 수 있다[55].
또한 혈관염의 염증에 대한 특이적인 치료와 함께 심혈관계 위험인자, 동맥경화, 고혈압, 폐동맥고혈압 등에 대한 평가와 적절한 모니터링 및 조절이 중요하다.
혈관재개통술(revascularization)
타카야수동맥염의 만성기에는 치료의 원칙 중 하나가 침범된 혈관의 외과적 혈관 성형 수술이나 혈관중재술(endovascular intervention)과 같은 혈관재개통술을 시행하는 것으로, 혈관중재술에는 풍선확장술(balloon angioplasty), 스텐트(stent) 및 스텐트그라프트삽입술(stent graft replacement)이 있다[65,66]. 혈관중재술의 결과 및 성공률은 병변의 위치 및 길이와 혈관 협착의 단계에 따라 다르다. 침범된 길이가 짧고(short-segment), 급성동맥협착이 있는 경우에는 풍선확장술이나 스텐트그라프트삽입술이 도움이 된다. Percutaneous transluminal angioplasty는 덜 침습적이고 안전한 방법이지만, 장기적으로 보았을 때에는 77.3%에서 재협착이 발생하는 단점이 있다[67]. 반면 혈관 협착의 범위가 길고, 동맥주위 섬유화가 많이 진행이 되거나 폐색(occlusion)이 발생한 경우에는, 동맥우회술(surgical bypass)이 혈관중재술보다 우월한 것으로 보고되었다[65,66]. 스텐트내 재협착(in-stent restenosis)이 혈관 성형 수술 및 혈관중재술 모두에서 발생하는 중요한 합병증으로, 최근 약물 방출 풍선/스텐트(drug eluting balloon/stent)가 스텐트내 재협착을 예방하는데 효과적인지의 여부에 대하여 연구가 진행되고 있다[68].



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






