 |
 |
| Korean J Med > Volume 92(5); 2017 > Article |
|
Abstract
Malignant biliary tract obstruction (MBTO) is caused by a group of neoplasms that compromise bile duct flow, and the clinical presentation includes obstructive jaundice. The optimal treatment depends on both the type of malignancy and the stage of disease. Surgical resection may be the first choice of treatment. However, an operation is often impossible because of locally advanced disease or a high metastatic potential at the time of diagnosis. Considering the unfavorable prognosis of unresectable MBTO, endobiliary radiofrequency ablation (EB-RFA) has emerged as a palliative therapeutic modality that directly ablates malignant tissue in the bile duct. To date, some reports have suggested that EB-RFA is possibly beneficial, but it remains unclear whether EB-RFA prolongs biliary stent patency or overall survival. Nevertheless, EB-RFA is regarded as a promising loco-regional therapy for MBTO. This review focuses on the clinical application of the technique and its appropriate use, along with the benefits afforded and the complications encountered.
ņĢģņä▒ ļŗ┤Ļ┤Ć ĒÅÉņćäļŖö ļŗ┤Ļ┤ĆņØ┤ ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ ņóüņĢäņĀĖ ļŗ┤ņ”Ö ļ░░ņĢĪņØś ņןņĢĀĻ░Ć ņ┤łļלļÉśļŖö Ļ▓ĮņÜ░ļĪ£ ļŗ┤Ļ┤ĆņĢö, ņĘīņןņĢö, ļ░öĒä░ĒīĮļīĆļČĆņĢö, ņĀäņØ┤ņĢö ļō▒ņØś ļŗżņ¢æĒĢ£ ņøÉņØĖņŚÉ ņØśĒĢ┤ņä£ ļ░£ņāØĒĢ£ļŗż. ļīĆļČĆļČäņØś ņĢģņä▒ ļŗ┤Ļ┤Ć ĒÅÉņćäļŖö ņĀäņØ┤ ļśÉļŖö ĻĄŁņåī ņ¦äĒ¢ē ņāüĒā£ļĪ£ ļ░£Ļ▓¼ļÉśņ¢┤ ĻĘ╝ņ╣śņĀü ņłśņłĀņØ┤ ņ¢┤ļĀżņÜ┤ Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄĻ│Ā, ņłśņłĀņØ┤ Ļ░ĆļŖźĒĢ£ Ļ▓ĮņÜ░ņŚÉļÅä ĒÖ®ļŗ¼ ļ░Å Ļ░äĻĖ░ļŖź ņĀĆĒĢśļĪ£ ņłśņłĀņĀü ņ╣śļŻīĻ░Ć ņ¦ĆņŚ░ļÉśņ¢┤ ņĀüņĀłĒĢ£ ņ╣śļŻī ņŗ£ĻĖ░ļź╝ ļåōņ╣śļŖö Ļ▓ĮņÜ░Ļ░Ć ĒØöĒĢśļŗż[1]. ņøÉĒÖ£ĒĢ£ ļŗ┤ņ”Ö ļ░░ņĢĪņØĆ ĒÖśņ×ÉņØś ņéČņØś ņ¦łĻ│╝ ņśłĒøäļź╝ Ļ▓░ņĀĢĒĢśļŖö ņżæņÜö ņØĖņ×ÉņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ, ļŗżņ¢æĒĢ£ ņ×¼ņ¦ł ļ░Å ĒśĢĒā£ņØś ļŗ┤ņ”Ö ļ░░ņĢĪĻ┤ĆņØä ņØ┤ņÜ®ĒĢ£ ņ╣śļŻīĻ░Ć ņŗ£ļÅäļÉśĻ│Ā ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņØ┤ļ¤¼ĒĢ£ ļŗ┤ņ”Ö ļ░░ņĢĪņłĀļōżņØĆ ļ¬©ļæÉ ņØ╝ņŗ£ņĀüņØĖ ĒÖ®ļŗ¼ņØś ĒśĖņĀäņØä ĻĖ░ļīĆĒĢśļŖö ņ╣śļŻīļ▓Ģņ£╝ļĪ£, ņ×¼Ēśæņ░®ņØś Ļ░ĆļŖźņä▒ņØ┤ ļåÆĻĖ░ ļĢīļ¼ĖņŚÉ ļé┤ņŗ£Ļ▓ĮņŚŁĒ¢ēņĘīļŗ┤Ļ┤ĆņĪ░ņśüņłĀ(endoscopic retrograde cholangiopancreatography, ERCP) ļ░Å Ļ▓ĮĒö╝Ļ▓ĮĻ░äļŗ┤ņ”Öļ░░ņĢĪ(percutaneous transhepatic biliary drainage, PTBD) ļō▒ņØś ĻĖ░ņĪ┤ ņ╣śļŻīļ▓ĢņŚÉ Ļ┤æņŚŁĒĢÖņ╣śļŻī(photodynamic therapy, PDT) ļśÉļŖö Ļ│ĀņŻ╝Ēīī ņåīņ×æņłĀ(radiofrequency ablation, RFA)ņØä ņČöĻ░ĆĒĢśņŚ¼ ņ╣śļŻī ņä▒ņĀüņØä Ē¢źņāüņŗ£ĒéżĻ│Āņ×É ĒĢśļŖö ļģĖļĀźņØ┤ ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŗż. ļ│ĖĻ│ĀņŚÉņä£ļŖö ļŗ┤Ļ┤ĆņĢöņØä ļ╣äļĪ»ĒĢ£ ņĢģņä▒ ļŗ┤Ļ┤Ć ĒÅÉņćäņŚÉņä£ ņĄ£ĻĘ╝ Ļ░üĻ┤æļ░øĻ│Ā ņ׳ļŖö ļŗ┤Ļ┤Ć ļé┤ ĻĄŁņåī ņ╣śļŻī ļ░®ļ▓ĢņØĖ Ļ│ĀņŻ╝Ēīī ņåīņ×æņłĀ(RFA)ņŚÉ ļīĆĒĢśņŚ¼ ĻĖ░ņłĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
Ļ│ĀņŻ╝Ēīī ņåīņ×æņłĀņØĆ Ļ░äņĢö, ņŗĀņןņĢö ļō▒ ņŚ¼ļ¤¼ ņĢģņä▒ ņóģņ¢æņØś ĻĄŁņåī ņ╣śļŻī ļ░®ļ▓Ģņ£╝ļĪ£ ļÅäņ×ģļÉśņ¢┤ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŖö ņ╣śļŻīļ▓Ģņ£╝ļĪ£, ņ┤łņØīĒīī ļśÉļŖö ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü(computed tomography) ļō▒ņØś ļÅäņøĆņØä ĒåĄĒĢ┤ ļ│æļ│Ć ļČĆņ£äņŚÉ ņĀäĻĘ╣ņØä ņéĮņ×ģĒĢ£ Ēøä, Ļ│ĀņŻ╝Ēīī ĻĄÉļźś ņĀäļźśļź╝ Ļ░ĆĒĢśņŚ¼ ņĢöņäĖĒż ļé┤ņØś ņØ┤ņś© ļČłņĢłņĀĢ(ionic agitation)ņØä ņ£Āļ░£ĒĢśĻ│Ā, ņØ┤ļĢī ļ░£ņāØĒĢśļŖö ņĪ░ņ¦üļé┤ ļ¦łņ░░ņŚ┤ļĪ£ ņäĖĒżļé┤ ļ░Å ņäĖĒżņÖĖ ņłśļČäņØ┤ ĻĖ░ĒÖö(evaporation)ļÉśļ®┤ņä£ ņóģņ¢æ ļČĆņ£ä ņØæĻ│Ā Ļ┤┤ņé¼(coagulation necrosis)ļź╝ ļ░£ņāØņŗ£ĒéżļŖö ņ╣śļŻīļ▓ĢņØ┤ļŗż. ņØ┤ļĢī ļ░£ņāØĒĢśļŖö ļ¦łņ░░ņŚ┤ņØĆ Ļ│ĀņŻ╝Ēīī ņĀäļźśņØś ņĀäņĢĢĻ│╝ ņĪ░ņé¼ ņŗ£Ļ░äņŚÉ ļ╣äļĪĆĒĢśĻ▓ī ļÉśĻ│Ā, ņĀäĻĘ╣Ļ│╝ņØś Ļ▒░ļ”¼ņŚÉ ļ░śļ╣äļĪĆĒĢśĻ▓ī ļÉ£ļŗż. RFAļĪ£ ņØĖĒĢ┤ ļ░£ņāØĒĢ£ ņŚ┤ņØ┤ 50ļÅä ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ ņäĖĒżļ▓Į ĒīīĻ┤┤ņÖĆ ļŗ©ļ░▒ņ¦ł ļ│Ćņä▒ņ£╝ļĪ£ ļ╣äĻ░ĆņŚŁņĀüņØĖ ņäĖĒż ņåÉņāüņØ┤ ļ░£ņāØĒĢśņŚ¼ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ĻĖ░ļīĆĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī, 100ļÅä ņØ┤ņāüņØś Ļ│Āņś©ņ£╝ļĪ£ ņ£Āņ¦ĆļÉśļŖö Ļ▓ĮņÜ░ RFA ņ╣┤ĒģīĒä░ Ēīü ņŻ╝ļ│Ć ņĪ░ņ¦üņŚÉ ņØæĻ│Āņ▓┤(coagulum)Ļ░Ć ļ¦īļōżņ¢┤ņ¦ĆĻ│Ā ņØ┤ļŖö ņĀäļźśņØś ņĀĆĒĢŁņØä ļåÆņØ┤Ļ│Ā ņśżĒ׳ļĀż RFAņØś ĒÜ©ņ£©ņØä ļ¢©ņ¢┤ļ£©ļ”¼Ļ▓ī ļÉ£ļŗż. ņ”ē RFA ļČĆņ£äņŚÉņä£ Ļ░æņ×æņŖżļ¤ĮĻ▓ī Ļ│Āņś©ņØ┤ ļ░£ņāØĒĢśļ®┤ ņśżĒ׳ļĀż ĒÜ©Ļ│╝ņĀüņØĖ ņ╣śļŻīļź╝ ĒĢĀ ņłś ņŚåĻĖ░ ļĢīļ¼ĖņŚÉ ņĄ£ĻĘ╝ņŚÉļŖö RFA ņ╣┤ĒģīĒä░ņŚÉ ņś©ļÅäņä╝ņä£ļź╝ ņ£äņ╣śņŗ£ņ╝£ ņĀüņĀĢ ņś©ļÅäļź╝ ņ£Āņ¦ĆĒĢśļŖö ļ░®ļ▓ĢņØ┤ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ļśÉĒĢ£ ļ│æļ│Ć ņŻ╝ņ£äņŚÉ ĒśłĻ┤ĆņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ļŖö ņŚ┤ ļ░░ņČ£ Ēśäņāü(heat sink phenomenon)ņØ┤ ļ░£ņāØĒĢśņŚ¼ ņĪ░ņ¦üļé┤ ņś©ļÅäĻ░Ć ļ¢©ņ¢┤ņĀĖ RFA ĒÜ©Ļ│╝Ļ░Ć ļ¢©ņ¢┤ņ¦ł ņłś ņ׳ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ļŗżļźĖ Ļ│ĀĒśĢņĢöņŚÉ ņé¼ņÜ®ļÉśļŖö RFA ĻĖ░ĻĖ░ļŖö ņĀæņ¦Ć Ēī©ļō£(grounding pad)ļź╝ ņŗĀņ▓┤ ļŗżļźĖ ļČĆņ£äņŚÉ ļČĆņ░®ĒĢśĻ│Ā RFA ņ╣┤ĒģīĒä░ļź╝ ļ│æļ│Ć ļČĆņ£äņŚÉ ņ£äņ╣śņŗ£ĒéżļŖö ļŗ©ĻĘ╣ĒśĢ(monopolar) ĻĖ░ĻĖ░Ļ░Ć ņŻ╝ļĪ£ ņé¼ņÜ®ļÉśņ¦Ćļ¦ī, ļŗ┤Ļ┤Ćļé┤ RFAņØś Ļ▓ĮņÜ░ļŖö ņ╣┤ĒģīĒä░ ļé┤ņŚÉ ņ¦ØņłśļĪ£ ņĀäĻĘ╣ņØä ļČĆņ░®ņŗ£ņ╝£ ļæÉ ņĀäĻĘ╣ņŚÉņä£ ļ░£ņāØĒĢśļŖö Ļ│ĀņŻ╝Ēīīļź╝ ņØ┤ņÜ®ĒĢ┤ ņäĖĒż Ļ┤┤ņé¼ļź╝ ņ£Āļ░£ĒĢśļŖö ņ¢æĻĘ╣ĒśĢ(bipolar) ļ░®ļ▓ĢņØ┤ ņØ┤ņÜ®ļÉ£ļŗż. ļŗ┤Ļ┤Ćļé┤ RFA ļ¬©ņŗØļÅäļŖö ĻĘĖļ”╝ 1Ļ│╝ Ļ░Öļŗż.
EB-RFA ņŗ£Ē¢ēņØä ņ£äĒĢ┤ņä£ļŖö ERCPņØś ņ▒äļäÉņØä ĒåĄĒĢ┤ ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŖö ņ╣┤ĒģīĒä░ ĒśĢĒā£ņØś ņĀäĻĘ╣ņØ┤ ĒĢäņÜöĒĢśļŗż. Ēśäņ×¼Ļ╣īņ¦Ć ņāüņÜ®ĒÖöļÉśņ¢┤ ņ׳ļŖö RFA ņ╣┤ĒģīĒä░ļŖö Habib EndoHBP┬« (EMcision, London, UK)ņÖĆ ELRA RFA catheter┬« (Starmed, Goyang, Korea)Ļ░Ć ņ׳ļŗż. Habib ņ╣┤ĒģīĒä░ļŖö 8 Fr ņ¢æĻĘ╣ĒśĢ ņ╣┤ĒģīĒä░ļĪ£, 2Ļ░£ņØś 8 mm ņĀäĻĘ╣ņØ┤ ļČĆņ░®ļÉśņ¢┤ ņ׳ļŖö ĒśĢĒā£ļĪ£ ņ£ĀļÅäņäĀ(guidewire)ņØä ļö░ļØ╝ņä£ ERCPļź╝ ĒåĄĒĢ┤ ļŗ┤Ļ┤Ć ļé┤ļĪ£ ņéĮņ×ģļÉĀ ņłś ņ׳ļŗż. RFAņŗ£ 7-10 WļĪ£ 90ņ┤ł ņ£Āņ¦ĆĒĢśļ®░, RFA ņåīņ×æ ĻĖĖņØ┤ļŖö ņĢĮ 25 mmļĪ£ ņśłņĖĪļÉ£ļŗż. ņĢäņ¦ü ĻĄŁļé┤ņŚÉ ļÅäņ×ģļÉśņ¢┤ ņ׳ņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī, ļīĆļČĆļČäņØś ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉņä£ļŖö Habib ņ╣┤ĒģīĒä░ļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ELRA ņ╣┤ĒģīĒä░ļŖö ĻĄŁļé┤ ĻĖ░ņłĀļĪ£ Ļ░£ļ░£ļÉ£ RFA ņ╣┤ĒģīĒä░ļĪ£ ļé┤ļČĆņŚÉ ņś©ļÅä ņä╝ņä£Ļ░Ć ņ׳ņ¢┤ RFA ļČĆņ£ä ņś©ļÅäļź╝ ņĖĪņĀĢĒĢśņŚ¼ ļ¬®Ēæ£ ņś©ļÅäļź╝ ņ┤łĻ│╝ĒĢśļŖö Ļ│ĀņŚ┤ņØä ļ░®ņ¦ĆĒĢĀ ņłś ņ׳ļŗż. 7 Fr ņ¢æĻĘ╣ĒśĢ ņ╣┤ĒģīĒä░ļĪ£ 11 mm, 18 mm, 22 mm, 33 mmņØś 4Ļ░Ćņ¦Ć ĒśĢĒā£Ļ░Ć ņ׳ļŗż. ļ¬®Ēæ£ ņś©ļÅä 80ŌäāļĪ£ 7-10 W, 120ņ┤łņØś settingņ£╝ļĪ£ ņś©ļÅä ņĪ░ņĀł(temperature controlled) RFAļź╝ ņŗ£Ē¢ēĒĢ£ļŗż.
ļæÉ ņóģļźśņØś ņ╣┤ĒģīĒä░ ļ¬©ļæÉ ņŗ£ņłĀ ļ░®ļ▓ĢņØĆ ļīĆļÅÖņåīņØ┤ĒĢśļŗż. ERCPļź╝ ņŗ£Ē¢ēĒĢśļ®┤ņä£ ņ£ĀļÅäņäĀņØä ļŗ┤Ļ┤Ćļé┤ ļ│æļ│Ć ļČĆņ£äļĪ£ ĒåĄĻ│╝ņŗ£Ēé© Ēøä, Ēł¼ņŗ£ ļ░®ņé¼ņäĀņ£╝ļĪ£ RFA ņ╣┤ĒģīĒä░ļź╝ ļ│æļ│Ć ļČĆņ£äņŚÉ ņ£äņ╣śņŗ£ĒéżĻ│Ā, ņĀĢĒĢ┤ņ¦ä setting Ļ░Æ(ELRA RFA 80┬░C 7-10 W, 120 s, Habib EB-RFA 7-10 W 60-120 s)ņŚÉ ļ¦×ņČöņ¢┤ Ļ│ĀņŻ╝Ēīī ņåīņ×æņłĀņØä ņŗ£Ē¢ēĒĢ£ļŗż. ņØ┤Ēøä ĒÆŹņäĀ ņ╣┤ĒģīĒä░ļź╝ ņØ┤ņÜ®ĒĢ┤ ņåīņ×æļÉ£ Ļ┤┤ņé¼ ņĪ░ņ¦üņØä ļŗ┤ņäØ ņĀ£Ļ▒░ņłĀĻ│╝ Ļ░ÖņØĆ ļ░®ļ▓Ģņ£╝ļĪ£ ņĀ£Ļ▒░ĒĢśļ®┤ņä£, ĒÆŹņäĀ ļŗ┤Ļ┤Ć ņĪ░ņśüņłĀņØä ņŗ£Ē¢ēĒĢśņŚ¼ ņ▓£Ļ│Ą ļ░Å ĒĢ®ļ│æņ”Ø ņŚ¼ļČĆļź╝ Ļ░Éļ│äĒĢ£ļŗż(Fig. 2). EB-RFA ņŗ£ņłĀņØĆ ERCP ņĀäļ¼ĖĻ░ĆļōżņŚÉĻ▓īļŖö Ēü░ ņ¢┤ļĀżņøĆ ņŚåņØ┤ ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ļŖö ņ╣śļŻī ļ░®ļ▓ĢņØ┤ņ¦Ćļ¦ī, ņŗ£ņłĀ Ēøä ļČĆņóģ ļō▒ņ£╝ļĪ£ ņØĖĒĢ┤ ņØ╝ņŗ£ņĀüņ£╝ļĪ£ ļŗ┤Ļ┤Ć Ēśæņ░®ņØ┤ ņĢģĒÖöļÉśĻ│Ā, ņןĻĖ░ņĀüņ£╝ļĪ£ļŖö ļŗ┤Ļ┤Ć ņ×¼Ēśæņ░®ņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ EB-RFA ņŗ£Ē¢ē ĒøäņŚÉļŖö ļŗ┤Ļ┤Ć Ļ░£ĒåĄņØä ņ£Āņ¦ĆĒĢśĻĖ░ ņ£äĒĢ£ ļ░░ņĢĪĻ┤Ć ņéĮņ×ģņØ┤ ņČöņ▓£ļÉ£ļŗż.
EB-RFAļŖö Ļ░Ćņŗ£ņĀüņ£╝ļĪ£ ņ╣śļŻī ļ▓öņ£äļź╝ ĒÖĢņØĖĒĢĀ ņłś ņŚåļŖö ļŗ©ņĀÉņØ┤ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ, ļŗ┤Ļ┤Ćļé┤ Ļ┤┤ņé¼ ņĀĢļÅä ļ░Å ņ╣śļŻī ļ▓öņ£äļź╝ ņśłņĖĪĒĢśĻ│Āņ×É ļŗżņ¢æĒĢ£ ņĀäņ×äņāü ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśņŚłļŗż. Habib RFAļŖö in vitro ļÅ╝ņ¦Ć ļŗ┤Ļ┤ĆņŚÉņä£ Ļ┤┤ņé¼ ņśüņŚŁņØś Ļ╣ŖņØ┤Ļ░Ć ļ░śĻ▓Į 2.6-4.1 mmļĪ£ ņĖĪņĀĢļÉśņŚłĻ│Ā[2], ELRA RFA catheterļź╝ ņé¼ņÜ®ĒĢ£ Cho ļō▒[3]ņØś in vivo mini pig ļÅÖļ¼╝ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņś©ļÅä ņĪ░ņĀł RFA ļ░®ļ▓Ģ ņé¼ņÜ®ņŗ£ ņĀĢņāü ļŗ┤Ļ┤ĆņŚÉņä£ Ļ┤┤ņé¼ Ļ╣ŖņØ┤Ļ░Ć ņĢĮ 1.7-4.3 mmļĪ£ ņĖĪņĀĢļÉśņŚłļŗż. ļśÉĒĢ£ EB-RFA ĒøäĻĖ░ ĒĢ®ļ│æņ”Ø ļÅÖļ¼╝ ņŗżĒŚśņŚÉņä£ļŖö EB-RFA 4ņŻ╝ Ēøä ļŗ┤Ļ┤Ć Ēśæņ░® ļ░Å ĒÖöļåŹņä▒ ļŗ┤Ļ┤ĆņŚ╝ņØ┤ ļ░£ņāØĒĢśņśĆĻ│Ā, Ēśæņ░® ĻĖĖņØ┤ļŖö RFA electrode ĻĖĖņØ┤ņØś ņĢĮ 40% ņĀĢļÅäļĪ£ ņĖĪņĀĢļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ņĀäņ×äņāü ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ņĀĢļ”¼ĒĢśļ®┤ EB-RFA ņŗ£ņłĀĻ│╝ ņŚ░Ļ┤ĆļÉ£ ņ▓£Ļ│Ą, ņČ£Ēśł ļō▒ņØś ĒĢ®ļ│æņ”ØņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī, ņŗ£ņłĀ Ēøä ļŗ┤Ļ┤Ć Ēśæņ░®ņØ┤ ļ░£ņāØĒĢśņśĆĻĖ░ ļĢīļ¼ĖņŚÉ ĒøäĻĖ░ ĒĢ®ļ│æņ”Ø ņśłļ░®ņØä ņ£äĒĢ┤ņä£ļŖö ļŗ┤Ļ┤Ć ņŖżĒģÉĒŖĖņØś ņČöĻ░Ć ņéĮņ×ģņØ┤ ĒĢäņÜöĒĢśļŗż.
Ēśäņ×¼Ļ╣īņ¦ĆļÅä EB-RFAļŖö ņåīĻĘ£ļ¬© ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļōżņØ┤ ļīĆļČĆļČäņØ┤ņ¦Ćļ¦ī, ĻĖ░ņĪ┤ ļ│┤Ļ│Āļź╝ ĒåĄĒĢ┤ ņĢłņĀäņä▒ ļ░Å ņ×äņāü ņĀüņÜ® Ļ░ĆļŖźņä▒ņØ┤ Ļ▓Ćņ”ØļÉśņŚłļŗż(Table 1). EB-RFAļŖö ņøÉņ£äļČĆ ļ░Å ĻĘ╝ņ£äļČĆ ļŗ┤Ļ┤Ć ļ¬©ļæÉņŚÉņä£ ĻĖ░ņłĀņĀü ņ¢┤ļĀżņøĆ ņŚåņØ┤ ņŗ£Ē¢ēļÉĀ ņłś ņ׳ņŚłĻ│Ā, ļīĆļČĆļČäņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŗ£ņłĀ Ēøä ļŗ┤Ļ┤ĆņŚ╝ņØś ņśłļ░®ņØä ņ£äĒĢ┤ ņŖżĒģÉĒŖĖļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ņĢäņ¦üĻ╣īņ¦Ć ņŖżĒģÉĒŖĖ Ļ░£ĒåĄ ĻĖ░Ļ░ä ļ░Å ņāØņĪ┤ ĻĖ░Ļ░äņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ļō£ļ¼╝ĻĖ░ ļĢīļ¼ĖņŚÉ ņĀĢĒÖĢĒĢ£ ņ×ÉļŻīļź╝ ņĀ£ņŗ£ĒĢśĻĖ░ļŖö ņ¢┤ļĀĄņ¦Ćļ¦ī, ĻĖ░ņĪ┤ ļ│┤Ļ│ĀņŚÉņä£ ļ│┤Ļ│ĀļÉśņŚłļŹś hemobilia, liver infarction ļō▒ņØś ņ£äņżæĒĢ£ ĒĢ®ļ│æņ”ØņØś ļ╣łļÅäļŖö ņĄ£ĻĘ╝ Ļ░ÉņåīĒĢśĻ│Ā ņ׳ļŖö ņČöņäĖņØ┤ļŗż[4-12]. ĻĘĖļ¤¼ļéś EB-RFAņØś ņØ╝ļ░śņĀüņØĖ ļČĆņ×æņÜ®ņØĖ ņØ╝ņŗ£ņĀüņØĖ ĒåĄņ”ØĻ│╝ ļ░£ņŚ┤ ļ░Å ERCP ņŗ£ņłĀ ņŚ░Ļ┤Ć ĒĢ®ļ│æņ”ØņØś ļ░£ņāØņØĆ ļō£ļ¼╝ņ¦Ć ņĢŖĻ│Ā, ņ£äņŚÉ ņ¢ĖĻĖēĒĢ£ ņ£äņżæĒĢ£ ĒĢ®ļ│æņ”ØņØś Ļ░ĆļŖźņä▒ļÅä ņŚåņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ ĒĢŁņāü EB-RFA ņŗ£ņłĀņØĆ ņŻ╝ņØśĻ░Ć ĒĢäņÜöĒĢśļŗż. ļśÉĒĢ£ cardiac pacemaker, ņ×äņé░ļČĆ, ņØæĻ│Ā ņןņĢĀ ĒÖśņ×ÉņŚÉņä£ļŖö EB-RFAņØś ņĀüņÜ®ņØ┤ ņ¢┤ļĀĄļŗż.
ņé¼ņŗż ņÖĖĻĄŁņŚÉņä£ļŖö EB-RFAĻ░Ć ņĢģņä▒ ļŗ┤Ļ┤Ć Ēśæņ░® ĒÖśņ×ÉņŚÉņä£ ļ│┤ņĪ░ņĀü ņ╣śļŻī ļ░®ļ▓Ģņ£╝ļĪ£ ĒÖ£ļ░£Ē׳ ņŗ£Ē¢ēļÉśĻ│Ā ņ׳ņ¦Ćļ¦ī, ĻĄŁļé┤ņŚÉņä£ļŖö ņĢäņ¦ü ņŗĀņØśļŻīĻĖ░ņłĀļĪ£ ļō▒ņ×¼ļ░øņ¦Ć ļ¬╗ĒĢśņŚ¼ ļ│┤ĒŚś ĻĖēņŚ¼ļź╝ ņŗĀņ▓ŁĒĢĀ ņłś ņŚåļŖö ĒśäņŗżņĀüņØĖ ņĀ£ņĢĮņØ┤ ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ņĀ£ĒĢ£ņĀÉņØś ĻĘ╣ļ│ĄņØä ņ£äĒĢ┤ ņĢģņä▒ ļŗ┤Ļ┤Ć Ēśæņ░® ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĻĄŁļé┤ ļŗżĻĖ░Ļ┤Ć ņĀäĒ¢źņĀü 2ņāü ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņŚ¼ EB-RFAņØś ļŗ©ĻĖ░ ņĢłņĀĢņä▒ņØä Ļ▓Ćņ”ØĒĢśĻ│Ā ņ׳ņ£╝ļ®░, ņČöĒøä EB-RFAņØś ņ×äņāü ņĀüņØæņ”Ø ņĀĢļ”ĮĻ│╝ ĒÜ©Ļ│╝ņĀüņØĖ ĒÖ£ņÜ®ņŚÉ ņĀüņÜ®ņØ┤ ĻĖ░ļīĆļÉ£ļŗż.
Ļ┤æņŚŁĒĢÖ ņ╣śļŻīļŖö EB-RFA ņŗ£ņłĀĻ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņłśņłĀņØ┤ ļČłĻ░ĆļŖźĒĢ£ ļŗ┤Ļ┤ĆņĢö ĒÖśņ×ÉņŚÉņä£ ņóģņ¢æņØś ņä▒ņןņØä ņżäņØ┤Ļ│Ā ļŗ┤ņ”Ö ņĀĢņ▓┤ļź╝ ņ╣śļŻīĒĢ©ņ£╝ļĪ£ņŹ© ņāØņĪ┤ ĻĖ░Ļ░äņØś ņ”ØļīĆļź╝ ĻĖ░ļīĆĒĢĀ ņłś ņ׳ļŖö ņóŗņØĆ ņ╣śļŻī ļ░®ļ▓ĢņØ┤ļŗż. ĒĢśņ¦Ćļ¦ī, EB-RFAņŚÉ ļ╣äĒĢ┤ Ļ│ĀĻ░ĆņØś ņןļ╣äņÖĆ Ļ┤æļ»╝Ļ░ÉņĀ£(photosensitizer)Ļ░Ć ņŗ£ņłĀņŚÉ ĒĢäņÜöĒĢśĻ│Ā, Ļ┤æļÅģņä▒ ņśłļ░®ņØä ņ£äĒĢ┤ņä£ PDT ņØ┤Ēøä 4-6ņŻ╝Ļ░ä Ē¢ćļ╣øņŚÉ ļģĖņČ£ļÉśņ¦Ć ļ¦ÉņĢäņĢ╝ ĒĢ£ļŗż. ļśÉĒĢ£ ĻĄŁļé┤ņØś Ļ▓ĮņÜ░ Ļ┤æņŚŁĒĢÖ ņ╣śļŻīļŖö ņ×äņāü ĒŚłĻ░ĆĻ░Ć ļÉśņ¢┤ ņ׳ļŖö ļ░śļ®┤ Ļ┤æĻ│╝ļ»╝ņĀ£Ļ░Ć ņĢäņ¦ü ņŗØņĢĮņ▓śņŚÉņä£ ņĀüņØæņ”ØņØä ļ░øņ¦Ć ļ¬╗ĒĢ£ ņāüĒā£ņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ Ļ┤æņŚŁĒĢÖ ņ╣śļŻīņØś ļīĆņżæĒÖöļŖö ņ¢┤ļĀżņøĆņØ┤ ļ¦Äļŗż. Ļ┤æņŚŁĒĢÖ ņ╣śļŻīņÖĆ EB-RFAņØś ņĀäĒ¢źņĀü ļ╣äĻĄÉ ņŚ░ĻĄ¼ļŖö ņ¢┤ļĀżņÜ┤ ņŗżņĀĢņØ┤ņ¦Ćļ¦ī, Strand ļō▒[11]ņØĆ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ ļæÉ ņ╣śļŻīļ▓ĢņØś ņāØņĪ┤ ĻĖ░Ļ░äņØä 9.6Ļ░£ņøöĻ│╝ 7.5Ļ░£ņøöļĪ£ ņ£Āņé¼ĒĢśĻ▓ī ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ EB-RFAļŖö Ļ┤æņŚŁĒĢÖ ņ╣śļŻīņŚÉ ļ╣äĒĢśņŚ¼ Ļ│ĀĻ░ĆņØś Ļ┤æĻ│╝ļ»╝ņĀ£ņÖĆ ņןļ╣äĻ░Ć ĒĢäņÜöĒĢśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ ņēĮĻ▓ī ņŗ£ņłĀņØ┤ Ļ░ĆļŖźĒĢśĻ│Ā, Ēö╝ļČĆ Ļ┤æĻ│╝ļ»╝ņä▒ņØ┤ ņŚåĻ│Ā, ņ╣śļŻī ņØ┤Ēøä ņ”ēĻ░üņĀüņØĖ ņØ╝ņāüņāØĒÖ£ņØ┤ Ļ░ĆļŖźĒĢśļŗżļŖö ņןņĀÉņØ┤ ņ׳ļŗż. ĻĘĖļ¤¼ļéś EB-RFAļŖö Ļ┤æņŚŁĒĢÖ ņ╣śļŻīņŚÉ ļ╣äĒĢ┤ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝Ļ░Ć ļČĆņĪ▒ĒĢśĻ│Ā, ņ╣┤ĒģīĒä░ņÖĆ ļ│æļ│ĆņØś ņĀæņ┤ēņØä ņ£Āņ¦ĆĒĢśļŖö Ļ▓āņØ┤ ĒÜ©Ļ│╝ņĀüņØĖ RFAņØś ņäĀĻ▓░ ņÜöĻ▒┤ņØ┤ ļÉśĻĖ░ ļĢīļ¼ĖņŚÉ ņĀæĻĘ╝ņØ┤ ļČłĻ░ĆļŖźĒĢ£ ļŗ┤Ļ┤Ć Ēśæņ░® ļČĆņ£äļŖö ņ╣śļŻīĻ░Ć ņ¢┤ļĀĄļŗż. ĻĘĖ ņÖĖņŚÉļÅä Ļ┤æņŚŁĒĢÖ ņ╣śļŻīļŖö ļ░śļ│ĄņĀüņØĖ ņŗ£ņłĀņØ┤ Ļ░ĆļŖźĒĢśņ¦Ćļ¦ī, EB-RFAļŖö ļ░śļ│Ą ņŗ£ņłĀņŗ£ ļŗ┤Ļ┤Ć ļČĆņ£äņØś Ļ│╝ņåÉņāüĻ│╝ ņ▓£Ļ│Ą ņ£äĒŚśņä▒ņØ┤ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņŻ╝ņØśļź╝ ņÜöĒĢśļ®░, ĻĖ░ņ£Āņ╣śļÉ£ metal stentļŖö bipolar EB-RFAņØś ņ×æļÅÖņØä ļ░®ĒĢ┤ĒĢĀ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņ╣śļŻīņŚÉ ņĀ£ĒĢ£ņĀÉņØ┤ ļÉĀ ņłś ņ׳ļŗż.
ņĢģņä▒ ļŗ┤Ļ┤Ć Ēśæņ░® ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£, Ļ┤æņŚŁĒĢÖņ╣śļŻīņÖĆ EB-RFA ņ╣śļŻī ņÖĖņØś Ļ┤ĆĻ░Ģļé┤ ĻĄŁņåī ņ╣śļŻīļ▓ĢņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż. Ļ│ĀņŻ╝Ēīī ņ┤łņØīĒīīļź╝ ņŻ╝ļ│Ć ņĪ░ņ¦ü Ļ╣ŖņłÖņØ┤ ņĪ░ņé¼ĒĢśņŚ¼ ņĢöņäĖĒżņØś ĻĄŁņåīņĀü ņé¼ļ®ĖņØä ņ£Āļ░£ĒĢśļŖö ŌĆ£Ļ│ĀņŻ╝Ēīī Ļ┤ĆĻ░Ģļé┤ ņ┤łņØīĒīī(high intensity intraductal ultrasound)ŌĆØļŖö 2000ļģäļīĆ ņ┤łļ░ś ņåīĻ░£ļÉśņ¢┤ ĒÖ£ņÜ®ņØ┤ ĻĖ░ļīĆļÉśņŚłņ£╝ļéś, ņĢäņ¦ü ĒÖ£ļ░£ĒĢ£ ņČöĻ░Ć ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśņ¦Ć ļ¬╗ĒĢśĻ│Ā ņ׳ļŗż[13]. ļśÉĒĢ£ ļ░®ņé¼ņäĀ ņÖĖļČĆ ņĪ░ņé¼ņØś Ēö╝ļČĆ, ņŻ╝ļ│Ć ņןĻĖ░ ņåÉņāüņØä ņżäņØ┤Ļ│Ā ĻĄŁņåīņĀüņ£╝ļĪ£ Ļ│ĀņäĀļ¤ēņØś ļ░®ņé¼ņäĀ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ļŖö ŌĆ£Ļ┤ĆĻ░Ģļé┤ ļ░®ņé¼ņäĀ ņ╣śļŻī(intraductal brachytherapy)ŌĆØļŖö ņ┤łĻĖ░ ņŚ░ĻĄ¼ņŚÉņä£ ĒÜ©Ļ│╝Ļ░Ć ĻĖ░ļīĆļÉśņŚłņ£╝ļéś[14,15], ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉņä£ ņ£ĀņÜ®ņä▒ņØ┤ Ļ▓Ćņ”ØļÉśņ¦Ć ļ¬╗ĒĢśņśĆļŗż[16]. ĻĘĖ ņÖĖ ņĄ£ĻĘ╝ ļŗżņ¢æĒĢ£ ņŖżĒģÉĒŖĖņØś ļ░£ņĀäņØä ĒåĀļīĆļĪ£ photosensitizer embedded self-expandable metallic stentĻ░Ć ņŗżĒŚśņĀüņ£╝ļĪ£ Ļ░£ļ░£ļÉśņ¢┤ Ļ┤æņŚŁĒĢÖ ņ╣śļŻī ņ×äņāü ņĀüņÜ®ņØ┤ ņŗ£ļÅäļÉśĻ│Ā ņ׳Ļ│Ā[17], ļŗżņ¢æĒĢ£ Ļ┤ĆĻ░Ģļé┤ ņ╣śļŻīļ▓ĢņØä ņØæņÜ®ĒĢ£ ņ┤łņØīĒīīļé┤ņŗ£Ļ▓Į ņ╣śļŻīļ▓ĢņØ┤ Ļ░£ļ░£ļÉśĻ│Ā ņ׳ļŗż.
ņĢģņä▒ ļŗ┤Ļ┤Ć Ēśæņ░®ņØĆ ņłśņłĀņØä ĒåĄĒĢ┤ ņÖäņ╣śļź╝ ĻĖ░ļīĆĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī, ņ¦äĒ¢ēņä▒ ļśÉļŖö ņĀäņØ┤ņä▒ ļŗ┤ņĘīĻ┤Ć ņĢöņŚÉ ņØśĒĢ£ Ēśæņ░®ņØĆ ĻĘ╝ņ╣śņĀü ņ╣śļŻīĻ░Ć ļČłĻ░ĆļŖźĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄĻ│Ā ņśłĒøäĻ░Ć ļČłļ¤ēĒĢśļŗż. Ļ┤æņŚŁĒĢÖ ņ╣śļŻī ļ░Å Ļ│ĀņŻ╝Ēīī ņåīņ×æņłĀ ļō▒ņØś Ļ┤ĆĻ░Ģļé┤ ĻĄŁņåī ņ╣śļŻīļ▓ĢņØĆ ļŗ┤ņ”Ö ļ░░ņĢĪņØä ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ņ£Āņ¦ĆĒĢĀ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņĪ░ĻĖ░ ļ│æļ│ĆņØś ņØ╝ņ░© ņ╣śļŻī ņØ┤ņÖĖņŚÉļÅä, ĻĄŁņåī ņ¦äĒ¢ē ļśÉļŖö ņĀäņØ┤ņä▒ ņóģņ¢æņØś ņØ┤ņ░© ņ╣śļŻī Ļ░£ļģÉņ£╝ļĪ£ ĻĖ░ļŖźņØä ļ│┤ņĀäĒĢśĻ│Ā ņ”Øņāü ņÖäĒÖöļź╝ ĻĖ░ļīĆĒĢĀ ņłś ņ׳ļŖö ļ░®ļ▓Ģņ£╝ļĪ£ ņé¼ņÜ®ļÉĀ ņłś ņ׳ļŗż. ĒŖ╣Ē׳ Ļ│ĀļĀ╣ ņĢöņØś ņ”ØĻ░Ć, ļ╣äņ╣©ņŖĄņĀüņØĖ ņ╣śļŻī ļ░®ļ▓Ģ ņäĀĒśĖ ĻĘĖļ”¼Ļ│Ā ņéČņØś ņ¦łņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ņØ┤ ņżæņŗ£ļÉśļŖö ņĄ£ĻĘ╝ ņØśļŻīĒÖśĻ▓ĮņØś ļ│ĆĒÖöļź╝ Ļ│ĀļĀżĒĢśļ®┤, ņĢģņä▒ ļŗ┤Ļ┤Ć Ēśæņ░® ĒÖśņ×ÉņØś Ļ░£ņØĖļ│ä ļ¦×ņČż ņ╣śļŻīļź╝ ņ£äĒĢ┤ņä£ ļŗżņ¢æĒĢ£ Ļ┤ĆĻ░Ģļé┤ ĻĄŁņåī ņ╣śļŻī ļ░®ļ▓ĢņØś ņś¼ļ░öļźĖ ņØ┤ĒĢ┤ņÖĆ ņĀüņÜ®ņØ┤ ĒĢäņÜöĒĢśļŗż.
REFERENCES
1. Cho JH, Jeon TJ, Park JY, et al. Comparison of outcomes among secondary covered metallic, uncovered metallic, and plastic biliary stents in treating occluded primary metallic stents in malignant distal biliary obstruction. Surg Endosc 2011;25:475ŌĆō482.


2. Itoi T, Isayama H, Sofuni A, et al. Evaluation of effects of a novel endoscopically applied radiofrequency ablation biliary catheter using an ex-vivo pig liver. J Hepatobiliary Pancreat Sci 2012;19:543ŌĆō547.


3. Cho JH, Lee KH, Kim JM, Kim YS, Lee DH, Jeong S. Safety and effectiveness of endobiliary radiofrequency ablation according to the different power and target temperature in a swine model. J Gastroenterol Hepatol 2017;32:521ŌĆō526.


4. Alis H, Sengoz C, Gonenc M, Kalayci MU, Kocatas A. Endobiliary radiofrequency ablation for malignant biliary obstruction. Hepatobiliary Pancreat Dis Int 2013;12:423ŌĆō427.


5. Dolak W, Schreiber F, Schwaighofer H, et al. Endoscopic radiofrequency ablation for malignant biliary obstruction: a nationwide retrospective study of 84 consecutive applications. Surg Endosc 2014;28:854ŌĆō860.


6. Figueroa-Barojas P, Bakhru MR, Habib NA, et al. Safety and efficacy of radiofrequency ablation in the management of unresectable bile duct and pancreatic cancer: a novel palliation technique. J Oncol 2013;2013:910897.



7. Laleman W, van der Merwe S, Verbeke L, et al. A new intraductal radiofrequency ablation device for inoperable biliopancreatic tumors complicated by obstructive jaundice: the IGNITE-1 study. Endoscopy. 2017. Jul. 21. [Epub]. http://dx.doi.org/10.1055/s-0043-113559

8. Laquiere A, Bousti├©re C, Leblanc S, Penaranda G, D├©silets E, Prat F. Safety and feasibility of endoscopic biliary radiofrequency ablation treatment of extrahepatic cholangiocarcinoma. Surg Endosc 2016;30:1242ŌĆō1248.


9. Sharaiha RZ, Natov N, Glockenberg KS, Widmer J, Gaidhane M, Kahaleh M. Comparison of metal stenting with radiofrequency ablation versus stenting alone for treating malignant biliary strictures: is there an added benefit? Dig Dis Sci 2014;59:3099ŌĆō3102.


10. Steel AW, Postgate AJ, Khorsandi S, et al. Endoscopically applied radiofrequency ablation appears to be safe in the treatment of malignant biliary obstruction. Gastrointest Endosc 2011;73:149ŌĆō153.


11. Strand DS, Cosgrove ND, Patrie JT, et al. ERCP-directed radiofrequency ablation and photodynamic therapy are associated with comparable survival in the treatment of unresectable cholangiocarcinoma. Gastrointest Endosc 2014;80:794ŌĆō804.


12. Tal AO, Vermehren J, Friedrich-Rust M, et al. Intraductal endoscopic radiofrequency ablation for the treatment of hilar non-resectable malignant bile duct obstruction. World J Gastrointest Endosc 2014;6:13ŌĆō19.



13. Prat F, Lafon C, De Lima DM, et al. Endoscopic treatment of cholangiocarcinoma and carcinoma of the duodenal papilla by intraductal high-intensity US: results of a pilot study. Gastrointest Endosc 2002;56:909ŌĆō915.


14. Fletcher MS, Brinkley D, Dawson JL, Nunnerley H, Williams R. Treatment of hilar carcinoma by bile drainage combined with internal radiotherapy using 192iridium wire. Br J Surg 1983;70:733ŌĆō735.


15. Kuvshinoff BW, Armstrong JG, Fong Y, et al. Palliation of irresectable hilar cholangiocarcinoma with biliary drainage and radiotherapy. Br J Surg 1995;82:1522ŌĆō1525.


16. Isayama H, Tsujino T, Nakai Y, et al. Clinical benefit of radiation therapy and metallic stenting for unresectable hilar cholangiocarcinoma. World J Gastroenterol 2012;18:2364ŌĆō2370.



17. Bae BC, Yang SG, Jeong S, et al. Polymeric photosensitizer-embedded self-expanding metal stent for repeatable endoscopic photodynamic therapy of cholangiocarcinoma. Biomaterials 2014;35:8487ŌĆō8495.


The schema of endobiliary radiofrequency ablation. EB-RFA, endobiliary radiofrequency ablation; RFA, radiofrequency ablation.
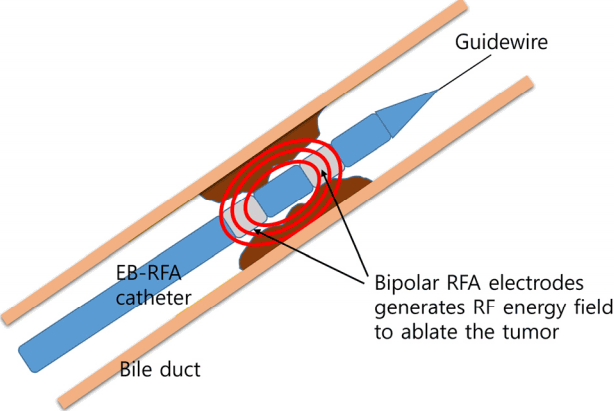
Figure┬Ā1.
Endobiliary RFA ablation. (A) Endoscopic retrograde cholangiography reveals intra-ductal filling defects in the distal CBD. (B) Cholangiography showing the EB-RFA catheter in the distal CBD stricture, along with the guidewire. EB-RFA was applied at 80Ōäā and 10 W for 120 s. The endoscopic image shows ablated tumor tissue after balloon retrieval. (C) At the end of the procedure, a single biliary self-expandable metallic stent was placed in the stricture site. RFA, radiofrequency ablation; CBD, common bile duct; EB-RFA, endobiliary radiofrequency ablation.
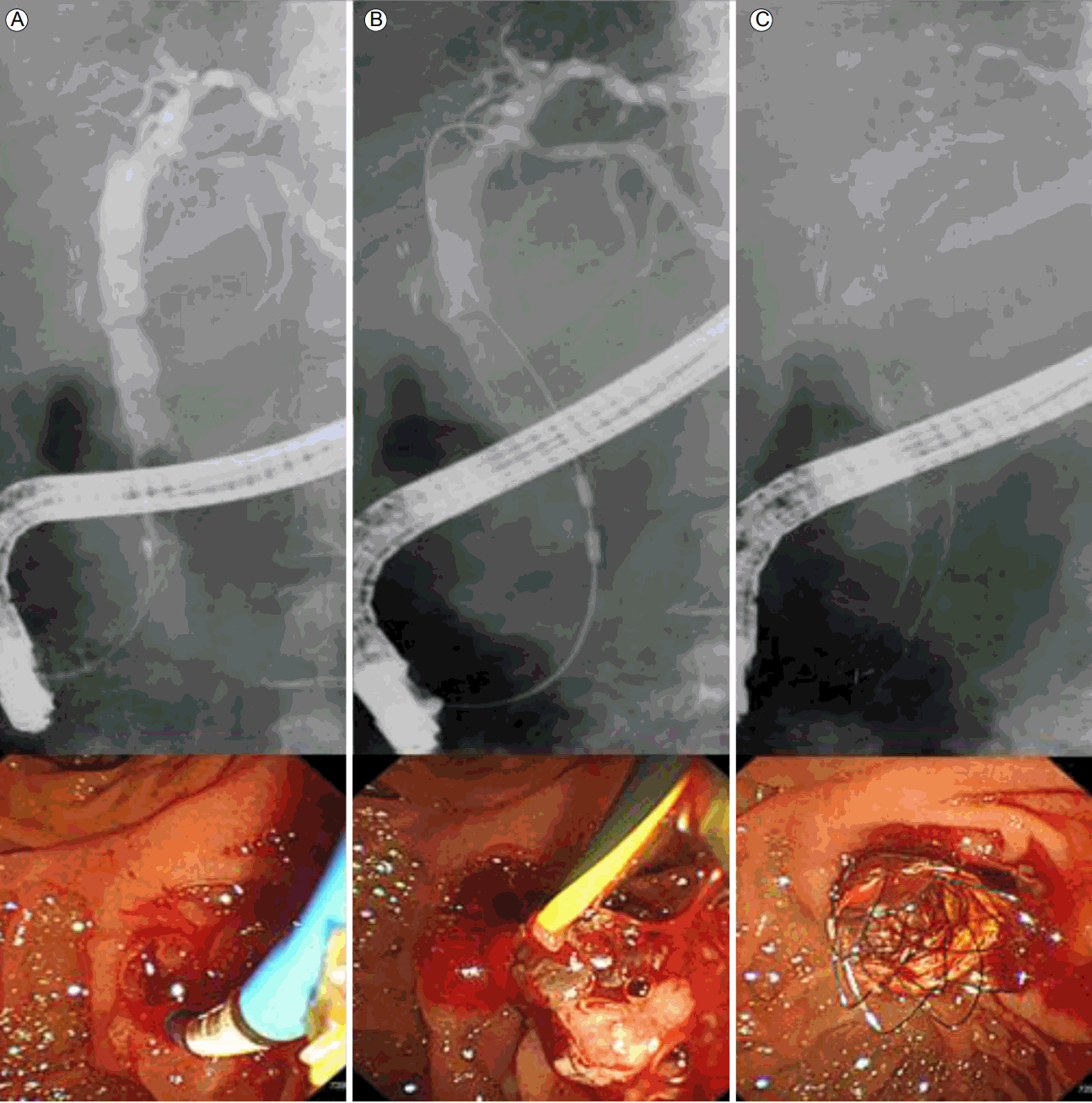
Figure┬Ā2.
Table┬Ā1.
Results of endobiliary radiofrequency ablation in previous study
| Author | Year | Patient No. | Tumor site | Technical success | Stent | Median stent patency (days) | Median survival (months) | Median No. of RFA sessions | Complications No. (%) |
|---|---|---|---|---|---|---|---|---|---|
| Steel et al. [10] | 2011 | 22 | Pancreatic cancer 16 | 21 (95.5) | Uncovered SEMS 21 | 114 | 2 | 4/21 (19) | |
| CCa 6 | Cholecystitis 2 | ||||||||
| Pancreatitis 1 | |||||||||
| Rigor 1 | |||||||||
| Tal et al. [12] | 2013 | 12 | Hilar CCa (BŌĆÉIV) 9 | 12 (100) | Plastic stent 12 | 6.4 | 1.5 | 6/12 (50%) | |
| Others 3 | Hemobilia 3 (mortality: 2) | ||||||||
| FigueroaŌĆÉBarojas et al. [6] | 2013 | 20 | CCa 11 | 20 (100) | Uncovered SEMS 1 | 5/20 (25%) | |||
| Pancreatic cancer 7 | Partially/fully covered SEMS 13 | Pancreatitis 1 | |||||||
| Other 2 | Cholecystitis 1 | ||||||||
| Plastic stent 6 | Pain: 5 | ||||||||
| Dolak et al. [5] | 2014 | 58 | Hilar CCa. 45 | 58 (100) | SEMSa 3 | 171 | 10.6 | 1.4 | 11/58 (19%) |
| Others 13 | Plastic stent 19 | Partial liver infarction 1 | |||||||
| No stent 4 | Hemobilia 3 | ||||||||
| GB empyema 1 | |||||||||
| Cholangitis 5 | |||||||||
| Sepsis 2 | |||||||||
| Hepatic coma 1 | |||||||||
| LBBB 1 | |||||||||
| Alis et al. [4] | 2013 | 17 | CCa (lesion unspecified) | 10 (58.8)b | Fully covered SEMS 10 | 270 | 3 | 3/10 (30%) | |
| Pancreatitis: 2 | |||||||||
| Strand et al. [11] | 2014 | 16 | CCa (hilar 13) | 10 (100) | Plastic stent 15 | 9.6 | 1.19 | ||
| Fully covered SMES 5 | |||||||||
| Uncovered SEMS 2 | |||||||||
| Sharaiha et al. [9] | 2014 | 26 | CCa 18 | 26 (100) | Uncovered SEMS 7 | 5.9 | 5/26 (19.2%) | ||
| Pancreatic cancer 8 | Covered SEMS 8 | Pancreatitis 1 | |||||||
| Plastic stent 11 | Cholangitis 1 | ||||||||
| Kallis et al. [18] | 2015 | 23 | Unresectable pancreatic cancer | 23 (100) | Uncovered SEMS 23 | 324 | 7.5 | 2/23 (8.7%) | |
| Hyperamylasemia 1 | |||||||||
| Cholangitis 1 | |||||||||
| Sharaiha et al. [19] | 2015 | 69 | CCa 45 | 69 (100) | SEMS 49 | 11.5 | 1.4 | 7/69 (10.1%) | |
| Pancreatic cancer 19 | Plastic stent 20 | PEP 1 | |||||||
| GB cancer 2 | Cholecystitis 2 | ||||||||
| Other 4 | Hemobilia 2 | ||||||||
| Mild abdominal pain 3 | |||||||||
| Laquiere et al. [8] | 2015 | 12 | 12 Cca (Hilar CCa. BŌĆÉI 4, BŌĆÉII 3, BŌĆÉIII 2, BŌĆÉIV 3) | 12 (100) | SEMS or plastic stent | 12.3 | 1.63 (1ŌĆÉ3) | 2/12 (16.7%) | |
| Sepsis: 1 | |||||||||
| Cholangitis: 1 | |||||||||
| Laleman et al. [7] | 2017 | 18 | Pancreatic cancer 7 | Distal: fully covered SEMS | 110 days | 7.6 | 1 | 6/18 (30%) | |
| Distal CCa 2 | Hilar: plastic or uncovered SEMS | ŌĆÉ Distal 187 | Mild cholangitis 4 | ||||||
| Hilar CCa 9 (Hilar CCa. BŌĆÉIII 6, BŌĆÉIV 3) | ŌĆÉ Hilar 139 | Mild PEP 2c |
Values are presented as number (%).
RFA, radiofrequency ablation; CCa, cholangiocarcinoma; SEMS, selfŌĆÉexpandable metallic stent; LBBB, left bundle branch block; PEP: postŌĆÉERCP pancreatitis.
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 9,147 View
- 319 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



