서 론
갈색세포종은 부신 수질의 크롬친화 세포에서 유래하는 종양으로, 카테콜아민을 분비하는 종양이며, 과도한 혈중 카테콜아민 분비로 인해 고혈압과 빈맥, 발한, 두통 등의 임상 양상을 나타낸다[1,2]. 갈색세포종에 의한 심혈관계 임상 양상 중에서 고혈압이 그 빈도가 95% 내외로 가장 흔하며, 치료가 가능한 고혈압 중 하나로 알려져 있다[1-3].
본 저자들은 고혈압 및 급성 대동맥 박리로 내원한 53세 남자에서 갈색세포종이 동반된 경우를 경험하였기에 문헌고찰과 함께 보고하고자 한다.
증 례
53세 남자가 내원 당일 발생한 배부통을 주소로 병원에 방문하였다. 환자는 내원 2년 전 고혈압을 진단받았으나 투약하지 않았다.
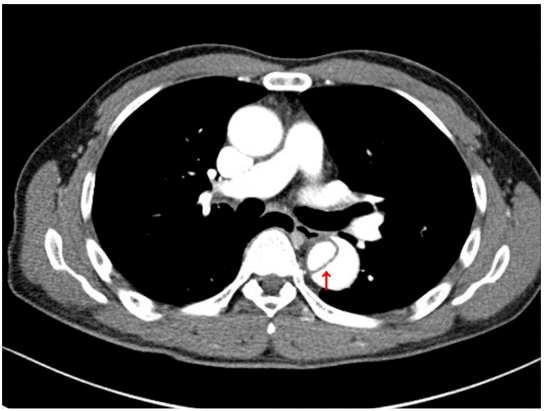
1차 입원 당시 활력 징후는 혈압 195/112 mmHg, 심박수 분당 72회, 호흡수 분당 12회, 체온 36.6도였다. 급성 대동맥 박리 등을 배제하기 위해 시행한 흉복부 전산화단층촬영 혈관조영술상, 하행 흉부 대동맥에서 기시하여 복부 대동맥을 거쳐 양측 장골 동맥까지 진행한 B형 대동맥 박리가 있었고(Fig. 1), 우측 신장 동맥에서는 협착으로 인한 관류 저하가 의심되었다. 그리고 신장 스캔(renal diethylenetriamine pentaacetic acid scan) 결과에서는 우측 신장의 관류 지연이 확인되었으며, 족관절 상완 혈압비(ankle brachial index)는 0.99/0.99였다.
상기와 같이 진단된 B형 대동맥 박리에 대해 우선 분당 심박수 60회 내외를 목표로 하여 정맥주사용 베타차단제(labetalol)를 사용하였고, 심박수가 분당 60회 가까이 조절된 이후에는 수축기압 120 mmHg 이하를 목표로 하여 안지오텐신 수용체 차단제(losartan 50 mg/day)와 함께 정맥주사용 칼슘 채널 차단제(nicardipine)를 시작하였다. 이후 맥박수 조절은 분당 심박수 60회 내외를 목표로 보면서 정맥주사용 베타차단제(labetaolol)을 대신하여 경구용 베타차단제(carvedilol 25 mg 하루 2회 복용)로 조절하였다.
이어서 수축기압 120 mmHg 이하를 유지하기 위해 경구용 안지오텐신 수용체 차단제(losartan 50 mg/day)와 경구용 칼슘 채널 차단제(amlodipine 10 mg/day) 복용을 시작하였고, 수축기압이 100-120 mmHg로 유지되는 것을 보면서 정맥주사용 칼슘 채널 차단제(nicardipine)는 종결하였다. 이후 경과 중 혈압이 140/80 mmHg까지 상승하는 경향을 보여 안지오텐신 수용체 차단제를 기존의 로사탄(losartan 50 mg/day) 대신 발사탄(valsartan 160 mg/day)으로 바꾸고, 티아지드(thiazide 25 mg/day) 및 스피로노락톤(spironolactone 25 mg/day) 등 이뇨제를 추가하여 수축기 혈압을 조절하였다.
입원 초기에는 내과적 치료에 혈압과 맥박수가 조절되고 통증도 호전되는 양상을 보여 경과를 지켜보았다. 하지만 통증이 입원 당시에 비해서는 심하지 않으나 입원 7일째부터 재발되는 경향을 보였고, 내원 당일 1.21 mg/dL였던 크레아티닌 수치도 2일 후에는 1.39 mg/dL로 소폭 상승하는 등 우측 신장 동맥 혈류 장애가 의심되었다. 이처럼 합병증이 동반된 B형 대동맥 박리의 임상 소견이 의심되면서, 입원 10일째 대동맥 스텐트 삽입술(thoracic endovascular aortic aneurysm repair) 및 우측 신장 동맥 스텐트 삽입술을 계획하게 되었다.
스텐트 삽입술을 진행하기에 앞서 아스피린(aspirin 300 mg), 클로피도그렐(clopidogrel 300 mg)을 투약하였고, 시술 직전에는 헤파린(heparin)을 정맥주사하였다. 대동맥 스텐트 삽입술을 위해서 우선 우측 대퇴동맥을 통해 가이드 와이어를 흉부 대동맥까지 진입시켰고, 이를 통해 Zenith 28-32 mm × 200 mm (Cook medical, Bloomington, IN, USA)를 좌측 쇄골하 동맥의 직하방에 위치시켰다(zone 3). 이를 통해 좌측 쇄골하 동맥 시작부로부터 4 cm 떨어진 하행 흉부 대동맥(mid descending thoracic aorta)에 있던 내막 파열(intimal tear) 부위를 덮을 수 있었다. 시술 이후 누출(endo-leak) 등의 소견은 없었고, 하지 마비 등의 합병증도 없었다. 혈관조영술 상에서 폐쇄 소견을 보인 우측 신장 동맥에 대하여서는 우측 대퇴동맥을 통해 우측 신장 동맥에 접근 후, 자가 팽창 가능한(self-expandable) Absolute pro 5 mm × 40 mm (Abbott Laboratories, Abbott Park, IL, USA)를 삽입하였다. 삽입 직후 보조풍선요법(adjuvant ballooning)하였고, 혈류 흐름이 회복된 것을 확인하였다. 상환에 대해 시술 이후 아스피린(aspirin 100 mg/day) 및 클로피도그렐(clopidogrel 75 mg/day) 사용을 시작하였다. 시술 이후 통증은 호전되었고 크레아티닌 수치도 시술 1일 후 1.10 mg/dL로 감소하였다.
한편 50대에 처음 발생한 고혈압에 대해 2차성 고혈압 가능성이 있을 수 있다고 보고, 관련 검사들을 진행하였다. 그리고 그 결과는 추후 외래에서 확인하기로 하고, 혈압과 맥박수 등이 안정화된 상태에서 1차 입원 16일째에 퇴원하였다. 퇴원 전에 이전의 흉복부 전산화단층촬영 혈관조영술 판독 소견을 다시 보았으나 부신내 종양에 대한 언급은 없었다.
환자는 1차 퇴원 이후 경과 중 상복부을 콕콕 쑤시는 듯한 불편감을 주소로 본원 응급실을 내원하였다. 응급실에서 시행한 신체 검사에서 혈압 180/70 mmHg의 고혈압 소견을 보여, 이전 병력 고려하여 혈압 및 맥박수 등 조절 목적으로 2차 입원하였다. 입원하면서 다시 촬영한 흉복부 전산화단층촬영 혈관조영술에서 대동맥 박리의 진행은 없었다. 재발한 고혈압에 대하여 이전 입원 중에 시행하였던 2차성 고혈압 배제를 위한 혈액 및 소변 검사 결과를 확인하였다. 그 결과 24시간 소변 메타네프린은 0.9 mg/day (0-0.8), 24시간 소변 vanillylmandelic acid는 10.1 mg/day (0-8)로 상승된 소견을 보였다. 혈장 2분획 메타네프린 검사에서는 혈장 메타네프린이 0.25 nmol/L (< 0.5)로 정상 범주였으나, 혈장 노르메타네프린은 1.05 nmol/L (< 0.9)로 상승되었다. 24시간 소변 에피네프린과 노르에피네프린은 각각 18.0 ug/day (0-20), 65.3 ug/day (15-80)로 측정되었다. 상기 혈액 검사 결과를 바탕으로 갈색세포종을 의심하였고, 이를 명확히 하기 위해 부신 전산화단층촬영을 진행하였다. 검사 결과, 좌측 부신의 선종성 과형성(adenomatous hyperplasia) 소견이 확인되었다(Fig. 2).
본 증례에서는 좌측 부신의 크기가 1.1 cm 내외로 전형적인 갈색세포종의 크기에 비해 작았고, 부신의 형태를 따라서 연조직(soft tissue)이 대칭적으로 두꺼워진 형태를 가지는 등 전형적인 갈색세포종과는 거리가 있었다. 이에 비조영기 및 동맥기 영상만 포함되어 있어 갈색세포종의 특징 중 하나인 조영제의 지연 배출 등을 확인할 수 없는 흉복부 전산화단층 혈관촬영술만 가지고는 대동맥 박리 등 심혈관 상태를 진단하는 것 이외에 갈색세포종을 1차 입원 당시에 의심하기란 매우 어려웠으리라 생각된다.
한편 갈색세포종과 동반 가능한 내분비 질환을 배제하기 위해 갑상선 기능 검사 및 갑상선 초음파, parathyroid hormone, IGF-1, prolactin, adrenocorticotropic hormone, cortisol, calcium 수치 검사 등을 시행하였고 모두 정상이었다.
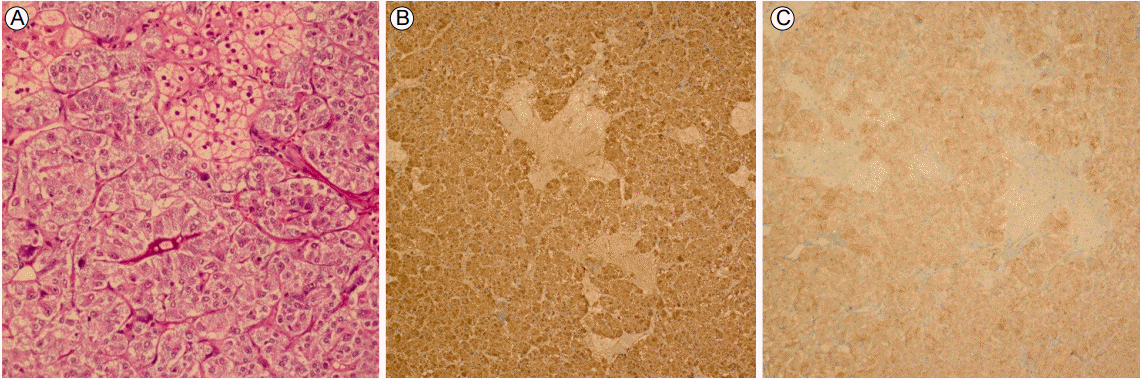
환자는 알파차단제(doxazocin 8 mg/day)를 2주 이상 투여받은 후, 혈압 120/70 mmHg, 맥박수 분당 62회의 안정된 상태에서 수술 5일 전 아스피린, 클로피도그렐 등은 중단된 상태에서 입원 20일째 개복하 좌측 부신절제술을 시행받았다. 아스피린과 클로피도그렐 중단 기간 동안에는 지속 정맥주사용 헤파린을 유지하였다. 수술 이후 부신 종양 조직검사상, 세포의 크기와 형태는 다양하였고, 풍부한 과립 모양세포질과 타원 내지 원형의 세포핵 소견을 보였다. 면역 조직 화학염색에서는 chromogranin (+), S-100 (+, weakly), synaptophsin (+), Ki-67 (-), CK (-) 소견을 나타내어 갈색세포종으로 최종 진단되었다(Fig. 3). 수술이 끝나고 2일이 경과하여 수술 창상 등 상태가 호전되고, 출혈 등이 없는 것을 확인한 상태에서 아스피린(aspirin 100 mg/day)과 클로피도그렐(clopidogrel 75 mg/day) 복용을 재개하였다. 이후 혈압 및 맥박이 안정화된 상태에서 수술 끝난 지 10일째에 퇴원하였다.
고 찰
갈색세포종은 카테콜아민 분비를 특징으로 하는 부신 종양으로, 연간 100만 명당 2-8명 정도만 발생하는 것으로 알려진 드문 질환이다. 하지만 30대에서 50대 사이의 환자를 대상으로 한 2차성 고혈압 검사에서는 유병률이 0.2-0.6%로 추정되는 고혈압의 한 원인이다[1,3]. 이 종양이 분비하는 카테콜아민은 두통, 빈맥, 식은땀, 고혈압 및 심근경색, 부정맥, 뇌경색 등의 증상을 일으킬 수 있는데 그중에서도 고혈압을 가장 흔하게 일으킨다[1,3].
갈색세포종에 의한 고혈압은 전체 환자의 80-90% 내외에서 발생하며, 이 중 절반은 지속성 고혈압(sustained hypertension) 양상을, 약 45%는 간헐적 고혈압(paroxysmal hypertension) 양상을 나타낸다[1]. 지속성 고혈압을 나타내는 환자의 경우, 노르에피네프린과 에피네프린의 혈중 농도가 정상 상한치의 5-10배 가량으로 높은 반면에, 정상 혈압을 보이는 경우는 혈중 카테콜아민 수치가 이에 비해서는 상대적으로 낮은 편이다[1]. 한편 간헐적인 고혈압 양상은 주로 혈중 에피네프린 농도가 높을 경우 나타나며, 이는 multiple endocrine neoplasia (MEN)-2 연관 갈색세포종에 특징적이다[1].
임상에서 심계항진과 두통, 발한 등의 3가지 전형적인 증상에 고혈압이 동반된다면, 갈색세포종을 강력히 의심해야 한다[3]. 하지만, 본 증례와 같이 전형적인 증상 없이 고혈압 및 대동맥 박리를 주소로 내원하는 경우, 갈색세포종을 의심하기란 쉽지 않다. 대동맥 박리의 주요 임상상 중 하나가 조절되지 않는 고혈압이기 때문이다.
서론에 기술한대로 갈색세포종의 심혈관계 임상 양상 가운데 고혈압은 흔하게 발생된다고 알려져 있으나, 갈색세포종과 관련한 급성 대동맥 박리 자체의 발생 빈도는 매우 낮게 보고되고 있다[4,5]. 따라서 급성 대동맥 박리 환자의 치료 계획 수립에 갈색세포종의 가능성을 염두 하기란 현실적으로 어렵다. 대동맥 박리의 내과적 치료 원칙은 혈압 및 맥박수의 조절이며, 이를 위해 거의 대부분의 경우 베타차단제가 사용된다[6]. 하지만 갈색세포종에서 10-14일의 충분한 알파 수용체 차단 없이 베타차단제를 사용할 경우, 베타 수용체 매개에 의한 혈관 이완을 차단시켜 고혈압이 악화될 수 있다[7].
갈색세포종과 대동맥 박리는 내과적 치료 방침이 상충되기 때문에, 갈색세포종이 동반된 대동맥 박리는 빠른 진단만이 예후를 호전시킬 수 있다.
본 증례에 있어서, 갈색세포종의 존재를 먼저 알았다면 종양 수술의 시기가 그 만큼 앞당겨질 수는 있었겠다. 하지만 대동맥 박리와 함께 갈색세포종을 동시에 발견하였다 해도 대동맥 박리에 대한 치료 원칙은 달라지지 않는다. 합병증이 없는 대동맥 박리는 약물을 통한 혈압 및 맥박수 조절이 우선적 치료이고, 지속적이거나 재발하는 통증, 조직 관류 저하(malperfusion) 등의 합병증이 동반될 때는 대동맥 스텐트 삽입술 등을 고려할 수 있다.
다만, 약물 치료에 있어서 대동맥 박리와 함께 갈색세포종의 존재를 동시에 인지한 경우에는 doxazocin과 같은 알파 차단제를 보다 조기에 투약하였을 것이다. 이 때문에 대동맥 박리 환자에 있어 갈색세포종을 적극적으로 배제하려는 노력이 필요하다.
갈색세포종이 만들어내는 카테콜아민에는 노르에피네프린, 에피네프린, 도파민 등이 있다. 이들 중에서 갈색세포종을 진단하는데 있어 소변 혹은 혈장의 증가된 카테콜아민 및 메타네프린이 등이 유용하게 쓰일 수 있다. 진단을 위한 여러 생화학적 검사 방법들이 있을 수 있는데, 이 가운데 혈장 유리 메타네프린 혹은 소변 분획 메타네프린이 보편적으로 권고되는 검사다[8]. 아울러, 갈색세포종과 동반되어 MEN type 2A, 2B 및 von Hippel-Lindau syndrome, neurofibromatosis type 1이 나타날 수 있기 때문에 진단 과정에서 함께 고려하는 것이 필요하다[8].
갈색세포종의 영상의학적 진단은 전산화단층촬영이 흉복부 및 골반 등을 평가하는데 있어 공간 해상도가 가장 우수하기에 우선적으로 권고된다[8].
부신 종양 감별을 위한 부신 조영 전산화단층촬영의 경우 비조영, 동맥기, 지연기의 영상이 있어야 하며, computed tomography 촬영 간격은 최소 3-5 mm 정도는 되어야 부신 종양 진단에 적합하다 할 수 있다[9].




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






