 |
 |
| Korean J Med > Volume 91(2); 2016 > Article |
|
žöĒžēĹ
ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžĚÄ Žß§žöį ŽďúŽ¨ľŽ©į žĚľŽįėž†ĀžĚł žúĄžĄ†žēĒžóź ŽĻĄŪēī žėąŪõĄÍįÄ Ž∂ąŽüČŪēėŽč§. žßĄŽč® ŽčĻžčú Ž¶ľŪĒĄž†ą ž†ĄžĚī ŽįŹ ÍįĄ ž†ĄžĚīŽ•ľ ŽŹôŽįėŪēú Í≤ĹžöįÍįÄ ŽßéžēĄ žīąžĻėŽ£ĆŽ°ú Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžĚĄ žčúŪĖČŪēėŽäĒ Í≤ĹžöįÍįÄ ŽßéžßÄŽßĆ ŪėĄžě¨ÍĻĆžßÄ ž†ēŽ¶ĹŽźú Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžĚÄ ž†úžčúŽźú ŽįĒ žóÜŽč§. ŽėźŪēú Ž¨łŪóĆ Ž≥īÍ≥†žóź ŽĒįŽ•īŽ©ī Í∑ł Ūö®Í≥ľÍįÄ žúĄžĄ†žēĒžóź ŽĻĄŪēī žĘčžßÄ žēäŽč§. Ž≥ł ž¶ĚŽ°ÄŽäĒ ÍĶ≠ŽāīžóźžĄú HER2 žĖĎžĄĪžĚĄ Ž≥īžĚł ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžĚė ž≤ę ž¶ĚŽ°ÄžĚīŽč§. Íłįž°ī Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžóź HER2 ŪĎúž†ĀžĻėŽ£Ćž†úžĚł trastuzumabžĚĄ ž∂ĒÍįÄŪēėžó¨ žā¨žö©ŪēėžėÄÍ≥† ŪėĄžě¨ Ž≥ĶŽ∂Ä ž†ĄžāįŪôĒŽč®žłĶžī¨žėĀ ŽįŹ AFP Í≤Äžā¨žÉĀ Ūėłž†Ą žÜĆÍ≤¨žĚĄ Ž≥īžĚīÍ≥† žěąŽč§.
Abstract
Gastric hepatoid adenocarcinoma is a rare adenocarcinoma that develops in the stomach. The prognosis of gastric hepatoid adenocarcinoma is poorer than that of ordinary gastric adenocarcinoma. Here, we report the first case of human epidermal growth factor receptor 2 (HER2)-positive gastric hepatoid adenocarcinoma in Korea. A 57-year-old male presented with abdominal distension and underwent endoscopic gastric biopsy and percutaneous core needle liver biopsy. The pathological findings were consistent with HER2-positive gastric hepatoid adenocarcinoma. He received six cycles of chemotherapy with cisplatin-capecitabine plus trastuzumab, which is a HER2 targeted agent. After chemotherapy, a follow-up abdominal computed tomography scan showed a partial tumor response. This case emphasizes the importance of using trastuzumab in a patient with HER2-positive gastric hepatoid adenocarcinoma.
ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒ(hepatoid gastric adenocarcinoma)žĚÄ 1985ŽÖĄ Ishikura ŽďĪ[1]žóź žĚėŪēī Ž™ÖŽ™ÖŽźźžúľŽ©į ÍįĄžĄłŪŹ¨žĖĎ Ž∂ĄŪôĒžôÄ žēĆŪĆĆŪÉúžēĄŽč®ŽįĪ(Alphafetoprotein, AFP)žĚĄ žÉĚžĄĪŪēėŽäĒ ŪäĻžßēžĚĄ ÍįĞߥŽč§. ŪõĄžóź Žč§žčú Ishikura ŽďĪ[1]žĚÄ AFPŽ•ľ žÉĚžĄĪŪēėžßÄ žēäŽäĒ ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžĚĄ Ž≥īÍ≥†ŪēėžėÄžúľŽ©į ŪėĄžě¨ žßĄŽč®žĚÄ Ūėąž§Ď AFP žł°ž†ēžĻėŽ≥īŽč§ŽäĒ ž°įžßĀŪēôž†Ā ŪäĻžßēžóź ÍłįŽįėŪēėžó¨ žĚīŽ£®žĖīžßÄÍ≥† žěąŽč§[2]. ž†Ąž≤ī žúĄžēĒžĚė 0.38-1%Ž•ľ žį®žßÄŪēėŽäĒ Í≤ÉžúľŽ°ú Ž≥īÍ≥†ŽźėžóąžúľŽ©į, žßĄŪĖČŽźú žÉĀŪÉúžóźžĄú žßĄŽč®ŽźėŽäĒ Í≤ĹžöįÍįÄ ŽßéÍ≥† ÍłįŪÉÄ žúĄžēĒžóź ŽĻĄŪēī Ž∂ąŽüČŪēú žėąŪõĄŽ•ľ Ž≥īžĚłŽč§. ŪėĄžě¨ žßĄŪĖČŪēú ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžóź ŽĆÄŪēú Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžĚÄ ž†ēŽ¶ĹŽźú ŽįĒÍįÄ žóÜŽč§. žĚľŽįėž†ĀžĚł žúĄžĄ†žēĒžĚÄ 5-fluorouracil, cisplatin Ž≥Ďžö©žöĒŽ≤ēžĚĄ ž£ľŽ°ú žā¨žö©ŪēėÍ≥† žěąžúľŽ©į Kang ŽďĪ[3]žĚī Ž≥īÍ≥†Ūēú ŽįĒžóź ŽĒįŽ•īŽ©ī capecitabineÍ≥ľ cisplatin Ž≥Ďžö©žöĒŽ≤ē žó≠žčú ŽßĆž°Īžä§Žü¨žöī žĻėŽ£Ć Ūö®Í≥ľŽ•ľ Ž≥īžó¨ ŽßéžĚī žā¨žö©ŽźėÍ≥† žěąŽč§. ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒ ž§Ď žĚłÍįĄžÉĀŪĒľž¶Ěžč̞̳žěźžąėžö©ž≤ī2 (human epidermal growth factor receptor type 2, HER2) žĖĎžĄĪžúľŽ°ú trastuzumabžĚĄ ŪÜĶŪēī žĻėŽ£ĆŪēú ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžĚė ÍįĄ ž†ĄžĚī 1žėąŽ•ľ Í≤ĹŪóėŪēėžėÄÍłįžóź Ž¨łŪóĆÍ≥†žįįÍ≥ľ Ūē®ÍĽė Ž≥īÍ≥†ŪēėŽäĒ ŽįĒžĚīŽč§.
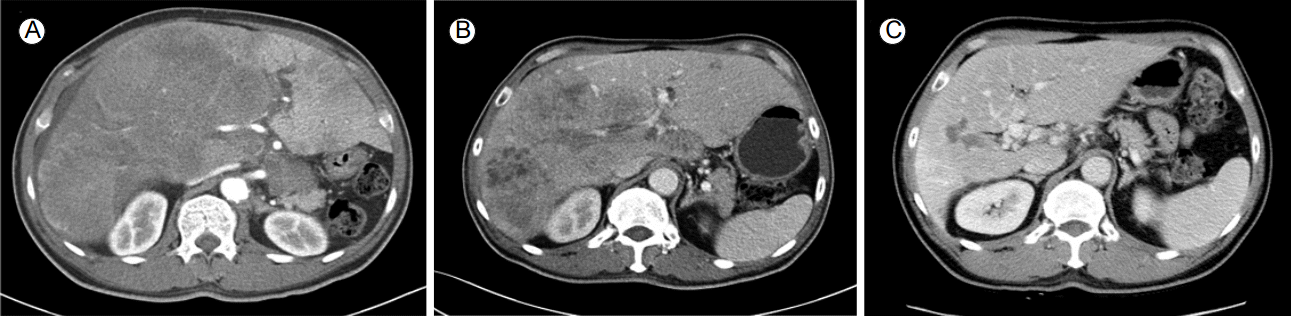
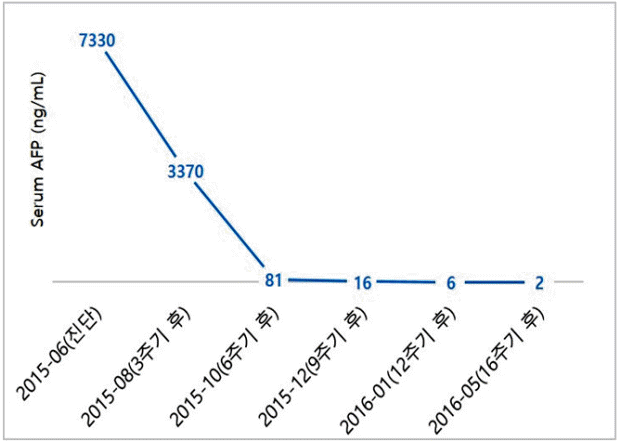
57žĄł Žā®žěźÍįÄ Žāīžõź 10žĚľ ž†ĄŽ∂ÄŪĄį Ž≥ĶŽ∂Ä ŪĆĹŽßĆÍįźžĚī ŽįúžÉĚŪēėžó¨ ŪÉÄ Ž≥ĎžõźžóźžĄú žčúŪĖČŪēú Ž≥ĶŽ∂Ä žīąžĚĆŪĆƞ󟞥ú ÍįĄŽāī žĘÖÍīīÍįÄ ÍīÄžįįŽźėžĖī ŽāīžõźŪēėžėÄŽč§. ŪôúŽ†• žßēŪõĄŽäĒ Ūėąžēē 140/90 mmHg, Žß•Žįē 98ŪöĆ/Ž∂Ą, ŪėłŪĚ° 18ŪöĆ/Ž∂Ą, ž≤īžė® 36.4‚ĄÉžėÄžúľŽ©į Í≥†ŪėąžēēžúľŽ°ú žĚīžóź ŽĆÄŪēú žēĹŽ¨ľ žā¨žö© ž§ĎžĚīžóąÍ≥† žĚīžôłžóź ÍłįŪÉÄ Í≥ľÍĪįŽ†• ŽįŹ žēĹŽ¨ľ Ž≥Ķžö©Ž†•žĚÄ žóÜžóąŽč§. žč†ž≤ī Í≤ĞߥžóźžĄú ž†Ąžč† žÉĀŪÉúŽäĒ ÍĪīÍįēŪēī Ž≥īžėÄÍ≥† žĚėžčĚžĚÄ Ž™ÖŽ£ĆŪēėžėÄŽč§. ŽĎźÍ≤ĹŽ∂Ä, ŪĚČŽ∂Ä žßĄžįįžóźžĄú ŪäĻžĚī žÜĆÍ≤¨žĚÄ žóÜžóąžúľŽ©į Ž≥ĶŽ∂Ä žßĄžįįžÉĀ Ž≥ĶŽ∂Ä ŪĆĹŽßĆžĚī ŪôēžĚłŽźėžóąŽč§. Žßźžīą Ūėąžē° Í≤Äžā¨žóźžĄú ŽįĪŪėąÍĶ¨ 7,600/mm3, ŪėąžÉČžÜĆ 9.5 g/dL, ŪėąžÜĆŪĆź 581,000/mm3žėÄÍ≥†, Ūėąž≤≠ žÉĚŪôĒŪēô Í≤Äžā¨žóźžĄú žīĚ Žč®ŽįĪ 6.4g/dL, žēĆŽ∂ÄŽĮľ 2.5 g/dL, žīĚ ŽĻĆŽ¶¨Ž£®ŽĻą 3.4 mg/dL, žßĀž†ĎŽĻĆŽ¶¨Ž£®ŽĻą 3.2 mg/dL, AST 210 IU/L, ALT 164 IU/L, ALP 1,017 IU/L, gamma glutamyl transpeptidase 714 IU/LžėÄŽč§. žĘÖžĖĎ ŪĎúžßÄžěź Í≤Äžā¨žóźžĄúŽäĒ AFP 7,330 ng/mL, proteins induced by vitamin K absence or antagonist-II test (PIVKA-II) 147 mAu/mL, carcinoembryonic antigen (CEA) 3,869 ng/mL, carbohydrate antigen 19-9 (CA 19-9) 128 U/mLžėÄŽč§. BŪėē ÍįĄžóľ ŪĎúŽ©īŪē≠žõźžĚÄ žĚĆžĄĪžĚīžóąÍ≥† ŪĎúŽ©īŪē≠ž≤ī žĖĎžĄĪžĚīžóąžúľŽ©į CŪėē ÍįĄžóľ Ūē≠ž≤ī žĄ†Ž≥Ą Í≤Äžā¨ žĚĆžĄĪžĚīžóąŽč§. Ž≥ĶŽ∂Ä ž†ĄžāįŪôĒŽč®žłĶžī¨žėĀžóźžĄú ÍįĄ Ž¨łŽß•žĚė žĘÖžĖĎ Ūėąž†ĄžĚĄ ŽŹôŽįėŪēú ÍĪįŽĆÄ Žč§Í≤įž†ąžĄĪ žĘÖÍīīÍįÄ ÍīÄžįįŽźėžóąÍ≥† ŽöúŽ†∑Ūēú ŽŹôŽß•Íłį ž°įžėĀ ž¶ĚÍįÄ ŪėĻžĚÄ Ž¨łŽß•Íłį ž°įžėĀ ÍįźžÜĆŽ•ľ Ž≥īžĚīžßÄŽäĒ žēäžēėŽč§. žúĄŪēėŽ∂Ä ž≤īŽ≤ĹžĚė Ž∂ąÍ∑úžĻôŪēú ŽĻĄŪõĄŽ•ľ Ž≥īžėÄžúľŽ©į ž£ľŽ≥ÄŽ∂Ä Ž¶ľŪĒĄž†ą žĘÖŽĆÄÍįÄ ÍīÄžįįŽźėžóąŽč§. ž†Ąžč† žĖĎž†ĄžěźŽč®žłĶžī¨žėĀžóźžĄú ÍįĄŽāī Í∑łŽ¶¨Í≥† žúĄž†Ąž†ēŽ∂Äžóź ŽĆÄžā¨ÍįÄ ž¶ĚÍįÄŽźú Ž≥ĎŽ≥ÄžĚī ŪôēžĚłŽźėžĖī žēÖžĄĪ žĘÖžĖĎžĚī žĚėžč¨ŽźėžóąÍ≥† žúĄ ž£ľŽ≥Ä Žč§žąėžĚė ž†ĄžĚīžĄĪ Ž¶ľŪĒĄž†ąžĚī ÍīÄžįįŽźėžóąŽč§. žčĚŽŹĄžúĄŽāīžčúÍ≤Ş󟞥úŽäĒ žúĄž†Ąž†ēŽ∂Ä 3 cm ŪĀ¨ÍłįžĚė Í∂§žĖĎžĄĪ žĘÖÍīīÍįÄ ŪôēžĚłŽźėžĖī ž°įžßĀÍ≤Äžā¨Ž•ľ žčúŪĖČŪēėžėÄÍ≥†(Fig. 1), ÍįĄŽāī žĘÖÍīīžóź ŽĆÄŪēėžó¨ ž§Ďžč¨ŽįĒŽäėžÉĚÍ≤Ğ̥ žčúŪĖČŪēėžėÄŽč§. ÍįĄžĘÖÍīīžĚė ž§Ďžč¨ŽįĒŽäėžÉĚÍ≤Ä ž°įžßĀžĚė ŪėĄŽĮłÍ≤Ĺ žÜĆÍ≤¨žĚÄ, ž†ÄŽ∂ĄŪôĒžĚė žēÖžĄĪ žč†žÉĚŽ¨ľŽ°ú ÍįĄžĄłŪŹ¨žĖĎ Ž∂ĄŪôĒžôÄ žÉė Ž∂ĄŪôĒÍįÄ Ūē®ÍĽė ÍīÄžįįŽźėžóąžúľŽ©į(Fig. 2), žúĄ ŽāīžčúÍ≤Ĺ žÉĚÍ≤Äž°įžßĀžóźžĄúŽäĒ ž†ÄŽ∂ĄŪôĒžĚė ÍįĄžĄłŪŹ¨žĖĎ žēĒžĘÖžĚī ÍīÄžįįŽźėžóąŽč§(Fig. 3). ÍįĄ žÉĚÍ≤Äž°įžßĀžĚė ÍįĄžĄłŪŹ¨žĖĎ Ž∂ĄŪôĒŽ•ľ Ž≥īžĚīŽäĒ Ž∂ÄŽ∂ĄÍ≥ľ žúĄ žÉĚÍ≤Äž°įžßĀžĚė ž†ÄŽ∂ĄŪôĒ žēĒžĘÖžĚÄ AFP Ž©īžó≠ž°įžßĀŪôĒŪēôžóľžÉȞ󟞥ú žĖĎžĄĪ žÜĆÍ≤¨žĚĄ Ž≥īžėÄŽč§. ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžĚė ÍįĄ ž†ĄžĚīŽ°ú žĶúžĘÖ žßĄŽč®ŽźėžóąŽč§. žúĄŽāīžčúÍ≤Ĺ žÉĚÍ≤Äž°įžßĀ ŽįŹ ÍįĄ žÉĚÍ≤Äž°įžßĀžóźžĄú ž∂ĒÍįÄŽ°ú žčúŪĖČŪēú HER2 Ž©īžó≠ž°įžßĀŪôĒŪēô žóľžÉȞ󟞥ú ÍįēžĖĎžĄĪžĚī ŪôēžĚłŽźėžóąŽč§. ÍįĄ ž†ĄžĚīŽ•ľ ŽŹôŽįėŪēú ŪôėžěźŽ°ú cisplatin, capecitabinežóź trastuzumabžĚĄ ž∂ĒÍįÄŪēėžó¨ Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžĚĄ 3ž£ľ ÍįĄÍ≤©žúľŽ°ú žčúŪĖČŪēėžėÄÍ≥† 2Žč¨ ÍįĄÍ≤©žúľŽ°ú Ž≥ĶŽ∂Ä ž†ĄžāįŪôĒŽč®žłĶžī¨žėĀžĚĄ ž∂Ēž†Ā ÍīÄžįįŪēėžėÄŽč§. Ūē≠žēĒŪôĒŪēô žĻėŽ£ĆŽ•ľ žčúŪĖČŪēėŽäĒ ŽŹôžēą 10ž£ľÍłį žĚīŪõĄ 2Žč®Í≥ĄžĚė Žßźžīąžč†Í≤ĹŽ≥Ďž¶ĚžĚī ŽįúžÉĚŪēėžó¨ cisplatinžĚĄ ž§ĎŽč®ŪēėžėÄžúľŽ©į capecitabine ŽįŹ trastuzumabžĚÄ ÍįźŽüČ ŽėźŽäĒ ž§ĎŽč® žóÜžĚī žú†žßÄŪēėžėÄŽč§. žĻėŽ£Ć Íįúžčú ž†ĄŪõĄ Í≤ĆžĚīŪ䳞訞ě•Ūėąžē°ŪíĞ䧞ļĒžĚĄ žčúŪĖČŪēėžėÄÍ≥† žč¨žě•ŽŹÖžĄĪžĚÄ ŪôēžĚłŽźėžßÄ žēäžēėŽč§. žīĚ 16ž£ľÍłįžĚė Ūē≠žēĒŪôĒŪēô žĻėŽ£ĆŽ•ľ žčúŪĖČŪēėžėÄžúľŽ©į ÍįĄŽāī ž†ĄžĚīžĄĪ žĘÖžĖĎžĚė ŪĀ¨ÍłįÍįÄ Žąąžóź ŽĚĄÍ≤Ć ÍįźžÜĆŪēėžėÄÍ≥† 1ŽÖĄ žĚīžÉĀ Ž¨īžßĄŪĖČ žÉĚž°īžĚĄ žú†žßÄŪēėÍ≥† žěąŽč§(Fig. 4). ŽėźŪēú žīąÍłį 7,330 ng/mLžĚīŽćė AFP žó≠žčú 2 ng/mLÍĻĆžßÄ ÍįźžÜĆŪēėžėÄŽč§(Fig. 5).
ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžĚė ŪŹČÍ∑† ŽįúŽ≥Ď žóįŽ†ĻžĚÄ 63.5žĄłžĚīŽ©į žó¨žĄĪžóź ŽĻĄŪēī Žā®žĄĪžóźžĄú ŪėłŽįúŪēėŽäĒ Í≤ÉžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽč§(2.32:1) [4]. žúĄžóźžĄú ŪėłŽįúŪēėŽ©į(83.9%) ŽčīŽā≠(3.7%), žěźÍ∂Ā(3.2%), ŪŹź(2.3%) Í∑łŽ¶¨Í≥† ŽďúŽ¨ľžßÄŽßĆ žčĚŽŹĄ ŽįŹ Ž≥ĶŽßȞ󟞥úŽŹĄ ŽįúžÉĚŪēúŽč§. žĚľŽįėž†ĀžĚł žúĄžĄ†žēĒžóź ŽĻĄŪēī Ž∂ąŽüČŪēú žėąŪõĄŽ•ľ Ž≥īžĚīŽäĒŽćį Liu ŽďĪ[5]žĚÄ 1ŽÖĄ, 3ŽÖĄ, 5ŽÖĄ žÉĚž°īžú®žĚĄ ÍįĀÍįĀ 53%, 35%, 28%Ž°ú Ž≥īÍ≥†ŪēėžėÄŽč§. žĚīŽäĒ AFPŽ•ľ Ž∂ĄŽĻĄŪēėžßÄ žēäŽäĒ ÍłįŪÉÄ žúĄžēĒžĚė 95%, 57%, 38%Í≥ľ ŽĻĄÍĶźŪēėžó¨ Ž∂ąŽüČŪēėŽč§. ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžĚė žėąŪõĄÍįÄ Ž∂ąŽüČŪēú žĚīžú†žóź ŽĆÄŪēī Ž™á ÍįÄžßÄ ÍįÄžĄ§žĚī ž†úžčúŽźėžóąŽč§. Inagawa ŽďĪ[6]žĚÄ ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžĚī AFPžôÄ ŽćĒŽ∂ąžĖī žēĆŪĆĆ-1 Ūē≠Ū䳎¶Ĺžč† ŽįŹ žēĆŪĆĆ-1 Ūē≠Ūā§Ž™®Ū䳎¶Ĺžč†žĚĄ Ž∂ĄŽĻĄŪēėŽäĒ Í≤ɞ̥ Ž≥īÍ≥†ŪēėžėÄŽč§. žĚī Ž¨ľžßąžĚī Ž©īžó≠ žĖĶž†ú žěĎžö©žĚĄ ŪēėŽ©į Žč®ŽįĪŽ∂ĄŪēīŪö®žÜĆ žĖĶž†úŽ•ľ ŪÜĶŪēī ž£ľžúĄ ž°įžßĀžúľŽ°úžĚė žĻ®Ūą¨žĄĪžĚī ŽÜížēĄžßÄÍ≥† žĚīžóź ŽĒįŽĚľ ž†ēŽß• žĻ®Ž≤ĒžĚī ŽßéžúľŽ©į ŽėźŪēú ÍįĄ ž†ĄžĚīÍįÄ ŪĚĒŪēú Í≤ÉžúľŽ°ú žÉĚÍįĀŽźúŽč§. Ž≥ł ž¶ĚŽ°ÄžóźžĄúŽŹĄ ÍįĄŽ¨łŽß•žĚė žĘÖžĖĎ Ūėąž†ĄžĚĄ ŽŹôŽįėŪēėÍ≥† žěąžóąŽč§. ŽėźŪēú žĻėŽ£Ćž†Ā ž†ąž†úžą†žĚī Ž∂ąÍįÄŽä•Ūēú Í≤Ĺžöį ŽćĒžöĪ Ž∂ąŽüČŪēúŽćį žĚī Í≤Ĺžöį žĚľŽįėž†ĀžĚł žúĄžĄ†žēĒžĚė žÉĚž°ī ž§ĎžēôÍįížĚł 9.3-10.5ÍįúžõĒžĚł Í≤Éžóź ŽĻĄŪēī[3] ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžĚė žÉĚž°ī ž§ĎžēôÍįížĚÄ 2.7-8.0ÍįúžõĒžóź Ž∂ąÍ≥ľŪēėŽč§[4,7]. žąėžą†žĚī Ž∂ąÍįÄŽä•Ūēú Í≤Ĺžöį Ūē≠žēĒ žĻėŽ£ĆÍįÄ ž£ľŽźú žĻėŽ£ĆžßÄŽßĆ žēĄžßĀÍĻĆžßÄ ŽßĆž°ĪŪē† ŽßĆŪēú žĻėŽ£Ć Ūö®Í≥ľŽ•ľ Ž≥īžĚł žėąÍįÄ žóÜžĖī žĚľŽįėž†ĀžĚł žúĄžĄ†žēĒžĚė Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžóź ÍłįŽįėŪēėžó¨ žĻėŽ£ĆŪēėÍ≥† žěąŽč§. 5-fluorouracil, cisplatin Ž≥Ďžö©žöĒŽ≤ēÍ≥ľ capecitabine, cisplatin Ž≥Ďžö©žöĒŽ≤ēžĚĄ ž£ľŽ°ú žā¨žö©ŪēėŽ©į žĚīžôłžóźŽŹĄ S-1 Žč®ŽŹÖ ŽėźŽäĒ paclitaxel, cisplatin Ž≥Ďžö©žöĒŽ≤ē Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžĚĄ žčúŪĖČŪēúŽč§[4]. ŪēėžßÄŽßĆ ŪėĄžě¨ Ūö®Í≥ľž†ĀžĚł Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžĚī ž†ēŽ¶¨ŽźėžßÄ žēäžēĄ žĻėŽ£ĆŪēėŽäĒŽćį žĖīŽ†§žõĞ̥ Í≤™Í≥† žěąŽč§. ÍĶ≠ŽāīžóźžĄúŽäĒ žąėžą† ŪõĄ 1ŽÖĄŽßĆžóź žě¨ŽįúŪēú ž¶ĚŽ°ÄÍįÄ žěąžóąÍ≥†[8], Baek ŽďĪ[7]žóź žĚėŪēėŽ©ī Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžóź Ž∂ÄŽ∂ĄŽįėžĚĎ žĚīžÉĀžĚĄ Ž≥īžĚł Í≤ĹžöįÍįÄ 8.3%žóź Ž∂ąÍ≥ľŪēúŽćį ÍĶ≠Žāī žĚľŽįėž†ĀžĚł žúĄžĄ†žēĒžĚė Ž∂ÄŽ∂ĄŽįėžĚĎŽ•† 32-46%žóź ŽĻĄŪēī Žß§žöį Ž∂ąŽüČŪēėŽč§[3]. žôłÍĶ≠ Ž≥īÍ≥†žóźžĄúŽŹĄ Žßąžį¨ÍįÄžßÄŽ°ú Ž∂ąŽüČŪēú žėąŪõĄŽ•ľ ŪôēžĚłŪē† žąė žěąŽč§. Lin ŽďĪ[4]žĚī Ž≥īÍ≥†Ūēú ŽįĒžóź ŽĒįŽ•īŽ©ī 87.1%žĚė ŪôėžěźÍįÄ žßĄŽč® ŽčĻžčú Ž¶ľŪĒĄž†ą ž†ĄžĚīŽāė žõźÍ≤©ž†ĄžĚīŽ•ľ ŽŹôŽįėŪēėÍ≥† žěąžóąžúľŽ©į, 5-fluorouracil ÍłįŽįėžĚė Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžĚĄ žčúŪĖČŪĖąžßÄŽßĆ ž§Ďžēô žÉĚž°ī ÍłįÍįĄžĚÄ 7.2žóź Ž∂ąÍ≥ľŪĖąŽč§. Su ŽďĪ[9]žĚī žčúŪĖČŪēú Ž©ĒŪÉÄŽ∂ĄžĄĚžóźžĄúŽäĒ žÉĚž°ī žěźŽ£ĆÍįÄ ŪôēžĚłŽźú Ūôėžěź 125Ž™Ö ž§Ď 51.2%žĚė ŪôėžěźÍįÄ žßĄŽč® 12ÍįúžõĒ Žāīžóź žā¨ŽßĚŪēėžėÄŽč§. ŪėĄžě¨ÍĻĆžßÄ ŽįúŪĎúŽźú Ž≥īÍ≥†žóźŽäĒ HER2 žĖĎžĄĪžĚĄ Ž≥īžĚł ž¶ĚŽ°ÄÍįÄ žóÜžúľŽ©į trastuzumabžĚĄ žā¨žö©Ūēú žėą žó≠žčú žóÜŽč§. Ž≥ł ž¶ĚŽ°ÄŽäĒ ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžóźžĄú HER2 žĖĎžĄĪžĚĄ Ž≥īžĚł ž≤ę ž¶ĚŽ°ÄžĚīŽč§. Bang ŽďĪ[10]žĚÄ žßĄŪĖČŪēú žĚľŽįėž†ĀžĚł žúĄžĄ†žēĒžóźžĄú HER2 žĖĎžĄĪžĚľ Í≤Ĺžöį Íłįž°ī Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžóź trastuzumabžĚĄ ž∂ĒÍįÄŪēėŽäĒ Í≤ÉžĚī žĘÄ ŽćĒ žöįžąėŪēú žĻėŽ£Ć Ūö®Í≥ľŽ•ľ ŽāėŪÉÄŽāīŽäĒ Í≤ÉžúľŽ°ú Ž≥īÍ≥†ŪēėžėÄŽč§. žĚīžóź Ž≥ł ž¶ĚŽ°ÄžóźžĄúŽŹĄ trastuzumabžĚĄ žā¨žö©ŪēėžėÄÍ≥† Ž¨īžßĄŪĖČ žÉĚž°īžĚĄ 1ŽÖĄ žĚīžÉĀ žú†žßÄŪēėÍ≥† žěąŽč§. ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒ Ūôėžěź ž§Ď 8.3%ŽßĆžĚī Ūē≠žēĒŪôĒŪēô žĻėŽ£Ćžóź ŽįėžĚĎŪēėžėÄÍ≥† žÉĚž°ī ž§ĎžēôÍįížĚī 8ÍįúžõĒ ŽĮłŽßĆ, 1žį® Ūē≠žēĒŪôĒŪēô žĻėŽ£ĆžĚė Ž¨īžßĄŪĖČ žÉĚž°īÍįížĚī 5ÍįúžõĒ ŽĮłŽßƞ쥞̥ Í≥†Ž†§ŪēėŽ©ī ŽßĆž°ĪŪē† ŽßĆŪēú žĻėŽ£Ć Í≤ĹÍ≥ľŽ°ú ŪĆźŽč®Ūē† žąė žěąŽč§. žĚľŽįėž†ĀžúľŽ°ú ÍįĄžĄłŪŹ¨žĖĎ žúĄžĄ†žēĒžĚÄ žĻėŽ£Ć žĄĪž†ĀžĚī žĘčžßÄ žēäžßÄŽßĆ Ž≥ł ž¶ĚŽ°ÄžóźžĄúžôÄ ÍįôžĚī HER2 Ž©īžó≠ ŪôĒŪēô Í≤Äžā¨Ž•ľ žčúŪĖČŪēėÍ≥† ŪĎúž†ĀžĻėŽ£Ćž†úžĚł trastuzumabžĚĄ žā¨žö©Ūē®žúľŽ°úžć® žĘÄ ŽćĒ žĘčžĚÄ žĻėŽ£Ć žĄĪž†ĀžĚĄ ÍłįŽĆÄŪēī Ž≥ľ žąė žěąŽč§.
REFERENCES
1. Ishikura H, Fukasawa Y, Ogasawara K, Natori T, Tsukada Y, Aizawa M. An AFP-producing gastric carcinoma with features of hepatic differentiation. A case report. Cancer 1985;56:840‚Äď848.


2. Ye MF, Tao F, Liu F, Sun AJ. Hepatoid adenocarcinoma of the stomach: a report of three cases. World J Gastroenterol 2013;19:4437‚Äď4442.



3. Kang YK, Kang WK, Shin DB, et al. Capecitabine/cisplatin versus 5-fluorouracil/cisplatin as first-line therapy in patients with advanced gastric cancer: a randomised phase III noninferiority trial. Ann Oncol 2009;20:666‚Äď673.


4. Lin CY, Yeh HC, Hsu CM, Lin WR, Chiu CT. Clinicopathologial features of gastric hepatoid adenocarcinoma. Biomed J 2015;38:65‚Äď69.


5. Liu X, Cheng Y, Sheng W, et al. Clinicopathologic features and prognostic factors in alpha-fetoprotein-producing gastric cancers: analysis of 104 cases. J Surg Oncol 2010;102:249‚Äď255.


6. Inagawa S, Shimazaki J, Hori M, et al. Hepatoid adenocarcinoma of the stomach. Gastric Cancer 2001;4:43‚Äď52.


7. Baek SK, Han SW, Oh DY, Im SA, Kim TY, Bang YJ. Clinicopathologic characteristics and treatment outcomes of hepatoid adenocarcinoma of the stomach, a rare but unique subtype of gastric cancer. BMC Gastroenterol 2011;11:56.



8. Moon JY, Kim GH, Cheong JH, Lee BE, Ryu DY, Song GA. A case of hepatic metastasis of gastric hepatoid adenocarcinoma mistaken for primary hepatocellular carcinoma. Korean J Gastroenterol 2012;60:262‚Äď266.


Esophagogastroduodenoscopy reveals a 3-cm ulcerative mass lesion at the distal antrum lesser curvature-anterior wall.
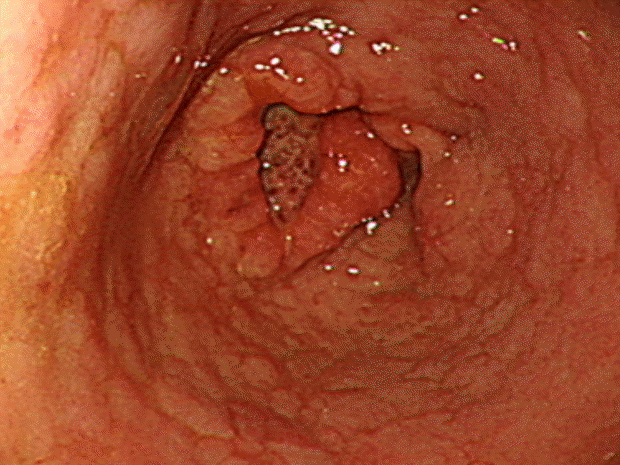
Figure 1.
Histological findings of the liver biopsy. (A) Core needle biopsy specimen is composed of solid sheet and glandular patterns of polygonal cells with eosinophilic and occasional clear cytoplasm. (Hematoxylin and eosin stain, √ó200). The tumor cells were positive for (B) alpha fetoprotein (AFP) (AFP immunohistochemical stain original magnification, √ó200) and (C) human epidermal growth factor receptor 2 (HER2) (HER2 immunohistochemical stain, √ó200).
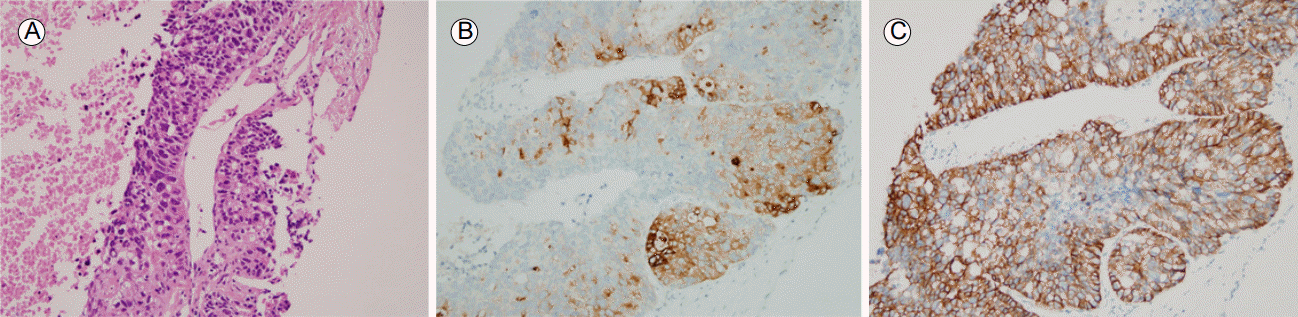
Figure 2.
Histological findings of the stomach biopsy. (A) Tumor cells consist of a solid sheet of large polygonal cells with eosinophilic cytoplasm resembling hepatocellular carcinoma. (Hematoxylin and eosin stain, √ó200). (B) The tumor cells were positive for alpha fetoprotein (AFP) (AFP immunohistochemical stain original magnification, √ó200) and (C) human epidermal growth factor receptor 2 (HER2) (HER2 immunohistochemical stain, √ó200).
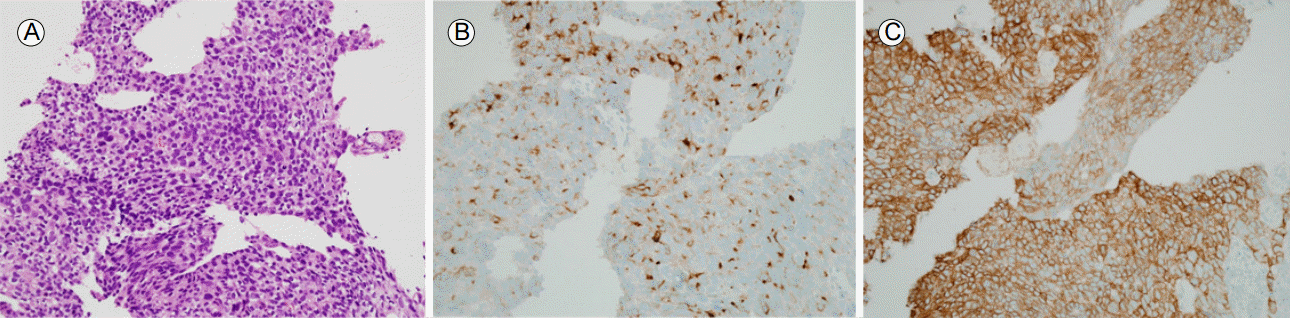
Figure 3.
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 6,189 View
- 155 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



