м„ң лЎ
кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…мқҖ нҳ•м§Ҳм„ёнҸ¬м—җм„ң л°ңмғқн•ҳлҠ” мў…м–‘мқҳ м•Ҫ 3%м—җ лӢ¬н•ҳл©° лі‘лҰ¬мЎ°м§Ғн•ҷм ҒмңјлЎң лӢЁнҒҙлЎ л©ҙм—ӯкёҖлЎңл¶ҲлҰ°мқ„ мғқмӮ°н•ҳл©° лӢӨм–‘н•ң м„ұмҲҷлҸ„лҘј ліҙмқҙлҠ” нҳ•м§Ҳм„ёнҸ¬мқҳ м№Ём°©мқ„ нҠ№м§•мңјлЎң н•ңлӢӨ[1]. м•Ҫ 80-90%мқҳ кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…мқҙ мғҒкё°лҸ„мқҳ м җл§ү м—°кҙҖ лҰјн”„мЎ°м§Ғм—җм„ң л°ңмғқн•ҳл©° к·ёмӨ‘ 75%к°Җ мҪ”мҷҖ мҪ” мЈјліҖм—җм„ң л°ңмғқн•ҳлҠ” л°ҳл©ҙм—җ мӢ мһҘ лҳҗлҠ” нӣ„ліөл§ү м№ЁлІ”мқ„ ліҙмқҙлҠ” кІҪмҡ°лҠ” л§Өмҡ° л“ңл¬јлӢӨ[2]. мһ„мғҒм ҒмңјлЎңлҠ” м„ңм„ңнһҲ мһҗлқјлҠ” нҠ№м§•мқ„ ліҙмқҙл©°, м№ҳлЈҢм—җ л°ҳмқ‘лҸ„ мўӢм•„ мҳҲнӣ„к°Җ 비көҗм Ғ м–‘нҳён•ң кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ[3]. ліё м Җмһҗл“ӨмқҖ мһҳ м•Ңл Ө진 мһ„мғҒм Ғмқё нҠ№м§•кіј лӢӨлҘҙкІҢ л§Өмҡ° кұ°лҢҖн•ҳкі , кёүкІ©н•ҳкІҢ 진н–үн•ҳлҠ” нӣ„ліөл§үмқҳ кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў… мҰқлЎҖлҘј кІҪн—ҳн•ҳмҳҖкё°м—җ м—¬кё°м—җм„ң ліҙкі н•ҳкі мһҗ н•ңлӢӨ.
мҰқ лЎҖ
нҷҳ мһҗ: 72м„ё лӮЁм„ұ
мЈј мҶҢ: ліөнҶө
нҳ„лі‘л Ҙ: 72м„ё лӮЁм„ұмқҙ 1к°ңмӣ” м „л¶Җн„° мӢңмһ‘лҗң ліөнҶөмқ„ мЈјмҶҢлЎң лӮҙмӣҗн•ҳмҳҖлӢӨ. ліөнҶөкіј н•Ёк»ҳ м җм°Ё ліөл¶ҖнҢҪл§Ңк°җмқҙ м•…нҷ”лҗҳм—Ҳкі н—ҲлҰ¬ нҶөмҰқ лҳҗн•ң нҳёмҶҢн•ҳмҳҖлӢӨ. л°ңм—ҙ, мІҙмӨ‘к°җмҶҢ л“ұмқҳ мҰқмғҒмқҖ м—Ҷм—ҲлӢӨ.
кіјкұ°л Ҙ л°Ҹ мӮ¬нҡҢл Ҙ: лӢ№лҮЁлі‘, м–‘м„ұ м „лҰҪм„ л№„лҢҖмҰқ(6к°ңмӣ” м „ кІҪмҡ”лҸ„м Ғ м „лҰҪм„ м Ҳм ңмҲ )
к°ҖмЎұл Ҙ: нҠ№мқҙмӮ¬н•ӯ м—ҶмқҢ
мӢ мІҙ кі„мёЎ: мӢ мһҘ 162 cm, мІҙмӨ‘ 70 kg, body mass index (BMI) 26.7 kg/m2
진찰 мҶҢкІ¬: лӮҙмӣҗмӢң нҳҲм•• 120/80 mmHg, л§Ҙл°• 80нҡҢ/분, нҳёнқЎ 20нҡҢ/분, мІҙмҳЁ 36.9в„ғ, мқҳмӢқмқҖ м •мғҒмқҙм—ҲлӢӨ. ліөл¶ҖнҢҪл§Ңкіј м „л°ҳм Ғмқё ліөл¶Җ м••нҶөкіј мҷјмӘҪ лҠ‘мІҷ추к°Ғ м••нҶөмқҙ мһҲм—ҲлӢӨ. 진찰н•ҳмҳҖмқ„ л•Ң м „мӢ м ҒмңјлЎң лҰјн”„м Ҳмў…лҢҖлҘј мқҳмӢ¬н• л§Ңн•ң мҶҢкІ¬мқҖ м—Ҷм—ҲлӢӨ.
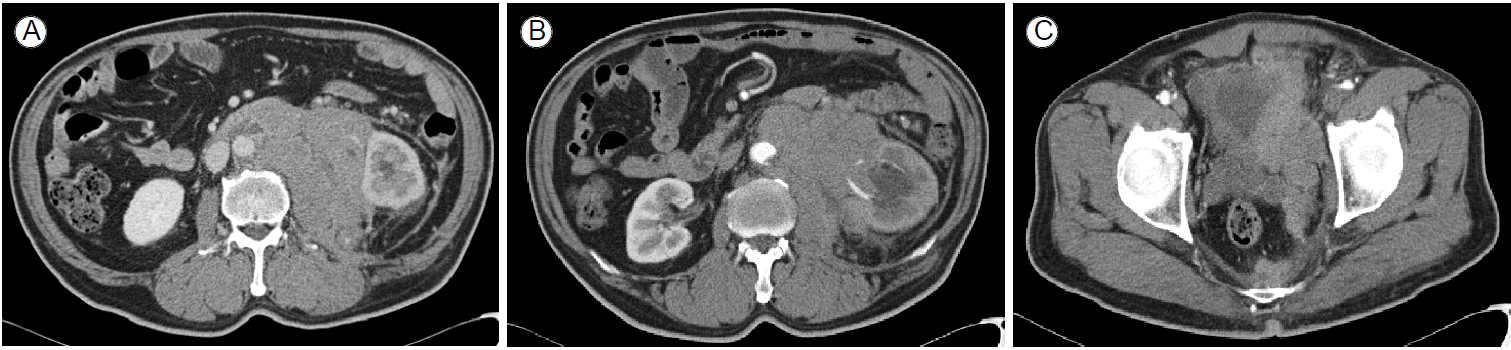
мҳҒмғҒ кІҖмӮ¬ мҶҢкІ¬: лӮҙмӣҗ лӢ№мқј ліөл¶Җ м»ҙн“Ён„°лӢЁмёөмҙ¬мҳҒмқ„ мӢңн–үн•ҳмҳҖкі к·ё кІ°кіј мҷјмӘҪ л¶ҖмӢ кіј ліөл¶Җ лҢҖлҸҷл§Ҙ мҷјнҺёмқҳ м—¬лҹ¬ нҳҲкҙҖ, мҷјмӘҪ мӢ мһҘ к·ёлҰ¬кі мҡ”кҙҖмқ„ к°җмӢёкі мһҲлҠ” 12 Г— 8 cm нҒ¬кё°мқҳ кұ°лҢҖн•ң ліөл¶Җ мў…кҙҙк°Җ л°ңкІ¬лҗҳм—ҲлӢӨ(Fig. 1). мқҙлЎң мқён•ҙ мҷјмӘҪ мҲҳмӢ мҰқмқҙ лҸҷл°ҳлҗҳм—Ҳмңјл©° м§Ғм ‘м Ғмқё мў…кҙҙмқҳ л°©кҙ‘ м№ЁлІ”кіј н•Ёк»ҳ м „мІҙм Ғмқё л°©кҙ‘ м җл§ү 비нӣ„лҸ„ ліҙмҳҖлӢӨ(Fig. 1B and 1C). мһ‘мқҖ мҳӨлҘёмӘҪ мӢ¬мһҘнҡЎкІ©л§ү лҰјн”„м Ҳл“Өмқҙ ліҙмҳҖм§Җл§Ң л°ҳмқ‘м„ұ лҰјн”„м ҲлЎң 추측лҗҳм—ҲлӢӨ.
кІҖмӮ¬мӢӨ мҶҢкІ¬: нҳҲм•Ўн•ҷм Ғ кІҖмӮ¬м—җм„ң л°ұнҳҲкө¬ 7.1 Г— 109/L (нҳёмӨ‘кө¬ 4.7 Г— 103/ОјL, лҰјн”„кө¬ 1.7 Г— 103/ОјL, лӢЁн•өкө¬ 0.6 Г— 103/ОјL, нҳёмӮ°кө¬ 0.1 Г— 103/ОјL, нҳём—јкө¬ 0.0 Г— 103/ОјL), нҳҲмғүмҶҢ(Hb) 12.2 g/dL, нҳҲмҶҢнҢҗ 251 Г— 109/L мҶҢкІ¬мқ„ ліҙмҳҖлӢӨ. мғқнҷ”н•ҷ кІҖмӮ¬м—җм„ң нҳҲмІӯ нҒ¬л Ҳм•„нӢ°лӢҢ(Cr) 1.66 mg/dL, мҡ”мҶҢм§ҲмҶҢ(BUN) 16.2 mg/dL, м –мӮ°нғҲмҲҳмҶҢнҡЁмҶҢ(LDH) 1,454 IU/L (м •мғҒлІ”мң„: 100-450 IU/L), мҙқ лӢЁл°ұлҹү 6.8 g/dL, м•Ңл¶ҖлҜј 3.8 g/dL, C-л°ҳмқ‘м„ұлӢЁл°ұ 2.48 mg/dL, мқёк°„л©ҙм—ӯкІ°н•Қл°”мқҙлҹ¬мҠӨ(HIV) кІҖмӮ¬лҠ” мқҢм„ұмқҙм—ҲлӢӨ.
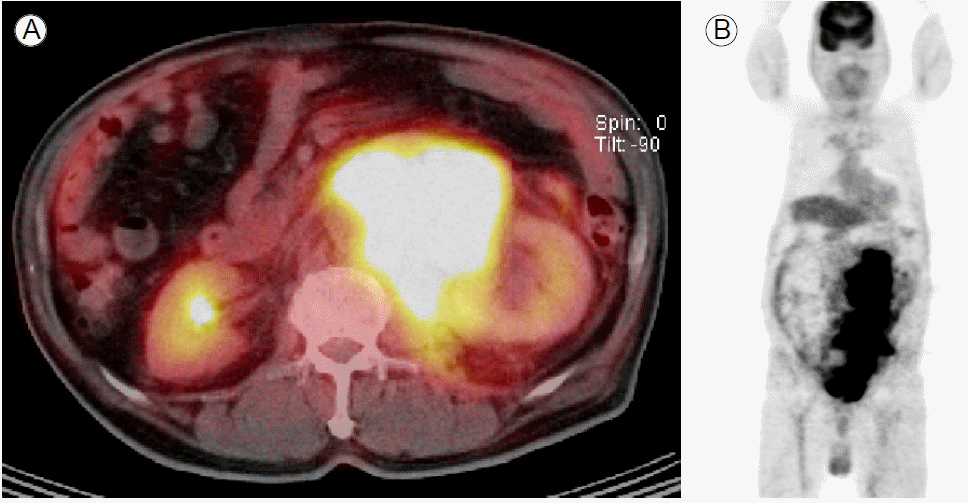
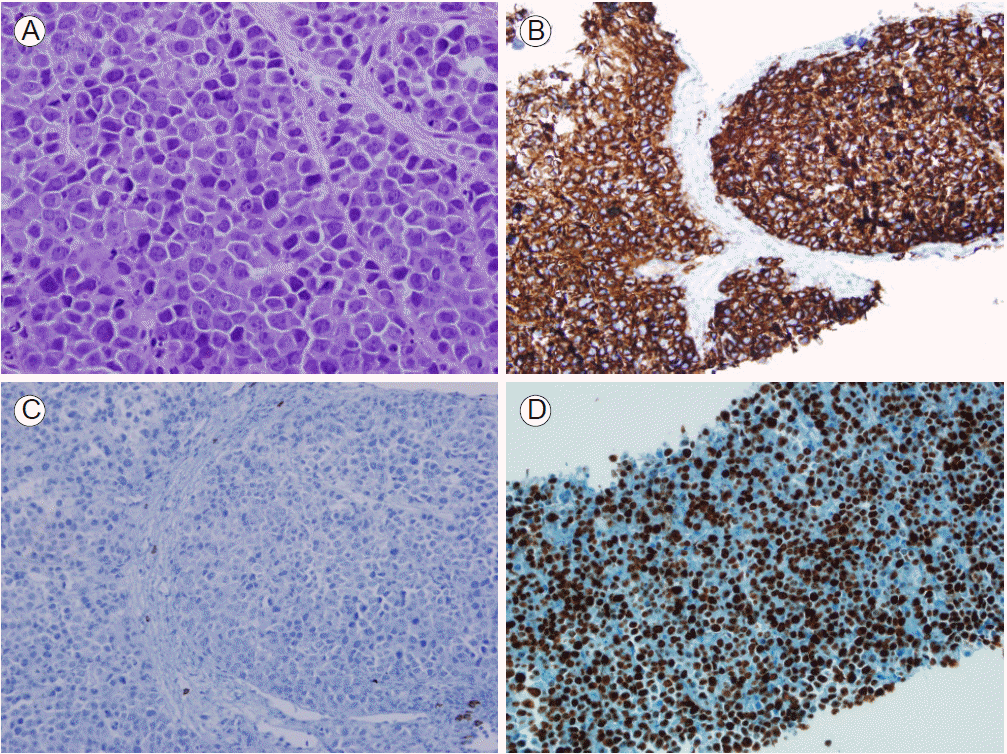
мһ„мғҒкІҪкіј: ліөл¶Җ м»ҙн“Ён„°мҙ¬мҳҒ л°Ҹ нҳҲм•Ў кІҖмӮ¬ мҶҢкІ¬мқ„ мў…н•©н•ҳм—¬ м•…м„ұ лҰјн”„мў…мқ„ мқҳмӢ¬н•ҳмҳҖмңјл©° мЎ°м§ҒкІҖмӮ¬, 추к°Җм Ғмқё мҳҒмғҒ кІҖмӮ¬ л°Ҹ PET-CT кІҖмӮ¬лҘј мӢңн–үн•ҳмҳҖлӢӨ. positron emission tomography-computed tomography (PET-CT)м—җм„ңлҠ” ліөл¶Җ м»ҙн“Ён„°мҙ¬мҳҒм—җм„ң ліҙмҳҖлҚҳ мҶҢкІ¬кіј лҸҷмқјн•ҳкІҢ лҢҖмӮ¬н•ӯ진лҗң мў…кҙҙк°Җ 비мһҘ м•„лһҳл¶Җн„° мҷјмӘҪ кіЁл°ҳк°•м—җ лӢ¬н•ҳлҠ” ліөл¶Җ лҢҖлҸҷл§Ҙ мҷјмӘҪ мЈјліҖ кіөк°„м—җм„ң л°ңкІ¬лҗҳм—ҲлӢӨ(Fig. 2). нҷ•м§„мқ„ мң„н•ҙ мҙҲмқҢнҢҢ н•ҳліөл¶Җ мў…кҙҙмқҳ мЎ°м§ҒкІҖмӮ¬лҘј мӢңн–үн•ҳмҳҖкі , мЎ°м§ҒкІҖмӮ¬м—җм„ң м–»м–ҙ진 кІҖмІҙлҠ” Ig GмҷҖ kappa кІҪмҮ„мқҳ лӢЁнҒҙлЎ м„ұмқ„ ліҙмқҙлҠ” нҳ•м§Ҳм„ёнҸ¬лЎң мқҙлЈЁм–ҙ진 мў…м–‘мЎ°м§Ғ(Fig. 3)мңјлЎң нҷ•мқёлҗҳм—Ҳмңјл©° л©ҙм—ӯмЎ°м§Ғнҷ”н•ҷ кІҖмӮ¬ кІ°кіјлҠ” CD 138 м–‘м„ұ, CD 20 мқҢм„ұ, Ki-67 > 97%мҳҖлӢӨ. нҳ•м§ҲлӘЁм„ёнҸ¬ лҰјн”„мў…мқ„ к°җлі„н•ҳкё° мң„н•ҳм—¬ epstein-barr virus (EBV) кІҖмӮ¬лҘј мӢңн–үн•ҳмҳҖмңјл©° epstein-barr virus-encoded small RNAs (EBERs) мқҢм„ұ мҶҢкІ¬мқ„ ліҙмҳҖлӢӨ. мһҘкё°мқҳ м№ЁлІ” мң л¬ҙлҘј нҷ•мқён•ҳкё° мң„н•ҙ мӢңн–үн•ң лӘ© м»ҙн“Ён„°лӢЁмёөмҙ¬мҳҒкіј к°ҖмҠҙ м»ҙн“Ён„°лӢЁмёөмҙ¬мҳҒ кІҖмӮ¬ кІ°кіј нғҖ мһҘкё° м№ЁлІ”мқҖ м—Ҷм—ҲлӢӨ. мЎ°м§ҒкІҖмӮ¬ кІ°кіј нҷ•мқё мқҙнӣ„ 추к°Җм ҒмңјлЎң нҳ•м§Ҳм„ёнҸ¬м§Ҳнҷҳм—җ лҢҖн•ң кІҖмӮ¬лҘј мӢңн–үн•ҳмҳҖлӢӨ.
нҳҲмІӯ л©ҙм—ӯкёҖлЎңл¶ҲлҰ°(Ig) G (1,105 mg/dL), нҳҲмІӯ Ig A (69 mg/dL), Ig M (53 mg/dL)мқҖ м •мғҒмқҙм—ҲлӢӨ. мҶҢліҖм—җм„ң лІӨмҠӨмЎҙмҠӨ лӢЁл°ұмқҖ кІҖм¶ңлҗҳм§Җ м•Ҡм•ҳлӢӨ. лӢЁл°ұ м „кё°мҳҒлҸҷм—җм„ң лӘ…нҷ•н•ң M лӢЁл°ұм§ҲмқҖ ліҙмқҙм§Җ м•Ҡм•ҳмңјлӮҳ л©ҙм—ӯкі м • м „кё° мҳҒлҸҷлІ•м—җм„ң лӢЁнҒҙлЎ к°җл§ҲкёҖлЎңл¶ҲлҰ°лі‘мҰқ(Ig GвҖҗkappa) мҶҢкІ¬мқҙ ліҙмҳҖлӢӨ. Free kappa кІҪмҮ„ 16.0 mg/L, free lambda кІҪмҮ„ 9.87 mg/L, free kappa/lambda 1.63мңјлЎң м •мғҒ лІ”мЈј мқҙлӮҙм—җ мһҲм—ҲлӢӨ. м—үлҚ©лјҲ лҠҘм„ м—җм„ң мӢңн–үн•ң кіЁмҲҳ нқЎмқё, мЎ°м§ҒкІҖмӮ¬м—җм„ң нҳ•м§Ҳм„ёнҸ¬ м№Ём°©мқҖ ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ. лІ нғҖ-2-л§ҲмқҙнҒ¬лЎңкёҖлЎңл¶ҲлҰ° 10,774.82 ng/mL мҶҢкІ¬мқ„ ліҙмҳҖлӢӨ. мөңмў…м ҒмңјлЎң нҷҳмһҗлҠ” нӣ„ліөл§үмқҳ кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…мңјлЎң 진лӢЁлҗҳм—ҲлӢӨ.
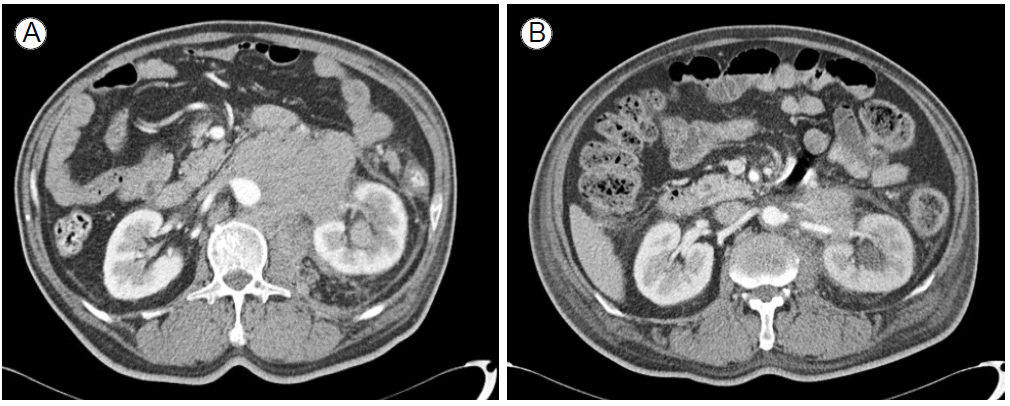
м№ҳлЈҢ л°Ҹ мһ„мғҒкІҪкіј: мҙҲ м№ҳлЈҢлЎң vincristine, adriamycin, dexamethasoneлЎң н•ӯм•”м ң м№ҳлЈҢлҘј мӢңн–үл°ӣм•ҳлӢӨ. н•ӯм•” м№ҳлЈҢ нӣ„ LDHк°Җ 1,454 IU/Lм—җм„ң 459 IU/LлЎң к°җмҶҢн•ҳмҳҖкі мў…кҙҙмқҳ нҒ¬кё°к°Җ мӨ„м–ҙл“Өл©ҙм„ң(н•ӯм•” м№ҳлЈҢ 16мқјм§ё нқүл¶Җ м»ҙн“Ён„°мҙ¬мҳҒм—җм„ң 진лӢЁмӢң 12 Г— 8 cm нҒ¬кё°мқҳ мў…кҙҙк°Җ 4.6 Г— 3.6 cmлЎң мӨ„м–ҙл“ кІғмңјлЎң нҷ•мқён• мҲҳ мһҲм—ҲлӢӨ) ліөнҶө лҳҗн•ң кІҪк°җлҗҳм—ҲлӢӨ. мӢ кё°лҠҘ м—ӯмӢң нҳҲмІӯ Cr мҲҳм№ҳк°Җ 1.66 mg/dLм—җм„ң 1.04 mg/dLлЎң нҳём „лҗҳм—ҲлӢӨ(Fig. 4). н•ӯм•” м№ҳлЈҢ 13мқјм°Ё нҷҳмһҗ л°ңм—ҙ, мҳӨн•ң, кё°м№Ё, к°ҖлһҳмҷҖ к°ҷмқҖ нҳёнқЎкё°кі„ мҰқмғҒ м—Ҷмқҙ м „мӢ мҮ„м•Ҫмқ„ нҳёмҶҢн•ҳмҳҖмңјл©°, к°ҖмҠҙ X-м„ кІҖмӮ¬м—җм„ң м–‘мӘҪ н•ҳм—Ҫм—җ кё°м§Ҳ кІҪнҷ” мҶҢкІ¬мқҙ нҷ•мқёлҗҳм—ҲлӢӨ. 16мқј м°Ёл¶Җн„°лҠ” л°ұнҳҲкө¬ 3.2 Г— 109/L(м ҲлҢҖ нҳёмӨ‘кө¬ 2.8 Г— 103/ОјL)мңјлЎң к°җмҶҢн•ҳкё° мӢңмһ‘н•ҳл©° нҳёнқЎкіӨлһҖмқҙ м•…нҷ”лҗҳм—Ҳкі к·ёл•Ң лӢ№мӢң мӢңн–үн•ң нқүл¶Җ м»ҙн“Ён„°лӢЁмёөмҙ¬мҳҒ кІ°кіј м–‘мӘҪ нҸҗм—җ м „мІҙм Ғмқё кё°м§Ҳ кІҪнҷ”лҘј ліҙмҳҖмңјл©° нҷҳмһҗлҠ” к·№мӢ¬н•ң нҸҗл ҙ л°Ҹ кёүм„ұ нҳёнқЎкіӨлһҖмҰқнӣ„кө° мғҒнғңм—җ мқҙлҘҙл ҖлӢӨ. 2к°ңмӣ”к°„ н•ӯмғқм ң, н•ӯм§„к· м ң м№ҳлЈҢ нӣ„ мһ„мғҒмҰқмғҒкіј мҳҒмғҒн•ҷм Ғмқё нҳём „мқ„ ліҙмҳҖлӢӨ. нҸҗл ҙмқҙ нҳём „лҗң мӢңкё° мҰҲмқҢм—җм„ң лӢӨмӢң ліөл¶ҖнҢҪл§Ңк°җкіј ліөнҶөмқ„ нҳёмҶҢн•ҳмҳҖмңјл©°, м „л°ҳм Ғмқё ліөл¶Җ м••нҶөмқҙ мһҲм—Ҳкі LDHлҠ” 2,055 IU/L, CrмқҖ 1.66 mg/dLлЎң мғҒмҠ№н•ҳмҳҖлӢӨ. кё°м Җм§Ҳнҷҳ нҸүк°ҖлҘј мң„н•ҙ ліөл¶Җ м»ҙн“Ён„°мҙ¬мҳҒмқ„ мӢңн–үн•ҳмҳҖкі нӣ„л°© мӢ мһҘмЈјмң„к°•, мҡ°мёЎ нӣ„ліөк°• к·ёлҰ¬кі л°©кҙ‘кіј м–‘мёЎ мҡ”кҙҖл°©кҙ‘мқҙмқҢл¶ҖлҘј к°җмӢёлҠ” мў…кҙҙмқҳ нҒ¬кё° мҰқк°ҖмҷҖ м–‘мёЎ мҲҳмӢ мҰқмқҳ м•…нҷ”лҘј ліҙм—¬ кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…мқҳ 진н–үмқ„ нҷ•мқён•ҳмҳҖлӢӨ. кө¬м ңмҡ”лІ•мңјлЎң melphalan, prednisoloneмқ„ нҲ¬м—¬н•ҳмҳҖмңјлӮҳ нҡЁкіј м—Ҷмқҙ м§ҖмҶҚм Ғмқё ліөнҶө, ліөл¶ҖнҢҪл§Ңкіј LDHмқҳ мғҒмҠ№мқ„ ліҙмҳҖлӢӨ. мқҙм—җ melphalan, prednisolone нҲ¬м—¬ 19мқј л’Ө bortezomib, dexamethasoneлЎң м•Ҫм ң ліҖкІҪн•ҳм—¬ н•ӯм•” м№ҳлЈҢлҘј мһ¬мӢңлҸ„н•ҳмҳҖмңјлӮҳ м№ҳлЈҢм—җ л°ҳмқ‘мқ„ ліҙмқҙм§Җ м•Ҡкі кі„мҶҚ 진н–үн•ҳм—¬ 1к°ңмӣ” л’Ө мӮ¬л§қн•ҳмҳҖлӢӨ.
кі м°°
ліё мҰқлЎҖлҠ” м җл§үмқҙ м•„лӢҢ нӣ„ліөл§үм—җм„ң л°ңмғқн•ң кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…мңјлЎң 진лӢЁ лӢ№мӢң 12 Г— 8 cmмқҳ кұ°лҢҖн•ң нҒ¬кё°лЎң 진лӢЁлҗҳм–ҙ л§Өмҡ° кёүкІ©н•ң 진н–үмқ„ ліҙмҳҖлҚҳ нҠ№мқҙн•ң мӮ¬лЎҖмҳҖлӢӨ. кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…мқҖ л§Өмҡ° л“ңл¬ё нҳ•м§Ҳм„ёнҸ¬м§ҲнҷҳмңјлЎң лӘЁл“ нҳ•м§Ҳ м„ёнҸ¬мў…мқҳ 1.6-4.0%лҘј м°Ём§Җн•ҳкі [4], м „ м„ёкі„м ҒмңјлЎң м—°к°„ л°ңмғқлҘ мқҖ 10л§Ң лӘ…лӢ№ 3лӘ…м—җ лӢ¬н•ңлӢӨ[5]. 80-90%мқҳ кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…мқҖ мғҒкё°лҸ„ м җл§ү м—°кҙҖ лҰјн”„мЎ°м§Ғм—җм„ң л°ңмғқн•ҳл©° к·ёмӨ‘ 75%лҠ” мҪ”мҷҖ мҪ” мЈјліҖ м җл§үм—җм„ң л°ңмғқ, к·ё мҷёлҠ” мң„мһҘкҙҖкі„, мӢ кІҪкі„, к°‘мғҒм„ , мң л°©, м№Ёмғҳ, кі нҷҳкіј мһ„нҢҢм„ л“ұм—җм„ң л°ңмғқн•ңлӢӨ[1,2]. нӣ„ліөл§үм—җм„ң л°ңмғқн•ҳлҠ” кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…мқҖ м „ м„ёкі„м ҒмңјлЎң л¬ён—ҢмғҒ 10мҳҲ м •лҸ„к°Җ ліҙкі лҗҳм—Ҳмңјл©° көӯлӮҙм—җм„ңлҠ” 1мҳҲк°Җ ліҙкі лҗң л°” мһҲлӢӨ[6]. мһ„мғҒм–‘мғҒмқҖ м–‘мӘҪ мӢ м •л§Ҙ нҸҗмғүм—җ мқҳн•ң мӢ л¶Җм „, мҳҶкө¬лҰ¬ нҶөмҰқ, мӢ м •л§Ҙ нҳҲм „м—җ мқҳн•ң нҳҲлҮЁ, нҸҗмҮ„м„ұ нҷ©лӢ¬, ліөл¶ҖнҢҪл§Ңкіј ліөнҶө к·ёлҰ¬кі кіјлӢӨм•„л°Җл ҲмқҙмҰҲнҳҲмҰқкіј к°ҷмқҖ лӢӨм–‘н•ң м–‘мғҒмқ„ лӮҳнғҖлӮј мҲҳ мһҲлӢӨ[2,3]. ліё мҰқлЎҖмқҳ нҷҳмһҗлҠ” ліөл¶ҖнҢҪл§Ң, ліөнҶө, л°°л¶ҖнҶөмҰқмқ„ нҳёмҶҢн•ҳмҳҖкі мў…кҙҙк°Җ мҷјмӘҪ мҡ”кҙҖмқ„ к°җмӢёкі мһҲм–ҙм„ң мқҙлЎң мқён•ң мҲҳмӢ мҰқкіј мӢ л¶Җм „ мҶҢкІ¬мқ„ ліҙмҳҖлӢӨ. нҳ•м§Ҳм„ёнҸ¬мў…мқ„ 진лӢЁн•ҳкё° мң„н•ҙм„ңлҠ” мў…м–‘мқҳ лі‘лҰ¬ мЎ°м§ҒкІҖмӮ¬ л°Ҹ л©ҙм—ӯмЎ°м§Ғнҷ”н•ҷ кІҖмӮ¬лҘј мӢңн–үн•ҳм—¬м•ј н•ҳл©°, л©ҙм—ӯмЎ°м§Ғнҷ”н•ҷ кІҖмӮ¬м—җм„ңлҠ” kappa, lambda кІҪмҮ„мҷҖ Ig G, Ig A, Ig M мӨ‘мҮ„мқҳ лӢЁнҒҙлЎ м„ұмқҙ нҷ•мқёлҗҳм–ҙм•ј н•ңлӢӨ. мқҙ мӨ‘ кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…мқҖ кіЁмҲҳ мЎ°м§ҒкІҖмӮ¬м—җм„ң нҳ•м§Ҳм„ёнҸ¬к°Җ 10% лҜёл§Ңмқҙл©° м •мғҒм Ғмқё кіЁкІ©кі„ кІҖмӮ¬ мҶҢкІ¬мқ„ ліҙм—¬м•ј н•ңлӢӨ[7]. мң„мһҘкҙҖкі„ нҳ•м§Ҳм„ёнҸ¬мў…мқҖ нҳ•м§Ҳм„ёнҸ¬ 분нҷ”лҘј н•ҳлҠ” Bм„ёнҸ¬ лҰјн”„мў…мңјлЎң мҳӨ진лҗҳлҠ” кІҪмҡ°к°Җ мһҲкё° л•Ңл¬ём—җ нӣ„ліөл§үмқҳ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў… м—ӯмӢң лҰјн”„мў…кіјмқҳ к°җлі„мқҙ н•„мҡ”н•ҳлӢӨ. нҠ№нһҲ нҳ•м§ҲлӘЁм„ёнҸ¬лҰјн”„мў…кіјмқҳ к°җлі„мқҙ н•„мҡ”н•ҳл©° мқҙлҘј мң„н•ҙм„ң л©ҙм—ӯ мЎ°м§ҒкІҖмӮ¬к°Җ мөңмў… 진лӢЁм—җ мң мҡ©н•ҳлӢӨ[2]. ліё нҷҳмһҗм—җм„ңлҠ” CD138 м–‘м„ұ, CD 20 мқҢм„ұ, мЎ°м§Ғмқҳ IgG-kappa л°ңнҳ„мқҳ лӢЁнҒҙлЎ м„ұмқ„ ліҙмҳҖмңјлӮҳ м„ңм„ңнһҲ 진н–үн•ҳлҠ” м„ұкІ©мқ„ ліҙмқҙлҠ” ліҙнҶөмқҳ нҳ•м§Ҳм„ёнҸ¬мў…кіјлҠ” лӢӨлҘҙкІҢ Ki-67мқҳ л°ңнҳ„мқҙ 90% мқҙмғҒмңјлЎң лҶ’мқҖ мҰқмӢқм„ұмқ„ ліҙмҳҖлӢӨ. л”°лқјм„ң, нҳ•м§ҲлӘЁм„ёнҸ¬лҰјн”„мў… л“ұмқҳ м§Ҳнҷҳмқ„ мўҖлҚ” нҷ•мӢӨнһҲ к°җлі„н•ҳкё° мң„н•ҙ мЎ°м§ҒмңјлЎң нҳ•м§ҲлӘЁм„ёнҸ¬лҰјн”„мў… 70% мқҙмғҒм—җм„ң м–‘м„ұ мҶҢкІ¬мқ„ ліҙмқҙлҠ” EBV кІҖмӮ¬лҘј мӢңн–үн•ҳмҳҖмңјл©°[8,9], EBVлҠ” мқҢм„ұмқҙм—Ҳкі , HIV м—ӯмӢң мқҢм„ұмқҙм—ҲлӢӨ. мҰү, 진лӢЁмқҖ нҳ•м§Ҳм„ёнҸ¬мў…м—җ н•©лӢ№н•ҳмҳҖм§Җл§Ң Ki-67мқҳ л°ңнҳ„ м •лҸ„к°Җ лҶ’мқҖ кІғмқҙ нҠ№мқҙн• л§Ңн•ң мҶҢкІ¬мқҙм—ҲлӢӨ. мқҙлҠ” мөңк·ј мҶҢмҲҳмқҳ ліҙкі к°Җ мһҲлҠ” нҳ•м§ҲлӘЁм„ёнҸ¬кіЁмҲҳмў…(plasmablastic myeloma) лІ”мЈјм—җ н•ҙлӢ№н•ҳлҠ” мЎ°м§ҒмҶҢкІ¬м—җ л¶Җн•©лҗ кІғмңјлЎң м¶”лЎ лҗҳм§Җл§Ң[9] м•„м§Ғк№Ңм§Җ мқҙлҘј 진лӢЁн•ҳкё° мң„н•ң лӘ…нҷ•н•ң 진лӢЁкё°мӨҖм—җ лҢҖн•ң м—°кө¬к°Җ л¶ҖмЎұн•ң мғҒнғңмқҙлӢӨ. кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…мқҖ нҳ„мһ¬к№Ңм§Җ м№ҳлЈҢм—җ мһҲм–ҙм„ң лӘ…нҷ•н•ң к°Җмқҙл“ңлқјмқёмқҖ м—Ҷм§Җл§Ң 비көҗм Ғ м„ңм„ңнһҲ 진н–үн•ҳкі м№ҳлЈҢм—җ л°ҳмқ‘мқ„ мһҳ н•ҳлҠ” м§ҲнҷҳмңјлЎң м•Ңл Өм ё мһҲлӢӨ[3]. кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…мқҖ нҠ№нһҲ л°©мӮ¬м„ м№ҳлЈҢм—җ лҜјк°җн•ҳм—¬ л°©мӮ¬м„ м№ҳлЈҢк°Җ н‘ңмӨҖ м№ҳлЈҢм—җ н•ҙлӢ№н•ңлӢӨ[2]. мқҙлҠ” көӯмҶҢ мЎ°м ҲлҘ 90-97%мқҙл©°, 5л…„ мғқмЎҙмңЁмқҖ 57-61%м—җ лӢ¬н•ҳлҠ” мўӢмқҖ мҳҲнӣ„лҘј ліҙмқёлӢӨ[7]. л°©мӮ¬м„ м№ҳлЈҢм—җ л¶Ҳмқ‘м„ұмқҙкұ°лӮҳ мһ¬л°ңн•ң кІҪмҡ° н•ӯм•” м№ҳлЈҢлҘј кі л Өн• мҲҳ мһҲмңјл©°, н•ӯм•” м№ҳлЈҢм—җ лҢҖн•ң л°ҳмқ‘лҸ„ 비көҗм Ғ мўӢмқҖ нҺёмқҙлӢӨ. м№ҳлЈҢ м•Ҫм ңлҠ” лӢӨл°ң кіЁмҲҳмў…м—җ нҡЁкіјм Ғмқё м•Ҫм ңл“Өмқ„ м„ нғқн•ҳкІҢ лҗҳл©°, л°©мӮ¬м„ м№ҳлЈҢ нӣ„ мһ¬л°ңн•ң кІҪмҡ°м—җлҸ„ н•ӯм•” м№ҳлЈҢмқҳ мҷ„м „ л°ҳмқ‘лҘ мқҖ 58% м •лҸ„лЎң ліҙкі лҗҳкі мһҲлӢӨ[7]. лҳҗн•ң мһ¬л°ңн•ң лӢӨл°ңкіЁмҲҳмў… нҷҳмһҗм—җм„ң bortezomibмқҙ нҸ¬н•Ёлҗң м•Ҫм ңмқҳ мЎ°н•©мңјлЎң н•ӯм•” м№ҳлЈҢлҘј мӢңн–үн•ҳмҳҖмқ„ л•Ң 1л…„ мғқмЎҙмңЁмқҙ 80%м—җ лӢ¬н•ҳкі кіЁмҲҳмҷё м№ЁлІ”м—җлҸ„ мўӢмқҖ л°ҳмқ‘мқ„ ліҙмҳҖлҚҳ ліҙкі лҸ„ мһҲм–ҙ кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў…м—җм„ңмқҳ л°ҳмқ‘лҸ„ мҳҲмёЎн•ҙ ліј мҲҳ мһҲкІ лӢӨ[7]. ліё мҰқлЎҖмқҳ нҷҳмһҗлҠ” мў…м–‘мқҳ нҒ¬кё°к°Җ л„Ҳл¬ҙ нҒ¬кі мқём ‘ нҳҲкҙҖ л°Ҹ мһҘкё°мқҳ м№ЁлІ”мқҙ мӢ¬н•ҳм—¬ л°©мӮ¬м„ м№ҳлЈҢлҘј мӢңн–үн• мҲҳ м—Ҷм—ҲлӢӨ. к·ёл ҮлӢӨ н•ҳлҚ”лқјлҸ„ ліҙнҶөмқҳ кІҪмҡ° н•ӯм•” м№ҳлЈҢм—җ л°ҳмқ‘мқ„ мһҳ н•ҳм—¬ мўӢмқҖ мҳҲнӣ„лҘј ліҙмқҙлӮҳ ліё мҰқлЎҖмқҳ нҷҳмһҗлҠ” к·ёл Үм§Җ м•Ҡм•ҳлӢӨ. Ozsahin л“ұ[10]мқҙ кі лҰҪм„ұ нҳ•м§Ҳм„ёнҸ¬мў… нҷҳмһҗ 258лӘ…мқҳ м№ҳлЈҢ мӢӨнҢЁ м–‘мғҒм—җ лҢҖн•ҙ ліҙкі н•ң л…јл¬ём—җм„ңлҠ” мў…м–‘мқҳ нҒ¬кё°к°Җ 4 cm мқҙмғҒ, кі л №, л°©мӮ¬м„ м№ҳлЈҢлҘј мӢңн–үн•ҳм§Җ лӘ»н•ң кІҪмҡ°, кіЁ лі‘ліҖмқҙ мһҲлҠ” кІҪмҡ° мҳҲнӣ„к°Җ лҚ”мҡұ л¶Ҳлҹүн•ң кІғмңјлЎң лӮҳмҷҖмһҲлӢӨ. мқҙлҘј ліё мҰқлЎҖм—җ м Ғмҡ©н•ҙ ліҙл©ҙ мў…м–‘мқҳ нҒ¬кё°к°Җ л§Өмҡ° нҒ¬кі , мІ« м№ҳлЈҢлЎң л°©мӮ¬м„ м№ҳлЈҢлҘј мӢңн–үн•ҳм§Җ лӘ»н•ң м җмқҙ н•ҙлӢ№лҗңлӢӨ. лҳҗн•ң 진лӢЁмӢң LDHк°Җ л§Өмҡ° лҶ’м•ҳмңјл©°, мЎ°м§Ғм—җм„ң ki-67 > 90%лЎң лҶ’м•ҳкі , нҷҳмһҗмқҳ м „мӢ мғҒнғңлҸ„ л§Өмҡ° л¶Ҳлҹүн–ҲлҚҳ м җмқҙ мҳҲнӣ„м—җ мҳҒн–Ҙмқ„ мЈјм—Ҳмқ„ к°ҖлҠҘм„ұмқҙ мһҲлҠ” мҡ”мҶҢлЎң м¶”м •лҗңлӢӨ. ліё мҰқлЎҖмқҳ нҷҳмһҗлҠ” к°ҖмһҘ нҡЁкіјм Ғмқё л°©мӮ¬м„ м№ҳлЈҢк°Җ л¶Ҳк°Җн•ҳкі ліҙн—ҳ кёүм—¬ м Ғмҡ©мқҙ м•Ҳ лҗҳлҠ” л¬ём ңк°Җ мһҲм–ҙм„ң мқјм°Ё м№ҳлЈҢлЎң bortezomib л“ұмқҳ м•Ҫм ңк°Җ нҸ¬н•Ёлҗң м№ҳлЈҢлҘј мӢңн–үн•ҳм§Җ лӘ»н•ҳм—¬ лӢӨл°ңкіЁмҲҳмў…мқҳ мҳҲм „ м№ҳлЈҢ м•Ҫм ңмқё VAD мҡ”лІ•мқ„ мӢңн–үн•ҳмҳҖмңјлӮҳ м „нҳҖ л°ҳмқ‘мқ„ ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ. Wei л“ұ[7]мқҙ VAD мҡ”лІ•м—җ л°ҳмқ‘мқҙ м—Ҷм—ҲлҚҳ м·ҢмһҘ нҳ•м§Ҳм„ёнҸ¬мў… нҷҳмһҗк°Җ bortezomibкіј кі лҶҚлҸ„ dexamethasone м№ҳлЈҢм—җ л°ҳмқ‘мқҙ мһҲм—ҲмқҢмқ„ мҰқлЎҖліҙкі н•ҳмҳҖлӢӨ. ліё мҰқлЎҖм—җм„ңлҸ„ кө¬м ңмҡ”лІ•мңјлЎң bortezomibмқҙ нҲ¬м—¬лҗҳм—ҲмңјлӮҳ мқҙлҜё лі‘мқҙ л„Ҳл¬ҙ 진н–үн•ң мғҒнғңм—¬м„ң мқјм°Ё м№ҳлЈҢмқҳ л°ҳмқ‘мқ„ нҷ•мқён•ҳкё° м „м—җ нҷҳмһҗк°Җ мӮ¬л§қн•ҳмҳҖлӢӨ. кі лҰҪм„ұ кіЁмҲҳмҷё нҳ•м§Ҳм„ёнҸ¬мў… мӨ‘ м•Ҫ 30%м—җм„ңлҠ” лӢӨл°ңкіЁмҲҳмў…мңјлЎң 진н–үн•ҳкұ°лӮҳ мһ¬л°ңн•ҳкІҢ лҗҳлҠ” лӢӨм–‘н•ң мһ„мғҒм–‘мғҒмқ„ ліҙмқҙлҠ” кІҪмҡ°лҸ„ мһҲкі [5] ліё мҰқлЎҖмҷҖ к°ҷмқҙ кІҪмҡ°м—җ л”°лқјм„ңлҠ” л§Өмҡ° кёүмҶҚлҸ„лЎң 진н–үн•ҳлҠ” кІҪмҡ°лҸ„ мһҲмңјлҜҖлЎң мўҖлҚ” нҡЁкіјм Ғмқё м№ҳлЈҢлІ•мқҳ м •лҰҪмқҙ н•„мҡ”н•ҳл©° мқҙмҷҖ к°ҷмқҖ мӮ¬лЎҖм—җм„ң ліҙн—ҳ кёүм—¬мқҳ м Ғмҡ© лІ”мң„к°Җ нҷ•лҢҖлҗ н•„мҡ”лҸ„ мһҲмқ„ кІғмңјлЎң ліҙмқёлӢӨ.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






