м„ң лЎ
м„ұмқё нҳҲм „м„ұнҳҲмҶҢнҢҗк°җмҶҢмһҗл°ҳмҰқ(thrombotic thrombocytopenic purpura, TTP)мқҖ лҜём„ёнҳҲкҙҖлі‘мҡ©нҳҲл№ҲнҳҲ(microangiopathic hemolytic anemia)кіј нҳҲмҶҢнҢҗк°җмҶҢмҰқмқҙ лҸҷл°ҳлҗң нҳҲм „лҜём„ёнҳҲкҙҖлі‘мҰқ(thrombotic microangiopathy)мқ„ нҠ№м§•мңјлЎң н•ҳл©° мӢ кІҪн•ҷм Ғ мқҙмғҒ, мӢ кё°лҠҘмһҘм• , л°ңм—ҙ л“ұмқҙ лҸҷл°ҳлҗ мҲҳ мһҲлҠ” 비көҗм Ғ л“ңл¬ё нҳҲм•Ўм§ҲнҷҳмңјлЎң a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member of 13 (ADAMTS-13)мқҳ кІ°н•Қ нҳ№мқҖ нҷңм„ұлҸ„ м Җн•ҳк°Җ кҙҖм—¬н•ҳлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ[1]. нҳҲмһҘкөҗнҷҳмҲ м—җ л¶Ҳмқ‘н•ҳкұ°лӮҳ мһ¬л°ңн•ң м„ұмқё нҠ№л°ңм„ұ TTPмқҳ кІҪмҡ° Bм„ёнҸ¬ лҰјн”„кө¬мқҳ н‘ңл©ҙ н•ӯмӣҗмқё CD20м—җ лҢҖн•ң лӢЁмқјнҒҙлЎ н•ӯмІҙмқё rituximabмқ„ мқҙмҡ©н•ң м№ҳлЈҢк°Җ нҡЁкіјк°Җ мһҲмқҢмқҙ лӢӨмҲҳмқҳ мҰқлЎҖ л°Ҹ мҶҢк·ңлӘЁ м—°кө¬лҘј нҶөн•ҳм—¬ ліҙкі лҗҳм–ҙ мһҲлҠ”лҚ° лҢҖл¶Җ분 1нҡҢ нҲ¬м•Ҫ мӢң 375 mg/m2мқҳ мҡ©лҹүмқ„ мӮ¬мҡ©н•ҳмҳҖлӢӨ[2-4]. мқҙлҠ” лҰјн”„кі„ мў…м–‘ л°Ҹ мқјл¶Җ мһҗк°Җл©ҙм—ӯм§Ҳнҷҳм—җм„ң мӮ¬мҡ©лҗҳлҠ” нҶөмғҒм Ғмқё мҡ©лҹү л°Ҹ мҡ©лІ•м—җ л”°лҘё кІғмңјлЎң мӢӨм ң м„ұмқёмқҳ TTPм—җм„ң rituximabмқҳ м Ғм Ҳн•ң мҡ©лҹүм—җ лҢҖн•ҳм—¬ кө¬мІҙм ҒмңјлЎң м—°кө¬лҗң л°”лҠ” м—ҶлӢӨ. м Җмһҗл“ӨмқҖ нҳҲмһҘкөҗнҷҳмҲ кіј л¶ҖмӢ н”јм§ҲмҠӨн…ҢлЎңмқҙл“ң м ңм ңм—җ л¶Ҳмқ‘м„ұмқё м„ұмқёмқҳ нҠ№л°ңм„ұ TTPм—җм„ң мғҒлҢҖм ҒмңјлЎң м ҒмқҖ мҡ©лҹүмқ„ нҲ¬м—¬н•ң нӣ„ кҙҖн•ҙм—җ мқҙлҘҙкІҢ лҗң мҰқлЎҖлҘј кІҪн—ҳн•ҳмҳҖкё°м—җ мқҙлҘј ліҙкі н•ҳкі мһҗ н•ңлӢӨ.
мҰқ лЎҖ
лІ нҠёлӮЁ м¶ңмӢ мқҳ 27м„ё лӮЁм„ұ мҷёкөӯмқё к·јлЎңмһҗлЎң, нҠ№лі„н•ң кіјкұ° лі‘л ҘмқҖ м—Ҷм—ҲлӢӨ. лӮҙмӣҗ 3мқј м „ л°ңм—ҙк°җкіј л¬ҙл Ҙк°җмңјлЎң к°ңмқё мқҳмӣҗм—җ лӮҙмӣҗн•ҳмҳҖкі , мғҒкё°лҸ„к°җм—јм—җ мӨҖн•ң 3мқјк°„мқҳ м•Ҫл¬ј м№ҳлЈҢ нӣ„м—җ мҰқмғҒмқҙ нҳём „лҗҳм§Җ м•Ҡм•„ мӢңн–үн•ң л§җмҙҲнҳҲм•Ў м „нҳҲкө¬кІҖмӮ¬м—җм„ң л№ҲнҳҲ кіј нҳҲмҶҢнҢҗ к°җмҶҢмҰқмқҙ л°ңкІ¬лҗҳм—Ҳкі , мҳӨн•ңкіј л°ңм—ҙк°җ л°Ҹ л¬ҙл Ҙк°җмқҙ лҚ”мҡұ мӢ¬н•ҙм§җмқ„ нҳёмҶҢн•ҳм—¬ ліёмӣҗмңјлЎң м „мӣҗлҗҳм—ҲлӢӨ.
лӮҙмӣҗ м§Ғнӣ„ мӢ мІҙкІҖмӮ¬м—җм„ң нҳҲм••мқҖ 110/60 mmHg, л§Ҙл°•мқҖ 105нҡҢ/분, нҳёнқЎмҲҳлҠ” 22нҡҢ/분, мІҙмҳЁмқҖ 38.5в„ғмҳҖлӢӨ. мқҳмӢқмқҖ лӘ…лЈҢн•ҳмҳҖмңјл©°, кёүм„ұ лі‘мғүмқ„ лқ„кі кІ°л§үмқҖ м°Ҫл°ұн•ҳмҳҖлӢӨ. мӢ кІҪн•ҷм Ғ мқҙмғҒмҶҢкІ¬мқҖ ліҙмқҙм§Җ м•Ҡм•ҳмңјл©°, нқүл¶Җ мІӯ진 кІ°кіјлҠ” м •мғҒмқҙм—ҲлӢӨ. ліөл¶ҖлҠ” л¶Җл“ңлҹҪкі нҢҪл§Ңлҗҳм–ҙ мһҲм§Җ м•Ҡм•ҳмңјл©°, мһҘмқҢмқҖ м •мғҒмқҙм—Ҳкі м••нҶөмқҙлӮҳ л°ҳл°ңнҶөлҸ„ м—Ҷм—ҲлӢӨ. к°„ л°Ҹ 비мһҘмқҳ мў…лҢҖлҘј кҙҖм°°н• мҲҳ м—Ҷм—ҲлӢӨ. мІҷ추лҠ‘кіЁк°Ғм••нҶөмқҙлӮҳ м–‘ н•ҳм§Җмқҳ н•Ёмҡ”л¶Җмў…мқҖ м—Ҷм—ҲлӢӨ.
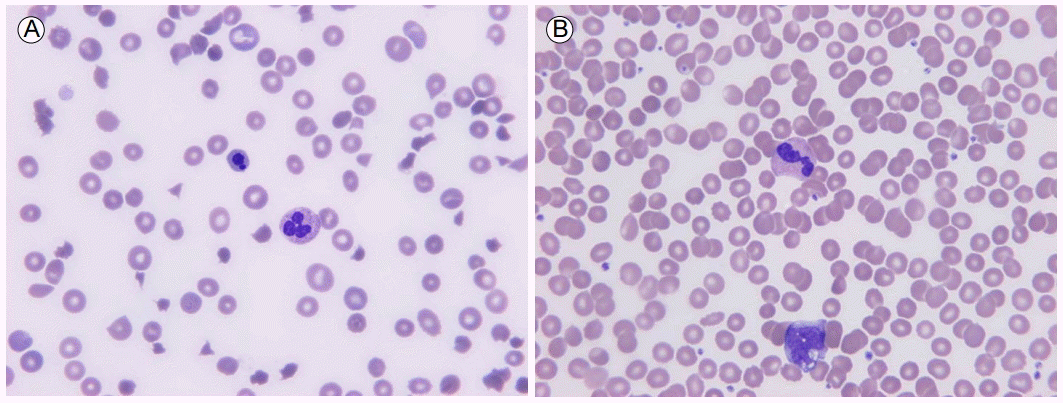
мһ…мӣҗ м§Ғнӣ„ мӢңн–үн•ң л§җмҙҲнҳҲм•Ў м „нҳҲкө¬кІҖмӮ¬ кІ°кіјлҠ” нҳҲмғүмҶҢ 5.1 g/dL, м ҒнҳҲкө¬ мҡ©м ҒлҘ 15.3%, л°ұнҳҲкө¬ 6,040/mm3 (нҳёмӨ‘кө¬ 62%, лҰјн”„кө¬ 22%, лӢЁн•өкө¬ 11%), нҳҲмҶҢнҢҗ 18,000/mm3мқҙм—ҲлӢӨ. л§қмғҒм ҒнҳҲкө¬к°Җ 17.5%лЎң мҰқк°Җлҗҳм–ҙ мһҲм—Ҳкі , haptoglobinмқҖ 20 mg/dL лҜёл§ҢмңјлЎң мёЎм •лҗҳм—ҲлӢӨ. л§җмҙҲнҳҲм•ЎлҸ„л§җ кІҖмӮ¬м—җм„ң кі л°°мңЁ мӢңм•ј лӢ№ 3к°ң мқҙмғҒмқҳ лӢӨмҲҳмқҳ (3+) 분м—ҙм ҒнҳҲкө¬(schistocyte)к°Җ нҷ•мқёлҗҳм—ҲлӢӨ(Fig. 1A). мқјл°ҳнҷ”н•ҷ нҳҲм•Ў кІҖмӮ¬м—җм„ң мҙқ лӢЁл°ұ 5.9 g/dL, м•Ңл¶ҖлҜј 3.6 g/dL, AST/ALT 40/17 IU/L, мҙқ л№ҢлҰ¬лЈЁл№Ҳ 1.9 mg/dL, мҡ”мҶҢм§ҲмҶҢ 13.9 mg/dL, нҳҲмІӯ нҒ¬л Ҳм•„нӢ°лӢҢ 0.7 mg/dL, м –мӮ° нғҲмҲҳмҶҢнҡЁмҶҢ(lactate dehydrogenase, LDH) 2,612 IU/L (м •мғҒлІ”мң„ 200-485), C-л°ҳмқ‘лӢЁл°ұм§Ҳ 0.91 mg/dLмқҳ кІ°кіјлҘј м–»м—ҲлӢӨ. н”„лЎңнҠёлЎ¬л№Ҳ мӢңк°„ 11.8мҙҲ(м •мғҒлІ”мң„ 9.5-13мҙҲ), нҷңм„ұнҷ” л¶Җ분프лЎңнҠёлЎ¬л№Ҳ мӢңк°„ 28.9мҙҲ(м •мғҒлІ”мң„ 25-39.5мҙҲ), D-dimerлҠ” 0.16 Ојg/mL (м •мғҒлІ”мң„ вүӨ 0.23 Ојg/mL)мқҙм—ҲлӢӨ. м§Ғм ‘ н•ӯкёҖлЎңлё”лҰ° кІҖмӮ¬ л°Ҹ к°„м ‘ н•ӯкёҖлЎңлё”лҰ° кІҖмӮ¬ лӘЁл‘җ мқҢм„ұмқҙм—ҲлӢӨ. к°Ғмў… мһҗк°Җл©ҙм—ӯ н•ӯмІҙкІҖмӮ¬(н•ӯн•өн•ӯмІҙ, н•ӯмқҙмӨ‘мҮ„DNAн•ӯмІҙ, н•ӯRo л°Ҹ н•ӯLa н•ӯмІҙ, н•ӯмқём§Җм§Ҳн•ӯмІҙ л°Ҹ н•ӯм№ҙл””мҳӨлҰ¬н•Җн•ӯмІҙ) кІ°кіјлҠ” лӘЁл‘җ мқҢм„ұмқҙм—ҲлӢӨ. мһ…мӣҗ лӢ№мӢң мӢңн–үн•ң л§җмҙҲнҳҲм•Ў л°°м–‘кІҖмӮ¬м—җм„ң лҸҷм •лҗң к· мқҖ м—Ҷм—Ҳкі нқүл¶Җ л°Ҹ ліөл¶Җ-кіЁл°ҳл¶Җмң„мқҳ м»ҙн“Ён„° лӢЁмёөмҙ¬мҳҒм—җм„ң м•…м„ұмў…м–‘мқ„ мӢңмӮ¬н•ҳлҠ” лі‘ліҖ л“ұ мқјмІҙмқҳ мқҙмғҒмҶҢкІ¬мқҖ м—Ҷм—ҲлӢӨ.
분м—ҙм ҒнҳҲкө¬мқҳ мЎҙмһ¬лҘј нҷ•мқён•ң м§Ғнӣ„ TTPлҘј мқҳмӢ¬н•ҳм—¬ мҰүмӢң 1мқј 1нҡҢмқҳ нҳҲмһҘкөҗнҷҳмҲ мқ„ мӢңмһ‘н•ҳмҳҖлӢӨ. нҳҲмһҘкөҗнҷҳмҲ мқ„ мӢңмһ‘н•ңм§Җ м ң3мқјм§ё л°ңм—ҙмқҙ мҶҢмӢӨлҗҳл©ҙм„ң нҳҲмҶҢнҢҗ мҲҳм№ҳк°Җ 120,000/mm3мңјлЎң, м ң4мқјм§ё 162,000/mm3мңјлЎң мғҒмҠ№н•ҳкі л§җмҙҲнҳҲм•ЎлҸ„л§җ кІҖмӮ¬м—җм„ң 분м—ҙм ҒнҳҲкө¬мқҳ к°җмҶҢ(1+)лҘј нҷ•мқён•ҳмҳҖлӢӨ. мқҙм—җ нҳҲмһҘкөҗнҷҳмҲ м ң7мқјм§ё нҳҲмһҘкөҗнҷҳмҲ мқ„ мӨ‘лӢЁн•ҳмҳҖмңјлӮҳ м ң9мқјм§ё нҳҲмҶҢнҢҗ мҲҳм№ҳк°Җ лӢӨмӢң 16,000/mm3мңјлЎң к°җмҶҢн•ҳкі , нҳҲмІӯ LDHмқҳ мҰқк°ҖмҷҖ 분м—ҙм ҒнҳҲкө¬мқҳ мҰқк°Җк°Җ ліҙм—¬(2-3+) нҳҲмһҘкөҗнҷҳмҲ м№ҳлЈҢлҘј мһ¬к°ңн•ҳмҳҖлӢӨ. нҳҲмһҘкөҗнҷҳмҲ мқ„ мң м§Җн•ҳмҳҖмңјлӮҳ нҳҲмҶҢнҢҗ мҲҳмқҳ мҰқк°ҖмҷҖ мҡ©нҳҲм„ұ л№ҲнҳҲмқҳ к°җмҶҢк°Җ м „нҳҖ мқҙлЈЁм–ҙм§Җм§Җ м•Ҡм•„ м ң32мқјм§ё methylprednisolone 60 mg/мқј м •л§Ҙ мЈјмӮ¬лҘј лі‘мҡ©н•ҳкі көҗнҷҳн•ҳлҠ” нҳҲмһҘлҹүмқ„ 1.5-2л°°лЎң лҠҳл Ө ліҙм•ҳлӢӨ. 7мқјк°„мқҳ мҠӨн…ҢлЎңмқҙл“ң м ңм ң лі‘мҡ©м—җлҸ„ л¶Ҳкө¬н•ҳкі лӢөліҙ мғҒнғңлҘј мң м§Җн•ҳлҚҳ мӨ‘ м ң37мқјл¶Җн„° л¬ҙкё°л Ҙн•Ёмқ„ нҳёмҶҢн•ҳлҚ”лӢҲ м ң39мқјм—җлҠ” нҳҲмҶҢнҢҗмқҙ лҚ”мҡұ к°җмҶҢн•ҳкі (13,000/mm3) нҳҲмІӯ LDHмқҳ мҰқк°Җ 추세мҷҖ н•Ёк»ҳ мқҳмӢқмқҙ лӘ…лЈҢн•ҳм§Җ лӘ»н•ң мҰқмғҒк№Ңм§Җ лҸҷл°ҳлҗҳм–ҙ нҳҲмһҘкөҗнҷҳмҲ кіј мҠӨн…ҢлЎңмқҙл“ң м№ҳлЈҢ л¶Ҳмқ‘м„ұмңјлЎң нҢҗлӢЁн•ҳмҳҖлӢӨ. мқҙм—җ rituximab мЈјмӮ¬ мӮ¬мҡ©мқ„ кі л Өн•ҳкё°лЎң н•ҳмҳҖмңјлӮҳ, кІҪм ңм Ғмқё мӮ¬м •мңјлЎң мқён•ҙ м№ҳлЈҢ кІ°м •мқ„ лӘ»н•ҳкі мһҲлҚҳ мӨ‘, мӣҗлӮҙм—җм„ң Bм„ёнҸ¬ лҰјн”„мў… нҷҳмһҗл“Өм—җкІҢ мӮ¬мҡ©н•ҳкі лӮЁмқҖ rituximabмқ„ м Җмҡ©лҹүмңјлЎң мӮ¬мҡ©н•ҙ ліҙкё°лЎң н•ҳмҳҖлӢӨ. мһ…мӣҗ м ң39мқјм—җ нҳҲмҶҢнҢҗ мҲҳм№ҳ 13,000/mm3, LDHк°Җ 523 IU/L, л§җмҙҲнҳҲм•ЎлҸ„л§җм—җм„ң 분м—ҙм ҒнҳҲкө¬к°Җ лӢӨмҲҳ кҙҖм°°лҗҳлҠ” мғҒнғңм—җм„ң нҳҲмһҘкөҗнҷҳмҲ м§Ғнӣ„м—җ rituximabмқ„ 250 mg (150 mg/m2) мЈјмӮ¬н•ҳмҳҖлӢӨ. мЈјмӮ¬ нӣ„м—җлҸ„ нҳҲмҶҢнҢҗк°җмҶҢмҰқкіј LDH мғҒмҠ№мқҖ м§ҖмҶҚлҗҳм—Ҳкі мһ…мӣҗ м ң46мқјм—җ rituximab 100 mg (60 mg/m2)мқ„ мһ¬м°Ё м •л§Ҙ мЈјмӮ¬н•ҳмҳҖлӢӨ. м ң47мқјл¶Җн„° кІҖмӮ¬мҶҢкІ¬ л°Ҹ мҰқмғҒмқҳ нҳём „мқҙ лӮҳнғҖлӮҳкё° мӢңмһ‘н•ҳм—¬ м ң49мқјм—җлҠ” нҳҲмҶҢнҢҗ 189,000/mm3, LDH 483 IU/L, л§җмҙҲнҳҲм•ЎлҸ„л§җм—җм„ң 분м—ҙм ҒнҳҲкө¬мқҳ к°җмҶҢк°Җ(1+) нҷ•мқёлҗҳм–ҙ, мқҙм—җ нҳҲмһҘкөҗнҷҳмҲ мқҖ м ң49мқј мқҙнӣ„ мӨ‘лӢЁн•ҳкі мҠӨн…ҢлЎңмқҙл“ңлҠ” м җ진м ҒмңјлЎң к°җлҹүн•ҳмҳҖлӢӨ. нҳҲмһҘкөҗнҷҳмҲ мӨ‘лӢЁ нӣ„м—җлҸ„ TTPмқҳ м•…нҷ” л°Ҹ мһ¬л°ңмқҖ м—Ҷм—Ҳкі , мқҙнӣ„ нҳҲмҶҢнҢҗ мҲҳм№ҳ 322,000/mm3, LDH 456 IU/Lк№Ңм§Җ м •мғҒлІ”мң„лЎң мҷ„м „нһҲ нҡҢліөлҗҳм—ҲлӢӨ. мқҙм–ҙм„ң мқјмЈјмқј к°„кІ©мңјлЎң 3м°Ё л°Ҹ 4м°Ёмқҳ rituximab 100 mgмқ„ мЈјмӮ¬н•ҳмҳҖлӢӨ. л§Ҳм§Җл§ү 4м°Ёмқҳ rituximab мӮ¬мҡ©мӢң нҳҲмҶҢнҢҗ мҲҳм№ҳ 198,000/mm3, LDHк°Җ 416 IU/L, л§җмҙҲнҳҲм•ЎлҸ„л§җм—җм„ң 분м—ҙм ҒнҳҲкө¬мқҳ л‘җл“ңлҹ¬м§„ к°җмҶҢлҘј ліҙм—¬ rituximab м№ҳлЈҢмқҳ мў…лЈҢ л°Ҹ нҮҙмӣҗмқ„ кІ°м •н•ҳмҳҖлӢӨ. нҮҙмӣҗ лӢ№мӢң methyprednisoloneмқҖ 20 mg/мқјлЎң к°җлҹүн•ҳм—¬ мӮ¬мҡ© мӨ‘мқҙм—Ҳмңјл©° нҮҙмӣҗ нӣ„ мҷёлһҳм—җм„ң 2мЈј лҸҷм•Ҳ м җ진м ҒмңјлЎң мҡ©лҹүмқ„ мӨ„мқё нӣ„ мӨ‘лӢЁн•ҳмҳҖлӢӨ. Rituximab м№ҳлЈҢ мӨ‘ нҲ¬м•Ҫкіј м—°кҙҖлҗң нҠ№лі„н•ң л¶Җмһ‘мҡ©мқҖ м—Ҷм—ҲлӢӨ. л§Ҳм§Җл§ү rituximab нҲ¬м—¬мқј нӣ„ м ң150мқј(нҳҲмһҘкөҗнҷҳмҲ мӢңмһ‘ нӣ„ 189мқј)м—җ нҳҲмҶҢнҢҗ 234,000/mm3, LDH 344 IU/L, л§җмҙҲнҳҲм•ЎлҸ„л§җм—җм„ң 분м—ҙм ҒнҳҲкө¬ мқҢм„ұмқҳ мҶҢмӢӨмқ„ ліҙмҳҖлӢӨ(Fig. 1B). мһ…мӣҗ мҙҲкё° нҳҲмһҘкөҗнҷҳмҲ к°ңмӢң м§Ғм „ мёЎм •н•ң ADAMTS-13мқҳ нҷңм„ұлҸ„лҠ” 추нӣ„ ліҙкі лҗҳм—Ҳкі 3% лҜёл§Ңмқҙм—ҲлӢӨ.
кі м°°
м„ұмқё TTPмқҳ мӣҗмқём—җлҠ” м•Ҫм ңм—җ мқҳн•ҳм—¬ мҙҲлһҳлҗң кІҪмҡ°, м „мӢ м„ұнҷҚл°ҳм„ұлӮӯм°Ҫ л“ұмқҳ мһҗк°Җл©ҙм—ӯм§Ҳнҷҳкіј лҸҷл°ҳлҗң кІҪмҡ°, мһ„мӢ л°Ҹ м•…м„ұ мў…м–‘м—җ кё°мқён•ҳлҠ” кІҪмҡ° л“ұмқҙ мһҲмңјлӮҳ нҠ№лі„н•ң мӣҗмқёмқ„ м°ҫмқ„ мҲҳ м—ҶлҠ” кІҪмҡ°(idiopathic, нҠ№л°ңм„ұ)к°Җ к°ҖмһҘ л§ҺмқҖ кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ[1,5]. 206лӘ…мқҳ м„ұмқё TTP нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң мЎ°мӮ¬н•ң л°”м—җ л”°лҘҙл©ҙ 37%к°Җ нҠ№лі„н•ң мӣҗмқёмқ„ м°ҫмқ„ мҲҳ м—ҶлҠ” кІҪмҡ°лЎң к°ҖмһҘ л§Һм•ҳкі м•Ҫм ңм—җ мқҳн•ң кІҪмҡ°к°Җ 13%, мһҗк°Җл©ҙм—ӯм§Ҳнҷҳкіј м—°кҙҖлҗң кІҪмҡ°к°Җ 13%лЎң к·ё л’ӨлҘј мқҙм—ҲлӢӨ[5]. нҠ№л°ңм„ұмқҳ м„ұмқё TTPмқҳ кІҪмҡ° ADAMTS-13м—җ лҢҖн•ң IgG мһҗк°Җн•ӯмІҙ мғқм„ұм—җ мқҳн•ҳм—¬ ADAMTS-13мқҙ м–өм ңлҗҳкұ°лӮҳ ADAMTS-13-мһҗк°Җн•ӯмІҙ ліөн•©мІҙлҘј нҳ•м„ұн•ЁмңјлЎңмҚЁ ADAMTS-13мқҳ мІӯмҶҢмңЁмқҙ мҰқк°Җлҗҳм–ҙ нӣ„мІңм ҒмңјлЎң ADAMTS-13мқҳ кІ°н•Қмқҙ мҙҲлһҳлҗҳлҠ” мһҗк°Җл©ҙм—ӯкё°м „мқҙ лі‘мқёмңјлЎң м ңм•Ҳлҗҳкі мһҲлӢӨ[6]. лі‘мқҳ кІҪкіјлҠ” лӢЁ н•ң лІҲмқҳ л°ңлі‘л§Ң ліҙмқҙкё°лҸ„ н•ҳм§Җл§Ң нҡҢліө нӣ„ мһ¬л°ңн• мҲҳ мһҲкі , м№ҳлЈҢм—җ л°ҳмқ‘мқҙ м—Ҷкұ°лӮҳ мһ¬л°ңн•ҳлҠ” кІҪмҡ°лҠ” мқҙнҷҳмңЁ л°Ҹ мӮ¬л§қлҘ мқҙ лҶ’лӢӨ[7].
нҳҲмһҘкөҗнҷҳмҲ мқҙ TTPмқҳ мЈјлҗң м№ҳлЈҢлІ•мңјлЎң лҸ„мһ…лҗң мқҙнӣ„ мӮ¬л§қлҘ мқҖ 95%м—җм„ң 20% лҢҖлЎң к°җмҶҢн•ҳмҳҖкі , мҷ„м№ҳмңЁлҸ„ 50-80%м—җ мқҙлҘҙм§Җл§Ң, 35-50%мқҳ нҷҳмһҗк°Җ нҳҲмһҘкөҗнҷҳмҲ лЎң кҙҖн•ҙлҘј м–»мқҖ нӣ„ TTPк°Җ мһ¬л°ңн•ҳл©°, 10-20%м—җм„ңлҠ” мҙҲкё°л¶Җн„° нҳҲмһҘкөҗнҷҳмҲ м№ҳлЈҢм—җ л°ҳмқ‘мқҙ м—ҶлӢӨ. мһ¬л°ң кІҪкіјлҘј ліҙмқҙлҠ” кІҪмҡ°, лі‘м Ғмқё мһҗк°Җн•ӯмІҙлҘј м–өм ңн•ҳкё° мң„н•ң лӢӨм–‘н•ң л©ҙм—ӯм–өм ңм ңмқҳ мӮ¬мҡ©мқҙ мӢңлҸ„лҗҳлҠ”лҚ° л¶ҖмӢ н”јм§ҲмҠӨн…ҢлЎңмқҙл“ң м ңм ң л°Ҹ vincristineмқҙлӮҳ cyclophosphamide л“ұмқҳ н•ӯм•”м ң нҲ¬м—¬, 비мһҘм Ҳм ңмҲ л“ұмқҙ нҳҲмһҘкөҗнҷҳмҲ кіј н•Ёк»ҳ лҳҗлҠ” лӢЁлҸ…мңјлЎң мӮ¬мҡ©лҗҳм–ҙ мҷ”лӢӨ[1,2,5-7].
м„ұмқёмқҳ нҠ№л°ңм„ұ TTPм—җм„ң нҳҲмһҘкөҗнҷҳмҲ м—җ л°ҳмқ‘н•ҳм§Җ м•Ҡкі мӢ кІҪн•ҷм Ғ мҰқмғҒмқҳ м•…нҷ” л“ұ мӢ¬к°Ғн•ң мһ„мғҒ кІҪкіјлҘј ліҙмқҙлҠ” нҷҳмһҗ, л¶ҖмӢ н”јм§ҲмҠӨн…ҢлЎңмқҙл“ң м ңм ңлҘј нҳҲмһҘкөҗнҷҳмҲ кіј н•Ёк»ҳ мӮ¬мҡ©н•ҙлҸ„ мҰқмғҒмқҙ нҳём „лҗҳм§Җ м•ҠлҠ” нҷҳмһҗ л°Ҹ мһ¬л°ң нҷҳмһҗл“Өм—җкІҢ rituximabмқҙ нҡЁкіјк°Җ мһҲмқҢмқҖ, TTPмқҳ мң лі‘лҘ мқҙ лҶ’м§Җ м•Ҡм•„ 비лЎқ лҢҖк·ңлӘЁмқҳ мһ„мғҒмӢңн—ҳмқ„ нҶөн•ң кІ°кіјлҠ” м—Ҷм§Җл§Ң л§ҺмқҖ мҰқлЎҖліҙкі мҷҖ лӢӨмҲҳмқҳ мҶҢк·ңлӘЁ м—°кө¬л“Өмқ„ нҶөн•ҳм—¬ лҲ„м Ғлҗң к·јкұ°к°Җ н’Қл¶Җн•ҳлӢӨ[2,3]. RituximabмңјлЎң мқён•ң B лҰјн”„кө¬мқҳ кі к°Ҳ(depletion)лЎң ADAMTS-13м—җ лҢҖн•ң IgG мһҗк°Җн•ӯмІҙмқҳ мғқм„ұмқҙ м–өм ңлҗҳм–ҙ кІ°кіјм ҒмңјлЎң ADAMTS-13мқҳ нҷңм„ұлҸ„к°Җ мҰқк°Җн•ҳлҠ” кІғмқҙ мЈјлҗң кё°м „мңјлЎң м•Ңл Өм ё мһҲмңјл©°[2,8] лҳҗн•ң кұ°лҢҖн•ң нҸ° л№Ңл ҲлёҢлһҖнҠё мқёмһҗмқҳ мӨ‘н•©мІҙ(multimer)мқҳ мғқм„ұмқ„ мһҗк·№н•ҳлҠ” мӢёмқҙнҶ м№ҙмқёл“Өмқҳ кіјлӢӨн•ң 분비лҘј rituximabмқҙ м–өм ңн•ҳлҠ” кІғлҸ„ к°ҖлҠҘн•ң кё°м „мңјлЎң м ңмӢңлҗҳкі мһҲлӢӨ[2].
Rituximabмқҳ м Ғм • мҡ©лҹү л°Ҹ нҲ¬м—¬ л°©лІ•м—җ лҢҖн•ҙм„ңлҠ” м•„м§Ғ м •лҰҪлҗң л°”к°Җ м—ҶлҠ”лҚ°, лӢӨмҲҳмқҳ мҰқлЎҖм—җм„ң м•…м„ұ Bм„ёнҸ¬ лҰјн”„кө¬мҰқмӢқм„ұ м§Ҳнҷҳм—җм„ң мӮ¬мҡ©н•ҳлҠ” кІғкіј к°ҷмқҙ 7мқј к°„кІ©мңјлЎң 375 mg/m2мқҳ мҡ©лҹүмқ„ мҙқ 4м°ЁлЎҖ нҲ¬м—¬н•ҳмҳҖлӢӨ. м„ұмқё нҠ№л°ңм„ұ TTPм—җм„ң rituximab м№ҳлЈҢм—җ лҢҖн•ң л‘җ к°ңмқҳ мІҙкі„м Ғ л¬ён—Ңкі м°°(systematic review)м—җм„ңлҠ” м „мІҙ нҷҳмһҗмқҳ м•Ҫ 93%м—җм„ң rituximabмқҳ нҡЁкіјлҘј кё°лҢҖн• мҲҳ мһҲлӢӨкі л¶„м„қн•ҳкі мһҲкі [2,3], 25лӘ…мқҳ нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң м№ҳлЈҢн•ҳмҳҖмқ„ л•Ң лӘЁл‘җк°Җ rituximab нҲ¬м•Ҫ нӣ„ TTPмқҳ кҙҖн•ҙлҘј нҡҚл“қн–Ҳкі , кҙҖн•ҙк№Ңм§Җмқҳ мӢңк°„мқҖ нҲ¬м•Ҫ мӢңмһ‘мңјлЎңл¶Җн„° нҡҢліөк№Ңм§Җ мӨ‘м•ҷк°’ 11мқјмһ„мқ„ ліҙкі н•ң кІғмқҙ нҳ„мһ¬к№Ңм§Җ лӢЁмқј м—°кө¬лЎңм„ң к°ҖмһҘ л§ҺмқҖ мҲҳмқҳ нҷҳмһҗл“Өмқ„ 분м„қн•ң м—°кө¬мқҙлӢӨ[4]. н”„лһ‘мҠӨм—җм„ң 22лӘ…мқҳ нҳҲмһҘкөҗнҷҳмҲ л¶Ҳмқ‘м„ұмқҳ TTPлҘј лҢҖмғҒмңјлЎң н•ң м „н–Ҙм Ғ м—°кө¬м—җм„ңлҠ” rituximab мӮ¬мҡ©мқҙ м „мІҙ м№ҳлЈҢ кё°к°„мқ„ мӨ„мқҙкі кіјкұ° м—°кө¬м—җм„ңмқҳ нҷҳмһҗ лҢҖмЎ°кө°кіј 비көҗн• л•Ң 1л…„ мһ¬л°ңлҘ лҸ„ мӨ„мқёлӢӨкі ліҙкі н•ҳмҳҖлӢӨ[9]. нҠ№мқҙн• л§Ңн•ң мӮ¬н•ӯмқҖ, нҲ¬м—¬ нӣ„мқҳ нҳҲмһҘкөҗнҷҳмҲ лЎң мқён•ҳм—¬ rituximabмқҙ мІҙлӮҙм—җм„ң м ңкұ°лҗ мҲҳ мһҲлӢӨлҠ” мҡ°л Өм—җлҸ„ л¶Ҳкө¬н•ҳкі л§Өмқјмқҳ нҳҲмһҘкөҗнҷҳмҲ мқ„ мң м§Җн•ҳл©ҙм„ң rituximabмқ„ мӮ¬мҡ©н•ҳлҚ”лқјлҸ„ rituximabмқҳ м№ҳлЈҢ нҡЁкіјк°Җ ліҙмЎҙлҗңлӢӨлҠ” м җмқҙлӢӨ[8,10]. McDonald л“ұ[8]мқҖ rituximabмңјлЎң м№ҳлЈҢл°ӣмқҖ TTP нҷҳмһҗл“Өмқҳ л§җмҙҲнҳҲм•Ўм—җм„ңмқҳ Bм„ёнҸ¬ кі к°Ҳмқҳ м •лҸ„мҷҖ мӢӨм ң мӮ¬мҡ©н•ң rituximabмқҳ лҲ„м Ғлҹү л°Ҹ нҳҲмһҘкөҗнҷҳмҲ мқҳ нҡҹмҲҳ мӮ¬мқҙм—җлҠ” м—°кҙҖ кҙҖкі„к°Җ м—ҶмқҢмқ„ нҷ•мқён•ҳмҳҖлҠ”лҚ° мқҙлҠ” нҶөмғҒм Ғмқё мӮ¬мҡ© мҡ©лҹүмқё 375 mg/m2мқҙ мӢӨм ң н•„мҡ”н•ң м№ҳлЈҢм Ғ мҡ©лҹүмқ„ мҙҲкіјн•ҳлҠ” м–‘мқј к°ҖлҠҘм„ұмқ„ мӢңмӮ¬н•ңлӢӨ.
ліё мҰқлЎҖм—җм„ң нҷҳмһҗлҠ” нҳҲмһҘкөҗнҷҳмҲ м§Ғнӣ„ мқјмӢң нҳём „ кІҪкіјлҘј ліҙмҳҖмңјлӮҳ кі§ м•…нҷ”лҗҳлҠ” кІҪкіјлҘј ліҙмҳҖкі , мҠӨн…ҢлЎңмқҙл“ң м ңм ңлҘј лі‘мҡ©н•ҳмҳҖмқҢм—җлҸ„ кҙҖн•ҙк°Җ лҗҳм§Җ лӘ»н•ҳмҳҖлӢӨ. мқҙм—җ нҳҲмһҘкөҗнҷҳмҲ л°Ҹ мҠӨн…ҢлЎңмқҙл“ңм—җ л°ҳмқ‘н•ҳм§Җ м•ҠлҠ” TTPлЎң нҢҗлӢЁн•ҳм—¬ м Җмҡ©лҹүмқҳ rituximabмқ„ мӮ¬мҡ©н•ҳмҳҖлӢӨ. Rituximab нҲ¬м•ҪмқҖ нҳҲмһҘкөҗнҷҳмҲ кіј н•Ёк»ҳ мқҙлЈЁм–ҙмЎҢмңјл©°, нҳҲмһҘкөҗнҷҳмҲ мқ„ нҶөн•ң м•Ҫмқҳ мҶҢмӢӨмқ„ мөңмҶҢнҷ”н•ҳкё° мң„н•ҳм—¬ нҳҲмһҘкөҗнҷҳмҲ м§Ғнӣ„ rituximabмқ„ мЈјмӮ¬н•ҳмҳҖлӢӨ. Rituximabмқҳ мІ« нҲ¬м—¬ нӣ„ м•Ҫ 9мқјм§ёл¶Җн„° нҳҲмҶҢнҢҗ мҲҳм№ҳк°Җ мғҒмҠ№н•ҳл©° LDHк°Җ к°җмҶҢн•ҳм—¬ мҷ„м „ кҙҖн•ҙм—җ мқҙлҘҙл Җмңјл©° мҳҲм •лҗҳм—ҲлҚҳ мҙқ 4нҡҢ нҲ¬м—¬лҘј мҷ„лЈҢн•ң нӣ„ мһҘкё°к°„ кҙҖн•ҙ мғҒнғңк°Җ мң м§Җлҗҳкі мһҲлӢӨ(Fig. 2). Rituximab мӮ¬мҡ© мӨ‘м—җлҸ„ нҳҲмһҘкөҗнҷҳмҲ кіј мҠӨн…ҢлЎңмқҙл“ң мӮ¬мҡ©мқ„ мң м§Җн•ҳкі мһҲм—Ҳкё°м—җ мӢӨм ң rituximabмқҙ м•„лӢҢ нҳҲмһҘкөҗнҷҳмҲ кіј мҠӨн…ҢлЎңмқҙл“ңмқҳ л’ӨлҠҰмқҖ нҡЁкіјк°Җ кҙҖн•ҙмқҳ мӣҗмқёмқј к°ҖлҠҘм„ұмқ„ м ңкё°н• мҲҳлҸ„ мһҲмңјлӮҳ, мҠӨн…ҢлЎңмқҙл“ң лі‘мҡ© мқҙнӣ„м—җлҸ„ 7мқј мқҙмғҒмқҳ нҳҲмһҘкөҗнҷҳмҲ м—җ кі„мҶҚ нҳём „мқҙ м—ҶлӢӨк°Җ rituximab мӮ¬мҡ© м§Ғм „м—җлҠ” мһ„мғҒм Ғ м•…нҷ”мҶҢкІ¬к№Ңм§Җ ліҙмҳҖлҚҳ кІҪкіјлҠ” кё°мЎҙ л¬ён—Ңл“Өмқҙ к°„мЈјн•ҳлҠ” л¶Ҳмқ‘м„ұ TTPм—җ л¶Җн•©н•ҳлҠ” м җ[2,4] л°Ҹ л§Ө нҡҢ 375 mg/m2мқҳ rituximabмқ„ мӮ¬мҡ©н–ҲлҚҳ кё°мЎҙ м—°кө¬л“Өм—җм„ң rituximab м№ҳлЈҢ мӢңмһ‘л¶Җн„° TTPмқҳ нҳём „к№Ңм§Җмқҳ мҶҢмҡ” мӢңк°„мқ„ мӨ‘м•ҷк°’ 11мқјлЎң ліҙкі н•ҳлҠ”лҚ°[2,4], мҰқлЎҖ нҷҳмһҗ м—ӯмӢң н•ҙлӢ№ мӢңм җм—җ нҡҢліөмқ„ ліҙмҳҖлҚҳ м җмқҖ rituximabмқҙ мӢӨм ңлЎң нҷҳмһҗмқҳ мһ„мғҒ кІҪкіјлҘј л°”кҫёлҠ” лҚ°м—җ кІ°м •м Ғмқё кё°м—¬лҘј н–ҲмқҢмқ„ мӢңмӮ¬н•ңлӢӨ.
Rituximab нҲ¬м—¬к°Җ мһ¬л°ң лҳҗлҠ” л¶Ҳмқ‘мқҳ м„ұмқё нҠ№л°ңм„ұ TTPмқҳ м№ҳлЈҢм—җм„ң нҳҲмһҘкөҗнҷҳмҲ л°Ҹ л©ҙм—ӯм–өм ңм№ҳлЈҢлҘј лҢҖмІҙн• мҲҳ мһҲлҠ” л°©лІ•мңјлЎң кі л Өлҗ мҲҳ мһҲмңјлӮҳ, нҳ„мһ¬к№Ңм§Җ нҲ¬м—¬ мҡ©лҹү л°Ҹ нҲ¬м—¬ кё°к°„, нҲ¬м—¬ мӢңкё°лҘј кІ°м •н•ҳлҠ” м§Җм№Ёмқҙ нҷ•лҰҪлҗҳм§Җ м•ҠмқҖ мғҒнғңмқҙлӢӨ. ліё мҰқлЎҖлҘј нҶөн•ҳм—¬ м Җмһҗл“ӨмқҖ м Җмҡ©лҹүмқҳ rituximab мӮ¬мҡ©мқ„ нҶөн•ҳм—¬ м„ұмқё нҠ№л°ңм„ұ TTPмқҳ м„ұкіөм Ғмқё м№ҳлЈҢ кІ°кіјлҘј кІҪн—ҳн•ң л°”, н–Ҙнӣ„ мғҒлҢҖм ҒмңјлЎң м ҒмқҖ мҡ©лҹүмқҳ rituximabмңјлЎңлҸ„ нҡЁкіјм Ғмқё м№ҳлЈҢк°Җ 충분нһҲ к°ҖлҠҘн• м§Җм—җ лҢҖн•ҳм—¬ 추к°Җ м—°кө¬к°Җ н•„мҡ”н• кІғмңјлЎң мғқк°ҒлҗңлӢӨ.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






