ýä£ Ùíá
ÙºÉý┤êýïáÛ▓¢ý┤êýØîÝîîÙèö Û│äýåì Ù░£ýáä ýñæýùÉ ý×êý£╝Ù®░, ÛÀ© ýÜ®ÙÅäÙèö ÝÖòý×ÑÙÉÿÛ│á ý×êÙïñ. 20ýù¼ Ùàä ýáä ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░ýØÿ ýïáÛ▓¢ý┤êýØîÝîî ýØ┤ýâüýåîÛ▓¼ýØ┤ ý▓ÿýØîý£╝Ùí£ Ù░£Ýæ£ÙÉ£ ÙÆñ[1], ý┤êÛ©░ýØÿ ýØÿÛÁ¼ýï¼Û│╝ ýêÿÙºÄýØÇ ýù░ÛÁ¼ ÙüØýùÉ ý┤êýØîÝîîÙèö Ýżý░®, ýóàýûæ, ÝÜíýáêÙï¿ Ùô▒ýØÿ ýïáÛ▓¢ýØÿ ÛÁ¼ýí░ýáü ýØ┤ýâüýØä ÝÅëÛ░ÇÝòÿÙèö ýêÿÙï¿ý£╝Ùí£ Û┤æÙ▓öý£äÝòÿÛ▓î ý×ÉÙª¼ÙºñÛ╣ÇÝòÿÛ▓î ÙÉÿýùêÙïñ. ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ýÖÇ Ýò¿Û╗ÿ ýé¼ýÜ®ÙÉÿÙèö Û▓¢ýÜ░, ÝÖÿý×É ýºäÙúîÙÑ╝ Û░£ýäáÝòá ýêÿ ý×êýØä Û▓âý£╝Ùí£ Û©░ÙîÇÙÉÿÙéÿ, ÙïñÙ░£ýïáÛ▓¢Ù│æ ÝÅëÛ░ÇýùÉýä£Ùèö ýòäýºü ÛÀ© ýù¡ÝòáýØ┤ Ù¬àÝÖòÝòÿÛ▓î ÛÀ£ýáòÙÉÿýºÇ ýòèýòä, Ýżý░®ýïáÛ▓¢Ù│æýØÿ ý┤êÛ©░ ýù░ÛÁ¼ ýï£ýáÉÛ│╝ ý£áýé¼Ýò£ ýûæýâüý£╝Ùí£ Ù│┤ýØ©Ùïñ. Ùìö ÙºÄýØÇ ý×Éýä©Ýò£ ýù░ÛÁ¼Û░Ç ÝòäýÜöÝòÿýºÇÙºî, ÙïñýûæÝò£ ýªØÙíÇÙ│┤Û│áýÖÇ ýØ╝Ùá¿ýØÿ ýªØÙíÇýù░ÛÁ¼ÙôñýØ┤ Ù░£Ýæ£ÙÉÿÛ│á ý×êýû┤ ÝؼٺØýáüýØ┤Ùïñ. Ù│© ýóàýäñýùÉýä£Ùèö ÙïñÙ░£ýïáÛ▓¢Ù│æýùÉ ÙîÇÝò£ Û©░ýí┤ Ù│┤Û│áÙôñýØä ýºäÙï¿, ý╣ÿÙúî, ýÿêÝøä Ùô▒Û│╝ Û┤ÇÙá¿Ýòÿýù¼ Û░äÙ×ÁÝòÿÛ▓î ýáòÙª¼ÝòÿýÿÇÙïñ.
ÛÁ¡ýåî ýïáÛ▓¢Ù│æ
ÛÁ¡ýåî ýïáÛ▓¢Ù│æýØÇ ÝåÁýªØ, Û░ÉÛ░ü ýáÇÝòÿ ÙÿÉÙèö ÛÀ╝ý£äýò¢ýØä ýØ╝ý£╝ÝéñÙèö ÙïñýûæÝò£ ÙºÉý┤êýïáÛ▓¢ Ù│æÙ│Çý£╝Ùí£ ýïáÛ▓¢ýØÿ ý£äý╣ÿÙéÿ Ù│æýØ©ýØä Û©░ýñÇý£╝Ùí£ ÙÂäÙÑÿÙÉ£Ùïñ. ýÖ©ÙÂÇýÜöýØ©ýØÇ ýïáÛ▓¢ýØä ýòòÙ░òÝòÿÛ▒░Ùéÿ ýåÉýâüýØä ýú╝Ùèö Û▓░ýáêýóà, Û▒┤ý┤êýù╝, ÛÀ╝ý£í Û©░Ýÿò, ÝÿêÛ┤Ç Û©░Ýÿò ÛÀ©Ùª¼Û│á ýûæýä▒ Ýÿ╣ýØÇ ýòàýä▒ýóàýûæ Ùô▒ýØ┤ ý×êÙïñ. Ùé┤ÙÂÇ ýÜöýØ©ý£╝Ùí£Ùèö ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░ýØ┤Ùéÿ ÝîöÛ┐ëÛÁ┤ýªØÝøäÛÁ░ý▓ÿÙƒ╝ Ùö▒Ùö▒Ýò£ ýä¼ý£á-Ù╝ê Ýä░ÙäÉýØä ýºÇÙéÿÙèö ýïáÛ▓¢ýØÿ Ýżý░®ýØ┤ ý×êÙïñ. ýÖ©ÙÂÇýÜöýØ©ýØÇ ýºÇýåìýáüýØ© ýòòÙ░òýØ┤Ùéÿ Ùæöýâü Ýÿ╣ýØÇ Û┤ÇÝåÁýâüÙÅä ÝżÝò¿Ýò£Ùïñ. Ùé┤ÙÂÇýÜöýØ©ýùÉ ýØÿÝò£ ÛÁ¡ýåî ýïáÛ▓¢Ù│æýØÇ ýÖ©ÙÂÇýÜöýØ©ýùÉ ýØÿÝò£ Û▓âÙ│┤ÙïñÙèö Ùì£ ÝØöÝò£Ùì░, ýïáÛ▓¢ýóà, ýïáÛ▓¢ý┤ê ýóàýûæ ÛÀ©Ùª¼Û│á ýïáÛ▓¢Û▓¢ýâëýØ┤ ý×êÙïñ.
ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░ýØÇ Û░Çý×Ñ ÝØöÝò£ Ýżý░®ýªØÝøäÛÁ░ýØ┤Ù®░, ÝîöÛ┐êý╣ÿýùÉýä£ýØÿ ý▓ÖÛ│¿ýïáÛ▓¢Ù│æýØÇ ÙæÉ Ù▓êýº©Ùí£ ÙºÄýØÇ ÛÁ¡ýåî ýïáÛ▓¢Ù│æýØ┤Ùïñ. ÝØöÝòÿÛ▓î Ù░£ýâØÝòÿÙèö ÙïñÙÑ© ÛÁ¡ýåî ýïáÛ▓¢Ù│æý£╝Ùí£Ùèö ýåÉÙ¬®ýùÉýä£ýØÿ ý▓ÖÛ│¿ýïáÛ▓¢Ù│æ, ýâüýÖäÛ│¿ýùÉýä£ýØÿ ýÜöÛ│¿ýïáÛ▓¢Ù│æÛ│╝ Ù╣äÛ│¿ÙæÉýùÉýä£ýØÿ Ù╣äÛ│¿ýïáÛ▓¢Ù│æýØ┤ ý×êÙïñ.
ýáòýñæýïáÛ▓¢
ÝîöÙ¬®(ýåÉÙ¬®Ýä░ÙäÉýªØÝøäÛÁ░)
ÝîöÙ¬®ýùÉýä£ýØÿ ýáòýñæýïáÛ▓¢ýØÇ ýïáÛ▓¢ÛÀ╝ý£íý┤êýØîÝîî ÙÂäýò╝ýùÉýä£ Û░Çý×Ñ ý▓ÿýØî ýù░ÛÁ¼ÙÉ£ ÙÂäýò╝Ùí£ Ù¼©ÝùîýùÉýä£ÙÅä ý×Éýú╝ ýù░ÛÁ¼ÙÉÿÛ│á Û©░ýêáÙÉÿÙèö ÙÂäýò╝ýØ┤Ùïñ. ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░ýØ┤ Û░Çý×Ñ ÝØöÝòá Ù┐ÉÙºî ýòäÙïêÙØ╝ Û©░ýêáýáüýØ© ý©íÙ®┤ýùÉýä£ÙÅä ýáòýñæýïáÛ▓¢ý┤êýØîÝîîÛ░Ç Ù╣äÛÁÉýáü ýë¢Û©░ ÙòîÙ¼©ýØ┤Û©░ÙÅä ÝòÿÙïñ.
ýåÉÙ¬®ýØä Û░ÇÙí£ýºêÙƒ¼ ýï£ýâüÙ®┤ý£╝Ùí£ ý┤êýØîÝîî ÝâÉýâëý×ÉÙí£ Û░ÇÙí£ýèñý║öýØä ÝòÿÙ®┤ ýáòýñæýïáÛ▓¢ýØÿ ýóàÙï¿Ù®┤Ù┐ÉÙºî ýòäÙïêÙØ╝ Û╣èýØÇýåÉÛ░ÇÙØ¢ÛÁ¢Ý×ÿÛÀ╝(flexor digitorum profundus), ýûòýØÇýåÉÛ░ÇÙØ¢ÛÁ¢Ý×ÿÛÀ╝(flexor digitorum superficialis)Û│╝ Ùï¿Ùï¿Ýò£ ÛÁ¢Ý×ÿÛÀ╝ýºÇýºÇÙØá Ù░æýØä ýºÇÙéÿÛ░ÇÙèö ýáòýñæýïáÛ▓¢ýØÿ Ýżý░®ýØä Ù│╝ ýêÿ ý×êÙïñ. ýï£ýâüÙ®┤ýùÉýä£ ýåÉÛ░ÇÙØ¢ýØä ÛÁ¢Ý×ÿý£╝Ùí£ýì¿ Ý×ÿýñäýØ┤ ÛÀ╝ý£äÙÂÇ Ù░Å ýøÉý£äÙÂÇÙí£ ýøÇýºüýØ┤Ùèö Û▓âýØä ÝÖòýØ©ÝòÿÙ®░ ýáòýâüýáüý£╝Ùí£Ùèö ýáòýñæýïáÛ▓¢ýØ┤ Û░ÖýØÇ Ù®┤ý£╝Ùí£ ýøÇýºüýØ┤ýºÇÙºî Ý×ÿýñäÙ│┤ÙïñÙèö ýøÇýºüý×äýØ┤ ý×æÙïñ. ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░ ÝÖÿý×ÉýùÉýä£Ùèö ýáòýñæýïáÛ▓¢ýØÿ ýøÇýºüý×äýØ┤ Û░ÉýåîÙÉ£Ùïñ.
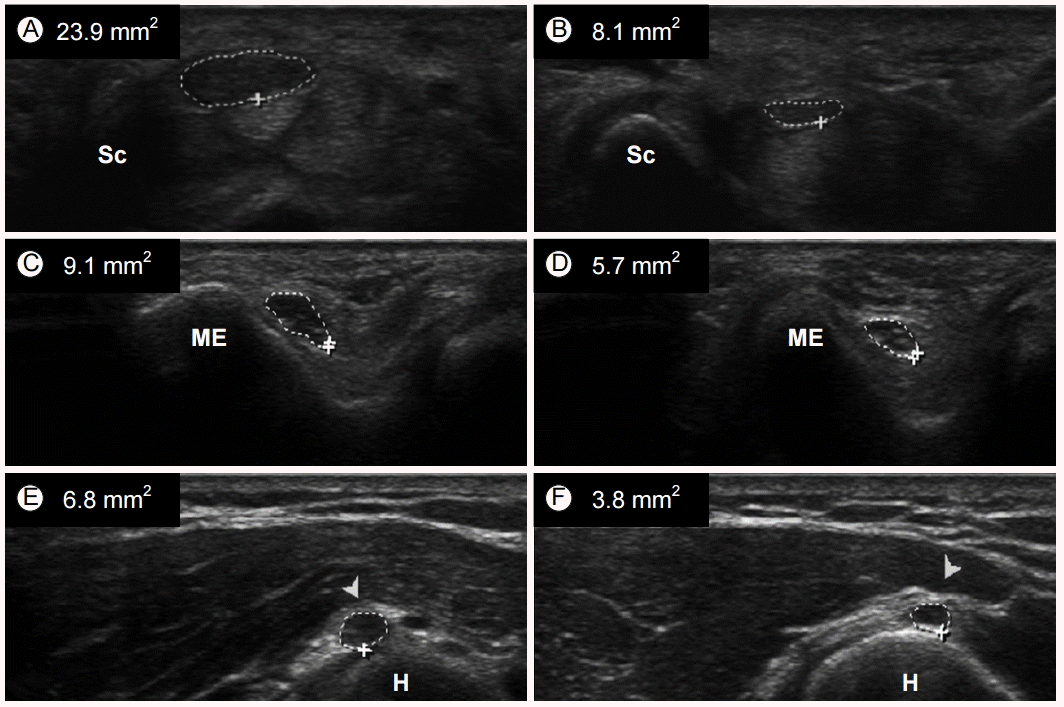
ýØ┤ýû┤ýä£ ýåÉÙ¬® ýøÉý£äÙÂÇýØÿ ÝÜíÙï¿Ù®┤ ýÿüýâüýØä ýû╗ÙèöÙïñ. ÝÜíýêÿÛÀ╝ýØ©ÙîÇ(transverse carpal ligament), ýáòýñæýïáÛ▓¢, ýåÉÛ░ÇÙØ¢ÛÁ¢Ý×ÿÛÀ╝ýØÿ Ý×ÿýñäÙôñ ÛÀ©Ùª¼Û│á ýåÉÙ¬®Ù╝êÙôñýØä Û┤Çý░░Ýòá ýêÿ ý×êÙïñ. ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░ýØä ýºäÙï¿ÝòÿÛ©░ ý£äÝò┤ ýåÉÙ¬®ÛÁ┤Ùí£ ýºäý×à ýï£ýùÉ ý╗ñýºä ýáòýñæýïáÛ▓¢ýØä ÝÖòýØ©ÝòÿÙèö Û▓âýØ┤ Û░Çý×Ñ Ù│┤ÝÄ©ýáüýØ┤Ùïñ(Fig. 1A and 1B). ý┤êÛ©░ýØÿ ýù░ÛÁ¼ÙôñýùÉýä£Ùèö ýáòýñæýïáÛ▓¢ýØÿ Ùï¿Ù®┤ýáüýØä ý©íýáòÝòÿÛ©░ ý£äÝò┤ ý£áÛÁ¼ÙÅîÛ©░(hook of hamate)Ùéÿ ý¢®ýòîÙ╝ê(pisiform) ÙÂÇý£äÙÑ╝ ýá£ýòêÝòÿýÿÇÙïñ[1,2]. ÝòÿýºÇÙºî Ýøäýåìýù░ÛÁ¼ÙôñýØÇ ýåÉÙ¬®ÛÁ┤ ÛÀ╝ý£äÙÂÇýùÉýä£ ýáòýñæýïáÛ▓¢ýØÿ Ùï¿Ù®┤ýáüýØ┤ Û░Çý×Ñ ÙäôýØÇ ÙÂÇý£äÙÑ╝ Û│¿ÙØ╝ ý©íýáòÝòÿÙèö Û▓âýØ┤ Ù»╝Û░ÉÙÅäýÖÇ Ýè╣ýØ┤ÙÅäÛ░Ç ÙåÆý£╝Ù®░ Ýò£ Ù▓êýØÿ ý©íýáòý£╝Ùí£ ý®ÙÂäÝòÿÙïñÛ│á ÝòÿýÿÇÙïñ[3]. ÝòÿýºÇÙºî ýáäÙ░ÿýáüýØ© ÙºÉý┤êýïáÛ▓¢ýØÿ ÙÂÇýóàýØä ý┤êÙ×ÿÝòÿÙèö ýâñÙÑ┤ý¢ö-ÙºêÙª¼-Ýê¼ýèñÙ│æÛ│╝ Û░ÖýØÇ Ýâêýêÿý┤ê ÙïñÙ░£ýïáÛ▓¢Ù│æýùÉýä£Ùèö ýåÉÙ¬®ýùÉýä£ýØÿ ýáòýñæýïáÛ▓¢ýØÿ ýØ╝ÝÜîýä▒ Ùï¿Ù®┤ýáüÙºî Û░ÇýºÇÛ│áÙèö Ùï¿ýê£ ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░ý£╝Ùí£ ýÿñýºäÙÉá ýêÿ ý×êÙïñ. Ùö░ÙØ╝ýä£ Hobson-Webb Ùô▒[4]ýØÇ ýòäÙ×ÿÝîöÛ│╝ ýåÉÙ¬®ýùÉýä£ýØÿ ýáòýñæýïáÛ▓¢ Ùï¿Ù®┤ýáüýØÿ Ù╣äý£¿ýØä ý©íýáòÝò¿ý£╝Ùí£ýì¿ ÛÀ©Ùƒ¼Ýò£ Ù¼©ýá£ÙÑ╝ Ýö╝Ýòá ýêÿ ý×êý£╝Ù®░ ýòäÙ×ÿÝîöÛ│╝ ýåÉÙ¬®ýØÿ ýáòýñæýïáÛ▓¢ Ùï¿Ù®┤ýáü Ù╣äÛ░Ç 1.4 ýØ┤ýâüýØ╝ Ùòî 100%ýØÿ Ù»╝Û░ÉÙÅäÙí£ ýåÉÙ¬®Ýä░ÙäÉýªØÝøäÛÁ░ýØä ýáòÝÖòÝ×ê ýºäÙï¿Ýòá ýêÿ ý×êÙïñÛ│á ÝòÿýÿÇÙïñ. ýáòýñæýïáÛ▓¢ýØÿ ÝÜíÙï¿Ù®┤ýØÿ ýÁ£Û│á Ù░Å ýÁ£ýáÇ ýºüÛ▓¢ýØä ý×¼ýä£ ÛÀ© Ù╣äý£¿Ùí£ ýáòýñæýïáÛ▓¢ýØÿ ÝÄ©ÝÅëÙÅäÙÑ╝ Û│äýé░Ýòÿýù¼ ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░ýØä ýºäÙï¿ÝòÿÛ©░ÙÅä ÝòÿÙ®░, ý£áÛÁ¼ÙÅîÛ©░ýÖÇ ý¢®ýòîÙ╝êÙÑ╝ ý×çÙèö ýäáýØä Û©░ýñÇý£╝Ùí£ Ýòÿýù¼ ÛÁ¢Ý×ÿÛÀ╝ýºÇýºÇÙØáýØÿ ÛÁ┤Û│íÙÅäÙÑ╝ Ù░öÝâòý£╝Ùí£ ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░ ýù¼ÙÂÇÙÑ╝ ÝîÉÙï¿ÝòÿÛ©░ÙÅä Ýò£Ùïñ. ÙÿÉÝò£ ý┤êýØîÝîîÙí£ ýåÉÙ¬®ÛÁ┤ýùÉýä£ ý×öÙÑÿ ýáòýñæÙÅÖÙºÑÛ│╝ ýåÉÙ¬®ÛÁ┤ ÛÀ╝ý£äÙÂÇýùÉýä£ ýØ┤ÙÂä ýáòýñæýïáÛ▓¢ýØ┤ Ù░£Û▓¼ÙÉÿÛ©░ÙÅä Ýò£Ùïñ[5-8].
ý▓ÖÛ│¿ýïáÛ▓¢
ýåÉÙ¬®(GuyonÔÇÖs canal)
ý▓ÖÛ│¿ýïáÛ▓¢ýØÿ ýï£ýâüÙ®┤ýØÇ ÝÖòýØ©ÝòÿÛ©░ ýû┤ÙáñýÜ© ýêÿ ý×êÛ©░ ÙòîÙ¼©ýùÉ ýåÉÙ¬®ýùÉýä£ýØÿ ý▓ÖÛ│¿ýïáÛ▓¢ýØÇ Ùï¿Ù®┤ýáüÙºî ý©íýáòýØ┤ Û░ÇÙèÑÝòÿÙïñ. ý▓ÖÛ│¿ÙÅÖÙºÑýØÇ ý▓ÖÛ│¿ýïáÛ▓¢ýØÿ Ù░öÙí£ ýÖ©ý©íýùÉ ýí┤ý×¼Ýòÿýù¼ ýïáÛ▓¢ýØä ÝÖòýØ©ÝòÿÙèö Ýæ£ýºÇÛ░Ç ÙÉ£Ùïñ. GuyonÛ┤ÇýØÿ ý▓ÖÛ│¿ýïáÛ▓¢Ù│æýØÇ Û▓░ýáêýóà, ÛÀ╝ý£íÛ©░Ýÿò, Ù╣äýáòýâü ý▓ÖÛ│¿ÙÅÖÙºÑ Ýÿ╣ýØÇ ýºÇÙ░®ýóàýùÉ ýØÿÝò┤ Ù░£ýâØÝòÿÛ©░ÙÅä Ýò£Ùïñ.
ÝîöÛ┐êý╣ÿ
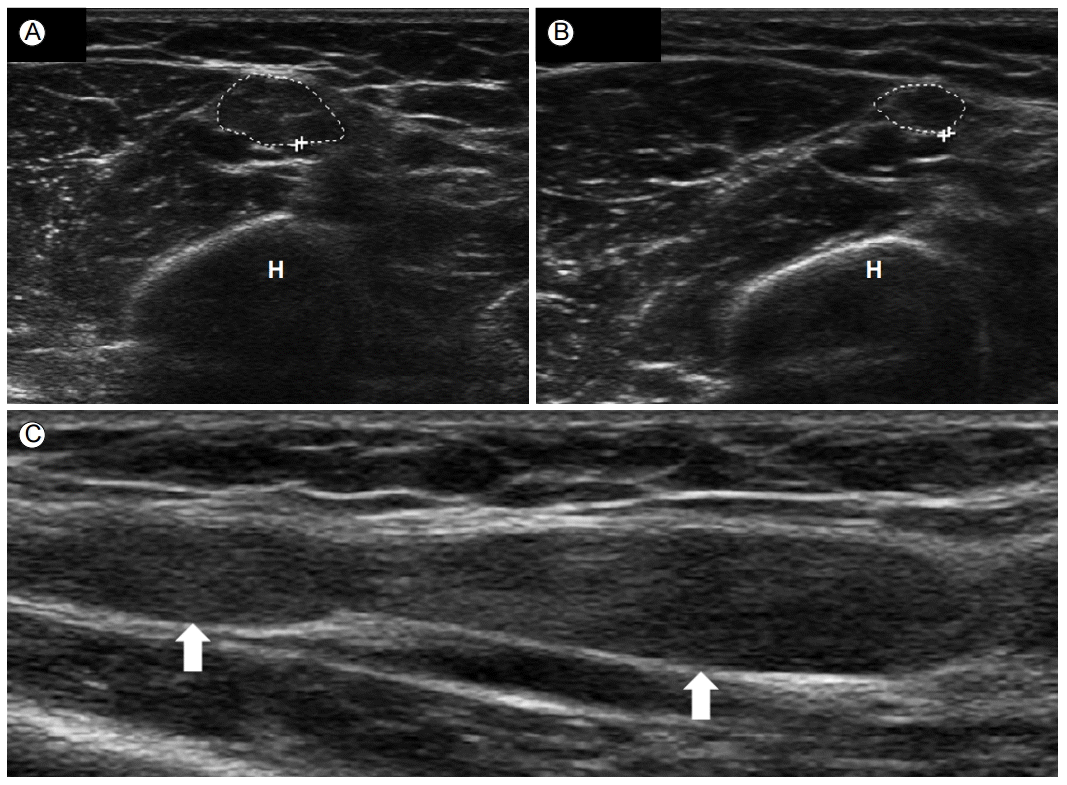
ÝîöÛ┐êý╣ÿýØÿ ý▓ÖÛ│¿ýïáÛ▓¢Ù│æýØÇ ÙæÉ Ù▓êýº©Ùí£ ÙºÄýØÇ Ýżý░®ýïáÛ▓¢Ù│æý£╝Ùí£ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼Û░Ç Ù»╝Û░ÉÝòÿÛ│á Ýè╣ýØ┤ýáüýØ© Û▓Çýé¼ýºÇÙºî, ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░ýùÉ Ù╣äÝò┤ ýáòÝÖòÙÅäÙèö Ùû¿ýû┤ýºäÙïñ. Ùö░ÙØ╝ýä£ ý┤êýØîÝîî ýºäÙï¿ýØ┤ ÙºñÙáÑýáüýØ╝ ýêÿ ý×êÙïñ. ÝîöÛ┐êý╣ÿýùÉýä£ýØÿ ý┤êýØîÝîîÙèö ýòêý¬¢ ý£äÛ┤Çýáêý£ÁÛ©░(medial epicondyle)ýÖÇ ÝîöÛ┐êý╣ÿÙ¿©Ùª¼ÙÅîÛ©░(olecrenon process) ýé¼ýØ┤ýØÿ ÝÖêýùÉýä£ ý▓ÖÛ│¿ýïáÛ▓¢ýØä ý×ÑýÂòý£╝Ùí£ ÝÖòýØ©ÝòÿÙèö Û▓âý£╝Ùí£ ýï£ý×æÝò£Ùïñ. ýØ┤ Ù░®Ù▓òýØÇ ýïáÛ▓¢ýØÿ ÛÁ¡ýåîýáüýØ© ÝÖòÙîÇýÖÇ ý▓ÖÛ│¿ýïáÛ▓¢ ýÖ©ÙÂÇýØÿ Ù╣äýáòýâü ÛÁ¼ýí░ÙÑ╝ ÝÖòýØ©ÝòÿÛ©░ ý£äÝò┤ ýé¼ýÜ®ÙÉ£Ùïñ. ýòêý¬¢ý£äÛ┤Çýáêý£ÁÛ©░ 5 cm ýøÉý£äÙÂÇ Ù░Å ÝîöÛ┐êý╣ÿ Ýä░ÙäÉýùÉýä£ ýé╝Û░üÝÿò Ù¬¿ýûæýØÿ ý▓ÖÛ│¿ýïáÛ▓¢ýØä ÝÖòýØ©Ýòá ýêÿ ý×êÙïñ(Fig. 1C and 1D). ýØ┤ ÙÂÇÙÂäÛ│╝ ýòêý¬¢ ý£äÛ┤Çýáêý£ÁÛ©░ýùÉýä£ 5 cm ýâüÙ░® Ù░Å ÛÀ╝ý£äÙÂÇýùÉýä£ ýïáÛ▓¢ýØÿ Ùï¿Ù®┤ýáüýØä ý©íýáòÝòÿÛ│á ý▓ÖÛ│¿ýïáÛ▓¢ýØ┤ ýÁ£ÙîÇÙí£ ý╗ñýºä ÙÂÇÙÂäýØä ý░¥ÙèöÙïñ. ÛÁ¡ýåîýáüýØ© ýïáÛ▓¢ýØÿ ÝÖòÙîÇÛ░Ç ýù¼Ùƒ¼ ÛÁ░Ùì░ýùÉýä£ Ù░£Û▓¼ÙÉá ýêÿÙÅä ý×êÙïñ. ýù¼Ùƒ¼ ýù░ÛÁ¼ýùÉýä£ ÝîöÛ┐êý╣ÿýùÉ ý▓ÖÛ│¿ýïáÛ▓¢Ù│æýØ┤ ý×êÙèö ÝÖÿý×ÉÙôñýØ┤ ÝîöÛ┐êý╣ÿ ýú╝Ù│ÇýùÉýä£ ÛÁ¡ýåîýáüý£╝Ùí£ ýïáÛ▓¢ýØÿ ÝÖòÙîÇÛ░Ç ý×êý£╝Ù®░, ý┤êýØîÝîîÛ░Ç ÝîöÛ┐êý╣ÿýØÿ ý▓ÖÛ│¿ýïáÛ▓¢Ù│æýØä ýºäÙï¿ÝòÿÙèö Ùì░ 80% ýØ┤ýâüýØÿ Ù»╝Û░ÉÙÅäýÖÇ Ýè╣ýØ┤ÙÅäÙÑ╝ Û░ÇýºÇÛ│á ý×êÙïñÛ│á ÝòÿýÿÇÙïñ[9]. Beekman Ùô▒[10]ýØÇ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ýùÉ ý┤êýØîÝîî Û▓Çýé¼ÙÑ╝ ýÂöÛ░Çýáüý£╝Ùí£ ÝòÿÙèö Û▓âýØ┤ Ù»╝Û░ÉÙÅäÙÑ╝ 78%ýùÉýä£ 98%Ùí£ ýªØÛ░Çýï£Ýé¼ ýêÿ ý×êÙïñÛ│á ÝòÿýÿÇÙïñ. ÝîöÛ┐êý╣ÿýùÉýä£ýØÿ ý▓ÖÛ│¿ýïáÛ▓¢Ù│æýØä ÙÅÖÙ░ÿÝò£ ýïáÛ▓¢ýØÿ ÝÖòÙîÇÙèö ýáäÙÅäý░¿Ùï¿ ý£äý╣ÿýÖÇÙÅä ýØ╝ý╣ÿÝòá ýêÿ ý×êÙïñ[11]. Ùö░ÙØ╝ýä£ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ýÖÇ Ýò¿Û╗ÿ ý┤êýØîÝîîÙèö ý▓ÖÛ│¿ýïáÛ▓¢ Ýżý░®ýØÿ ý£äý╣ÿÙÑ╝ ÛÁ¡ýåîÝÖöýï£Ýé¼ ýêÿ ý×êÙïñ[12,13]. ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ýùÉ Ýò┤ÙÂÇÝòÖ ýáòÙ│┤ÙÑ╝ Ùìö Ýò┤ýú╝Ùèö ý┤êýØîÝîîÙÑ╝ ÝòÿÙ®┤ ÙæÉ ýºäÙï¿Ù▓òýØä ýí░Ýò®Ýòÿýù¼ ýâüýè╣ ÝÜ¿Û│╝ÙÑ╝ Ùé╝ ýêÿ ý×êÙïñ. ÝîöÛ┐êý╣ÿÛÁ¢Ý×ÿ ýñæ Ù░£ýâØÝòÿÙèö ý▓ÖÛ│¿ýïáÛ▓¢ýØÿ ýòäÝâêÛÁ¼(subluxation)ýÖÇ ýáäý£ä(dislocation)Ùèö ýáòýâüýØ©ýùÉýä£ÙÅä 25%ýùÉýä£ Ù░£ýâØÝò£Ùïñ. ÝîöÛ┐ëÛÁ┤ýùÉýä£ ý▓ÖÛ│¿ýïáÛ▓¢ýØ┤ ýᣠý£äý╣ÿÙÑ╝ Ù▓ùýû┤ÙéÿÙ®┤ ýïáÛ▓¢ýáäÙÅä Û▓Çýé¼ Ù░®Ù▓òýØ┤ ÙÂÇýáòÝÖòÝòá ýêÿ ý×êÛ│á, ýØ┤ýùÉ Ùö░ÙØ╝ ý£äýØîýä▒ýØÿ Û▓░Û│╝ÙÑ╝ Ù│┤ýØ╝ ýêÿ ý×êÙïñ[14]. Ùö░ÙØ╝ýä£ ý▓ÖÛ│¿ýïáÛ▓¢Ù│æýØ┤ ýØÿýï¼ÙÉÿýºÇÙºî ýïáÛ▓¢ýáäÙÅä Û▓Çýé¼Û░Ç ýáòýâüýØ© ÝÖÿý×ÉÙôñýØÇ ý┤êýØîÝîîÙÑ╝ ÝåÁÝò┤ ýïáÛ▓¢ýØÿ ÝÖòÙîÇýÖÇ ýòäÝâêÛÁ¼ÙÑ╝ ÝÖòýØ©Ýòá ÝòäýÜöÛ░Ç ý×êÙïñ.
ýÜöÛ│¿ýïáÛ▓¢
ýáòýñæýïáÛ▓¢ýØ┤Ùéÿ ý▓ÖÛ│¿ýïáÛ▓¢Û│╝ ÙïñÙÑ┤Û▓î ýÜöÛ│¿ýïáÛ▓¢ýØÇ ýáäý▓┤ ýïáÛ▓¢ Û▓¢Ùí£ÙÑ╝ Ùö░ÙØ╝ ÝÖòýØ©ÝòÿÙèö Û▓âýØ┤ ýë¢ýºÇ ýòèÙïñ. ýáäýú╝ýÖÇ(antecubital fossa) Ù░öÙí£ ÛÀ╝ý£äÙÂÇýùÉýä£ ýë¢Û▓î Ù│╝ ýêÿ ý×êý£╝Ù®░ ýòíýÖÇÛ╣îýºÇ ýÂöýáüÝò┤ Ù│╝ ýêÿ ý×êÙïñ. ÝòÿýºÇÙºî, ýÜöÛ│¿ýïáÛ▓¢ýØä ýáäýú╝ýÖÇ ý£êý£äÙÂÇýùÉýä£ Ùö░ÙØ╝Û░äÙïñÙèö Û▓âýØÇ Û¢ñ ýû┤ÙáÁÙïñ. Û░Çý×Ñ Ýü░ ýØ┤ý£áÙèö ýïáÛ▓¢ýØ┤ ýØ┤Ýøä Ýæ£ý×¼ýÜöÛ│¿ýïáÛ▓¢Û│╝ ÝøäÛ│¿Û░äýïáÛ▓¢ ÙæÿÙí£ ÙéÿÙëÿýû┤ýä£ ýáòýñæýïáÛ▓¢ýØ┤Ùéÿ ý▓ÖÛ│¿ýïáÛ▓¢Ù│┤Ùïñ ýºüÛ▓¢ýØ┤ Ýø¿ýö¼ ý×æýòäýºÇÛ©░ ÙòîÙ¼©ýØ┤Ùïñ.
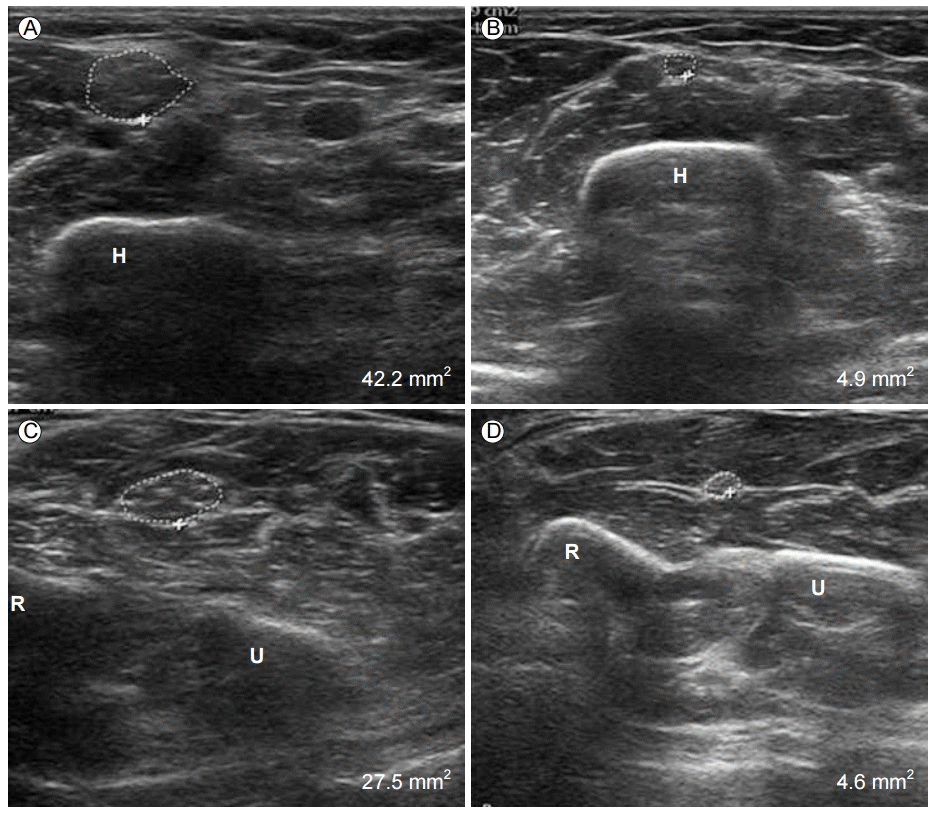
ý£äÝîöýùÉýä£ýØÿ ýÜöÛ│¿ýïáÛ▓¢ ýåÉýâüýØÿ Û░Çý×Ñ Ýü░ ýøÉýØ©ýØÇ ý£äÝîöÙ╝êýØÿ Û│¿ýáêýØ┤Ù®░, ý┤êýØîÝîîÙí£ ÝÖòýØ©Ýòá ýêÿ ý×êÙïñ. Bodner Ùô▒[15]ýØÇ ý£äÝîöÙ╝êÛ│¿ýáê ýØ┤Ýøä ýÜöÛ│¿ýïáÛ▓¢ýåÉýâüýØä Û░Çýºä ÝÖÿý×ÉýùÉýä£ ý┤êýØîÝîîÙí£ ýÜöÛ│¿ýïáÛ▓¢ýåÉýâüýØÿ ýáòÙÅäÙÑ╝ ÝÖòýØ©ÝòÿýÿÇÛ│á, Ù│┤ýí┤ ý╣ÿÙúîÙ│┤Ùïñ ýêÿýêá ý╣ÿÙúîÛ░Ç ýÜ░ýøöÝòÿÙ®░ ýêÿýêá ýåîÛ▓¼Û│╝ÙÅä ÙÂÇÝò®ÙÉ¿ýØä Ù│┤Û│áÝòÿýÿÇÙïñ. ýÜöÛ│¿ýïáÛ▓¢ýåÉýâüýØÿ ÙîÇÙÂÇÙÂäýØ┤ ýºÇýåìýáüýØ© ýòòÙ░ò(ÝåáýÜöýØ╝Ù░ñ ÙºêÙ╣ä)ýùÉ ýØÿÝò£ ýØ┤ý░¿ýáüýØ© Û▓âý£╝Ùí£ ý┤êýØîÝîîÙèö ýÜöÛ│¿ÛÁ¼ýùÉýä£ ýïáÛ▓¢ýØ┤ Ù╣äýáòýâüýáüý£╝Ùí£ Ýî¢ÙîÇÙÉ£ Û▓âýØä Ù│┤ýù¼ýñä ýêÿ ý×êý£╝Ù®░(Fig. 1E and 1F), ý£äÝîöÙ╝êÛ│¿ýáê Ýøä Û░ÇÛ│¿ Ù░Å ýÜöÛ│¿ý©í Ýö╝ÙÂÇýáòÙºÑ(cephalic vein) ÙÅÖÙºÑÙÑÿýùÉ ýØÿÝò£ Ýżý░®ýÜöÛ│¿ýïáÛ▓¢Ù│æýªØýùÉ ÙîÇÝò£ Ù│┤Û│áÙÅä ý×êÙïñ[16-18].
Ù╣äÛ│¿ýïáÛ▓¢
Ù╣äÛ│¿ýïáÛ▓¢ýØÇ Ù╣äÛ│¿ÙæÉýùÉýä£ ÝØöÝòÿÛ▓î Ýżý░®ÙÉÿÛ│á ý┤êýØîÝîîÙí£ ýë¢Û▓î Ù│╝ ýêÿ ý×êÛ©░ ÙòîÙ¼©ýùÉ ÝòÿýºÇýØÿ ýïáÛ▓¢ ýñæýùÉýä£ Û░Çý×Ñ ÝÖ£Ù░£Ý×ê ýù░ÛÁ¼ÙÉÿÙèö ÙÂäýò╝ýØ┤Ùïñ. Û©░Ù│©ýáüý£╝Ùí£ Ù╣äÛ│¿ýïáÛ▓¢ýØ┤ ÛÂüÙæÑýïáÛ▓¢ýùÉýä£ ÙÂäýºÇÝòÿýù¼ Ù╣äÛ│¿ÙæÉ Ù░öÙí£ ýøÉý£äÙÂÇÛ╣îýºÇýØÿ ýú╝ÝûëÝòÿÙèö Û▓âýØä ÝÖòýØ©Ýò£Ùïñ. Ù╣äÛ│¿ýïáÛ▓¢ýØÇ ÛÂüÙæÑýïáÛ▓¢ýØÿ ý×æýØÇ ÙÂäýºÇÙí£ ÙºÉý┤êýïáÛ▓¢ýØÿ ýáäÝÿòýáüýØ© Ù▓îýºæÙ¬¿ýûæýØä Ù│┤ýØ©Ùïñ. Ù╣äÛ│¿ÙæÉ ÛÀ╝ý▓ÿýùÉýä£ Ýæ£ý×¼Ù╣äÛ│¿ýïáÛ▓¢ Ù░Å ýï¼Ù╣äÛ│¿ýïáÛ▓¢ý£╝Ùí£ ÙéÿÙëÿÛ▓î ÙÉÿÛ│á ÛÀ© ýØ┤ÝøäýùÉÙèö ý┤êýØîÝîîÙí£ ýïáÛ▓¢ýØÿ ýú╝ÝûëýØä ÝÖòýØ©ÝòÿÙèö Û▓âýØÇ ýû┤ÙáÁÙïñ.
Ù╣äÛ│¿ÙæÉ ÛÀ╝ý▓ÿýùÉýä£ ýïáÛ▓¢ Ùé┤ýÖ©ýØÿ Û▓░ýáêýóàÙôñýØ┤ Ù╣äÛ│¿ýïáÛ▓¢Ù│æýØä ýØ╝ý£╝ÝéñÙèö Û▓âýØä ýë¢Û▓î ý┤êýØîÝîîÙí£ ÝÖòýØ©Ýòá ýêÿ ý×êÙïñ. Visser Ùô▒[19]ýØ┤ Ù░£ý▓ÿýºÉ ýªØýâüýØä Û░Çýºä 41Ù¬àýØÿ ÝÖÿý×ÉÙôñ ýñæ 28Ù¬àýùÉýä£ Ù╣äÛ│¿ÙæÉýùÉýä£ ýïáÛ▓¢Ù│æýØ┤ ý×êÛ│á ÛÀ© ýñæ 5Ù¬àýØ© 18%ýùÉýä£ ýïáÛ▓¢Ùé┤ Û▓░ýáêýóàýØ┤ ý×êýØîýØä Ù│┤Û│áÝòÿýÿÇÙïñ. ýØ┤ ýù░ÛÁ¼Ùèö Ù╣äÛ│¿ýïáÛ▓¢Ù│æý£╝Ùí£ ýØ©Ýò£ Ù░£ý▓ÿýºÉ ýªØýâüýØ┤ ýêÿýêá ý╣ÿÙúîÙí£ ýÖäý╣ÿÙÉá ýêÿ ý×êÙïñÙèö ýáÉýùÉýä£ ýñæýÜöÝòÿÙïñ.
ýï¼Û░üÝò£ Ù╣äÛ│¿ýïáÛ▓¢Ù│æýØÿ ÙïñÙÑ© ýøÉýØ©ý£╝Ùí£ Ù¼┤ÙªÄýØÿ ÝâêÛÁ¼ÙÑ╝ Ùôñ ýêÿ ý×êÙïñ[20]. ýè¼ýÖÇýùÉýä£ Ù╣äÛ│¿ýïáÛ▓¢ýØä ýòòÙ░òÝòÿÙèö ÙÅÖÙºÑÙÑÿÙéÿ Û░Çýä▒ÙÅÖÙºÑÙÑÿÙÑ╝ Ù│╝ ýêÿÙÅä ý×êÙïñ.
Û▓¢Û│¿ýïáÛ▓¢
Û▓¢Û│¿ýïáÛ▓¢ýØÇ ýÿñÛ©êÛ│╝ Ù░£Ù¬®ýùÉýä£ ÝÖòýØ©Ýòá ýêÿ ý×êÙèöÙì░ ÛÂüÙæÑýïáÛ▓¢ýùÉýä£ ýØ┤ýû┤ýºÇÙèö ÙÂäýºÇÙÑ╝ ýÿñÛ©êýùÉýä£ ÝÖòýØ©Ýòá ýêÿ ý×êý£╝Ù®░ ýóàýòäÙª¼ ýòêý£╝Ùí£ Ùôñýû┤Û░ÇÙ®┤ ÝÖòýØ©ýØ┤ ýû┤ÙáÁÙïñ. ÝòÿýºÇÙºî, Ùé┤ý©í Ù│Áýé¼Ù╝êýØÿ Ù░öÙí£ ýøÉý£äÙÂÇýùÉýä£ Ùïñýï£ ý×ÿ Ù│┤ýØ©Ùïñ.
Ù░£Ù¬®
Ù░£Ù¬®ýùÉýä£ýØÿ Û▓¢Û│¿ ÛÁ¡ýåî ýïáÛ▓¢Ù│æýØÇ Û▓¢Û│¿ýïáÛ▓¢ýØ┤ ýí▒ÛÀ╝Û┤ÇýØä ÝåÁÛ│╝ÝòÿÛ©░ ÙòîÙ¼©ýùÉ ýí▒ÛÀ╝Û┤ÇýªØÝøäÛÁ░ýØ┤ÙØ╝Û│áÙÅä ÙÂêÙª░Ùïñ. ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░Û│╝Ùèö ÙïñÙÑ┤Û▓î Ýè╣Ù░£ýä▒ýØÿ ýí▒ÛÀ╝Û┤ÇýªØÝøäÛÁ░ýØÇ Ùô£Ù¼╝Û©░ ÙòîÙ¼©ýùÉ ýí▒ÛÀ╝Û┤ÇýªØÝøäÛÁ░ ýºäÙï¿ýØÇ Û│╝ý×ëýØ© Û▓¢ýÜ░Û░Ç ÙºÄÙïñ. Ù░£Ù¬® Ùé┤ý©íýØÇ ý┤êýØîÝîîÙí£ ýë¢Û▓î Ù│╝ ýêÿ ý×êÛ©░ ÙòîÙ¼©ýùÉ Ýè╣Ù░£ýä▒ ýí▒ÛÀ╝Û┤ÇýªØÝøäÛÁ░ýØ┤ Ùô£Ù¼╝Ùïñ ÝòÿÙìöÙØ╝ÙÅä Û▓¢Û│¿ýïáÛ▓¢Ù│æýØä ýØ╝ý£╝ÝéñÙèö ÛÁ¼ýí░ýáü ýØ┤ýâüÙôñýùÉ ÙîÇÝò£ Ù│┤Û│áÛ░Ç ÙºÄýØÇ ÝÄ©ýØ┤Ùïñ[24]. ýïáÛ▓¢ýºæýóà, Ù│┤ýí░ÛÀ╝ Ýÿ╣ýØÇ Û▒░Û│¿-ýóàÛ│¿ Û░ä ý£áÝò®ýªØ, Û▓░ýáêýóà, ÝòÿýºÇ ýáòÙºÑÙÑÿ Ùô▒ýØ┤ Ýò┤Ùï╣ÙÉ£Ùïñ[25,26].
Ù®┤ýù¡-ÙºñÛ░£ ýïáÛ▓¢Ù│æ
Ùºîýä▒ýù╝ýªØÝâêýêÿý┤êÙïñÙ░£ýïáÛ▓¢Ù│æ(chronic inflammatory demyelinating polyneuropathy, CIDP)
Ùºîýä▒ýù╝ýªØÙïñÙ░£ýïáÛ▓¢Ù│æ(CIDP)ýØÇ ÙºÉý┤ê ýïáÛ▓¢Û│äýØÿ ý×ÉÛ░ÇÙ®┤ýù¡ýºêÝÖÿý£╝Ùí£ ýÜ┤ÙÅÖÛ░ÉÛ░ü Û▓░ýåÉýØä ýØ╝ý£╝ÝéñÙ®░ Ýÿ©ýáäÛ│╝ ýòàÝÖöÙÑ╝ Ù░ÿÙ│ÁÝòÿÙèö ý×äýâüÛ▓¢Û│╝ÙÑ╝ Ù│┤ýØ©Ùïñ. Ù│┤ÝåÁ ý¢öÙÑ┤Ýï░ý¢öýèñÝàîÙí£ýØ┤Ùô£, Ù®┤ýù¡Û©ÇÙí£ÙÂêÙª░ýáòÙºÑýú╝ýé¼, Ýÿêý×ÑÛÁÉÝÖÿýêáýùÉ Ù░ÿýØæÝò£Ùïñ. ÛÀ©Ùƒ¼Ùéÿ ÝÜîÙ│ÁýØÿ ýáòÙÅäÙèö ýóàýóà ýØ┤ý░¿ýáüý£╝Ùí£ Ù░£ýâØÝò£ ýÂòýé¡ ýåÉýâüýØÿ Ùï¿Û│äýùÉ Ùö░ÙØ╝ ÙïñÙÑ┤Ùïñ. ý×ÑÛ©░ýáüýØ© ý×ÑýòáÙÑ╝ ýÿêÙ░®ÝòÿÛ©░ ý£äÝò┤ ýí░Û©░ ý╣ÿÙúîÛ░Ç ÝòäýêÿýáüýØ┤ýºÇÙºî ýí░Û©░ýùÉ ýºäÙï¿ÝòÿÙèö Û▓âýØ┤ ýû┤ÙáñýÜ© ýêÿ ý×êÙïñ. ýºäÙï¿ýØÇ ý×äýâüýåîÛ▓¼Û│╝ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ Û▓░Û│╝ÙÑ╝ ýóàÝò®Ýòÿýù¼ Ùé┤Ùª░Ùïñ. CIDPýØÿ ÝÖòýáò ýºäÙï¿ýØä ý£äÝò£ ýù░ÛÁ¼ ýºäÙï¿Û©░ýñÇýØÇ Ùïñýåî ýùäÛ▓®Ýò£ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ýØÿ ýØ┤ýâüýåîÛ▓¼ýØä ýÜöÛÁ¼Ýò£Ùïñ(ýáüýû┤ÙÅä 2Û░£ ýØ┤ýâüýØÿ ýÜ┤ÙÅÖ ýïáÛ▓¢ýùÉýä£ýØÿ ÝÖòýïñÝò£ ýáäÙÅäý░¿Ùï¿). ýØ┤Ùƒ¼Ýò£ ýØ┤ýâüýåîÛ▓¼ýØÇ ýºêÙ│æýØÿ ÙïñýûæÝò£ Ùï¿Û│äýùÉýä£ ýóàýóà Û┤Çý░░ÙÉÿýºÇ ýòèýØä ýêÿ ý×êý£╝Ù®░ ýí░Û©░ ýºäÙï¿Û│╝ ý╣ÿÙúîÙÑ╝ Û░ÇÙèÑÝòÿÛ▓î ÝòÿÙèö ýºäÙï¿ Û©░Ù▓òýØÇ ÝÖÿý×É ý╣ÿÙúîÙÑ╝ ÝÿäýáÇÝòÿÛ▓î Û░£ýäáÝòá ýêÿ ý×êýØä Û▓âýØ┤Ùïñ.
CIDPýùÉýä£ ýïáÛ▓¢ý┤êýØîÝîî ýåîÛ▓¼ýùÉ ÙîÇÝò£ ý▓½ Ù▓êýº© Ù│┤Û│áÙèö 2000ÙàäýùÉ ý×êýùêý£╝Ù®░, ýáÇý×ÉÙôñýØÇ 3ÙàäýØÿ ý£áÙ│æ Û©░Û░äýØ┤ ý×êÙèö Ùï¿ýØ╝ ÝÖÿý×ÉýùÉýä£ 7-MHZ ýºüýäáÝâÉýâëý×ÉÙí£ ýûæý©í ýâüýÖä ýïáÛ▓¢ý┤ØýØ┤ Ýü¼Û▓î Ýî¢ÙîÇÙÉ£ ýåîÛ▓¼ýØä Û©░ýêáÝòÿýÿÇÙïñ[27]. ýØ┤Ùƒ¼Ýò£ ýåîÛ▓¼ýØÇ ÙºÉý┤êýïáÛ▓¢ýùÉ ÙîÇÝò£ ýÂöÛ░ÇýáüýØ© ý┤êýØîÝîî Û▓Çýé¼Ùí£ ýØ┤ýû┤ýíîÛ│á, Ù¬¿Ùôá ýïáÛ▓¢ýØÇ ýòäÙïêýºÇÙºî ýØ╝ÙÂÇ ýïáÛ▓¢ÙôñýùÉýä£ýØÿ Ù╣äÙîÇÛ░Ç Ù░ØÝÿÇýíîÙïñ. Ùï¿Ù®┤ýáüýØÇ ýá£ýï£ÙÉÿýºÇ ýòèýòÿý£╝Ùéÿ Û░ÇÙí£ýèñý║ö ýÿüýâüýùÉýä£ ýáòýñæýïáÛ▓¢ýØÿ ýºüÛ▓¢ýØÇ 5 mmýÿÇÙïñ. ýïáÛ▓¢Ýî¢ÙîÇÙèö CIDP ÝÖÿý×ÉýùÉýä£ýØÿ ý×ÉÛ©░Û│ÁÙ¬àýÿüýâüÛ▓Çýé¼(magnetic resonance imaging)ýØÿ Û©░ýí┤ Ù│┤Û│áÛ░Ç ý×êýùêÛ©░ ÙòîÙ¼©ýùÉ ýáäÝÿÇ ýâêÙí£ýÜ┤ ýåîÛ▓¼ýØÇ ýòäÙïêÙ®░, CIDP ÝÖÿý×É ýïáÛ▓¢ýùÉýä£ ýáäÝÿòýáüý£╝Ùí£ Û┤Çý░░ÙÉÿÙèö ýûæÝîîÛÁ¼ÛÀ╝(onion bulb) ýûæýâüýØÿ ýí░ýºüýåîÛ▓¼ýùÉ ÙÂÇÝò®ÙÉ£Ùïñ. ýûæÝîîÛÁ¼ÛÀ╝ ýûæýâüýØÇ ýïáÛ▓¢ýØ┤ Ýâêýêÿý┤êÝÖöýÖÇ ý×¼ýêÿý┤êÝÖöÙÑ╝ Ù░ÿÙ│ÁÝòÿÙ®┤ýä£ Ù░£ýâØÝòÿÙèö ýïáÛ▓¢ Ù╣äÙîÇÙí£ ÙéÿÝâÇÙé£Ùïñ.
ýØ┤ýû┤ýä£ 2004ÙàäýùÉ Matsuoka Ùô▒[28]ýØÇ 13Ù¬àýØÿ CIDP ÝÖÿý×ÉÙôñýØÿ Û▓¢ýÂö 5-7Ù▓ê ýïáÛ▓¢Ù┐îÙª¼ÙÑ╝ 7.5-MHZ ýºüýäá ÝâÉýâëý×ÉÙÑ╝ ýé¼ýÜ®Ýòÿýù¼ ýáòýâüýØ© 35Ù¬àÛ│╝ Ù╣äÛÁÉÝòÿýÿÇÛ│á, 13Ù¬à ýñæ 9Ù¬àýØÿ CIDP ÝÖÿý×ÉÙôñýùÉýä£ Û▓¢ýÂöýïáÛ▓¢Ù┐îÙª¼ Ýî¢ÙîÇÙÑ╝ ÝÖòýØ©ÝòÿýÿÇÙïñ. ÙÿÉÝò£ ýïáÛ▓¢ Ù╣äÙîÇÛ░Ç Ùçîý▓Öýêÿýòí Ùï¿Ù░▒ýºê ýªØÛ░ÇýÖÇ ýºüýáæýáüýØ© ýâüÛ┤ÇÛ┤ÇÛ│äÛ░Ç ý×êýØîýØä ýªØÙ¬àÝòÿýÿÇÙïñ. ýØ┤Ùƒ¼Ýò£ ÛÀ╝Û▒░Ùí£ ýáÇý×ÉÙôñýØÇ ýïáÛ▓¢Ù┐îÙª¼ Ù╣äÙîÇýùÉ ÙîÇÝò£ ý┤êýØîÝîî ýäáÙ│ä Û▓Çýé¼Û░Ç CIDP ýºäÙï¿ Û▓Çýé¼ ýù¡ÝòáýØä Ýòá ýêÿ ý×êÙïñÛ│á ýú╝ý×ÑÝòÿýÿÇÙïñ.
CIDPýùÉýä£ýØÿ ýïáÛ▓¢ý┤êýØîÝîî ýåîÛ▓¼ýùÉ ÙîÇÝò£ ÙìöýÜ▒ ÝżÛ┤äýáüýØ© ýí░ÙºØýØÇ 2009Ùàä Zaidman Ùô▒[29]ýùÉ ýØÿÝò┤ ýØ┤Ùú¿ýû┤ýíîÙïñ. ÙïñÙ░£ýïáÛ▓¢Ù│æýùÉýä£ýØÿ ý┤êýØîÝîî ýù░ÛÁ¼ýØÿ Ýò£ ÙÂÇÙÂäý£╝Ùí£ýä£ 36Ù¬àýØÿ CIDP ÝÖÿý×ÉÙôñýØ┤ ÙîÇýâüýØ┤ýùêÛ│á, ýáòýñæýïáÛ▓¢Û│╝ ý▓ÖÛ│¿ýïáÛ▓¢ýØä Û▓Çýé¼Ýûêý£╝Ù®░, Ù»©Ùª¼ ýáòÝò£ ÙÂÇý£äýùÉýä£ ýïáÛ▓¢ Ùï¿Ù®┤ýáüýØä ý©íýáòÝòÿýÿÇÙïñ. CIDP ÝÖÿý×ÉÙôñýØÇ ýáòýâüýØÿ 2-3Ù░░ýùÉ Ùï¼ÝòÿÙèö Û┤æÙ▓öý£äÝò£ ýïáÛ▓¢Ýî¢ÙîÇ ýåîÛ▓¼ýØ┤ Û┤Çý░░ÙÉÿýùêý£╝Ù®░, ý£áÙ│æ Û©░Û░äÛ│╝ ýïáÛ▓¢ Ýü¼Û©░ýùÉýä£ ýºüýáæýáüýØ© ýâüÛ┤ÇÛ┤ÇÛ│äÛ░Ç Ù│┤ýÿÇÛ│á, Ùï¿Ù®┤ýáüÛ│╝ ýáäÙÅä ýåìÙÅäýùÉýä£Ùèö ýù¡ýØÿ ýâüÛ┤ÇÛ┤ÇÛ│äÛ░Ç ý×êýùêÙïñ.
CIDPýùÉýä£ ýïáÛ▓¢ý┤êýØîÝîîýØÿ ÙÿÉ ÙïñÙÑ© ý£áýÜ®ýä▒ýØÇ ýáäÙÅä ý░¿Ùï¿ýØä ÝÖòýØ©ÝòÿÙèö Û▓âýØ┤Ùïñ. ýïáÛ▓¢ ÛÀ╝ý£äÙÂÇýùÉ ýáäÙÅä ý░¿Ùï¿ýØ┤ ý×êÙèö Û▓¢ýÜ░ýùÉÙèö ýØ┤ÙÑ╝ ýªØÙ¬àÝòÿÙèö Û▓âýØ┤ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼Ùí£Ùèö ýóàýóà ýû┤ÙáÁÛ©░ ÙòîÙ¼©ýùÉ ýºäÙï¿Û│╝ ý╣ÿÙúîýùÉ ýºÇýù░ýØ┤ ýâØÛ©© ýêÿ ý×êÙïñ. 3Û▒┤ýØÿ Ùà╝Ù¼©ýùÉýä£ 2Ù¬àýØÿ CIDP ÝÖÿý×ÉýØÿ ýáäÛ©░ýºäÙï¿ÝòÖýáüý£╝Ùí£ ýáäÙÅäý░¿Ùï¿ ÙÂÇý£äýùÉýä£ ÛÁ¡ýåîýáüýØ© ýïáÛ▓¢ Ù╣äÙîÇÛ░Ç Û©░ýêáÙÉÿýùêÙïñ[30-32]. 2Û▒┤ýØÿ Ùà╝Ù¼©ýùÉýä£Ùèö ýâüýºÇýØÿ ýáòýñæýïáÛ▓¢Û│╝ ý▓ÖÛ│¿ýïáÛ▓¢ýØÿ Û░ÇÙí£ýèñý║öýùÉýä£ ýïáÛ▓¢Ýî¢ÙîÇÙÑ╝ ÝÖòýØ©Ýòá ýêÿ ý×êýû┤ýä£ Û│áÙ¼┤ýáüýØ┤ýùêý£╝Ùéÿ[31,32], Zaidman Ùô▒[29]ýØÿ Ù│┤Û│áýùÉýä£Ùèö ý£áýé¼Ýò£ ýûæýâüýØ┤ Û┤Çý░░ÙÉÿýºÇ ýòèýòÿÙïñ. 1Û▒┤ýùÉýä£Ùèö ÝÖÿý×ÉÛ░Ç ý×äýâüýáüý£╝Ùí£ ÝÜîÙ│ÁÙÉÿýùêýØîýùÉÙÅä ÙÂêÛÁ¼ÝòÿÛ│á ÛÁ¡ýåî ýïáÛ▓¢Ù╣äÙîÇ ýåîÛ▓¼ýØ┤ ýºÇýåìÙÉÿÙèö ýûæýâüýØä Û©░ýêáÝòÿýÿÇÙïñ[32]. Ùö░ÙØ╝ýä£ ýïáÛ▓¢ Ýü¼Û©░Ùèö ý£áÙ│æ Û©░Û░äÛ│╝ ýâüÛ┤Ç Û┤ÇÛ│äÛ░Ç ý×êý£╝Ù®░, ÛÁ¡ýåî ýïáÛ▓¢Ýî¢ÙîÇÙèö Ù¼┤Û©░Ýò£ýáüý£╝Ùí£ ýºÇýåìÙÉá ýêÿÙÅä ý×êÙïñ. ýØ┤Ùƒ¼Ýò£ ýÜöýåîÙèö ý╣ÿÙúî Ù░ÿýØæýØä Û░Éýï£ÝòÿÙèö ýïáÛ▓¢ý┤êýØîÝîîýØÿ ýù¡ÝòáýØä ýá£Ýò£Ýòá ýêÿ ý×êýØä Û▓âý£╝Ùí£ ýâØÛ░üÙÉÿýùêý£╝Ùéÿ ýÁ£ÛÀ╝ýùÉ Zaidman Ùô▒[33]ýØÇ ýí░Û©░ ý╣ÿÙúîÙÑ╝ Ù░øýØÇ CIDP ÝÖÿý×ÉýùÉýä£ ýïáÛ▓¢ Ùï¿Ù®┤ýáü Û░ÉýåîÛ░Ç ý×äýâü ýªØýâüýØÿ Ýÿ©ýáäÛ│╝ ý£áýØÿÝò£ ýâüÛ┤Ç Û┤ÇÛ│äÛ░Ç ý×êýØîýØä Ù│┤Û│á ÝòÿýÿÇÛ│á, ÝÿêÛ┤Ç ÙÂäÝżÙÅäÙÅä ýªØÛ░ÇÝòÿÙèö Û▓âý£╝Ùí£ ýòîÙáñýíîÙïñ[34].
ýáòÙª¼Ýò┤ Ù│┤Ù®┤, CIDPÙèö ÙºÉý┤êýïáÛ▓¢Û│╝ ÛÀ╝ý£äÙÂÇýïáÛ▓¢Ù┐îÙª¼ýØÿ Ù╣äÙîÇýÖÇ Û┤ÇÙá¿ýØ┤ ý×êý£╝Ù®░, ýØ┤ ÝÿäýâüýØÇ ýóàýóà ýïáÛ▓¢ ýâØÛ▓ÇýùÉýä£ Ù│┤ýØ┤Ùèö ýûæÝîîÛÁ¼ÛÀ╝ ýûæýâüÛ│╝ ýâüÛ┤ÇÛ┤ÇÛ│äÛ░Ç ý×êÙïñÛ│á ýâØÛ░üÙÉ£Ùïñ. CIPD ýºäÙï¿ýùÉýä£ ýïáÛ▓¢Ýî¢ÙîÇÙÑ╝ ýªØÙ¬àÝòÿÙèö Û▓âýØÇ ýºäÙï¿ýùÉ ÙÅäýøÇýØ┤ ÙÉÿÙ®░, ÝûÑÝøä Ù│┤ýí░ýáüýØ© ýºäÙï¿ Û©░ýñÇý£╝Ùí£ÙÅä ýé¼ýÜ®ÙÉá ýêÿ ý×êýØä Û▓âý£╝Ùí£ Û©░ÙîÇÙÉ£Ùïñ. ýáäÙÅäý░¿Ùï¿ ÙÂÇý£äýùÉýä£ Ù░£Û▓¼ÙÉÿÙèö ýïáÛ▓¢Ù╣äÙîÇÙèö ýâüý®ÙÉÿÙèö ÛÀ╝Û▒░Û░Ç ý×êý£╝Ùéÿ ýïáÛ▓¢Ù│æýØÿ Ù░£Ù│æ ýûæýâüýØä Ù░ØÝ×êÙèöÙì░ ÙÅäýøÇýØ┤ ÙÉá ýêÿ ý×êýØä Û▓âý£╝Ùí£ Û│áÙáñÙÉÿÙ®░, ý┤êÛ©░ýùÉÙèö Ùïñý┤êýáÉýáüý£╝Ùí£ Ýî¢ÙîÇÛ░Ç ýâØÛ©░ÙïñÛ░Ç ýºêÙ│æýØ┤ ýºäÝûëÝòÿÙèö ýï£Û░ä Û▓¢Û│╝ýùÉ Ùö░ÙØ╝ ýáäÙ░ÿýáüýØ© Ù╣äÙîÇÛ░Ç Ù░£ýâØÝòÿÙèö Û▓âý£╝Ùí£ ýÂöýáòÙÉ£Ùïñ. ýØ┤Ùƒ¼Ýò£ Û┤Çý░░ýåîÛ▓¼ýØÇ ý×äýâü ýØÿýé¼Û░Ç CIDPÙÑ╝ ÙìöýÜ▒ ýáòÝÖòÝ×ê ýºäÙï¿ÝòÿÛ│á ýºêÝÖÿýØÿ Ùºîýä▒ÙÅäÙÑ╝ ÝÅëÛ░ÇÝòÿÙèöÙì░ ÙÅäýøÇýØ┤ ÙÉá Û▓âýØ┤Ùïñ.
Û©ëýä▒ýù╝ýªØÙïñÙ░£ýïáÛ▓¢Ù┐îÙª¼ýïáÛ▓¢Ù│æ(acute inflammatory demyelinating polyradiculoneuropathy, AIDP)
Û©ëýä▒ýù╝ýªØÝâêýêÿý┤êÙïñÙ░£ýïáÛ▓¢Ù┐îÙª¼ýïáÛ▓¢Ù│æ(AIDP) ýªë Û©©ÙסÙ░öÙáêýªØÝøäÛÁ░(Guillain-Barr├® syndrome, GBS)ýØÇ ýáä ýä©Û│äýáüý£╝Ùí£ Ù╣äýÖ©ýâüýä▒ ÙºêÙ╣äýØÿ Û░Çý×Ñ ÝØöÝò£ ýøÉýØ©ý£╝Ùí£, Ù®┤ýù¡ÙºñÛ░£ýºêÝÖÿýØ┤Ù®░, ýâüÝûëýä▒ ýØ┤ýâüÛ░ÉÛ░üÛ│╝ ÛÀ╝ý£äýò¢, Û▒┤Ù░ÿýé¼ ýåîýïñýØ┤ Û©ëýä▒ý£╝Ùí£ Ù░£Ù│æÝò£Ùïñ. Ù¬ç ýòê ÙÉÿÙèö ýØæÛ©ë ýïáÛ▓¢ÛÀ╝ý£íýºêÝÖÿ ýñæ ÝòÿÙéÿÙí£ýä£, Ýÿ©ÝØíÛÀ╝ ý£äýò¢ýØ┤ Ù░£ýâØÝòá ýêÿ ý×êý£╝Ù»ÇÙí£, ýí░Û©░ ýºäÙï¿ýØ┤ ýñæýÜöÝòÿÙïñ. ýºäÙï¿ýØÇ ýú╝Ùí£ ý×äýâüýáüý£╝Ùí£ Ùé┤ÙáñýºÇÙèöÙì░ ÛÀ© ýØ┤ý£áÙèö ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ýÖÇ Ùçîý▓ÖýêÿýòíýØÿ Ùï¿Ù░▒ýä©Ýż Ýò┤Ùª¼ýÖÇ Û░ÖýØÇ ýåîÛ▓¼ýØ┤ ýºêÝÖÿýØÿ ý┤êÛ©░ ýêÿýØ╝ Ùé┤ýùÉÙèö ÙéÿÝâÇÙéÿýºÇ ýòèÛ©░ ÙòîÙ¼©ýØ┤Ùïñ.
AIDPýØÿ ý┤êýØîÝîî ýåîÛ▓¼ýùÉ ÙîÇÝò┤ýä£Ùèö ýòîÙáñýºä Û▓âýØ┤ ÙºÄýºÇÙèö ýòèýØÇÙì░, Zaidman Ùô▒[29]ýØÇ 17Ù¬àýØÿ AIDP ÝÖÿý×ÉÙôñýØä ÙîÇýâüý£╝Ùí£ ý┤êýØîÝîîÙÑ╝ ýºäÝûëÝòÿýÿÇÛ│á, ýØ┤ýñæ 13Ù¬àýØÇ Ù░£Ù│æ 4ýú╝ Ùé┤ýùÉ ýï£ÝûëÙÉÿýùêÙïñ. ý▓ÖÛ│¿ýïáÛ▓¢Û│╝ ýáòýñæýïáÛ▓¢ýØä Û▓Çýé¼ÝòÿýÿÇÙèöÙì░, ýáòýâüÛ│╝ Ù╣äÛÁÉÝòá Ùòî, 1.4Ù░░ ýáòÙÅä ý╗ñýá© ý×êýùêÙïñ. ýïáÛ▓¢Ù╣äÙîÇÙèö ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ ý▓ÖÙÅäýÖÇ ý£áýØÿÝò£ ýâüÛ┤Ç Û┤ÇÛ│äÙÑ╝ Ù│┤ýØ┤ýºÇ ýòèýòÿÙïñ.
Ùïñý┤êýáÉýÜ┤ÙÅÖýïáÛ▓¢Ù│æ(multifocal motor neuropathy)
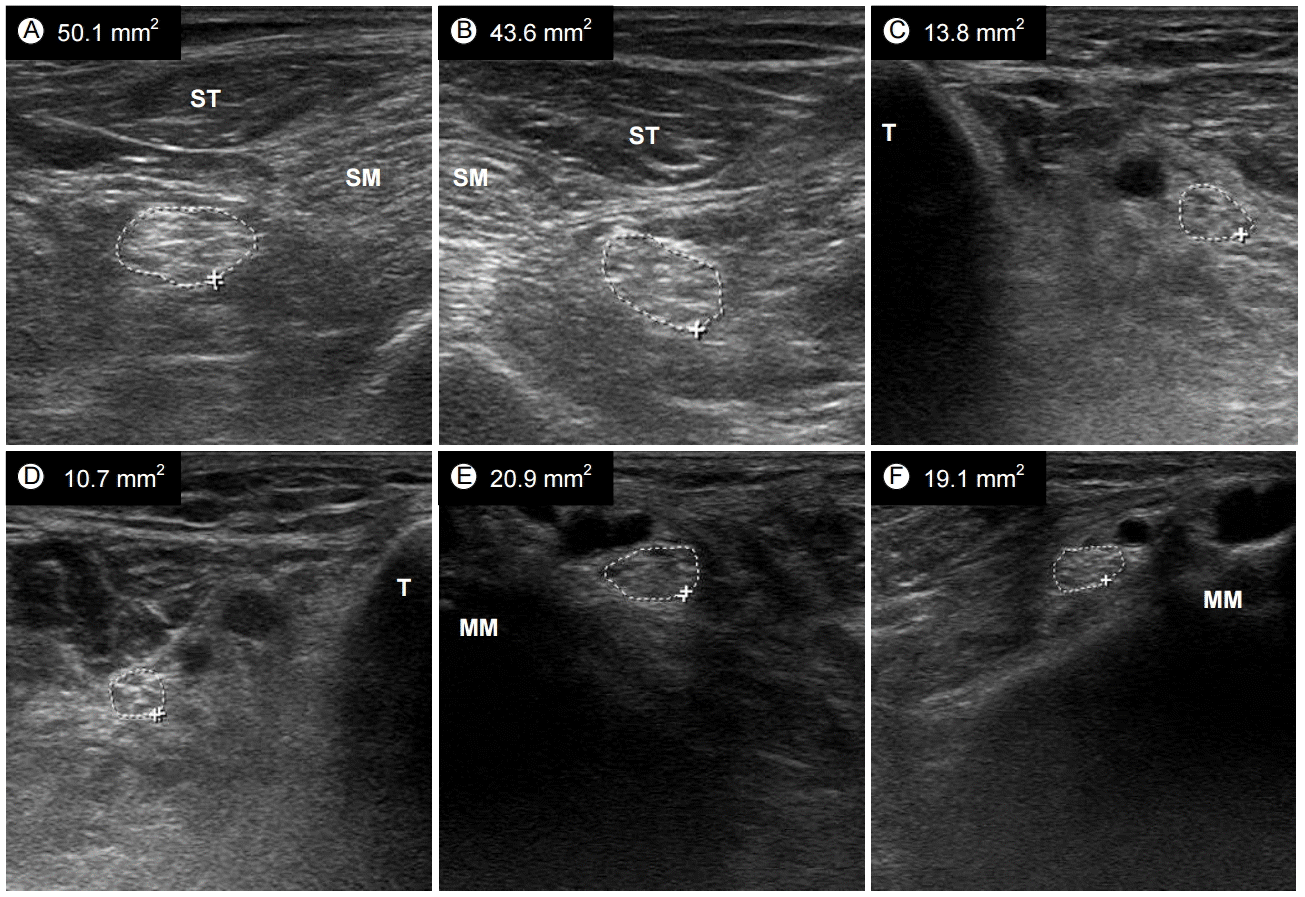
Ùïñý┤êýáÉýÜ┤ÙÅÖýïáÛ▓¢Ù│æýØÇ ýÜ┤ÙÅÖýïáÛ▓¢ÙºîýØä ý╣¿Ù▓öÝòÿÙèö Ýâêýêÿý┤êÙïñÙ░£ýïáÛ▓¢Ù│æý£╝Ùí£ Ýò¡GM1 Ýò¡ý▓┤ýÖÇ Û┤ÇÙá¿ÙÉÿÙ®░, ýºäÙï¿ýØÇ ý×äýâüýåîÛ▓¼Û│╝ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ Û▓░Û│╝ýùÉ ýØÿÝò┤ ýØ┤ÙñäýºäÙïñ. CIDPýùÉýä£ý▓ÿÙƒ╝, ýáäÙÅä ý░¿Ùï¿ýØÇ Ýîîýêÿ(sentinel)Û░ÖýØÇ Ýè╣ýºòýØ┤ýºÇÙºî, ÛÀ╝ý£äÙÂÇ ýïáÛ▓¢ýùÉ ý×êý£╝Ù®┤ ýóàýóà ý░¥Û©░Û░Ç ýë¢ýºÇ ýòèÙïñ. ýïáÛ▓¢ ýâØÛ▓Ç ýí░ýºüýåîÛ▓¼ýØÇ Ýâêýêÿý┤êÙ│æÙ│Çý£╝Ùí£ ýïáÛ▓¢ ÙÂÇýóàÛ│╝ Ùô£Ù¼© ýûæÝîîÛÁ¼ÛÀ╝ Ýÿòýä▒ýØ┤ Û┤Çý░░ÙÉ£Ùïñ. ýïáÛ▓¢Ýî¢ÙîÇ/Ù╣äÙîÇÛ░Ç ýâêÙí£ýÜ┤ ýåîÛ▓¼ýØÇ ýòäÙïêÙ®░, CIDPýùÉýä£ý▓ÿÙƒ╝ ý┤êýØîÝîîÛ░Ç ýºäÙï¿Û│╝ ý╣ÿÙúî Ù░ÿýØæ Û░Éýï£ ýûæý×ÉýùÉýä£ ýñæýÜöÝò£ ýù¡ÝòáýØä Ýòá Û▓âý£╝Ùí£ Û©░ÙîÇÙÉ£Ùïñ. ÙÿÉÝò£ Ù░£Ù│æ ýï£ýáÉýùÉ Ýò¡ýâü ýí┤ý×¼ÝòÿÙèö Û▓âýØ┤ ýòäÙïêÙ»ÇÙí£ ýïáÛ▓¢ý┤êýØîÝîîÙÑ╝ ÝåÁÝò£ ýí░Û©░ ýºäÙï¿ýØ┤ ý£áýÜ®Ýòá ýêÿ ý×êÙïñ. Û©░ýí┤ Ù│┤Û│áýùÉ ýØÿÝòÿÙ®┤ Ýâêýêÿý┤êýùÉ ýØ┤ýû┤ýºÇÙèö ýûæÝîîÙºØýÜ© Ýÿòýä▒ýùÉ ýØÿÝò┤ ýïáÛ▓¢ Ù╣äÙîÇÛ░Ç Ù░£ýâØÝòÿÛ│á(Fig. 2) ýØ┤ÙÑ╝ ýïáÛ▓¢ý┤êýØîÝîîÙí£ Ùïñý┤êýáÉ ÛÁ¡ýåî ýïáÛ▓¢Ù╣äÙîÇ ýåîÛ▓¼ýØä Ù│┤Û│áÝòÿýÿÇÙïñ[37].
ý£áýáä ýïáÛ▓¢Ù│æ
ýØ©ÛÁ¼ 2,500Ù¬àÙï╣ 1Ù¬àýùÉýä£ Ù░£Ù│æÝòÿÙèö ý£áýáä ýÜ┤ÙÅÖÛ░ÉÛ░ü ÙïñÙ░£ýïáÛ▓¢Ù│æýØ© ýâñÙÑ┤ý¢ö-ÙºêÙª¼-Ýê¼ýèñÙ│æ(Charcot-Marie-Tooth disease, CMT)ýØÇ ýïáÛ▓¢ÛÀ╝ý£íýºêÝÖÿýùÉýä£Ùèö Ùô£Ù¼╝ýºÇ ýòèýØÇ ÝÄ©ýØ┤Ùïñ[38]. ýä£ÙÑ© ýóàÙÑÿ ýØ┤ýâüýØÿ ýä©ÙÂÇ ýòäÝÿòýØ┤ Ù░ØÝÿÇýíîÛ│á ýêÿý┤êýÖÇ ýÂòýé¡ Ùï¿Ù░▒ýºêýØÿ ÛÁ¼ýä▒ýùÉ ýÿüÝûÑýØä ýú╝Ùèö ý£áýáäý×ÉýØÿ Û▓░Ýò¿ý£╝Ùí£ Ù░£ýâØÝòÿÙèöÙì░ ý£áýáäý×É Û▓Çýé¼Û░Ç ÝÖòýºäýØä ý£äÝò┤ ýñæýÜöÝòÿýºÇÙºî Û│áÛ░ÇýØÿ Û▓Çýé¼ýØ┤Û│á Û©░ýí┤ýùÉ ýòîÙáñýºä ý£áýáäý×ÉÛ░Ç ýòäÙïî ýâêÙí£ýÜ┤ ý£áýáäý×É ÙÅîýù░Ù│ÇýØ┤ýØ╝ Û▓¢ýÜ░ýùÉÙèö ýøÉýØ©ýØä ýòîÛ©░ ýû┤ÙáñýøîýºäÙïñ. Ùö░ÙØ╝ýä£ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ÙÑ╝ ÝåÁÝò┤ ýÂòýé¡ÝÿòÛ│╝ Ýâêýêÿý┤êÝÿòýØä ÙÂäÙÑÿÝòÿÙèö Û▓âýØ┤ Ýò£Û│äÙèö ý×êýºÇÙºî ýù¼ýáäÝ×ê ýñæýÜöÝòÿÙïñ. Ýè╣Ý×ê ýºêÝÖÿýØ┤ ýñæýªØý£╝Ùí£ ýºäÝûëÙÉÿýùêÛ▒░Ùéÿ ýÂòýé¡ÝÿòÛ│╝ Ýâêýêÿý┤êÝÿòýØÿ ýñæÛ░ä Ýæ£ÝÿäÝÿòýØ© Û▓¢ýÜ░ýùÉ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼Ùèö ýá£Ýò£ýáüýØ┤Ù®░, CMT ÝÖÿý×ÉýùÉýä£ Ýżý░®ýïáÛ▓¢Ù│æýØ┤ ÙÅÖÙ░ÿÙÉ£ Û▓¢ýÜ░ýùÉÙÅä ý┤êýØîÝîî ýùåýØ┤ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼Ùí£ ÝÅëÛ░ÇÝòÿÙèö Û▓âýØÇ ýë¢ýºÇ ýòèÙïñ. ýÁ£ÛÀ╝ ýù░ÛÁ¼ÙôñýØÇ CMT ýºäÙï¿ýùÉ ýïáÛ▓¢ý┤êýØîÝîîÛ░Ç ÙÅäýøÇýØ┤ ÙÉ£ÙïñÙèö ÛÀ╝Û▒░ÙÑ╝ ýá£ýï£ÝòÿÛ│á ý×êÙïñ[29]. Ýâêýêÿý┤êÙïñÙ░£ýïáÛ▓¢Ù│æýØ© CMT1ýùÉýä£ýØÿ Û┤æÙ▓öý£äÝò£ ýïáÛ▓¢ ÙÂÇýóà ýåîÛ▓¼ýØÇ(Fig. 3) CMT1ýØ┤ ýØÿýï¼ÙÉÿÙèö ÝÖÿý×ÉýùÉýä£ ýäáÙ│ä Û▓Çýé¼Ýòá Ùòî ýé¼ýÜ®ÙÉá ýêÿ ý×êýØîýØ┤ Ù│┤Û│áÙÉÿýùêÛ│á[39], ÙÿÉÝò£ ÝÖÿý×ÉýØÿ Û░Çýí▒ÙôñýùÉýä£ ý┤êýØîÝîî Û▓Çýé¼ÙÑ╝ ýï£ÝûëÝò¿ý£╝Ùí£ýì¿ ýäáÝâØýáü ý£áýáäý×É Û▓Çýé¼, ýï£Û░ä ýáêýò¢, ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ýØÿ ýäáÝâØýáü ýáüýÜ® Ùô▒ýØ┤ Û░ÇÙèÑÝòá ýêÿ ý×êÙïñ. ý£áýáä ýòòÙ░ò ýïáÛ▓¢ÙºêÙ╣ä(hereditary neuropathy with a liability to pressure palsy)ýÖÇ ýÂòýé¡ÝÿòýïáÛ▓¢Ù│æýØ© CMT2ýùÉýä£Ùèö ýòäýºü ýïáÛ▓¢ý┤êýØîÝîîýØÿ ýù¡ÝòáýØ┤ ýáòÙª¢ÙÉÿýºÇ ýòèýòäýä£ ýÂöÛ░ÇýáüýØ© ýù░ÛÁ¼Û░Ç ÝòäýÜöÝòÿÙïñ[29,40].
Û©░ÝâÇ Ýøäý▓£ ýïáÛ▓¢Ù│æ
Ùï╣Ùç¿Ù│æýä▒ ýïáÛ▓¢Ù│æ
Ùï╣Ùç¿Ù│æýØÇ ýáäýä©Û│äýáüý£╝Ùí£ Û░Çý×Ñ ÝØöÝò£ ÙºÉý┤êýïáÛ▓¢Ù│æýØÿ ýøÉýØ©ýØ┤Ùïñ. ÝÖÿý×ÉÙèö ÝåÁýªØýØä ÙÅÖÙ░ÿÝò£ ýáÇÙª╝, ÝòÿýºÇýØÿ ÛÂñýûæ, ÛÀ╝ý£äÙÂÇ ÝåÁýªØÛ│╝ ý£äýò¢ Ùô▒ýØÿ ÙïñýûæÝò£ ýªØýâüýØä Ù│┤ýØ©Ùïñ. Û©©ýØ┤ ýØÿýí┤ýáü ÙºÉý┤êÛ░ÉÛ░üýÜ┤ÙÅÖ ÙïñÙ░£ýïáÛ▓¢Ù│æÛ│╝ Ùï╣Ùç¿Ù│æýä▒ ÛÀ╝ý£äýÂò ýÖ©ýùÉ Ýżý░®ýïáÛ▓¢Ù│æýØ┤ Ù░£ýâØÝòá ý£äÝùÿÙÅä Ýü¼Ùïñ. Ùï╣Ùç¿Ù│æýä▒ ÙºÉý┤êýïáÛ▓¢Ù│æýØÇ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼Û░Ç ýÜ®ýØ┤ÝòÿýºÇ ýòèýØÇ ÝÖÿÛ▓¢ýùÉýä£Ùèö ýïáý▓┤Û▓Çýé¼Ùí£ ýºäÙï¿ÙÉ£Ùïñ. ýºÇÙé£ ýêÿÙàäÛ░ä Ùï¿ý×öýä¼ý£áÛ▓Çýé¼Ùí£ Û░ÉÛ░ü ý×ÑýòáÙÑ╝ ýäáÙ│äÝò┤ýÿñÛ│ñ ÝûêÙèöÙì░, ýïáÛ▓¢Ù│æ ýºäÙï¿ Ù»╝Û░ÉÙÅäÙèö ýïáÛ▓¢ýáäÙÅä Û▓Çýé¼ýÖÇ Ù╣äÛÁÉÝòá Ùòî 57-93%ýùÉ Ùï¼Ýò£Ùïñ. ýïáÛ▓¢Ù│æýØÿ ýí░Û©░ Ù░£Û▓¼ýØÇ Ù»©ý╣ÿý£á ÛÂñýûæýØ┤Ùéÿ ýé¼ýºÇ ýáêÙï¿ Ùô▒ýØÿ Ýò®Ù│æýªØýØä ýÿêÙ░®ÝòÿÛ©░ ý£äÝò┤ ÝòäýêÿýáüýØ┤Ùïñ. Ùï╣Ùç¿Ù│æýä▒ ÙºÉý┤êýïáÛ▓¢Ù│æýØÿ ÙïñýûæÝò£ ýûæýâü ÙòîÙ¼©ýùÉ ý┤êýØîÝîî ýåîÛ▓¼ýØä Û░ÇýáòÝòÿÙèö Û▓âýØÇ ýë¢ýºÇ ýòèÙïñ. ýïáÛ▓¢ Ù¬¿ýûæýùÉ ýÿüÝûÑýØä ýú╝Ùèö Ù│ÇýêÿÙèö Ùï╣Ùç¿Ù│æýØÿ ý£áÙ│æÛ©░Û░ä, ýïáÛ▓¢Ù│æýØÿ ýñæýªØÙÅä, ýïáÛ▓¢Ù│æýØÿ ý£áÝÿò Ùô▒ýØ┤Ùïñ. ýïáÛ▓¢ýùÉ ýåîÙÑ┤Ù╣äÝå¿ýØ┤ ýÂòýáüÙÉÿÙ»ÇÙí£ ýïáÛ▓¢ ÙÂÇýóàýØ┤ Ù░£ýâØÝò£ÙïñÙèö Û░ÇýäñÙÅä ý×êý£╝Ùéÿ, Ùºîýä▒ ýïáÛ▓¢Ù│æýØÿ Û▓¢ýÜ░ ýÂòýé¡ ýåÉýâüý£╝Ùí£ ýØ©Ýòÿýù¼ ýïáÛ▓¢ Ùï¿Ù®┤ýáüýØ┤ Û░ÉýåîÝòÿÛ│á ýùÉý¢ö Ù░£ýâØÙÅäÛ░Ç ýáÇÝòÿÙÉ£ÙïñÙèö ýú╝ý×ÑýØ┤ Ùìö ýäñÙôØÙáÑýØ┤ ý×êÙïñ. Lee Ùô▒[41]ýØÇ 24Ù¬àýØÿ Ùï╣Ùç¿Ù│æýä▒ ýïáÛ▓¢Ù│æ ÝÖÿý×ÉýØÿ Û▓¢Û│¿ýïáÛ▓¢ Ùï¿Ù®┤ýáüýØä Ù░£Ù¬®ÛÁ┤ýùÉýä£ ý©íýáòÝûêÙèöÙì░, Ùï╣Ùç¿Ù│æýØ┤ ýùåÛ▒░Ùéÿ ÙºÉý┤êýïáÛ▓¢Ù│æ ýªØýâüýØ┤ ýùåÙèö Ùï╣Ùç¿Ù│æ ÝÖÿý×ÉýùÉýä£Ùèö 12 mm2ýÿÇý£╝Ùéÿ, ÙºÉý┤êýïáÛ▓¢Ù│æ ýªØýâüýØ┤ ý×êÙèö Ùï╣Ùç¿Ù│æ ÝÖÿý×ÉýùÉýä£Ùèö 24 mm2ýØ┤ýùêÙïñ. ýØ┤Ùƒ¼Ýò£ ý░¿ýØ┤Ùèö ýØÿÙ»©Û░Ç ý×êýºÇÙºî ý©íýáò ÙÂÇý£äÛ░Ç Ýżý░®ýØ┤ ý×ÿ ÙÉÿÙèö Û││ýØ┤Ù»ÇÙí£ ýú╝ýØÿÛ░Ç ÝòäýÜöÝòÿÙïñ. Watanabe Ùô▒[42]ýØÇ 20Ù¬àýØÿ Ùï╣Ùç¿Ù│æ ÝÖÿý×ÉýÖÇ ýáòýâüÛÁ░ýùÉýä£ ýåÉÙ¬®ÛÁ┤, ýòäÙ×ÿÝîö ÝòÿÙï¿, ÝîöÛ┐êý╣ÿ Ùô▒ýùÉýä£ ýáòýñæýïáÛ▓¢ Ùï¿Ù®┤ýáüýØä ý©íýáòÝòÿýÿÇÙèöÙì░, ýåÉÙ¬®ÛÁ┤ýªØÝøäÛÁ░ýªØýâüýØÇ Ù│┤ýØ┤Ùèö ÝÖÿý×ÉÙôñýØÇ ýá£ýÖ©ÝòÿýÿÇÙïñ. Ùï╣Ùç¿Ù│æ ÝÖÿý×ÉÙôñýØÇ ýïáý▓┤Û▓Çýé¼ýùÉ ýØÿÝò£ ÙºÉý┤êýïáÛ▓¢Ù│æýØÿ ý£áÙ¼┤ýùÉ Ùö░ÙØ╝ ÛÁ¼ÙÂäÙÉÿýùêÛ│á, ÙºÉý┤êýïáÛ▓¢Ù│æýØ┤ ýùåÙèö Ùï╣Ùç¿Ù│æ ÝÖÿý×ÉÙôñÛ│╝ ýáòýâüÛÁ░ýØÿ ýïáÛ▓¢ Ùï¿Ù®┤ýáüýØÿ ý░¿ýØ┤Ùèö ýùåýùêÙïñ. ÙºÉý┤êýïáÛ▓¢Ù│æýØ┤ ý×êÙèö Ùï╣Ùç¿Ù│æ ÝÖÿý×ÉÙôñýØÇ ýáòýâüÛÁ░ýùÉ Ù╣äÝò┤ ýåÉÙ¬®ÛÁ┤Û│╝ ýòäÙ×ÿÝîö ÝòÿÙï¿ýùÉýä£ ýïáÛ▓¢ Ùï¿Ù®┤ýáüýØÿ Ýü¼Û©░Û░Ç ýªØÛ░ÇÙÉÿýû┤ ý×êýùêÙïñ. ýØ┤ Û▓░Û│╝ ÙÿÉÝò£ Ýżý░®ýïáÛ▓¢Ù│æÛ│╝ýØÿ Û┤ÇÙá¿ýä▒ýùÉ ýú╝ýØÿÙÑ╝ Û©░ýÜ©ýù¼ýò╝ ÝòÿÛ▓áÙïñ. Zaidman Ùô▒[29]ýØÇ Ùï╣Ùç¿Ù│æ Ùô▒ýØÿ ýÂòýé¡Ýÿò ýïáÛ▓¢Ù│æ ÝÖÿý×ÉÙôñÛ│╝ ýáòýâüÛÁ░ýØÿ ýïáÛ▓¢ Ùï¿Ù®┤ýáüýØÿ ý░¿ýØ┤Ùèö ýùåÙïñÛ│á ýú╝ý×ÑÝòÿýÿÇÙïñ. Ùï╣Ùç¿Ù│æýä▒ ÙºÉý┤êýïáÛ▓¢Ù│æýØÿ Ù│æÝâ£ýâØÙª¼ýùÉ ÙîÇÝò┤ýä£Ùèö Ù░ØÝÿÇýá©ýò╝ Ýòá Û▓âÙôñýØ┤ Ù¼┤ýêÿÝòÿÛ©░ ÙòîÙ¼©ýùÉ, Û©░ÙîÇÙÉÿÙèö ýïáÛ▓¢ý┤êýØîÝîî ýåîÛ▓¼ýØ┤ Ù¬àÝÖòÝòÿýºÇ ýòèýØÇ ýáÉýØÇ Ùï╣ýù░Ýòá ýêÿ ý×êÙïñ. Ùìö ÙºÄýØÇ ýù░ÛÁ¼ Û▓░Û│╝ÙôñýØ┤ ÙéÿýÖÇýä£ Ùï╣Ùç¿Ù│æýØÿ ÙïñýûæÝò£ ýèñÝÄÖÝè©Ùƒ╝ýùÉýä£ýØÿ ýïáÛ▓¢Ù│æÛ│╝ Û┤ÇÙá¿ÙÉ£ ý┤êýØîÝîî ýåîÛ▓¼ýØ┤ ÙÅäý£ÙÉÿýû┤ýò╝ ÝòÿÛ▓áÙïñ.
ÝÿêÛ┤Çýù╝ýïáÛ▓¢Ù│æ
ÝÿêÛ┤Çýù╝ýïáÛ▓¢Ù│æýØÇ ýïáÛ▓¢ÛÀ╝ý£íýºêÝÖÿýùÉýä£ Û░Çý×Ñ ýû┤ÙáñýÜ┤ ýºäÙï¿ ýñæýØÿ ÝòÿÙéÿÙí£ ýïáÛ▓¢ ýâØÛ▓ÇýØ┤ ýÁ£ýáü Ýæ£ýñÇý£╝Ùí£ ÙÉÿýû┤ ý×êÙïñ. ÛÀ©Ùƒ¼Ùéÿ ýïáÛ▓¢ýØ┤ Ù░ÿýáÉÝÿòý£╝Ùí£ ý╣¿Ù▓öÙÉ£ Û▓¢ýÜ░ ýïáÛ▓¢ ýâØÛ▓ÇýØä ÝòÿÙìöÙØ╝ÙÅä Ýò¡ýâü ýáòÝÖòÝò£ ýºäÙï¿ýØä Ùé┤Ùª┤ ýêÿ ý×êýºÇÙèö Ù¬╗ÝòÿÙïñ. ýïáÛ▓¢ ýâØÛ▓ÇýØÿ Ù»╝Û░ÉÙÅäÙèö 60% ýáòÙÅäÙí£ Ùé«ýØÇ ÝÄ©ýØ┤Ùïñ. ÙÿÉÝò£ ýïáÛ▓¢ ýâØÛ▓ÇýØÇ ÝÖÿý×ÉýùÉÛ▓î Û░ÉÛ░üýØ┤Ùéÿ ÛÀ╝ÙáÑýùÉýä£ ýÿüÛÁ¼ Û▓░ýåÉýØä ýóàýóà Ùé¿Û©░Û▓î ÙÉ£Ùïñ. ÝÿêÛ┤Çýù╝ýïáÛ▓¢Ù│æýØÇ ýØ╝ý░¿ýáüýØ© Ù╣äýáäýïáýºêÝÖÿý£╝Ùí£ Ù░£ýâØÝòÿÛ▒░Ùéÿ Churg-Strauss ýªØÝøäÛÁ░ý▓ÿÙƒ╝ Û┤æÙ▓öý£äÝò£ ýáäýïáÝÿêÛ┤Çýù╝ýØÿ ýù╝ýªØÙ░ÿýØæýùÉ ýØ┤ý░¿ýáüý£╝Ùí£ ýâØÛ©© ýêÿ ý×êÙïñ. ýáäÝåÁýáüý£╝Ùí£Ùèö ÝòÿýºÇÙÑ╝ ý╣¿Ù▓öÝòÿÙèö Ù╣áÙÑ© Ù░£Ù│æýØÿ ÝåÁýªØýØä ÙÅÖÙ░ÿÝòÿÙèö ýÜ┤ÙÅÖ Û░ÉÛ░ü ýåîýïñÙí£ Ù░£ÝÿäÝòÿÙ®░, ÙïñÙ░£ýä▒ Ùï¿ýØ╝ýïáÛ▓¢ýù╝ýØ┤ ÛÁÉÛ│╝ýä£ýáüýØ© ý×äýâüÝÿòýØ┤ýºÇÙºî Û©©ýØ┤ýØÿýí┤ýáü ÙîÇý╣¡ÙïñÙ░£ýïáÛ▓¢Ù│æý£╝Ùí£ ÙéÿÝâÇÙéÿÛ©░ÙÅä Ýò£Ùïñ. ýïáÛ▓¢ ýâØÛ▓ÇýØÇ ÙïñýûæÝò£ ýåîÛ▓¼ýØä ýá£Û│ÁÝò£Ùïñ. ÝÿêÛ┤Ç ýú╝ý£ä ýù╝ýªØýùÉ ýÂöÛ░ÇÙí£ ýïáÛ▓¢ ýú╝ý£ä Ù╣äÝøäÙÅä Û┤Çý░░ÙÉ£Ùïñ(Fig. 4). ýêÿý┤êýïáÛ▓¢ýä¼ý£á ýåîýïñÙÅä Ù│┤ýØ©Ùïñ. ýí░ýºü ýåîÛ▓¼ýØÇ ý£áÙ│æ Û©░Û░ä, Ýÿäý×¼ýØÿ ýºêÝÖÿ ÝÖ£ÙÅÖýä▒, ýâØÛ▓Ç ýí░ýºüýØÿ ý╣¿Ù▓ö ýáòÙÅäýÖÇ Û░ÖýØÇ ÙïñýûæÝò£ ýØ©ý×ÉýùÉ ýÿüÝûÑýØä Ù░øÙèöÙïñ. ýØ┤Ùƒ¼Ýò£ ýØ┤ýºêýä▒ý£╝Ùí£ ý┤êýØîÝîî ýåîÛ▓¼ýØä ýÿêý©íÝòÿÙèö Û▓âýØÇ ýë¢ýºÇ ýòèý£╝Ùéÿ Û©ëýä▒Û©░ýùÉÙèö ÙÂÇýóàý£╝Ùí£ ýïáÛ▓¢ýØ┤ ý╗ñýºÇÙèö Û▓âý£╝Ùí£ ýâØÛ░üÙÉ£Ùïñ. ÝÿêÛ┤Çýù╝ýïáÛ▓¢Ù│æýØÿ ýí░Û©░ ýºäÙï¿Û│╝ ý╣ÿÙúîÙèö ýÿüÛÁ¼ ýïáÛ▓¢ Û▓░ýåÉýØä ýÿêÙ░®ÝòÿÛ│á Û┤æÙ▓öý£äÝò£ ýáäýïá ýåÉýâüÛ│╝ ýé¼ÙºØýØä ýÿêÙ░®ÝòÿÙèöÙì░ ÝòäýêÿýáüýØ┤Ùïñ. ýáäýïáÝÿêÛ┤Çýù╝ýïáÛ▓¢Ù│æýØÇ ý╣ÿÙúîÝòÿýºÇ ýòèý£╝Ù®┤ ýóàýóà ý╣ÿÙ¬àýáüýØ┤Ùïñ. ýù░ÛÁ¼Ùèö ýá£Ýò£ýáüýØ┤ýºÇÙºî, ý┤êýØîÝîîÙèö ÝÿêÛ┤Çýù╝ýïáÛ▓¢Ù│æýØÿ ýí░Û©░ ýºäÙï¿Û│╝ ýáòÝÖòÝò£ ýïáÛ▓¢ ýâØÛ▓Ç ÙÂÇý£äÙÑ╝ ýá£Û│ÁÝòá ýêÿ ý×êÙïñ. 2006Ùàä Nodera Ùô▒[43]ýØÇ ÝÿêÛ┤Çýù╝ýïáÛ▓¢Ù│æýùÉýä£ ýáòýñæ, ý▓ÖÛ│¿, Û▓¢Û│¿ýïáÛ▓¢Û│╝ Û▓¢ýÂöýïáÛ▓¢ Ù┐îÙª¼ýØÿ ýáÇýùÉý¢ö Ù░£ýâØÙÅäýÖÇ Û┤æÙ▓öý£äÝò£ Ù╣äÝøä ýåîÛ▓¼ýØä Ù│┤Û│áÝûêÙïñ. ýèñÝàîÙí£ýØ┤Ùô£ ý╣ÿÙúî Ýøä 2ýú╝ ý░¿ýùÉ ýï£ÝûëÝò£ ýÂöýáü Û▓Çýé¼ýùÉýä£ ý▓ÖÛ│¿ýïáÛ▓¢ýØÿ Ýü¼Û©░Û░Ç Ýü¼Û▓î Û░ÉýåîÝò£ Û▓âýØä Ù░£Û▓¼ÝòÿýÿÇý£╝Ùéÿ ÙïñÙÑ© ýïáÛ▓¢ýùÉ ÙîÇÝò£ ýû©Û©ëýØÇ ýùåýùêÙïñ. ÙÿÉÝò£ ýïáÛ▓¢ Ùï¿Ù®┤ýáüýØ┤ ýòäÙïî ýïáÛ▓¢ ýºüÛ▓¢ýØ┤ ý©íýáòÙÉÿýùêÙïñ. 2007Ùàä Ito Ùô▒[44]ýØÇ ÝÿêÛ┤Çýù╝ýïáÛ▓¢Ù│æ ÝÖÿý×ÉýØÿ Û▓¢Û│¿ýïáÛ▓¢ ýØ┤ýâüýØä ýáòýâüÛÁ░Û│╝ ý┤êýØîÝîîÙí£ Ù╣äÛÁÉÝòÿýÿÇÙïñ. ÝÖÿý×É 8Ù¬àýØÿ Û▓¢Û│¿ýïáÛ▓¢ 11Û░£ÙÑ╝ 35Ù¬àýØÿ ýáòýâü ÙîÇýí░ÛÁ░ýØÿ Û▓¢Û│¿ýïáÛ▓¢ 35Û░£ýÖÇ Ù╣äÛÁÉÝòÿýÿÇÙèöÙì░, ÝÖÿý×ÉýØÿ Ùï¿Ù®┤ýáüýØÇ 13.5 ┬▒ 3.7 mm2ýÿÇÛ│á, ýáòýâüÛÁ░ýØÇ 7.9 ┬▒ 1.5 mm2ýØ┤ýùêÙïñ. ýù░ÛÁ¼ý×ÉÙôñýØÇ ÝÿêÛ┤Çýù╝ýïáÛ▓¢Ù│æýØÿ ýïáÛ▓¢Ýî¢ÙîÇÛ░Ç ÙÂÇýóàÙ┐ÉÙºî ýòäÙïêÙØ╝ ýïáÛ▓¢ýÖ©ÙºëýùÉýä£ýØÿ ÝÿêÛ┤Çýù╝-ý£íýòäýóàÙ│æÙ│ÇýùÉ Ùö░ÙÑ© Û▓âý£╝Ùí£ ýÂöýáòÝòÿýÿÇÙïñ. ýïáÛ▓¢Ýî¢ÙîÇÛ░Ç ÝÿêÛ┤Çýù╝ýïáÛ▓¢Ù│æýØÿ ýØ╝Û┤ÇÙÉ£ Ýè╣ýºòýØ╝ Û▓¢ýÜ░, ý┤êýØîÝîîÙèö ýâØÛ▓ÇýØä ý£äÝò£ ýÁ£ýáüýØÿ ÙÂÇý£äÙÑ╝ Û▓░ýáòÝòÿÙèöÙì░ ÙÅäýøÇýØä ýñä ýêÿ ý×êÙïñ.
ÙéÿÙ│æ ýïáÛ▓¢Ù│æ
ÙéÿÙ│æýØÇ Ùºîýä▒ Û░Éýù╝Ù│æý£╝Ùí£ Ýö╝ÙÂÇýÖÇ ýïáÛ▓¢ýØä ý╣¿Ù▓öÝòÿÙ®░, ý╣¿Ù▓öÙÉ£ ýïáÛ▓¢ýØÇ ýØ╝ý░¿ýáüý£╝Ùí£ Û░ÉÛ░üýØ┤ ýåîýïñÙÉ£Ùïñ. ýïáÛ▓¢ ýåÉýâüýØä ýí░Û©░ýùÉ ýØ©ýºÇÝòÿÙèö Û▓âýØ┤ ý╣ÿÙúîÙÑ╝ ýï£ý×æÝòÿÛ│á ýÿüÛÁ¼ýáüýØ© Ýò┤ÙÑ╝ Ù░®ýºÇÝòÿÙèö Ùì░ýùÉ ýñæýÜöÝòÿÙïñ. Fornage Ùô▒[45]ýØÇ 1987ÙàäýùÉ Û▓░ÝòÁÝÿò ÙéÿÙ│æ ýºäÙï¿ýØä ý£äÝò┤ ýïáÛ▓¢ý┤êýØîÝîîÙÑ╝ ýé¼ýÜ®Ýò£ ýªØÙíÇÙÑ╝ Ù│┤Û│áÝòÿýÿÇÛ│á, ýØ┤Ýøä Martinoli Ùô▒[46]ýØ┤ 2000ÙàäýùÉ ÙéÿÙ│æ ÝÖÿý×É 23Ù¬àýØä ÙîÇýâüý£╝Ùí£ ýïáÛ▓¢ý┤êýØîÝîîÙÑ╝ ýï£ÝûëÝòÿýÿÇÙïñ. ý×äýâüýáü ÙÿÉÙèö ýáäÛ©░ýºäÙï¿ÝòÖýáüý£╝Ùí£ ýØ┤ýâüýØ┤ ý×êÙèö 58 ýïáÛ▓¢ýØä Û▓Çýé¼ÝòÿýÿÇÛ│á, 50Û░£Ùèö ý×ÉÛ©░Û│ÁÙ¬àýÿüýâüý£╝Ùí£ÙÅä Û▓Çýé¼ÝòÿýÿÇÙïñ. 17Û░£ýØÿ ýïáÛ▓¢ýØ┤ ý┤êýØîÝîîýÖÇ ý×ÉÛ©░Û│ÁÙ¬àýÿüýâü Ù¬¿ÙæÉýùÉýä£ ýáòýâüýØ┤ýùêý£╝Ùéÿ, 52%ýØ© 30Û░£ýØÿ ýïáÛ▓¢ýùÉýä£ ýáÇýùÉý¢öýØÿ Ù░®ýÂöÝÿòý£╝Ùí£ ÝÖòý×ÑÙÉ£ ÙÂÇý£äÛ░Ç Û┤Çý░░ÙÉÿýùêÙïñ. ÙéÿÙ¿©ýºÇ ýïáÛ▓¢ÙôñýØÇ Ýü¼Û©░Ùèö ýáòýâüýØ┤ýùêý£╝Ùéÿ ýáÇýùÉý¢öÙéÿ Û│áýùÉý¢öýØÿ Ù╣äýáòýâü ýùÉý¢öÙ░£ýâØ ýåîÛ▓¼ýØä Ù│┤ýÿÇÙïñ. Elias Ùô▒[47]ýØÇ 2009Ùàä ÙéÿÙ│æýØ┤ ýâêÙí£ ýºäÙï¿ÙÉ£ ÝÖÿý×ÉýØÿ ý▓ÖÛ│¿ýïáÛ▓¢ Û▓Çýé¼ÙÑ╝ ý£äÝò£ ý┤êýØîÝîî Û▓Çýé¼ÙÑ╝ ýù░ÛÁ¼ÝòÿýÿÇÙïñ. 21Ù¬àýØÿ ÙéÿÙ│æ ÝÖÿý×ÉÙôñýØ┤ ý╣ÿÙúî ýï£ý×æ ýáäýùÉ ý▓ÖÛ│¿ýïáÛ▓¢ý┤êýØîÝîîÙÑ╝ ýºäÝûëÝòÿýÿÇÛ│á, ýØ┤ýñæ 19Ù¬àýØÇ ýáäÛ©░ýºäÙï¿ Û▓Çýé¼ÙÅä Ù│æÝûëÝòÿýÿÇÙïñ. ý▓ÖÛ│¿ýïáÛ▓¢ Ùï¿Ù®┤ýáüýØÇ ýáòýâüÛÁ░Û│╝ Ù╣äÛÁÉÝòá Ùòî, ý£áýØÿÝòÿÛ▓î ýªØÛ░ÇÝòÿýÿÇý£╝Ù®░, ÝîöÛ┐ëÛÁ┤ýùÉýä£ ýáòýâüýØÇ 6.84 ┬▒ 1.92 mm2ýÿÇý£╝Ùéÿ, ÙéÿÙ│æ ÝÖÿý×ÉÛÁ░ýØÇ 14.51 ┬▒ 6.31 mm2ýÿÇÙïñ. 21Ù¬à ýñæ 19Ù¬àýùÉýä£ ýïáÛ▓¢Ýî¢ÙîÇÛ░Ç Ù│┤ýÿÇÛ│á, 16Ù¬àýùÉýä£ ýïáÛ▓¢ýáäÙÅä Û▓Çýé¼Û░Ç Ù╣äýáòýâüýØ┤ýùêÙïñ. ý£áýé¼Ýò£ ýù░ÛÁ¼Û░Ç 2009Ùàä 20Ù¬àýØÿ ÙéÿÙ│æ ÝÖÿý×ÉýÖÇ 30Ù¬àýØÿ ýáòýâüÛÁ░ýØä ÙîÇýâüý£╝Ùí£ ýï£ÝûëÙÉÿýùêÛ│á, ý▓ÖÛ│¿, ýáòýñæ, ýÖ©ý©íýÿñÛ©ê, ÝøäÛ▓¢Û│¿ýïáÛ▓¢ýØä Û▓Çýé¼ÝòÿýÿÇÙïñ[48]. Ù¬¿Ùôá Û▓Çýé¼ÙÉ£ ýïáÛ▓¢ýùÉýä£ ÙéÿÙ│æ ÝÖÿý×ÉÛÁ░ýØ┤ ýáòýâüÛÁ░Ù│┤Ùïñ ýªØÛ░ÇÙÉ£ ýïáÛ▓¢ Ùï¿Ù®┤ýáüýØä Ù│┤ýÿÇÛ│á, ÛÀ© ý░¿ýØ┤Ùèö ýâüÙï╣Ý×ê ý╗©Ùïñ(ýáòýâü 8.5 mm2, ÙéÿÙ│æ 22.7 mm2). ýùÉý¢ö Ù░£ýâØÙÅäýÖÇ ÝÿêÛ┤Ç ÙÂäÝżÙÅäýùÉýä£ÙÅä Ù│ÇÝÖöÛ░Ç Û┤Çý░░ÙÉÿýùêý£╝Ùéÿ, ýûæÛÁ░ýØÿ ý░¿ýØ┤Ùèö ÙæÉÙô£Ùƒ¼ýºÇýºÇÙèö ýòèýòÿÙïñ. ÙéÿÙ│æýØÇ ýòäýºüÙÅä Ùö░Ù£╗Ýò£ Û©░ÝøäýùÉýä£Ùèö ýù¼ýáäÝ×ê Ù░£ýâØÙÉÿÛ│á ý×êý£╝Ù»ÇÙí£, ý┤êýØîÝîîÙèö ýºäÙï¿Û│╝ ý╣ÿÙúî Ù░ÿýØæ Û░Éýï£ýùÉ ý£áýÜ®Ýòá ýêÿ ý×êÙïñ.
Û▓░ Ùíá
Ù│© ýóàýäñýùÉýä£Ùèö ÙºÉý┤êýïáÛ▓¢Ù│æýùÉ ÙîÇÝò£ ý┤êýØîÝîî Û©░ýí┤ Ùà╝Ù¼©ýØä Û░äÙ×ÁÝ×ê ýáòÙª¼ÝòÿýÿÇÙïñ. ýá£Û│ÁÙÉ£ ýáòÙ│┤Ùèö ýá£Ýò£ýáüýØ┤ýùêý£╝Ùéÿ, ýïáÛ▓¢Ù│æýØÿ ýºäÙï¿, ýïáÛ▓¢ ýâØÛ▓Ç ÙÂÇý£äýØÿ ýäáÝâØ, Ù│æÙ░£ÙÉ£ ÛÁ¼ýí░ýáü Ù│æÙ│ÇÛ│╝ Ýżý░® Ùô▒ýØÿ ýºäÙï¿ýùÉýä£ ý┤êýØîÝîîÙèö ý£áýØÿÝò£ ýù¡ÝòáýØä Ùï┤Ùï╣Ýòá ýêÿ ý×êýØîýØä ýï£ýé¼ÝòÿýÿÇÙïñ. ÙÿÉÝò£ ý┤êýØîÝîîÙèö Ù│æÝâ£ýâØÙª¼ýùÉ ÙîÇÝò£ ýâêÙí£ýÜ┤ ýáòÙ│┤ÙÑ╝ ýá£Û│ÁÝò¿ý£╝Ùí£ýì¿ ýïáÛ▓¢Ù│æ ýØ┤Ýò┤ýØÿ ÝÅ¡ýØä ÙäôÝÿÇ ýñä ýêÿ ý×êÙïñ. ýïáÛ▓¢ý┤êýØîÝîîÙèö Ù╣áÙÑ┤Û▓î Ù░£ýáäÝòÿÛ│á ý×êÛ│á Ýżý░®ýïáÛ▓¢Ù│æ Ù░Å ýÖ©ýâüýïáÛ▓¢Ù│æ ýºäÙï¿ýùÉýä£ ÝÖòÙª¢ÙÉ£ ýù¡Ýòá ýÖ©ýùÉÙÅä Ùïñý┤êýáÉ ýÜ┤ÙÅÖýïáÛ▓¢Ù│æ, CIDP, ý£áýáäýïáÛ▓¢Ù│æ Ùô▒ýØÿ ÙïñÙ░£ýïáÛ▓¢Ù│æýùÉýä£ ýí░Û©░ ýºäÙï¿ Ù░Å ý╣ÿÙúî Ù░ÿýØæÙÅä ÝÅëÛ░ÇÙÑ╝ ý£äÝò£ ýºÇÝæ£ýùÉ ÙîÇÝò£ ýù░ÛÁ¼ÙôñýØ┤ ýºäÝûëÙÉÿÛ│á ý×êÙïñ. Ýÿäý×¼Û╣îýºÇÙèö ýïáÛ▓¢ Ùï¿Ù®┤ýáüý£╝Ùí£ Ýâêýêÿý┤êýïáÛ▓¢Ù│æýØÿ ýïáÛ▓¢ ÙÂÇýóàýØä ý©íýáòÝòÿÛ│á ýºäÙï¿ÝòÿýÿÇý£╝Ùéÿ ÝûÑÝøä ýïáÛ▓¢ ÝÿêÛ┤Ç ÙÂäÝżÙÅäýÖÇ ýùÉý¢ö Ù░£ýâØÙÅä Ù░Å Ù░ÇÙÅäýùÉ ÙîÇÝò£ ýù░ÛÁ¼ýÖÇ 3D ý┤êýØîÝîî, ý┤êýØîÝîî ýí░ýºüÝâäÙáÑÙÅä Ùô▒ýØÿ ýïáÛ©░ýêá Ùô▒ýØ┤ ÙºÉý┤êýïáÛ▓¢Ù│æýùÉýä£ýØÿ ýïáÛ▓¢ý┤êýØîÝîîýØÿ ýù¡Ýòá ýáòÙª¢ýùÉ ÙÅäýøÇýØ┤ ÙÉá Û▓âý£╝Ùí£ ýâØÛ░üÙÉ£Ùïñ.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






