서 론
대동맥 박리는 대동맥을 침범하는 가장 치명적 질환 중 하나로 연간 발생률은 10만 명당 3-30명 정도로 보고되고 있다[1-4]. 대동맥 박리는 혈관 내막(intima)의 일차적인 파열로 인해 대동맥내 혈류가 중막(media)으로 흘러 들어와 박리를 일으키거나, 혈관 중막에 존재하는 혈관 맥관(vasa vasorum)의 파열로 인해 발생한 혈관벽내 출혈(intramural hematoma)이 내막을 손상시켜 이차적인 파열을 일으켜 발생시킨다고 알려져 있다.
흉부 혈관내 대동맥 치료(thoracic endovascular aortic repair, TEVAR)는 1988년 외상성 흉부 대동맥류 환자에서 처음으로 시행되었고[5], 대동맥 박리에서의 첫 연구는 1999년에 Dake 등[5-7]이 보고한 것으로, 혈관내 치료가 대동맥 박리 환자의 임상 결과를 개선시켰다고 발표하였다. 이후 많은 연구에서 혈관내 치료가 낮은 시술 관련 합병증 및 사망률, 짧은 입원 기간 등 향상된 초, 중기 성적을 보인다고 알려지면서, 수술적 및 보존적 치료가 대부분 이었던 기존의 치료 방법에서 점차 영역을 넓혀가게 되었다. 특히, 하행 대동맥 박리의 외과적 치료에 있어서는 현재 수술보다는 혈관내 대동맥 치료가 우선적으로 권고되고 있는 상황이다. 하지만 흉부 혈관내 대동맥 치료는 여전히 장기 성적, 하행 대동맥 박리 환자에서 내과적 치료에 대비한 임상결과, 시술 적응증 등에서 논란이 남아 있으며, 시술 방법적인 측면에서도 아직 정립되지 않은 부분이 있다. 향후 스텐트 그라프트(stent graft)의 개선, 시술 방법의 발전 및 혈관내 치료에 관한 더 많은 연구를 통해, 혈관내 대동맥 치료의 명확한 치료 지침 확립과 함께 치료 영역의 확대를 기대해 볼 수 있겠다.
진 단
대동맥 박리는 증상 발생 후 첫 48시간에 가장 높은 사망률을 보이며, 치료 받지 않은 급성 A형 박리의 경우 첫 24시간 동안의 사망률이 시간당 1-2%, 48시간 동안 30%, 1주 내에 약 50%에서 사망하는 것으로 알려져 있다[4]. 따라서 정확하고 빠른 진단이 치료 성적과 예후를 개선시키는 데 중요한 부분이 되겠다. 이러한 측면에서 영상 검사의 목적은 대동맥 박리의 진단 및 다른 형태의 급성 대동맥 증후군(혈관 벽내 혈종, 대동맥 궤양)을 감별하는 것뿐 아니라, 박리의 분류, 내막 파열의 위치, 박리의 침범 범위 및 응급 처치의 필요성 여부에 대한 정보를 얻어 올바른 치료 계획을 확립하는 데 있다.
대표적인 영상검사로는 computed tomography (CT), 경식도 초음파 및 magnetic resonance imaging이 있다. 세 가지 검사 모두 95% 이상의 민감도와 특이도를 가지고 있어 각 병원의 여건에 맞는 검사법을 선택하면 될 것이다. 하지만 조영 증강 CT가 가장 널리 쓰이는 진단 방법으로, 검사 시간이 적게 소요되고 박리의 진단뿐 아니라 치료 계획에 필요한 다양한 정보를 제공해주기 때문에 우선적으로 고려되어야 한다.
분 류
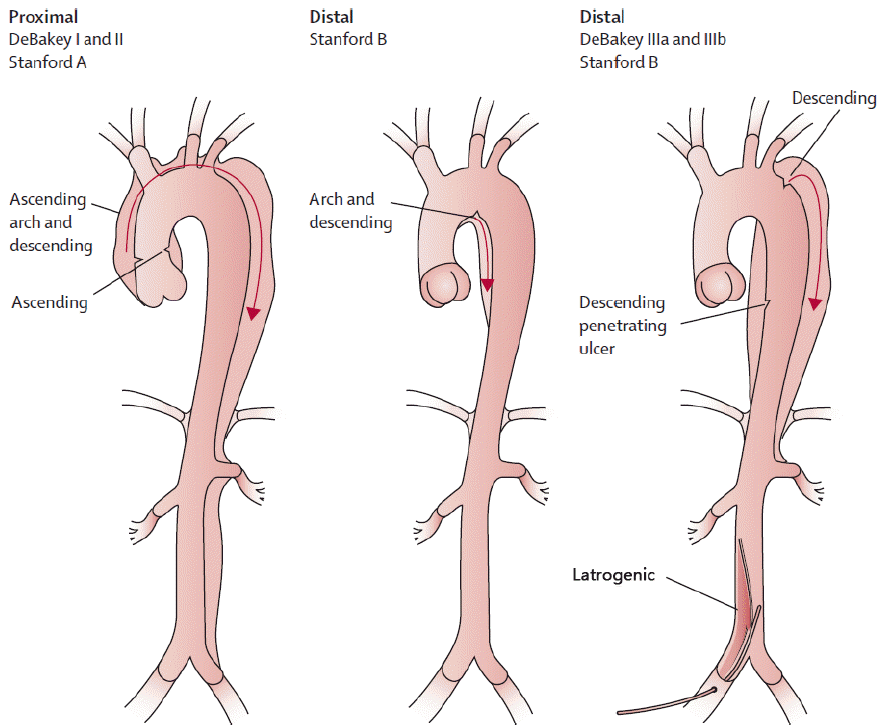
대동맥 박리는 일반적으로 박리의 해부학적 위치에 따른 분류 방법이 널리 쓰이고 있고, 그 외 발생 시간, 합병증의 유무에 따른 분류 방법이 있다. 해부학적 위치에 따른 분류 방법 중 가장 흔히 쓰이는 분류 체계는 DeBakey와 Stanford 분류로 다음과 같다(Fig. 1) [8].
해부학적 위치에 따른 분류
시간에 따른 분류
전통적으로 증상 발생 후 2주 이내를 급성 박리, 2주 이상을 만성 박리로 정의하고 있으며, 대부분의 연구 및 치료 지침에서 이러한 분류를 사용하고 있다. 이는 1958년에 발표된 대동맥 박리 환자의 부검 연구에서 74%의 환자가 2주 이내에 합병증으로 사망했다는 결과를 근거로 2주를 기점으로 급성과 만성으로 나누게 되었다[9,10]. 하지만, 이는 근래의 진단 기법 및 치료 방법이 사용되기 전의 결과로 이를 지금에도 적용해야 되는가에 대한 논란이 있다. 특히, 급성 박리 직후의 기간(> 2주)인 아급성(subacute) 기간에도 임상 사건의 발생빈도가 높고[11,12], 혈관내 대동맥 치료의 적절한 시행 시점과 관련하여서도 아급성 기간의 정의가 필요해, 최근에는 아급성 기간을 따로 구분해서 정의하고 있다[13,14]. 하지만 아급성 박리 기간을 유럽 심장학회에서는 15-90일로 정의하고 있으나, 다른 연구들에서는 8-30일[12], 15-30일[14], 2-6주[15] 등 일관되지 않아 공통된 정의의 확립이 필요하겠다.
합병증 유무에 따른 분류
합병증의 유무에 따른 분류는 특히 Stanford B형 대동맥 박리 환자에서 치료 방향을 결정하는 데 중요한 방법으로, 합병증이 있는 대동맥 박리(complicated aortic dissection)와 없는 대동맥 박리(uncomplicated aortic dissection)로 나눌 수 있다. 여기서, 합병증이 있는 대동맥 박리는 혈관 파열이 발생했거나 임박한 경우, 장기(뇌, 신장, 장, 간, 비장) 및 상하지의 혈류 장애로 인한 허혈, 치료에 반응 없는 고혈압 및 통증이 있는 경우로 정의하고 있으며, B형 대동맥 박리 환자의 약 30%에서 초기 진단 시 동반되어 있다[16].
치 료
약물치료
대동맥 박리의 치료는 약물치료가 기본이 되고 적응증이 된다면 추가적으로 수술적 치료 혹은 혈관내 치료를 시행하게 된다. 약물치료는 통증 조절과 함께 혈압과 맥박수를 조절함으로써 좌심실 압력상승의 dP/dt를 감소시켜 혈관의 전단 스트레스(shear stress)를 줄이는 것이 일차적 목표이다. 급성 박리에서는 베타 차단제를 우선적으로 정주 투여하며, 추가적 혈압 조절을 위해 니트로푸루시드 나트륨(sodium nitroprusside)을 사용할 수 있다. 하지만 니트로푸루시드 나트륨을 단독 투여하는 경우 dP/dt가 오히려 증가할 수 있기 때문에 반드시 베타 차단제와 함께 사용하여야 한다.
흉부 혈관내 대동맥 치료(TEVAR)
대동맥 박리에서 혈관내 치료는 혈관 내막의 파열된 부위를 스텐트 그라프트로 덮어 가강(false lumen)으로의 혈류유입을 차단시킴과 동시에 진강(true lumen)으로의 혈류를 증가시키기 위해 시행된다. 이러한 원리로 사지 허혈 및 장기 허혈을 보이는 B형 대동맥 박리 환자에서 스텐트 그라프의 삽입은 원위부의 관류를 개선시키게 된다. 또한, 혈류가 차단된 가강에는 혈전이 생성되고 시간이 경과하면서 가강은 위축되고 진강은 확장되는 대동맥 재형성(aortic remodeling)이 나타나 최종적으로는 혈관의 동맥류성 확장 및 파열을 억제함으로써 사망 위험을 낮추게 된다.
분류에 따른 치료방법의 선택
급성 A형 대동맥 박리
급성 A형 대동맥 박리는 내과적 치료만을 받은 경우 일주일 이내에 절반이 사망하는 치명적인 형태이다. 이전 international registry of acute aortic dissection (IRAD) 등록 연구 결과를 보면, 내과적 치료를 받은 경우보다 수술적 치료를 받은 경우 사망률을 절반 이하로 감소시킬 수 있었고(58% vs. 26%) (Fig. 2) [4], 이는 많은 다른 연구에서도 증명되었다. 현재 모든 치료 지침에서는 급성 A형 대동맥 박리의 경우 수술적 치료를 class I으로 권고하고 있다[13,17,18]. 하지만 수술적 치료의 비교적 높은 수술 사망률(26%) 및 신경학적 합병증(18%)과 수술 이후 남아있는 B형 대동맥 박리 등이 개선되어야 할 부분이다[19,20]. 이런 문제점을 해결하기 위해 수술 고위험 환자군에서 탈분지(debranching) 혹은 대동맥 궁 치환(arch replacement) 수술 후 스텐트 그라프트를 삽입하는 혼합 치료(hybrid procedure)가 하나의 대안으로 제시되고 있다. 유럽 심장 학회에서는 급성 A형 박리환자에서 장기 및 상하지 허혈이 동반되어 있다면 혼합 치료를 고려해 볼 것을 권고하고 있다(IIa) [13]. 다른 연구에서는 수술적 치료를 받은 A형 급성 대동맥 박리 환자의 CT 영상을 분석한 결과, 30-40%의 환자에서 이론적으로 혈관내 대동맥 치료가 가능한 해부학적 구조를 가지고 있다고 보고하였으며[21,22], 이러한 결과를 바탕으로 수술적 치료가 어렵고 해부학적 구조가 적합한 A형 박리환자에서 혈관내 치료를 시행한 결과도 보고되었다(n = 15, 원내 사망률 0%) [23].
합병증이 동반된 B형 대동맥 박리
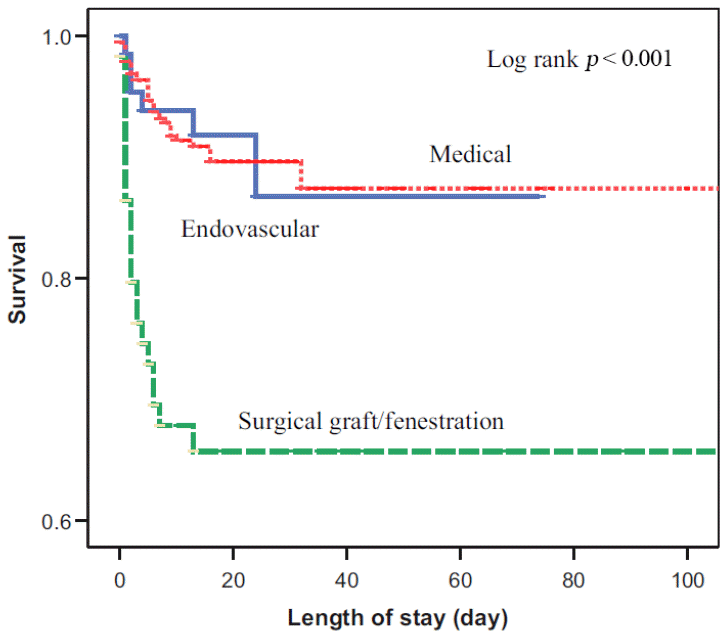
합병증이 동반된 B형 대동맥 박리의 치료는 수술적 치료와 흉부 혈관내 대동맥 치료가 있다. 합병증이 동반된 박리의 경우 수술적 치료는 25-50%에 이르는 높은 사망률과 함께 척수 허혈(spinal cord ischemia, 6.8%), 뇌졸중(stroke, 9%), 장간막 허혈(mesenteric ischemia, 4.9%) 및 급성 신부전(acute renal failure, 19%)과 같은 치명적 합병증이 비교적 높은 빈도로 보고되고 있다[16,24]. 치료 방법에 따른 임상 결과를 보면, 합병증이 동반된 B형 대동맥 박리 환자에서 혈관내 치료가 수술적 치료에 비해 유의하게 생존율을 개선시켰고(33.9% vs 10.6%, p = 0.002) (Fig. 3) [16]. 이 이외에 여러 메타 연구들에서도 혈관내 치료가 수술적 치료에 비해 사망률 및 합병증의 빈도를 감소시킨다고 보고되었다[25,26]. 이러한 연구들을 근거로, 현재 대부분의 치료 지침에서는 합병증이 동반된 B형 대동맥 박리의 경우 우선적으로 혈관내 재건술을 권고하고 있다[13,17].
흉부 혈관내 대동맥 치료의 임상 결과에 관한 메타 분석을 보면, 급성기의 경우에는 초기 사망률 10.2%, 뇌졸중 및 척수 허혈은 각각 4.9%, 4.2.%이었고, 급성기 이후(> 2주)에는 초기 사망률 6.6%, 뇌졸중 및 척수 허혈은 각각 1.9%, 1.5%로 보고되었다[15]. 급성기에 혈관내 재건술은 2주 이후에 시행한 경우보다 비교적 높은 빈도의 사건 발생을 보이지만, 현재까지 적절한 치료 시점에 대한 연구는 부족하고, 또한 혈관내 치료의 장기 성적, 그리고 혈관내 치료와 수술적 치료의 성적을 직접 비교한 무작위 배정 연구는 없어 향후 추가적인 연구가 필요하겠다.
합병증이 없는 B형 대동맥 박리
합병증이 동반되지 않은 안정적인 B형 대동맥 박리의 치료는 전통적으로 내과적 치료를 권고하고 있다. 초기 연구들에서 합병증이 없는 B형 대동맥 박리 환자에서 보존적 치료가 수술적 치료에 비해 입원 중 사망률이 현저히 낮고[4], 수술과 관련된 합병증 및 사망률의 빈도가 상당히 높아 현재 치료지침에서는 우선적으로 내과적 치료를 할 것을 권고하고 있다.
하지만 불행히도 약물치료를 한 B형 대동맥 박리 환자의 장기 임상 결과를 살펴보면, 1년 사망률 9.7%, 3년 사망률 22.4%, 5년 사망률 30%로 장기 추적 시 높은 사망률을 보이며[27], 박리 후 가강의 후기 확장(delayed expansion)도 4년에 20-50%에 이르는 것으로 알려져 있어[28], 보존적 치료 이외의 추가적 치료 전략이 필요해 보인다.
이러한 임상적 필요성에 따라 합병증이 동반되지 않은 B형 대동맥 박리 환자에서 혈관내 치료에 대한 연구들이 진행되어 왔다.
대표적 후향적 연구로는, 혈관내 치료 또는 약물치료를 받은 B형 대동맥 박리 환자 1,129명의 IRAD 등록 자료를 비교 분석한 결과로, 1년 추적 시에는 양 군 간에 유의한 차이를 보이지 않았으나, 5년 추적에서는 혈관내 재건술을 받은 군에서 사망률이 유의하게 낮았다(15.5% vs. 29.0%, p = 0.018) [29].
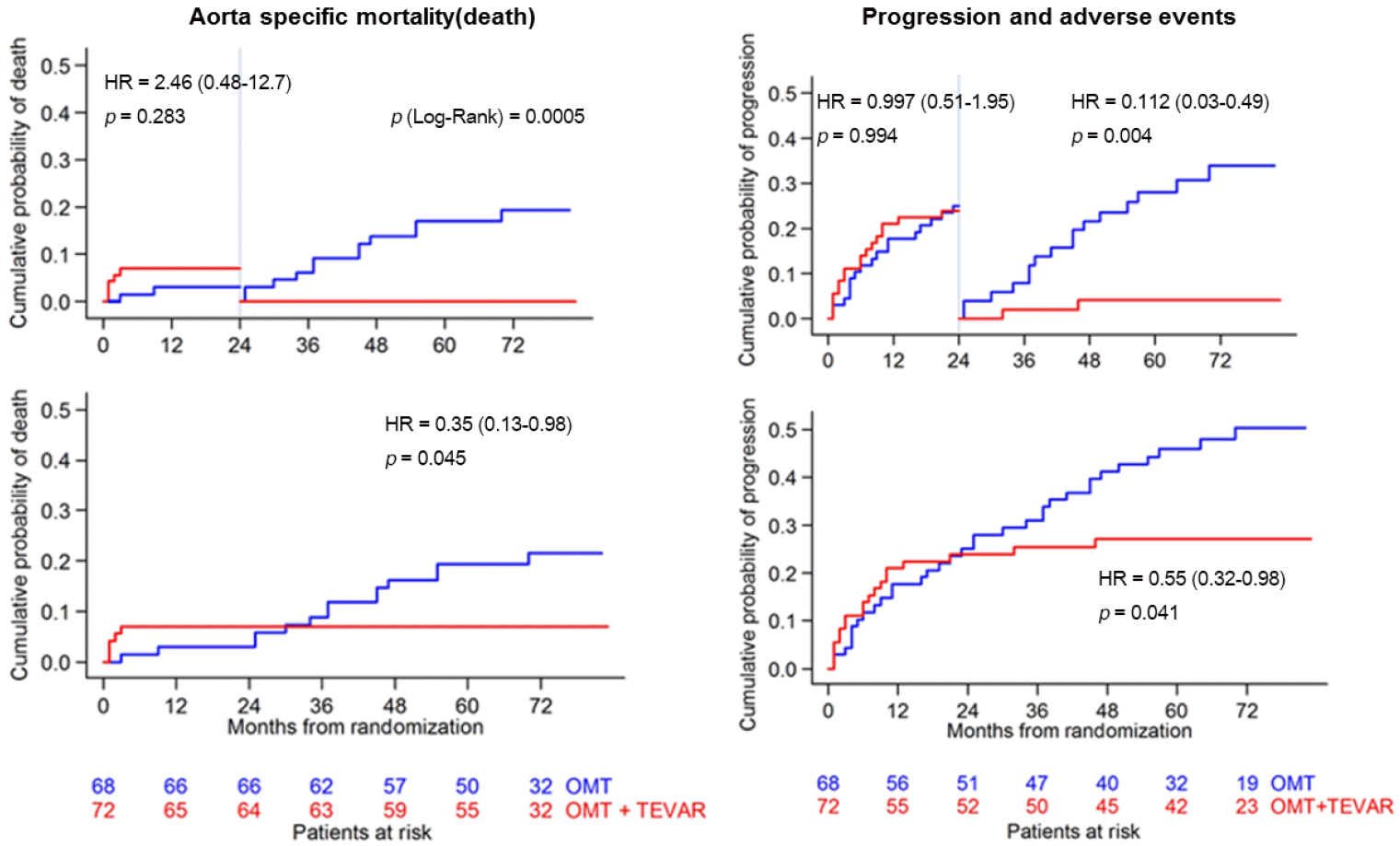
가장 주목할 만한 연구로는, 합병증이 동반되지 않은 B형 대동맥 박리 환자를 대상으로 보존적 치료와 혈관내 치료를 무작위배정 비교한 INSTEAD 연구와 ADSORB 연구가 있다[30-32]. 1년 추적 시, 두 연구 모두에서 가강의 혈전형성 및 진강의 확장으로 정의되는 대동맥 재형성(aortic remodeling)에서는 혈관내 치료가 보존적 치료에 비해 유의하게 좋은 결과를 보여주었지만, 실망스럽게도 생존율 및 임상 사건에서는 양 군 간 유의한 차이가 없었다[30]. 하지만 5년간 추적한 결과에서는 약물치료를 받은 군에서보다, 혈관내 치료를 받은 군이 질환악화의 빈도(27.0% vs. 46.1%; p = 0.045)뿐 아니라 대동맥관련 사망률(6.9% vs. 19.3%; p = 0.041)을 개선시켰다는 획기적인 결과를 발표하였다(Fig. 4) [31]. 이러한 결과들을 바탕으로, 현재 유럽 심장학회 치료 지침에서는 합병증이 동반되지 않은 안정적인 B형 대동맥 박리 환자에서도 혈관내 치료를 고려해 볼 것을 권고(IIa)하고 있다[13].
후기 대동맥 관련 합병증(delayed aortic related complications)과 흉부 혈관내 대동맥 치료
급성기 B형 대동맥 박리 환자에서 합병증이 동반되어 있지 않은 경우에는 약물치료가 권고된다. 하지만 5년 사망률이 30%까지 보고되고 있고, 사망원인의 대부분은 동맥류성 확장(aneurysm dilatation) 및 박리의 진행과 같은 후기 합병증들로 인한 동맥류 파열에 의한 것으로 알려져 있다. 대동맥 관련 사망 및 합병증 발생 가능성이 높은 박리의 특징에 관한 연구 결과를 정리해 보면, 1) 박리가 55-60 mm 이상의 동맥류성 확장을 보이는 경우 2) 급성기에 대동맥 박리의 직경이 40 mm 이상인 경우 3) 가강이 열려있는 경우(patent false lumen)나 가강내에 부분적인 혈전이 생성된 경우 4) 급성기에 가강의 직경이 22 mm 이상인 경우 5) 동맥류성 확장이 진행되는 경우(4-10 mm/year)이고, 이러한 환자에게는 흉부 혈관내 대동맥 치료가 고려되어야 한다.
대동맥 박리환자에서 혈관내 치료의 방법
합병증이 동반된 대동맥 박리 환자에서 시술방법은 크게 3가지로 나누어진다. 흉부 혈관내 대동맥 치료, 가강에 의하여 진강으로의 혈류가 차단된 신장동맥(renal artery), 경동맥(carotid artery), 상장관막 동맥(superior mesenteric artery) 등의 분지동맥에서의 선택적인 스텐트 삽입술(selective stenting), 진강과 가강 간의 개창술(fenestration)이 있다. 환자의 상황에 따라서 시술 방법을 선택하게 되는데, 위의 치료들을 동시에 같이 시행하여야 하는 경우들도 적지 않다.
흉부 혈관내 대동맥 치료
시술방법
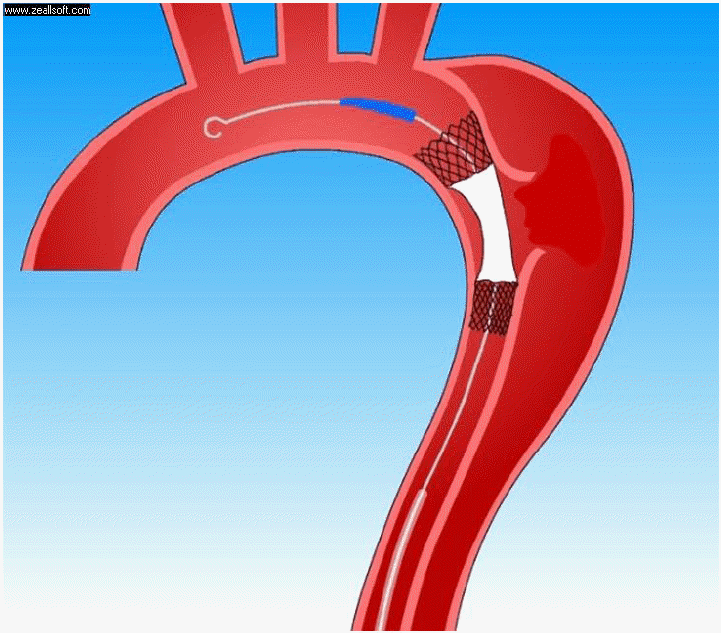
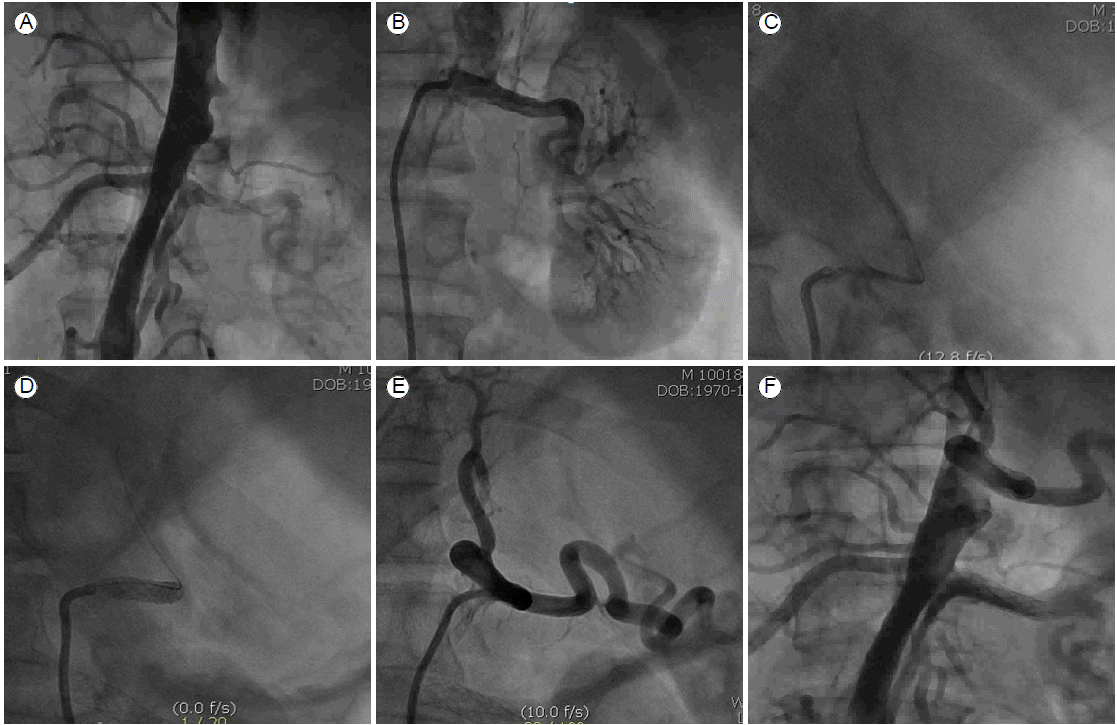
흉부 혈관내 대동맥 치료는 대동맥 박리의 내막 파열 부위(intimal tear)를 찾아서 스텐트 이식편으로 막아서 진강으로의 혈류를 회복하고 가강을 막아서 가강으로 가는 혈류를 차단하는 시술이다(Fig. 5). 시술 전에 CT를 자세히 평가하는 것이 무엇보다 중요하다. 내막 파열 부위가 어디에 있는지를 잘 찾아야 하며 대동맥 박리가 장골동맥까지 진행된 경우에는 진강에서 기시하는 대퇴동맥을 천자하여야 한다. 상장간동맥, 신장동맥, 경동맥 등의 주요 분지혈관이 진강 또는 가강에서 기시하는지를 잘 평가하여야 하고 시술 후에도 대동맥 조영술(aortography)을 통하여 주요혈관의 혈류가 회복되었는지 확인하여야 한다. 만일 혈류가 회복되지 않았다면 추가적으로 신장동맥, 상장간막 동맥 등에 대한 스텐트 시술이 필요하다.
진강에서 기시하는 대퇴동맥을 수술적인 절개(cut down)를 하거나, 봉합방식의 지혈기구인 perclose를 사용하여서 매듭을 준비해놓은 후에 시술을 시작한다. 대동맥 조영술을 통하여 병변을 평가하고 내막 파열 부위가 확인이 되면 그 부위에 스텐트 그라프트로 충분히 덮힐 수 있도록 계획한다. 적절한 근위부 착지부위(proximal landing zone)의 경우에는 내막 파열 부위가 좌쇄골하동맥(left subclavian artery)에서 15 mm 이상 떨어져 있어야 한다. 응급으로 위험한 상황에서는 좌쇄골하동맥을 막는 시술도 가능하다. 그러나 응급 상황이 아니라면 좌총경동맥과 좌쇄골하동맥을 인조혈관으로 연결하는 우회수술(left common carotid artery to left subclavian artery bypass operation)을 시행한 후에 스텐트 그라프트를 삽입하는 것이 바람직하다. 흉부 혈관내 대동맥 치료 후에는 스텐트 그라프트가 잘 펴지도록 5-20분 정도 기다려서 대동맥 조영술을 실시하여 혈관내 누출 여부와 가강으로의 혈류가 잘 차단되었는지 평가하고 상장간막 동맥, 신장동맥, 경동맥, 하지혈관동맥 등 주요 혈관의 혈류가 잘 회복되었는지를 평가한다. 혈류가 회복되지 않은 주요 혈관이 있다면 추가적으로 스텐트 시술이 필요하다.
스텐트 그라프트의 선택
국내에서 대동맥 박리에 사용 가능한 스텐트 그라프트는 3종류가 있다. 각각의 허가 상황을 살펴보면 S&G사 seal stent graft가 국내에서 대동맥 박리에 허가를 받았지만 국외 허가는 아직 없는 상태이고, Gore사 TAG stent graft는 대동맥 박리에 미국, 유럽의 허가와 임상 결과를 가지고 있고, 국내 허가는 진행 중이다. Medtronic사의 Valiant stent graft는 스텐트 부분이 노출되지 않고 갈고리 고정장치(barb)를 가지지 않은 제품만이 미국, 유럽, 국내에 대동맥 박리에 허가를 받은 상태이다.
스텐트 그라프트의 크기는 대동맥 박리가 없는 근위부와 원위부 혈관의 크기를 참조하여서 10-20% 정도 더 큰 크기의 기기를 선택하여 시술한다. 특히 대동맥궁의 굴곡 부위에는 스텐트 그라프트에 의한 혈관손상을 줄이기 위해 10% 정도 큰 스텐트 그라프트의 크기를 사용하는 것이 권고된다. 대동맥 박리가 길게 있는 경우 스텐트를 길게 넣을 것인지 짧게 넣을 것인지에 대해서 각각의 장단점이 있기 때문에 아직은 이견이 있는 상태이다. 짧은 스텐트 그라프트을 이용하는 경우에는 스텐트 그라프트 하방에서 혈류가 가강내로 역방향으로 유입될 수 있는 위험이 증가한다. 반면 긴 스텐트 그라프트를 삽입하는 경우에는 사지마비의 위험이 증가할 수도 있다. 대동맥 박리증 환자에서 스텐트 그라프트를 삽입하는 경우에는 스텐트 그라프트의 원위부가 추가적인 내막파열을 유발시킬 수 있기 때문에 원위부 직경이 점차 감소하는 직경 감소형 스텐트 그라프트를 이용하는 것도 적절한 선택이 될 수 있다. 그 외에는 척수로 혈류를 공급하는 혈관이 진강이 아닌 가강에서 기시하는 경우에 사지마비가 발생할 수 있다는 의견도 있다. 환자의 상태를 고려하여서 적절한 선택이 필요할 것으로 생각된다. 스텐트 그라프트 하방에 길게 추가적인 bare metal stent를 넣는 시술 방법의 임상성적은 기대만큼 좋지 않았다.
신장동맥, 상장간막동맥, 장골동맥, 경동맥 등 주요혈관의 선택적 스텐트 삽입술(selective branch artery stenting)
대동맥 박리가 발생해서 복강동맥(celiac trunk), 상장간막 동맥, 신동맥, 장골동맥 등 주요혈관의 혈류를 차단하는 경우 스텐트 시술이 필요하다. 시술 전에 CT를 평가해서 진강에서 기시하는 대퇴동맥으로 천자하여 시술을 시행한다. 혈관 촬영을 시행하면 가강에 의하여 막힌 혈관의 기시부를 찾을 수 있고 풍선확장술 후에 스텐트 삽입술을 한다. 이때 스텐트는 길게 주요 혈관에서 가강을 가로질러서 진강까지 이어지는 다리를 만드는 형태로 시술한다(Fig. 6).
결 론
흉부 대동맥 박리환자에서 혈관내 치료는 안전하고 양호한 임상성적들을 나타내고 있다. 대동맥 박리증 환자에서 합병증이 동반된 경우에는 상황에 따라 다양한 혈관내 시술 방법이 필요하다. 그러나 스텐트 그라프트는 삽입 후 제거가 어렵고 장기 추적관찰 시 재시술이 필요한 경우가 적지 않음으로 시술 전 영상 소견을 정확히 평가하고 모든 상황을 고려하여 치료 여부를 결정하는 것이 중요하다. 시술 후에는 정기적인 추적검사를 시행하는 것이 바람직하다. 합병증이 동반되지 않은 B형 대동맥 박리증 환자에서는 현재 혈관내 치료의 장기적인 성적에 대한 데이터가 충분하지 않음으로 더 많은 연구가 필요할 것으로 사료된다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






