 |
 |
| Korean J Med > Volume 89(3); 2015 > Article |
|
요약
저자들은 인접장기나 원발 장기의 폐렴사슬알균 감염의 근거가 없고 죽상 경화증을 동반하지 않은 혈관에서 폐렴사슬알균에 의해 발생한 감염성 대동맥류를 인공혈관 치환술과 항균제 병합요법으로 치료한 증례를 경험하였다. 감염성 대동맥류는 신속한 수술과 연장된 기간의 항균제 치료가 중요하므로 폐렴사슬알균 균혈증 발생 시 원인으로 감염성 대동맥류도 반드시 고려해야 한다.
Abstract
Streptococcus pneumoniae (S. pneumoniae), a bacterium that is part of the normal flora of the upper respiratory tract, can cause pneumonia, bacteremia, otitis media, and meningitis. There are few reports of infected abdominal aortic aneurysms due to S. pneumoniae, especially in Korea. We here present a 53-year-old male with an infected abdominal aortic aneurysm caused by S. pneumoniae. This patient had no previous history of atherosclerosis or infection of other organs such as the lungs, heart, or bones. He underwent resection of the abdominal aorta and iliac artery as well as bypass surgery, with maintenance of peri-operative intravenous antibiotics for 6 weeks. He has shown favorable outcomes after a 3-month follow-up.
환 자: 53세 남자
주 소: 배꼽 주위 통증
현병력: 내원 2개월 전부터 배꼽 주위 통증이 있다가 내원 10일 전부터 통증이 악화되어 외부 병원에서 복부 컴퓨터 단층 촬영(computed tomography, CT) 시행 후 복부 감염성 대동맥류를 진단받고 본원으로 전원되었다.
과거력: 내원 9년 전 알코올 유발성 만성 췌장염을 처음 진단받았고 이후 복통과 주췌관의 심한 협착으로 2006년부터 일년에 두 번 입원하여 반복적으로 내시경적 역행성 담췌관 조영술(endoscopic retrograde cholangiopancreatography, ERCP)을 통해 췌장 배액관 교환 시술을 받았으며, 가장 최근에는 내원 23일 전에 시행 받았다. 총 17번 췌장 배액관 교환 시술동안 항균제 노출력은 없었다.
사회력: 음주력 매일 소주 한 병, 흡연력 20갑년
가족력: 특이 사항 없었다.
신체 검사 소견: 내원 당시 만성 병색 소견이었고 혈압 140/90 mmHg, 심박수 60회/분, 체온 36.9℃, 호흡수 20회/분이었고 의식은 명료하였다. 심잡음은 들리지 않았고 폐음도 정상이었다. 복부 신체 진찰에서 배꼽 주변에 압통이 있으나 반발압통은 없었다.
검사실 소견: 말초 혈액 검사는 백혈구 6,700/μL (중성구 68%), 혈색소 9.8 g/dL (정상 범위: 12-16 g/dL), 혈소판 332,000/μL (정상 범위: 130,000-450,000/μL), C-반응 단백(C-reactive protein) 3.49 mg/dL(정상 범위: 0-0.5 mg/dL), 적혈구 침강 속도(erythrocyte sedimentation rate) 120 mm/hr (정상 범위: 0-30 mm/hr)이었다. 내원 시 시행한 혈액 배양 3쌍 중 3쌍 모두에서 폐렴사슬알균이 동정되었다. 항균제 감수성 검사는 Microscan WalkAway-96 plus system (Siemens, Wittelsbacherplatz, Muenchen, Germany)으로 시행하였고 2014년 1월 개정된 Clinical and Laboratory Standards Institute 가이드라인에 따라 감수성을 해석하였다. 배양된 폐렴사슬알균의 항균제 감수성은 penicillin에 중간내성(최소억제농도 4 μg/mL), ceftriaxone에 감수성(최소억제농도 0.5 μg/mL), vancomycin에 감수성(최소억제농도 0.25 μg/mL), meropenem에 내성(최소억제농도 > 0.5 μg/mL)이었다.
방사선 소견: 흉부 X-선 촬영에서 심비대는 없었고 폐실질에 폐렴은 없었다. 본원에서 내원 4개월 전에 시행한 복부 CT와 비교했을 때, 내원 당일 외부 병원에서 시행한 복부 CT에서 양쪽 신동맥부터 양쪽 총장골 동맥이 불규칙하게 늘어나 있고(가장 긴 직경: 3.2 cm) 동맥 내부에 석회화를 동반하지 않은 국소적인 궤양이 새로 발생하여 감염성 대동맥류에 합당한 소견이었다(Fig. 1 and 2).
병리 조직 소견: 혈관벽이 불규칙하게 늘어나 있고 내벽에는 점액질 섬유화로 두꺼워져 있었고, 혈관 주변으로 급성 염증 세포의 침윤이 관찰되었다.
치료와 경과: 입원과 동시에 메티실린 내성 황색포도알균, 녹농균을 포함한 그람음성균에 항균력이 있는 cefepime과 vancomycin 병합 치료를 시작하였고 혈액 배양 결과 확인 후 ceftriaxone에 감수성이었지만 penicillin에 중간내성으로 vancomycin 병합 치료를 총 6주 시행하였다. 주변의 감염 병소, 원위부 감염과 전이성 병변을 확인하기 위해 가슴경유심 초음파검사, 뼈스캔을 시행하였으나 감염성 심내막염, 척추의 골수염은 없어 폐렴사슬알균 균혈증의 원발병소로 감염성 대동맥류를 진단하였다. 항균제 치료 5일째 균혈증은 음전되었다. 입원 8일째 신동맥 기시부 직하방의 복부 대동맥과 양측 총장골 동맥, 그리고 외내장골동맥을 절제하고 polytetrafluoroethylene 인조혈관을 이용하여 복부대동맥-우측외장골 동맥, 좌측 대퇴동맥에 문합하고 우측 내장골 동맥을 인조혈관에 문합하는 인조혈관 치환술을 시행하였다(Fig. 3 and 4). 좌측 요관과 복부대동맥의 심한 유착과 요관의 협착 소견 관찰되어 요관의 일부를 절제하고 요관 스텐트 삽입 후 요관을 단단문합하였다. 수술 후 7일째 혈관영상검사를 시행하였고 인조혈관은 잘 유지되었고 혈관이 좁아지거나 막힌 부분은 없었다. 퇴원 이후 3개월 추적관찰 기간 동안 감염성 대동맥류의 재발이나 인조혈관 감염은 없었다.
감염성 동맥류는 드문 질환이나 패혈증 발생과 동맥류 파열의 가능성이 높아 진단과 치료가 늦어지면 예후가 매우 불량하다. 감염성 동맥류는 대동맥, 말초동맥, 뇌혈관 순으로 흔하게 발생하며 대동맥류는 신하복부 대동맥에서 가장 많이 발생한다[2].
감염성 동맥류의 위험인자는 고령, 죽상 경화, 기존의 동맥류, 감염성 심내막염, 당뇨, 장기간의 스테로이드 사용, 악성 종양, 항암치료, 만성 알코올 중독 그리고, 만성 신부전에 의한 면역저하 등이다[4]. 감염성 동맥류는 패혈성 색전, 동맥 손상(사고, 약물 주입, 카테터 삽입술 등), 그리고 죽상 경화성 플라크와 같은 혈관 내막의 손상부위를 통하여 균이 침투하거나 살모넬라처럼 정상 혈관 내막을 통하여 균이 혈관벽으로 침투하는 경우에 발생한다[5].
감염성 동맥류의 증상은 통증(복부, 등, 엉덩이, 다리)과 열이 흔하나 전신 쇄약감, 체중 감소, 설사, 구토 등의 비특이적인 증상도 많아 진단하기 어렵다. 크기가 크면 박동성 종괴가 만져지거나 혈관잡음이 들리는 경우도 있다[2].
혈액 배양에서 가장 흔히 동정되는 원인균은 황색포도알균과 살모넬라이다. 폐렴사슬알균에 의한 감염성 동맥류에 대한 보고는 외국과 국내 모두 드물며 혈액과 감염된 동맥 조직에서 폐렴사슬알균이 배양되었는지는 증례마다 다양하게 보고하였다. Cartery 등[4]이 폐렴사슬알균에 의한 감염성 복부 대동맥류 31예를 정리하여 보고하였는데 60%에서 혈액 배양 양성, 40%에서 감염된 동맥 조직 배양 양성이었다. 이미 항균제 치료 시작 후 수술한 경우 감염된 동맥 조직에서 균은 배양되지 않았다.
폐렴사슬알균에 의한 감염성 대동맥류의 penicillin 감수성에 따른 으뜸 치료는 잘 알려져 있지 않으며 대개 감수성 결과에 따라 치료하거나 감수성임에도 병합치료를 하는 등 증례에 따라 항균제 선택이 다양하였다. 감염성 대동맥류가 여러 부위에 발생하였거나 penicillin 내성인 경우 병합치료를 추천하였다. Rojas 등[6]의 증례 보고에 따르면 2010년까지 항균제 감수성 결과를 알 수 있었던 폐렴사슬알균에 의한 감염성 대동맥류 26예 중 2예가 penicillin, ceftraxone에 내성이었다. 국내에서 2005년 Choi 등[1]은 penicillin에 감수성이었으나 ceftriaxone으로 치료 중 열이 지속되어 인공혈관의 감염을 추정하고 imipenem, vancomycin 병합요법으로 치료한 폐렴사슬알균에 의한 감염성 대동맥류 첫 증례를 보고하였다. 과거 페니실린 내성 기준(≥ 2 mg/L)에 따른 내성률은 아시아 지역에서 특히 높았지만 이의 임상적 의미에 대해서는 논란이 있었다. Kim 등[7]이 2008년부터 2년 동안 아시아 11개국, 60개 병원에서 수집한 폐렴사슬알균의 항균제 내성 변화를 분석하였는데 우리나라의 비수막염 분리주 315건에서 새로운 페니실린 내성 기준(최소억제농도 ≥ 8 mg/L)을 충족하는 내성균은 0.3%, 중간 내성균(최소억제농도 4 mg/L)은 1.9%로 드물었다. 우리 증례는 페니실린 중간 내성 폐렴사슬알균에 의한 복부 대동맥의 감염으로, 수술 소견에서 감염된 혈관 주변 조직들이 구별이 안될 정도로 감염이 심하고 2004년 Baddour 등[8]이 중증 환자의 폐렴사슬알균 균혈증의 치료로 병합 항균제 치료가 단독 치료보다 14일 사망률을 낮추었다고 보고하여 그 근거로 항균제 병합요법을 유지하였다.
최근 치아 질환, 구강 내 시술과 관련된 동맥류, 경피적 담도계 시술과 경피 경간적 시술이 늘면서 발생하는 동맥류 등 침습적 시술과 관련된 감염성 동맥류가 증가하고 있다. 대부분 위장관의 상재균이 감염성 동맥류의 원인균이었고 이는 위장관의 침습적 시술로 인해 균혈증이 발생할 수 있음을 시사한다[5]. 내원 3주 전 대장 내시경을 한 것 외에는 세균의 침입 경로가 명확하지 않은 면역 저하 환자에서 Candida에 의한 감염성 동맥류가 발생한 증례가 보고된 적이 있다[9]. ERCP를 시행한 후 일시적인 균혈증은 치료적 목적인 경우 27%에 달하나 면역이 정상인 환자에서 심각한 합병증을 일으키는 경우는 드물다. 미국 인디애나에서 치료적 목적의 ERCP를 시행 받은 환자에서 시술 7일 후 위십이지장동맥에 감염성 동맥류가 발생하였고 배양 결과 Morganella morganii, Staphylococcus epidermidis가 배양된 증례가 보고되기도 하였다[10].
본 증례의 경우 감염성 동맥류 진단 23일 전 ERCP를 시행받았지만 복부 통증은 내원 2개월 전부터 시작되어 시술과의 연관성은 명확하지 않다. 향후 내시경적 시술과 감염성 동맥류와의 연관성에 대한 추가 연구가 필요하다.
REFERENCES
1. Choi SY, Peck KR, Ki HK, et al. A case of abdominal aneurysm due to Streptococcus pneumoniae infection. Infect Chemother 2005;37:116–118.
2. Dubois M, Daenens K, Houthoofd S, Peetermans WE, Fourneau I. Treatment of mycotic aneurysms with involvement of the abdominal aorta: single-centre experience in 44 consecutive cases. Eur J Vasc Endovasc Surg 2010;40:450–456.


3. Jeon MH, Ko OB, Jeong WJ, et al. A case of aortitis associated with primary Streptococcus pneumoniae bacteremia. Infect Chemother 2005;37:307–310.
4. Cartery C, Astudillo L, Deelchand A, et al. Abdominal infectious aortitis caused by Streptococcus pneumoniae: a case report and literature review. Ann Vasc Surg 2011;25:266.e9–e16.

5. Lee MB, Kim HJ, Koh JK, et al. Mycotic aneurysm of the common femoral artery: which ruptured into the retroperitoneal space. Korean J Thorac Cardiovasc Surg 1988;21:734–740.
6. Rojas A, Mertens R, Arbulo D, Garcia P, Labarca J. Multiple mycotic aneurysms due to penicillin nonsusceptible Streptococcus pneumoniae solved with endovascular repair. Ann Vasc Surg 2010;24:827.e5–e8.

7. Kim SH, Song JH, Chung DR, et al. Changing trends in antimicrobial resistance and serotypes of Streptococcus pneumoniae isolates in Asian countries: an Asian Network for Surveillance of Resistant Pathogens (ANSORP) study. Antimicrob Agents Chemother 2012;56:1418–1426.



8. Baddour LM, Yu VL, Klugman KP, et al. Combination antibiotic therapy lowers mortality among severely ill patients with pneumococcal bacteremia. Am J Respir Crit Care Med 2004;170:440–444.


Abdominal computed tomography shows irregular aortic and vascular aneurysmal dilation (maximum diameter: 3.2 cm) from the lower abdominal aorta to both common iliac arteries.
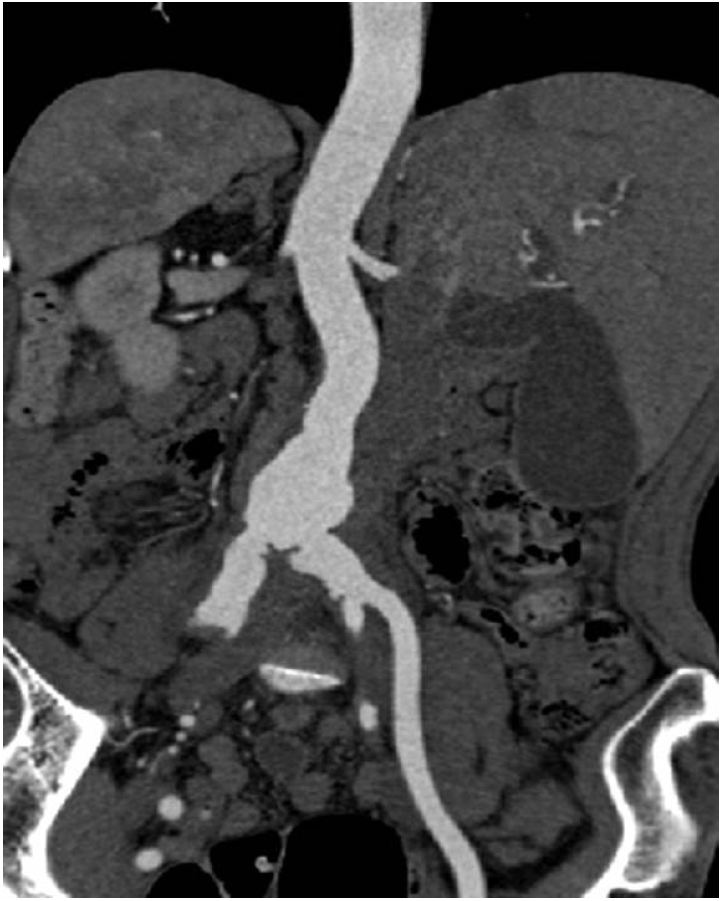
Figure 1.
Computed tomography angiography shows aneurysmal dilation of the upper end of the abdominal aorta and the left common iliac artery.
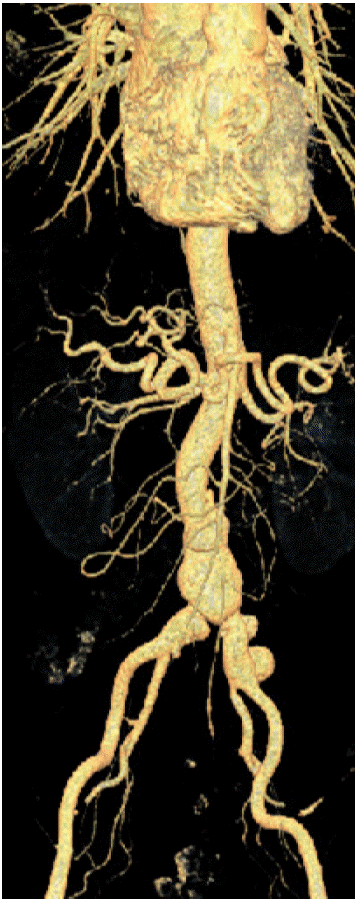
Figure 2.
Preoperative findings: The inferior mesenteric artery was divided, and diffuse swelling and inflammatory changes in the aortic wall were also noted. There was severe fibrosis and adhesion with adjacent structures, including the inferior vena cava, ureter, and iliac vein.
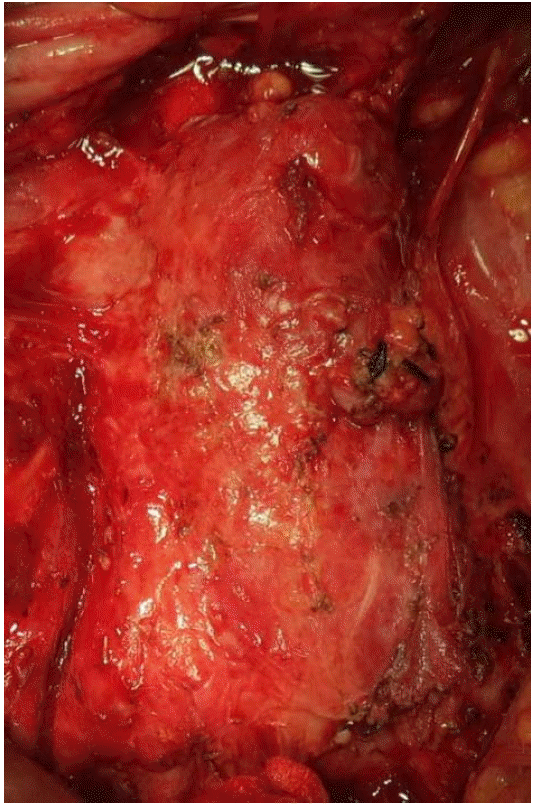
Figure 3.
Postoperative findings: The aneurysm and inflammatory tissue were resected. A Y-shaped PTFE graft was used to create anastomoses to the infrarenal aorta, the right external iliac artery, and the left superficial femoral artery. The right internal iliac artery was re-implanted to the graft. PTFE, polytetrafluoroethylene.
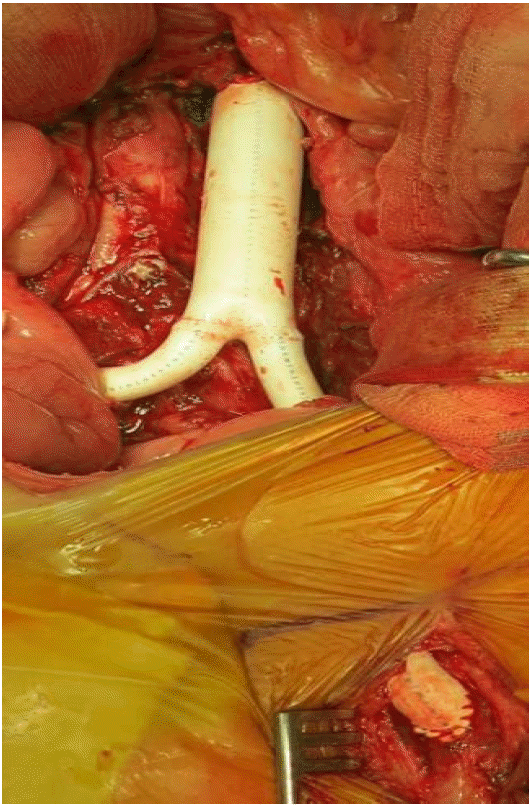
Figure 4.
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 7,079 View
- 112 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



