서 론
단백뇨의 검출은 신장 질환에서 중요한 부분을 차지하며 단백뇨의 양 및 종류에 따라 신장 질환에서의 증상 및 예후가 달라지기도 한다. 정상적인 사구체 내피 세포는 100 nm 정도의 미세공을 가지는 장벽을 구성하며 대부분의 단백질 손실을 방지한다. 사구체 기저막은 큰 분자량의 단백질 소실을 막고 상피세포의 족세포 돌기는 여러 작은 용질과 물은 통과시키나 단백질은 통과하지 못하게 한다. 이러한 사구체의 장벽에도 불구하고 단백뇨가 검출될 수 있다. 일반적으로 소변 검사에서 정상적으로 검출될 수 있는 단백뇨의 양은 하루 150 mg 미만이며 이 중에 알부민뇨는 하루 30 mg 미만으로 검출될 수 있다. 알부민뇨 이외의 주요 구성 성분은 면역글로블린 A (IgA)와 같은 low molecular weight protein (20,000 dalton)과 Tamm-Horsfall glycoprotein (23,000,000 dalton)이다[1].
단백뇨 측정
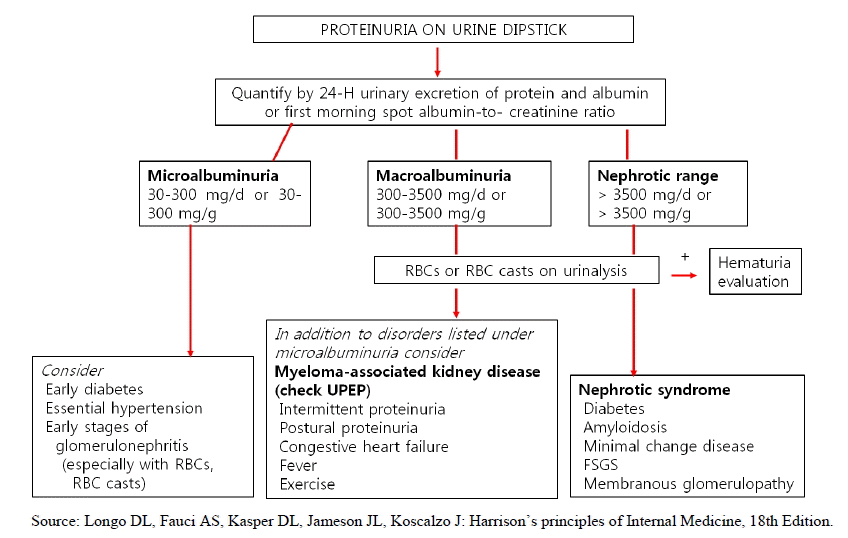
단백뇨의 측정 방법은 몇 가지 방법이 있다. 일정기간 수집한 소변(24hours urine or overnight collected urine) 및 일회성 소변(spot urine)을 통해 측정하는 방법이다. 일반적으로 24시간 수집한 소변을 통한 단백뇨 정량 측정이 가장 보편화된 방법이기는 하나 불편함과 소변이 정확히 모아졌느냐에 대한 정확성에 대한 문제가 있다[2,3]. 최근 이러한 문제를 보충하고자 소변내 abumin/creatinine ratio (spot urine ACR)을 사용하고 있다. 그러나 여러 요인들이 urinary ACR의 결과에 영향을 줄 수 있기 때문에 아침 첫 소변을 이용한 ACR 측정이 권장되며 3-6개월 사이에 측정한 urinary ACR 결과가 최소 2회 이상 비정상적일 때 진단적 의의를 가질 수 있다(Table 1). 그리고 알부민뇨 또는 단백뇨의 측정 방법에 따라 분류가 달라질 수 있다(Table 2) [4].
기능성 또는 생리적 단백뇨(functional or physiologic proteinuria)
사구체나 세뇨관의 손상 없이 심한 운동이나 발열, 스트레스를 심하게 받는 경우에 사구체의 혈역동학적 변화에 의한 일시적인 단백뇨가 관찰될 수 있다. 이처럼 기능성 단백뇨의 발생기전은 사구체의 내압의 증가에 의한 것으로 알려져 있다.
사구체 단백뇨(glomerular proteinuria)
다양한 사구체 질환에서 보이는 가장 흔한 원인으로 단백뇨의 60-90%는 알부민으로 구성된다. 주요한 단백뇨 발생 기전은 사구체내 세극막(slit diaphragm)의 여과 미세공(filtration pore)과 전하 장벽(charge barrier)의 변화가 중요한 역할을 할 것으로 추정된다. 사구체를 이루는 내피세포(visceral epithelium)인 족세포(podocyte)의 족돌기(foot process)는 nephrin, podocin, synaptopodin, CD2-AP 등의 여러 단백질로 구성되어있다. 이들 단백질에 손상 및 변화가 생기게 되면 단백뇨가 발생할 수 있다.
세뇨관성 단백뇨(tubular proteinuria)
정상적으로 여과된 저분자 단백질의 대부분은 근위세뇨관에서 재흡수된다. 재흡수에 관여하는 기전은 근위세뇨관 상피세포에 존재하는 megalin과 cubulin이 비선택적으로 세뇨관에 존재하는 단백질과 결합하여 세포 내로 이동시키고 세포내에서 lysosome에 의해 분해되게 된다. 그러므로 세뇨관 손상을 유발하여 이러한 단백질 재흡수 기전을 방해하는 급성신손상, 중금속 중독, Fanconi 증후군 등에서 단백뇨가 발생할 수 있다.
과생산성 단백뇨(overproduction proteinuria)
다발성 골수종, monoclonal gamopathy와 같은 질환에서는 혈액 내에 비정상적으로 단백질을 과량으로 합성하여 사구체 및 세뇨관의 기능이 정상이더라도 너무 많은 양의 단백질이 여과되어 소변으로 단백질이 배설되게 된다. 대개 단백뇨는 거품뇨와 관련이 있는데 단백뇨 유무의 선별 검사는 dipstick test를 통해 이루어진다. Dipstick test로는 알부민뇨만 측정이 가능하므로 알부민뇨 이외의 단백뇨가 의심되는 경우 특별한 단백뇨 검사(e.g., multiple myeloma, amyloidosis, lymphoma 등)를 시행하여야 한다.
단백뇨의 치료
단백뇨의 치료는 원인 질환에 따라 달라지게 된다. 단백뇨의 원인 감별진단 후 각 질환에 대해 ARB 또는 ACE-I의 사용 및 보존적인 치료를 하게 되나 자가면역질환의 경우 면역억제제(cyclosporine, cyclophosphamide, steroid 등)를 사용한다. 그러나 일반적인 만성신부전 환자의 경우 KDIGO(Kidney Diseases: Improving Global Outcomes) 2012에서는 다음과 같은 가이드라인이 제시하고 있다[4].
만성 신부전이며 알부민뇨 < 30 mg/24hours (or equivalent)를 동반한 당뇨 및 비당뇨 성인 환자에서는 수축기 혈압 140 mmHg 미만, 이완기 혈압 90 mmHg 미만으로 유지하기 위해 항고혈압제를 사용한다. 만성 신부전이며 알부민뇨 ≥ 30 mg/24hours (or equivalent)를 동반한 당뇨 및 비당뇨 성인 환자에서는 수축기 혈압 130 mmHg 미만, 이완기 혈압 80 mmHg 미만을 유지하기 위해 항고혈압제를 사용한다. 만성신부전이며 알부민뇨 30-300 mg/24hours (or equivalent)를 동반한 성인 당뇨 환자에서는 안지오텐신 수용체 차단제(ARB) 또는 안지오텐신 전환효소 억제제(ACE-I)를 사용한다. 만성신부전이며 알부민뇨 > 300 mg/24hours (or equivalent)를 동반한 당뇨 및 비당뇨 성인 환자에서는 ARB 또는 ACE-I를 사용한다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






