žĄú Ž°†
ŽßĆžĄĪž∑Ćžě•žóľžĚÄ žßÄžÜ枆ĀžúľŽ°ú žßĄŪĖČŽźėŽäĒ žóľž¶ĚÍ≥ľ žĄ¨žú†ŪôĒ Í≥ľž†ēžúľŽ°ú žĚłŪēėžó¨ ž∑Ćžě•žĚė žč§žßąžĚī žÜźžÉĀžĚĄ ŽįõÍ≥† žĄ¨žú† ž°įžßĀžúľŽ°ú ŽĆÄžĻėŽź®žúľŽ°úžć®, Í≤įÍ≥ľž†ĀžúľŽ°úŽäĒ ž∑Ćžě• žč§žßąÍ≥ľ ž∑ĆÍīÄžĚė ŪėēŪÉúŪēôž†Ā Ž≥ÄŪôĒŽ•ľ žīąŽěėŪēėÍ≤Ć ŽźėŽäĒ ŽßĆžĄĪ žßąŪôėžĚīŽč§. žĚīŽü¨Ūēú Í≥ľž†ēžúľŽ°ú žĚłŪēėžó¨ Í∂ĀÍ∑Ļž†ĀžúľŽ°ú ž∑Ćžě•žĚė žôłŽ∂ĄŽĻĄ Í∑łŽ¶¨Í≥† ŽāīŽ∂ĄŽĻĄ ÍłįŽä•žóź žěąžĖīžĄúŽŹĄ žėĀÍĶ¨ž†ĀžĚł žě•žē†Ž•ľ ÍįÄž†łžė§Í≤Ć ŽźúŽč§[1]. ŽßĆžĄĪž∑Ćžě•žóľ ŪôėžěźžĚė žēĹ 40-50%žóźžĄúŽäĒ ŽßĆžĄĪž†ĀžĚł ž∑Ćžě• žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚī ŽįúžÉĚŪēėžó¨ ŪĚ°žąė žě•žē†Ž•ľ žīąŽěėŪēėÍ≥† žĚīŽ°ú žĚłŪēėžó¨ žĄ§žā¨, žßÄŽį©Ž≥ÄÍ≥ľ ž≤īž§Ď ÍįźžÜĆ ŽďĪžĚė ž¶ĚžÉĀžĚĄ ŽāėŪÉÄŽāėŽ©į[1], žēĹ 40% žĚīžÉĀžóźžĄúŽäĒ ŽāīŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžúľŽ°ú žĚłŪēú ŽčĻŽá®ÍįÄ ŽŹôŽįėŽźúŽč§[2].
žĻėŽ£Ćžóź žěąžĖīžĄúŽäĒ žĚīž†úÍĻĆžßÄ žė§Žěú ÍłįÍįĄžĚė žó¨Žü¨ žóįÍĶ¨žóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† ŽßĆžĄĪž∑Ćžě•žóľžĚė žĻėŽ£ĆŽäĒ ŽĆÄŽ∂ÄŽ∂Ą Í≤ĹŪóėž†ĀžĚł žĻėŽ£Ćžóź Ž®łŽ¨ľŽü¨ žěąÍ≥†[3], žóľž¶Ě ŽįŹ žĄ¨žú†ŪôĒ Í≥ľž†ēžóź žßĀž†Ď žěĎžö©Ūēėžó¨ Í≤ĹÍ≥ľŽ•ľ Ūėłž†ĄžčúŪā§ŽäĒ Ūö®Í≥ľž†ĀžĚł žĻėŽ£Ć Žį©Ž≤ēžĚÄ žēĄžßĀÍĻĆžßÄ žóÜŽäĒ žč§ž†ēžĚīŽč§. ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú žĻėŽ£ĆžĚė Ž™©ŪĎúŽäĒ ͳȞĄĪ ŪėĻžĚÄ ŽßĆžĄĪžĚė ŪÜĶž¶ĚžĚĄ ž°įž†ąŪēėÍ≥†, žě¨ŽįúžĚĄ Žį©žßÄŪē† žąė žěąŽŹĄŽ°Ě žßąŽ≥ĎžĚė Í≤ĹÍ≥ľŽ•ľ žēąž†ēžčúŪā§Ž©į, žėĀžĖĎžě•žē†, ŽčĻŽá® ŽďĪžĚė ŽĆÄžā¨Ūē©Ž≥Ďž¶ĚžĚĄ ÍĶźž†ēŪēėÍ≥†, Ūē©Ž≥Ďž¶ĚžĚī ŽįúžÉĚŪēėŽ©ī žĚīŽ•ľ žĻėŽ£ĆŪēėŽ©į ŽćĒŽ∂ąžĖī ž†ēžč†žā¨ŪöĆŪēôž†ĀžĚł Ž¨łž†úŽ•ľ Žč§Ž£®ŽäĒŽćį žěąŽč§[3].
ŽßĆžĄĪž∑Ćžě•žóľžĚÄ žĚľŽįėž†ĀžúľŽ°ú ÍĶ¨ž°įž†ĀžĚł žĚīžÉĀžĚī Žß§žöį žßĄŪĖČŽźėžĖī žěąŽäĒ big-duct disease (large-duct disease, ž£ľž∑ĆÍīÄžĚė žßĀÍ≤ĹžĚī 6 mm žĚīžÉĀ)žôÄ Í∑łŽ†ážßÄ žēäžĚÄ small-duct disease (ž£ľž∑ĆÍīÄžĚė žßĀÍ≤ĹžĚī 6 mm ŽĮłŽßĆ)Ž°ú Ž∂ĄŽ•ėŪēúŽč§(Table 1). žĚīŽ†áÍ≤Ć Ž∂ĄŽ•ėŪēėŽäĒ Í≤ÉžĚÄ žěĄžÉĀ Í≤ĹÍ≥ľ, žĻėŽ£Ć, žėąŪõĄžóź žěąžĖīžĄú ÍįĀ ŪėēŪÉúžóź ŽĒįŽĚľ žį®žĚīŽ•ľ ŽāėŪÉÄŽāīÍłį ŽēĆŽ¨łžóź žěĄžÉĀž†ĀžúľŽ°ú ž§ĎžöĒŪēú žĚėžĚėŽ•ľ ÍįĖŽäĒŽč§[4]. ŽāīÍ≥ľž†Ā žĻėŽ£ĆŽäĒ ŽĎź ŪėēŪÉú Ž™®ŽĎźžóź ž†Āžö©Ūē† žąė žěąžßÄŽßĆ, ŽāīžčúÍ≤Ĺ žĻėŽ£ĆŽāė žąėžą† ŽďĪžĚė žĻėŽ£ĆŽäĒ ž£ľŽ°ú big-duct diseasežóź ž†Āž†ąŪēú žĻėŽ£Ć Žį©Ž≤ēžĚīŽč§[5].
žēĹŽ¨ľžĚĄ žĚīžö©Ūēú ŽāīÍ≥ľž†Ā žĻėŽ£ĆŽäĒ ž£ľŽ°ú ŪÜĶž¶ĚžĚė ž°įž†ą, žôłŽ∂ĄŽĻĄÍłįŽä•Ž∂Äž†Ąžóź ŽĆÄŪēú žĻėŽ£Ć, Í∑łŽ¶¨Í≥† ŽāīŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†Ąžóź ŽĆÄŪēú žĻėŽ£ĆŽ°ú žĚīŽ£®žĖīžßĄŽč§. ŽāīžčúÍ≤Ĺ žĻėŽ£ĆžôÄ žąėžą†žĚÄ ŪÜĶž¶ĚžĚīŽāė ŪäĻž†ēŪēú Ūē©Ž≥Ďž¶ĚžĚĄ žĻėŽ£ĆŪēėŽäĒ Žćį žěąžĖīžĄú ž†Āž†ąŪēú ŽāīÍ≥ľž†Ā žĻėŽ£ĆžóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† ž°įž†ąžĚī ŽźėžßÄ žēäžĚĄ ŽēĆ Í≥†Ž†§ŪēúŽč§[3]. žĚīŽ≤ą ͳĞ󟞥úŽäĒ ŽßĆžĄĪž∑Ćžě•žóľžĚė ŽāīÍ≥ľž†Ā žĻėŽ£Ćžóź ŽĆÄŪēėžó¨ žĶúÍ∑ľžĚė žóįÍĶ¨ Í≤įÍ≥ľžôÄ žĚėÍ≤¨Žď§žĚĄ Ū܆ŽĆÄŽ°ú Ūēėžó¨ žěĄžÉĀžóźžĄú žú†žö©Ūēú Žāīžö©Žď§žĚĄ ž§Ďžč¨žúľŽ°ú žēĆžēĄŽ≥īÍ≥†žěź ŪēúŽč§.
ŪÜĶž¶Ě ž°įž†ą
ŽßĆžĄĪž∑Ćžě•žóľžĚė ž£ľž¶ĚžÉĀžĚł Ž≥ĶŪÜĶžĚÄ ŽßĆžĄĪž∑Ćžě•žóľ ŪôėžěźžĚė 80-90%žóźžĄú ŽŹôŽįėŽźėÍ≥† žěÖžõźŪēėŽäĒ Í≤ĹžöįžĚė 93%žóźžĄú žěÖžõźžĚĄ ŪēėÍ≤Ć ŪēėŽäĒ žõźžĚł ž¶ĚžÉĀžĚī ŽźúŽč§[6,7]. ŪÜĶž¶ĚžĚÄ ž†ĄŪėēž†ĀžúľŽ°úŽäĒ ŪäĻžßēžóź ŽĒįŽĚľ ŽĎź ÍįÄžßÄžĚė žĖĎžÉĀžúľŽ°ú ŽāėŽąĆ žąė žěąŽäĒŽćį ŪēėŽāėŽäĒ ÍįĎžěϞ䧎ü¨žöī ž∑Ćžě•žóľžĚī ŽįėŽ≥Ķž†ĀžúľŽ°ú ŽāėŪÉÄŽāėÍ≥† Í∑ł žā¨žĚīžóźŽäĒ ž¶ĚžÉĀžĚī žóÜŽäĒ ŪėēŪÉúžôÄ Žč§Ž•ł ŪėēŪÉúŽäĒ žēÖŪôĒŽźėŽäĒ žßÄžÜ枆ĀžĚł ŪÜĶž¶ĚžĚī žė§Žěꎏôžēą žßÄžÜ掟ėŽ©īžĄú žā¨žĚī žā¨žĚīžóź Ž©įžĻ† ž†ēŽŹĄžĚė žÉĀŽĆÄž†ĀžúľŽ°ú ŪÜĶž¶ĚžĚī ž°įÍłą ŽćúŪēú ÍłįÍįĄžĚī žěąŽäĒ ŪėēŪÉúžĚīŽč§[3]. žĶúÍ∑ľ žčúŪĖČŽźėžóąŽćė Žč§ÍłįÍīÄ žóįÍĶ¨žóźžĄúŽäĒ žßÄžÜ枆ĀžĚł ŪÜĶž¶ĚžĚī žěąŽäĒ Í≤Ĺžöįžóź ÍįĄŪ󟞆ĀžúľŽ°ú ŪÜĶž¶ĚžĚī žěąŽäĒ Í≤ĹžöįŽ≥īŽč§ žā∂žĚė žßąžĚī žú†žĚėŪēėÍ≤Ć ž†ÄŪēėŽźėÍ≥†, žĚľžÉĀ žÉĚŪôúžĚė žě•žē†Žāė žĚėŽ£ĆžčúžĄ§žĚė žĚīžö©ŽŹĄ ŽÜíŽč§Í≥† Ž≥īÍ≥†ŪēėžėÄŽč§[8].
žėąž†ĄŽ∂ÄŪĄį Ž≥ĎžĚī žßĄŪĖČŽź®žóź ŽĒįŽĚľžĄú ž∑Ćžě• ŪÜĶž¶ĚžĚÄ Í∑ł ÍįēŽŹĄŽāė ŪöüžąėÍįÄ ž†źžį® ÍįźžÜĆŪēėÍ≥† Í∂ĀÍ∑Ļž†ĀžúľŽ°úŽäĒ ‚Äúburnout‚ÄĚžĚė ÍįúŽÖźžúľŽ°ú ŪÜĶž¶ĚžĚī žěźžóįž†ĀžúľŽ°ú žÜƞ觎źėÍ≤Ć ŽźúŽč§ŽäĒ ž£ľžě•žĚī žěąžóąžúľŽāė[9,10], Ž™®Žď† ŪôėžěźžóźžĄú Í∑łŽüį Í≤ĹÍ≥ľŽ•ľ Ž≥īžĚīŽäĒ Í≤ÉžĚÄ žēĄŽčąžĖīžĄú ŽÖľŽěÄžĚī žěąžĖīžôĒžúľŽ©į ŽėźŪēú žĚīŽ•ľ žėąžł°ŪēėÍłįŽŹĄ Žß§žöį žĖīŽ†ĶŽč§[5,11]. Í∑łŽü¨ŽĮÄŽ°ú ŪÜĶž¶ĚžĚī žěąŽäĒ ŪôėžěźžóźžĄú žĚīŪõĄ ŪÜĶž¶ĚžĚī žÜƞ觎ź† Í≤ɞ̥ ÍłįŽĆÄŪēėÍ≥† Žč®žßÄ ÍłįŽč§Ž¶¨ŽäĒ Í≤ÉžĚÄ ž†Āž†ąŪēėžßÄ žēäŽč§[7]. žĶúÍ∑ľžóźŽäĒ ž∑Ćžě•žĚė ŽįėŽ≥Ķž†ĀžĚł žóľž¶ĚÍ≥ľ žÜźžÉĀžĚÄ Í≤įÍĶ≠ ŽĻĄÍįÄžó≠ž†ĀžĚł žÜźžÉĀžúľŽ°ú žßĄŪĖČŽźėÍ≥†, žĚīÍ≤ÉžĚī ŽßźžīąžôÄ ž§Ďž∂ĒžĚė ŪÜĶÍįĀ žč†Í≤ĹžĚī ŽĮľÍįźŪēėÍ≤Ć ŽźėŽäĒ Í≤ÉÍ≥ľ žóįÍīÄŽźėŽ©īžĄú žßÄžÜ枆ĀžĚł ŽßĆžĄĪ ŪÜĶž¶ĚžĚī ŽįúžÉĚŪēėŽäĒ Žćį žěąžĖī ž§ĎžöĒŪēú žó≠Ūē†žĚĄ ŪēėŽäĒ Í≤ÉžúľŽ°ú žÉĚÍįĀŪēėÍ≥† žěąŽč§. ŽĒįŽĚľžĄú ž∑Ćžě•žóľžĚī žßĄŪĖČŽźėžĖī žĚīŽü¨Ūēú Í≥ľž†ēžĚī ŪôēŽ¶ĹŽźėÍ≤Ć ŽźėŽ©ī ŪÜĶž¶Ě ž°įž†ąžĚė Ūö®Í≥ľÍįÄ ž†źžį® Ūõ®žĒ¨ Žćú ŪēīžßÄÍłį ŽēĆŽ¨łžóź ÍįÄŽä•Ūēú žīąÍłįžóź ž†ĀÍ∑Ļž†ĀžúľŽ°ú žĻėŽ£ĆŽ•ľ Ūēėžó¨ žĚīŽü¨Ūēú žßĄŪĖȞ̥ ŽßČŽäĒ Í≤ÉžĚī Žß§žöį ž§ĎžöĒŪēėŽč§[12].
ŪÜĶž¶ĚžĚÄ ž£ľŽ°ú žÉĀŽ≥ĶŽ∂Ğ󟞥ú ŽäźÍĽīžßÄŽ©į ŽßéžĚÄ ŪôėžěźžóźžĄú ŽďĪ ž™ĹžúľŽ°ú Žį©žā¨ŽźėŽäĒ žĖĎžÉĀžĚĄ Ž≥īžĚīÍłįŽŹĄ ŪēúŽč§. ŽēĆŽ°úŽäĒ žčĚžā¨Ž•ľ ŪēėŽ©ī žēÖŪôĒŽźėÍłįŽŹĄ ŪēėÍ≥†, ŪÜĶž¶ĚžĚī žč¨Ūēú Í≤ĹžöįžóźŽäĒ žė§žč¨žĚīŽāė ÍĶ¨Ū܆ÍįÄ ŽŹôŽįėŽźėÍłįŽŹĄ ŪēúŽč§. žĚīŽü¨Ūēú ŪäĻžßēŽď§žĚī ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú ŽįúžÉĚŪēėŽäĒ Ž≥ĶŪÜĶžĚė ŪÜĶž¶ĚžĚė ŪäĻžßēžĚīŽĚľÍ≥†ŽŹĄ Ūē† žąė žěąžßÄŽßĆ ŪÜĶž¶ĚžĚė žúĄžĻė, žßÄžÜćžčúÍįĄ, žĖĎžÉĀ, ÍįēŽŹĄ ŽďĪžóź žěąžĖīžĄú ŪÜĶž¶ĚžĚī Žß§žöį Žč§žĖĎŪēėÍ≤Ć ŽāėŪÉÄŽā† žąė žěąŽč§. ŪēúŪéł ŪÜĶž¶ĚžĚė žěźžóį Í≤ĹÍ≥ľŽŹĄ Ūôėžěźžóź ŽĒįŽĚľ Žß§žöį Žč§žĖĎŪēėŽč§[5]. Í∑łŽü¨ŽĮÄŽ°ú žĻėŽ£Ć ž†Ą ŪÜĶž¶ĚžĚĄ ŪŹČÍįÄŪēėŽäĒ Žćį žěąžĖīžĄú ž†Āž†ąŪēú ÍįĚÍīÄŪôĒŽźú Žį©Ž≤ēžĚī žóÜÍ≥† Žč§žĖĎŪēú ŪÜĶž¶ĚžĚė žĖĎžÉĀÍ≥ľ žěźžóį Í≤ĹÍ≥ľŽ°ú žĚłŪēėžó¨ žĻėŽ£ĆžĚė Ūö®Í≥ľŽ•ľ ŪĆźž†ēŪēėŽäĒ Žćį žěąžĖīžĄúŽŹĄ žĖīŽ†§žöī ž†źžĚī žěąÍłį ŽēĆŽ¨łžóź[5], ŪÜĶž¶Ě žĻėŽ£Ćžóź ŽĆÄŪēú žó¨Žü¨ žóįÍĶ¨ Í≤įÍ≥ľžóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú ŪÜĶž¶ĚžĚė žĻėŽ£ĆŽ•ľ ŪĎúž§ÄŪôĒŪēėÍłįŽäĒ Žß§žöį žĖīŽ†ĶŽč§.
ŪÜĶž¶Ě žĻėŽ£Ćžóź žěąžĖīžĄú Ž™á ÍįÄžßÄ Í≥†Ž†§Ūēīžēľ Ūē† ž†źŽď§žĚī žěąŽč§. žöįžĄ† ž≤ę Ž≤ąžßłŽ°ú ŽßĆžĄĪž∑Ćžě•žóľžóź žĚėŪēú Í≤ÉžúľŽ°ú žÉĚÍįĀŽźėŽäĒ ŪÜĶž¶ĚžĚĄ žĻėŽ£ĆŪēėÍłįžóź žē장ú ŽßĆžĄĪž∑Ćžě•žóľžĚė žßĄŽč®žĚī Ūôēžč§ŪēúžßÄ ŪôēžĚłŪēīžēľŪēúŽč§. ž∑Ćžě•žóľžĚī žßĄŪĖČŽźú ŪôėžěźžĚė Í≤ĹžöįžóźŽäĒ žßĄŽč®žĚī žĖīŽ†ĶžßÄ žēäžßÄŽßĆ Í≤Ĺžöįžóź ŽĒįŽĚľ žßĄŽč®žĚī žĖīŽ†§žöī Í≤ĹžöįÍįÄ žěąÍ≥†, ŪäĻŪěą small-duct diseasežĚė Í≤ĹžöįžóźŽäĒ žßĄŽč®žĚī ŽćĒžöĪ žĖīŽ†§žöł žąė žěąŽč§. ŽĎź Ž≤ąžßłŽäĒ ŽßĆžĄĪž∑Ćžě•žóľžĚė ž†ēŽŹĄžôÄ ŪÜĶž¶ĚžĚĄ žú†ŽįúŪē† ŽßĆŪēú Ūē©Ž≥Ďž¶ĚžĚī žěąŽäĒžßÄ žó¨Ž∂ÄŽ•ľ ŪôēžĚłŪēėŽäĒ Í≤ÉžĚīŽč§. Ūē©Ž≥Ďž¶ĚžĚł ž∑Ćžě•žēĒ, ÍįÄžĄĪŽā≠žĘÖ, žč≠žĚīžßÄžě• ŪėĻžĚÄ ŽčīŽŹĄ ŪŹźžáĄ ŽďĪÍ≥ľ žóįÍīÄŽźėžĖī ŪÜĶž¶ĚžĚī ŽįúžÉĚŪēėŽäĒ Í≤ĹžöįžóźŽäĒ žĚīŽü¨Ūēú Ūē©Ž≥Ďž¶Ěžóź ŽĆÄŪēú žĻėŽ£ĆÍįÄ žĚīŽ£®žĖīž†łžēľ ŪÜĶž¶ĚžĚī Ūėłž†ĄŽź† žąė žěąŽč§. ŽßąžßÄŽßČžúľŽ°ú ŪÜĶž¶ĚžĚė žĖĎžÉĀžĚī Žß§žöį Žč§žĖĎŪēėÍłį ŽēĆŽ¨łžóź ÍįĀÍįĀžĚė ŪôėžěźžóźžĄú ž∂©Ž∂ĄŪēú žčúÍįĄžĚĄ Žď§žó¨ ŪÜĶž¶ĚžĚė žĖĎžÉĀžĚĄ žěė ŪĆĆžēÖŪēėÍ≥† žĚīŪēīŪēėŽäĒ Í≤ÉŽŹĄ ŪēĄžöĒŪēėŽč§[5].
ž∑Ćžě• žÜźžÉĀžĚė žßĄŪĖȞ̥ ž§ĄžĚľ žąė žěąŽŹĄŽ°Ě ŪēėŽäĒ Í≤ÉžĚī ŪÜĶž¶Ě žôĄŪôĒžĚė ž≤ę Žč®Í≥ĄŽĚľÍ≥† Ūē† žąė žěąžúľŽĮÄŽ°ú, ŽßĆžĄĪž∑Ćžě•žóľžĚė žõźžĚłžĚĄ ŪôēžĚłŪēėŽäĒ Í≤ÉžĚÄ Žß§žöį ž§ĎžöĒŪēėŽč§. žēĆžĹĒžė¨žĄĪ ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú Íłąž£ľŽ•ľ ŪēėŽäĒ Í≤ÉžĚī Ž™®Žď† ŪôėžěźžóźžĄú ŪÜĶž¶ĚžĚĄ žóÜžē†ž£ľŽäĒžßÄžóź ŽĆÄŪēīžĄúŽäĒ žĚľŽ∂Ä ŽÖľŽěÄžĚī žěąžßÄŽßĆ Íłąž£ľÍįÄ ž∑Ćžě•žóľžĚė žßĄŪĖȞ̥ Žä¶ž∂ú žąė žěąÍ≥† ŪÜĶž¶Ě ž°įž†ąžóźŽŹĄ ŽŹĄžõĞ̥ ž£ľŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§[1,5,12-14]. Í∑łŽ¶¨Í≥† Íłąž£ľŽäĒ ŽßĆžĄĪž∑Ćžě•žóľ ŪôėžěźžóźžĄú žÉĚž°īÍłįÍįĄžĚĄ ŽäėŽ†§ž£ľŽ©į žā∂žĚė žßąžĚĄ ŪĖ•žÉĀžčúŪā§ŽäĒ ŽćįŽŹĄ ŽŹĄžõĞ̥ ž§ÄŽč§. Í∑łŽü¨ŽĮÄŽ°ú žĚĆž£ľŽ•ľ ŪēėŽäĒ ŪôėžěźžóźžĄúŽäĒ Íłąž£ľŽ•ľ ŪēėŽäĒ Í≤ÉžĚī ŪēĄžöĒŪēėŽč§[5]. ŪĚ°žóįŽŹĄ ŽßĆžĄĪž∑Ćžě•žóľžĚė ž§ĎžöĒŪēú žúĄŪóėžĚłžěźžĚė ŪēėŽāėžĚīŽ©į žĶúÍ∑ľ ŽßĆžĄĪž∑Ćžě•žóľ, žĄĚŪöĆŪôĒŽ°úžĚė žßĄŪĖČ, ž∑Ćžě• ÍłįŽä• žě•žē† ŽďĪžóź žěąžĖīžĄú ŽŹÖŽ¶Ĺž†ĀžúľŽ°ú žóįÍīÄžĚī ŽźėŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§žßÄÍ≥† žěąžĖīžĄú[15-17], ÍłąžóįžĚĄ ÍįēŽ†•Ūěą Í∂Ćžú†Ūēīžēľ ŪēúŽč§.
žßĄŪÜĶž†ú
ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú žēĄžßĀÍĻĆžßÄ ŪÜĶž¶Ě ž°įž†ąžóź ÍįÄžě• ŽßéžĚī žĚīžö©ŽźėŽäĒ žēĹž†úŽäĒ žßĄŪÜĶž†úžĚīŽč§. ŽßéžĚÄ ŪôėžěźžóźžĄú ž≤ėžĚĆžóźŽäĒ ŪÜĶž¶ĚžĚī ÍįĄŪ󟞆ĀžúľŽ°ú ŽįúžÉĚŪēėÍ≥† Í∑ł žā¨žĚīžóź ŪÜĶž¶Ě žóÜžĚī žěė žßÄŽāīŽäĒ ÍłįÍįĄŽŹĄ žěąŽč§. žĚīž≤ėŽüľ ÍįĄŪ󟞆ĀžúľŽ°úŽßĆ ŪÜĶž¶ĚžĚī ŽįúžÉĚŪēėŽäĒ Í≤ĹžöįžóźŽäĒ žßÄžÜ枆ĀžúľŽ°ú žßĄŪÜĶž†úŽ•ľ Ūą¨žó¨Ūē† ŪēĄžöĒŽäĒ žóÜÍ≥†, ŪÜĶž¶ĚžĚī žßÄžÜ枆ĀžúľŽ°ú žěąŽäĒ Í≤ĹžöįžóźŽäĒ Í∑úžĻôž†ĀžĚīÍ≥† žßÄžÜ枆ĀžĚł žßĄŪÜĶž†úžĚė Ūą¨žó¨ÍįÄ ŪēĄžöĒŪēėŽč§[3].
žßĄŪÜĶž†úžĚė žā¨žö©žĚÄ žĚľŽįėž†ĀžúľŽ°ú ŽßĆžĄĪ ŪÜĶž¶Ěžóź ŽĆÄŪēú 3Žč®Í≥ĄžĚė WHO ÍįÄžĚīŽďúŽĚľžĚłžĚĄ ŽĒįŽ•łŽč§[1,3]. ž≤ėžĚĆžóźŽäĒ žēĄžĄłŪäłžēĄŽĮłŽÖłŪéúžĚīŽāė ŽĻĄžä§ŪÖĆŽ°úžĚīŽďúžĄĪ žÜƞ󾞆ú(NSAIDs)Ž•ľ Žč®ŽŹÖžúľŽ°ú ŪėĻžĚÄ žĚīŽ•ľ Ž≥ĎŪē©Ūēėžó¨ Ūą¨žó¨ŪēėŽäĒ Í≤ÉžúľŽ°ú žčúžěĎŪēėžó¨ ŪÜĶž¶ĚžĚĄ ž°įž†ąŪēīŽ≥łŽč§. Žßƞ̾ Ūö®Í≥ľÍįÄ ž∂©Ž∂ĄžĻė žēäžĚĄ ŽēĆžóźŽäĒ Žßźžīąžóź žěĎžö©ŪēėŽäĒ žēĹž†úžôÄ ž§Ďž∂Ēžóź žěĎžö©ŪēėŽäĒ žēĹž†úŽ•ľ Ž≥ĎŪē©ŪēėŽäĒ Í≤ɞ̥ Í≥†Ž†§ŪēúŽč§. ŽĻĄŽßąžēĹžĄĪ žßĄŪÜĶž†úžôÄ žēĹŪēú ŽßąžēĹžĄĪ žßĄŪÜĶž†úžĚł Ū䳎̾ŽßąŽŹĆžĚĄ Ž≥ĎŪē©Ūēėžó¨ žā¨žö©ŪēúŽč§[1]. Ū䳎̾ŽßąŽŹĆžĚÄ Ž≥īŽč§ Ūö®Í≥ľÍįÄ ÍįēŪēú ŽßąžēĹžĄĪ žßĄŪÜĶž†úžôÄ ŽĻĄžä∑Ūēú ž†ēŽŹĄŽ°ú ŪÜĶž¶ĚžĚĄ ž°įž†ąŪēėŽ©īžĄúŽŹĄ žÉĀŽĆÄž†ĀžúľŽ°ú žēĹŽ¨ľ ž§ĎŽŹÖžĚīŽāė žė§žö©žĚė ÍįÄŽä•žĄĪžĚī ŽāģÍ≥† žúĄžě•ÍīÄžĚė žöīŽŹôžóźŽŹĄ Žćú žėĀŪĖ•žĚĄ ž£ľŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§[18].
ŪÜĶž¶ĚžĚė ž†ēŽŹĄŽ•ľ ŪŹČÍįÄŪēėÍ≥† žēĹž†úžĚė žö©ŽüȞ̥ ž°įž†ąŪēėŽäĒŽćį žěąžĖīžĄúŽäĒ žčúÍįĀž†Ā ŪÜĶž¶Ě ž≤ôŽŹĄ(visual analogue scale, VAS)Ž•ľ žĚīžö©ŪēėŽäĒ Í≤ÉžĚī žú†žö©ŪēėŽč§[1]. žöįžöłž¶ĚžĚĄ ŽŹôŽįėŪēėŽäĒ Í≤ĹžöįžóźŽäĒ žßĄŪÜĶž†úžôÄ žč†Í≤ĹžĚīžôĄžĄĪ Ūē≠žöįžöłž†úŽ•ľ Ž≥ĎŪē©Ūēėžó¨ žā¨žö©ŪēúŽč§[1,3].
žĚľŽ∂Ä ŪôėžěźžóźžĄúŽäĒ Ž≥īŽč§ ÍįēŽ†•Ūēú Ūö®Í≥ľŽ•ľ ÍįĞߥ ŽßąžēĹžĄĪ žßĄŪÜĶž†úŽ•ľ ŪēĄžöĒŽ°ú ŪēúŽč§. žĚīŽüį ŪôėžěźŽď§žóźÍ≤ĆŽäĒ Ž™®ŽĎź žßĄŪÜĶž†úžôÄ Ūē®ÍĽė Ž≥īž°įž†ĀžĚł žēĹž†úŽ•ľ ÍįôžĚī Ūą¨žó¨ŪēėŽäĒ Í≤ÉžĚī žĘčŽč§. žĚīŽü¨Ūēú Ž≥īž°įž†ĀžĚł ž†úž†úŽ°úŽäĒ žāľŪôėÍ≥Ą Ūē≠žöįžöłž†ú, žĄ†ŪÉĚž†Ā žĄłŽ°úŪ܆ŽčĆ žě¨ŪĚ°žąė žĖĶž†úž†ú(selective serotonin reuptake inhibitors, SSRIs), žĄłŽ°úŪ܆ŽčĆ-ŽÖłžóźŪĒľŽĄ§ŪĒĄŽ¶į žě¨ŪĚ°žąė žĖĶž†ú Ž≥ĎŪē© ž†úž†ú(duolexitine) ŽďĪžĚī žú†žö©Ūēú Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§[1,5]. žĶúÍ∑ľ žóįÍĶ¨žóźžĄú őĪ2őī žĖĶž†úž†ú(pregabalin, gabapentine)ŽŹĄ ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú ŪÜĶž¶Ě ž°įž†ąžóź Ž≥īž°įž†ĀžúľŽ°ú žā¨žö©ŪēėŽ©ī Ūö®Í≥ľž†ĀžĚł Í≤ÉžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽč§[19]. ÍįÄŽä•Ūēú ŽßąžēĹžĄĪ žßĄŪÜĶž†úŽäĒ žā¨žö©ŪēėžßÄ žēäŽäĒ Í≤ÉžĚī ŽįĒŽěĆžßĀŪēėžßÄŽßĆ žēĹŽ¨ľ Žā®žö©žĚė žúĄŪóėžĄĪ Ž≥īŽč§ŽäĒ žĚľžį®ž†ĀžúľŽ°ú ŪÜĶž¶Ě ž°įž†ąžóź ŽćĒ žīąž†źžĚĄ Žßěž∂ĒžĖīžēľ ŪēėÍłį ŽēĆŽ¨łžóź, ŪÜĶž¶ĚžĚī ž†Āž†ąŪēėÍ≤Ć ž°įž†ąŽźėžßÄ žēäŽäĒ Í≤ĹžöįÍĻĆžßÄ ŽßąžēĹžĄĪ žßĄŪÜĶž†úžĚė Ūą¨žó¨Ž•ľ ž£ľž†ÄŪēėÍĪįŽāė ŪĒľŪēėŽäĒ Í≤ÉžĚÄ ž†Āž†ąŪēėžßÄ žēäŽč§[1,7]. žßĄŪÜĶž†úžĚė žö©ŽüČžĚīŽāė Ūą¨žó¨ žčúÍįĄ ÍįĄÍ≤©žĚÄ Ūôėžěź ÍįúžĚłžĚė ŪÜĶž¶ĚžĚė ŪäĻžßēžóź ŽĒįŽĚľ ÍįúŽ≥Ąž†ĀžúľŽ°ú ž°įž†ēŪēėžó¨žēľ ŪēúŽč§.
Í≤ĹÍĶ¨ ž∑Ćžě• Ūö®žÜĆ ž†úž†ú
Í≤ĹÍĶ¨ ž∑Ćžě• Ūö®žÜĆ ž†úž†úžóź žĚėŪēú ŪÜĶž¶Ě ž°įž†ąžĚė Íłįž†ĄžĚÄ žĚĆžĄĪ ŪĒľŽďúŽįĪžóź žĚėŪēėžó¨ ž∑ƞ앞̥ žĖĶž†úŪēėŽäĒ Í≤ÉžúľŽ°ú žĄ§Ž™ÖŽźúŽč§[7]. žč≠žĚīžßÄžě•ŽāīžĚė žĹúŽ†ąžčúžä§Ū܆Ūā§ŽčĆ Ž∂ĄŽĻĄ Ūé©ŪÉÄžĚīŽďú(CCK releasing peptide)ŽäĒ ž†ēžÉĀž†ĀžúľŽ°ú ž∑Ćžě•žĚė Ū䳎¶Ĺžč†žóź žĚėŪēėžó¨ Ž≥ÄžĄĪŽźúŽč§. Í∑łŽü¨Žāė ŽßĆžĄĪž∑Ćžě•žóľžóźžĄúŽäĒ ž∑Ćžě• žĄ†Žį©žĄłŪŹ¨(acinar cell)žĚė žÜźžÉĀžúľŽ°ú ž∑Ćžě•Ū䳎¶Ĺžč† Ž∂ĄŽĻĄžĚė ÍįźžÜĆŽ•ľ ÍįÄž†łžė§Í≥† Í≤įÍ≥ľž†ĀžúľŽ°ú žĹúŽ†ąžčúžä§Ū܆Ūā§ŽčĆ Ž∂ĄŽĻĄ Ūé©ŪÉÄžĚīŽďúžĚė Ž≥ÄžĄĪžĚī Ž∂ąž∂©Ž∂ĄŪēėÍ≤Ć žĚľžĖīŽāėÍ≤Ć ŽźúŽč§. žĚīŽ°ú žĚłŪēėžó¨ žĹúŽ†ąžčúžä§Ū܆Ūā§ŽčĆžĚė ÍįēŪôĒžôÄ Ūē®ÍĽė Ž∂ĄŽĻĄŽŹĄ ž¶ĚÍįÄŪēėÍ≤Ć ŽźėÍ≥† žĚīŽäĒ Í≤įÍĶ≠ ž∑Ćžě• Ūö®žÜĆžĚė Ž∂ĄŽĻĄŽ•ľ ž¶ĚÍįÄžčúŪāīžúľŽ°úžć® ŪÜĶž¶ĚžĚĄ žú†ŽįúŪēėÍ≤Ć ŽźúŽč§. Í∑łŽü¨Žāė ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽ•ľ Í≤ĹÍĶ¨Ž°ú Ūą¨žó¨ŪēėŽ©ī žĹúŽ†ąžčúžä§Ū܆Ūā§ŽčĆ Ž∂ĄŽĻĄ Ūé©ŪÉÄžĚīŽďúžĚė Ž≥ÄžĄĪžĚī žĚľžĖīŽāėŽĮÄŽ°ú žĹúŽ†ąžčúžä§Ū܆Ūā§ŽčĆžĚė Ž∂ĄŽĻĄŽäĒ ÍįźžÜĆŪēėÍ≤Ć ŽźúŽč§[20].
žĚīŽüį Íłįž†Ąžóź žĚėŪēėžó¨ Í≤ĹÍĶ¨ ž∑Ćžě• Ūö®žÜĆ ž†úž†úÍįÄ ŪÜĶž¶ĚžĚĄ ÍįźžÜĆžčúŪā§Íłį žúĄŪēīžĄúŽäĒ ŪôúžĄĪŪôĒŽźú Žč®ŽįĪ Ž∂ĄŪēī ž∑Ćžě• Ūö®žÜĆÍįÄ žč≠žĚīžßÄžě•žúľŽ°ú ž†ĄŽč¨ŽźėžĖīžēľ ŪēėŽäĒŽćį, žĚīŽ•ľ žúĄŪēīžĄúŽäĒ ŽĻĄ žě•žö©ž†úŪĒľ ž†úž†ú(non-enteric coated preparation)Ž•ľ Ūą¨žó¨Ūēīžēľ ŪēúŽč§. žě•žö© ž†úŪĒľ ž†úž†úžĚė Í≤ĹžöįžóźŽäĒ Í≥Ķžě• ŪėĻžĚÄ ŪöĆžě•žóź žĚīŽ•īÍłį ž†ĄžóźŽäĒ ŪôúžĄĪŪôĒŽźú Žč®ŽįĪ Ž∂ĄŪēī Ūö®žÜĆÍįÄ Žįįž∂úŽźėžßÄ žēäÍłį ŽēĆŽ¨łžóź žč≠žĚīžßĞ앞󟞥úŽäĒ ž∑Ćžě• Ūö®žÜĆÍįÄ ŪôúžĄĪŪôĒŽźėžßÄ žēäÍ≥†, ŽĒįŽĚľžĄú žĹúŽ†ąžčúžä§Ū܆Ūā§ŽčĆ Ž∂ĄŽĻĄ Ūé©ŪÉÄžĚīŽďúŽŹĄ Ž≥ÄžĄĪžčúŪā¨ žąė žóÜŽč§[1,5].
1998ŽÖĄ ŽĮłÍĶ≠žÜĆŪôĒÍłįŪēôŪöĆ(American Gastroenterological Association, AGA) ÍįÄžĚīŽďúŽĚľžĚłžóźžĄúŽŹĄ ŽßĆžĄĪž∑Ćžě•žóľžĚė ŪÜĶž¶Ěžóź ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽ•ľ Ūą¨žó¨Ūē† Í≤ɞ̥ Í∂ĆÍ≥†ŪēėžėÄŽč§[21]. Í∑łŽü¨Žāė ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú Í≤ĹÍĶ¨ ž∑Ćžě• Ūö®žÜĆ ž†úž†ú Ūą¨žó¨žĚė ŪÜĶž¶Ě ž°įž†ąžóź ŽĆÄŪēú žó¨Žü¨ žóįÍĶ¨Žď§žóźžĄúŽäĒ Í∑ł Ūö®Í≥ľžóź ŽĆÄŪēėžó¨ Žč§žĖĎŪēėÍ≤Ć Ž≥īÍ≥†ŪēėžėÄŽäĒŽćį[22,23], žĚīŽäĒ žúĄžēĹžóź ŽĆÄŪēú ŽÜížĚÄ ŽįėžĚĎŽ•†, Ūą¨žó¨Ūēú Ūö®žÜĆ ž†úž†úÍįÄ žúĄžāįžĚīŽāė ž∑Ćžě• Ūö®žÜĆ ž†úž†úžóź žĚėŪēėžó¨ Ž∂ąŪôúžĄĪŪôĒŽźėžóąžĚĄ ÍįÄŽä•žĄĪ, žĚľŽ∂Ğ󟞥ú žě•žö© ž†úŪĒľ ž†úž†ú(enteric coated preparation)Ž•ľ Ūą¨žó¨Ūēėžó¨ Ūö®Í≥ľÍįÄ žóÜžóąžĚĄ ÍįÄŽä•žĄĪ ŽďĪžóź ÍłįžĚłŪēú Í≤ÉžúľŽ°ú žÉĚÍįĀŽźúŽč§[7].
Ūą¨žó¨ŪēėŽäĒ Žį©Ž≤ēžĚÄ ŽĻĄ žě•žö©ž†úŪĒľ ž†úž†úŽ•ľ ž∂©Ž∂ĄŪēú žö©ŽüČžúľŽ°ú žčĚžā¨žčúžôÄ Žį§žóź Ūą¨žó¨ŪēėÍ≥†, žč≠žĚīžßÄžě•žóź ŽŹĄŽč¨ŪēėÍłį ž†Ą žúĄžāįžóź žĚėŪēī Žč®ŽįĪ Ž∂ĄŪēī Ūö®žÜĆÍįÄ Ž≥ÄžĄĪŽźėŽäĒ Í≤ɞ̥ Žį©žßÄŪēėÍłį žúĄŪēėžó¨ žúĄžāį žĖĶž†úŽ•ľ žúĄŪēú ŪĒĄŽ°úŪܧ ŪéĆŪĒĄ žį®Žč®ž†úŽāė H2 žąėžö©ž≤ī žį®Žč®ž†ú ŽďĪžĚĄ ÍįôžĚī Ūą¨žó¨Ūēīžēľ ŪēúŽč§. 6-8ž£ľ ž†ēŽŹĄ ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽ•ľ Ūą¨žó¨ŪēėŽ©ī žĚīŽü¨Ūēú Ūö®žÜĆ ž†úž†úžóź žĚėŪēėžó¨ ŪÜĶž¶Ě ž°įž†ąžĚī ŽįėžĚĎžĚī žěąŽäĒžßÄ ŪŹČÍįÄŪē† žąė žěąŽč§[5,12]. ž∑Ćžě• Ūö®žÜĆ ž†úž†ú Ūą¨žó¨žóź ŽįėžĚĎžĚī žěąžúľŽ©ī 6ÍįúžõĒÍįĄ ŪÜĶž¶Ě žóÜŽäĒ ÍłįÍįĄžĚī žú†žßÄŽź† ŽēĆÍĻĆžßÄ Ūö®žÜĆ ž†úž†úžĚė Ūą¨žó¨Ž•ľ žßÄžÜćŪēúŽč§. žôúŽÉźŪēėŽ©ī Ūö®žÜĆ ž†úž†úŽ•ľ ž§ĎŽč®ŪēėŽ©ī žēĹ 50%žóźžĄú ž¶ĚžÉĀžĚī Žč§žčú žě¨ŽįúŪēėÍłį ŽēĆŽ¨łžĚīŽč§[1].
Ūē≠žāįŪôĒž†ú
Žč§žĖĎŪēú Ūē≠žāįŪôĒž†úŽď§ŽŹĄ ŽßĆžĄĪž∑Ćžě•žóľžóźžĄúžĚė ŪÜĶž¶Ě ž°įž†ąžóź Ūö®Í≥ľÍįÄ žěąŽäĒžßÄ žóįÍĶ¨ŽźėžóąŽč§. žāįŪôĒ žä§Ū䳎†ąžä§žóź žóįÍīÄŽźėŽäĒ ŪĎúžßĞ쟎吏Ěī ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú ŽįúÍ≤¨ŽźėÍ≥† ŽėźŪēú ž∑Ćžě• žÜźžÉĀžóźŽŹĄ žāįŪôĒ žä§Ū䳎†ąžä§ÍįÄ ž§ĎžöĒŪēú žó≠Ūē†žĚĄ ŪēėŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąžĖī Ūē≠žāįŪôĒž†úÍįÄ Ūö®Í≥ľž†ĀžĚľ Í≤ÉžúľŽ°ú žÉĚÍįĀŽźėžóąŽč§. Žč®žĚľ Ūē≠žāįŪôĒž†úŽ•ľ žĚīžö©Ūēú žóįÍĶ¨žóźžĄúŽäĒ Ūö®Í≥ľÍįÄ ž¶ĚŽ™ÖŽźėžßÄ žēäžēėžúľŽāė, žĶúÍ∑ľ žóįÍĶ¨žóźžĄú žÖÄŽ†ąŽäĄ, Ž©ĒŪčįžė§ŽčĆ, ŽĻĄŪÉÄŽĮľ EžôÄ C, Ž≤†ŪÉÄ žĻīŽ°úŪčī ŽďĪžĚė Ūē≠žāįŪôĒž†ú Ž≥ĶŪē©ž†úž†úŽ•ľ Ūą¨žó¨ŪēėžėĞ̥ ŽēĆ ŪÜĶž¶ĚžĚĄ Ūėłž†ĄžčúŪā§Í≥† žāįŪôĒ žä§Ū䳎†ąžä§Ž•ľ ÍįźžÜĆžčúŪā§ŽäĒ Žćį Ūö®Í≥ľÍįÄ žěąŽč§Í≥† Ž≥īÍ≥†ŪēėžėÄŽč§[24,25]. Ūē≠žāįŪôĒž†úžĚė Ūö®Í≥ľžóź ŽĆÄŪēīžĄúŽäĒ Ž≥īŽč§ ŪĀį Í∑úŽ™®žĚė ž∂ĒÍįÄ žóįÍĶ¨ÍįÄ ŪēĄžöĒŪēėŽč§.
žė•Ū䳎†ąžė§ŪÉÄžĚīŽďú(octreotide)
žė•Ū䳎†ąžė§ŪÉÄžĚīŽďúŽäĒ žě•žčúÍįĄ žßÄžÜ掟ėŽäĒ žÜĆŽßąŪ܆žä§ŪÉÄŪčīžĚė Ūē©žĄĪžú†žā¨ž≤īŽ°ú žĹúŽ†ąžčúžä§Ū܆Ūā§Žčƞ̥ ÍįźžÜĆžčúžľú ž∑Ćžě•žĚė Ž∂ĄŽĻĄŽ•ľ žĖĶž†úŪēúŽč§. žĚīŽü¨Ūēú žěĎžö©žĚÄ žúĄžóź žĖłÍłČŪēú ŽĻĄ žě•žö©ž†úŪĒľž†úž†úžĚė ž∑Ćžě• Ūö®žÜĆžóź žĚėŪēú Íłįž†ĄÍ≥ľ žú†žā¨ŪēėŽč§. ŪēúŪéł ž∑ĆÍīÄ ŪŹźžáĄžóźžĄú ž∑ĆÍīÄŽāī žēēŽ†•žĚĄ Žāģž∂ĒÍ≥†, Žč®ŽįĪ Ž∂ĄŪēīŽ•ľ ÍįźžÜĆžčúŪā®Žč§. žĚīŽü¨Ūēú žěĎžö©žĚĄ Í≥†Ž†§Ūēėžó¨ ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú ŪÜĶž¶Ě ž°įž†ąžóź ŽĆÄŪēú Ūö®Í≥ľžóź ŽĆÄŪēėžó¨ žóįÍĶ¨ÍįÄ žěąžóąŽč§. žīąŽ°ĚžúľŽ°úŽßĆ ŽįúŪĎúŽźėžóąŽćė Ž™á žóįÍĶ¨žóźžĄú ŪēėŽ£® žĄł Ž≤ą ŪĒľŪēėž£ľžā¨Ž•ľ ŪēėžėĞ̥ ŽēĆ ŪÜĶž¶Ě Ūėłž†Ąžóź ŽŹĄžõÄžĚī ŽźúŽč§Í≥† Ž≥īÍ≥†ŪēėžėÄžúľŽāė ŪÜĶÍ≥Ąž†ĀžúľŽ°úŽäĒ žú†žĚėŪēėžßÄ žēäžēėÍ≥†, žĚīŪõĄ žóįÍĶ¨žóźžĄúŽäĒ Ūö®Í≥ľÍįÄ ž¶ĚŽ™ÖŽźėžßÄŽäĒ žēäžēĄžĄú[26,27] ž∂Ēž≤úŽźėžßÄ žēäŽäĒŽč§.
ž∑Ćžě• žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚė žĻėŽ£Ć
ž∑Ćžě•žĚė žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚÄ žÜĆŪôĒÍīÄ ŽāīžĚė žėĀžĖĎžÜĆŽ•ľ žÜĆŪôĒŪēėÍłį žúĄŪēėžó¨ žÜĆžě• ŽāīŽ°ú ž∂©Ž∂ĄŪēú žĖĎžĚė ž∑Ćžě• žÜĆŪôĒ Ūö®žÜĆŽ•ľ Ž∂ĄŽĻĄŪēėžó¨ ž†ĄŽč¨ŪēėžßÄ Ž™ĽŪēėŽäĒ Í≤ɞ̥ žĚėŽĮłŪēúŽč§. žěĄžÉĀž†ĀžúľŽ°ú žĚėŽĮłžěąŽäĒ ž∑Ćžě• žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚÄ ž∑Ćžě•žĚė ÍłįŽä•žĚī 90% žĚīžÉĀ žÜźžÉĀŽźėÍ≥† ž∑Ćžě• Ūö®žÜĆžĚė Ž∂ĄŽĻĄÍįÄ ž†ēžÉĀžĚė 10% ŽĮłŽßĆžúľŽ°ú ÍįźžÜĆŪēėžėĞ̥ ŽēĆ ŽįúžÉĚŪēėÍ≤Ć ŽźúŽč§[28]. ŽßĆžĄĪž∑Ćžě•žóľ ŪôėžěźžĚė žēĹ 40-50%žóźžĄú žôłŽ∂ĄŽĻĄ ÍłįŽä• Ž∂Äž†ĄžĚī ŽįúžÉĚŪēėžó¨ žÜĆŪôĒ žě•žē†Žāė ŪĚ°žąė žě•žē†ÍįÄ žĚľžĖīŽāėŽ©į žĄ§žā¨, žßÄŽį©Ž≥Ä, ž≤īž§Ď ÍįźžÜĆ ŽďĪžĚė ž¶ĚžÉĀžĚĄ ŽāėŪÉÄŽāłŽč§[1]. Ž¶¨ŪĆĆž†úžĚė Ž∂ĄŽĻĄÍįÄ Žč§Ž•ł Ūö®žÜĆžóź ŽĻĄŪēėžó¨ ŽćĒ ŽĻ®Ž¶¨ ÍįźžÜĆŪēėÍłį ŽēĆŽ¨łžóź žěĄžÉĀžóźžĄúŽäĒ žßÄŽį©žĚė ŪĚ°žąė žě•žē†ÍįÄ ÍįÄžě• Ž¨łž†úÍįÄ ŽźėÍ≥† ŽĒįŽĚľžĄú žßÄŽį©Ž≥ÄžĚī Ž®ľž†Ä ŽįúžÉĚŪēėÍ≥† Žč®ŽįĪŽ≥ÄŽ≥īŽč§ žč¨ŪēėÍ≤Ć ŽāėŪÉÄŽāúŽč§. ŽėźŪēú Žč®ŽįĪžßąžĚė ŪĚ°žąė žě•žē†(Žč®ŽįĪŽ≥Ä)ŽŹĄ ŽįúžÉĚŪē† žąė žěąžßÄŽßĆ žßÄŽį©žĚė ŪĚ°žąė žě•žē† Ž≥īŽč§ŽäĒ žČĹÍ≤Ć ÍĶźž†ēŪē† žąė žěąŽč§. Žč®ŽįĪ Ž∂ĄŪēī Ūö®žÜĆŽäĒ Ž≥ÄžĄĪžóź ÍįēŪē† ŽŅźŽßĆ žēĄŽčąŽĚľ ž∑Ćžě• Žč®ŽįĪ Ž∂ĄŪēī Ūö®žÜĆžĚė ÍįźžÜĆŽüȞ̥ žúĄžôÄ žÜƞ앞󟞥úžĚė Žč®ŽįĪ Ž∂ĄŪēī Ūö®žÜĆÍįÄ Ž≥īžÉĀŪēėÍłį ŽēĆŽ¨łžĚīŽč§.
ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžúľŽ°úžĚė žßĄŪĖČžĚÄ žõźžĚł žßąŪôėžóź ŽĒįŽĚľ žį®žĚīÍįÄ žěąžĖīžĄú žēĆžĹĒžė¨žĄĪ ŽßĆžĄĪž∑Ćžě•žóľžĚė Í≤Ĺžöį žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚī ŪŹČÍ∑† 10ŽÖĄ ž†ēŽŹĄ ŪõĄžóź ŽįúžÉĚŪēėžßÄŽßĆ, ŪäĻŽįúžĄĪ ŽßĆžĄĪ ž∑Ćžě•žóľžĚė Í≤ĹžöįžóźŽäĒ 20-30ŽÖĄžĚī ÍĪłŽ¶ī žąėŽŹĄ žěąŽč§[29,30].
ž†ēŪôēŪēú ŪÜĶÍ≥ĄŽäĒ žóÜžúľŽāė žĄúÍĶ¨žóź ŽĻĄŪēėžó¨ žßÄŽį© žĄ≠ž∑®ŽüČžĚī ž†ĀžĖīžĄúžĚłžßÄ žöįŽ¶¨ŽāėŽĚľžĚė ŽßĆžĄĪž∑Ćžě•žóľ ŪôėžěźŽď§ž§ĎžóźžĄúŽäĒ žč¨Ūēú žßÄŽį©Ž≥Ğ̥ ŪėłžÜĆŪēėŽäĒ ŪôėžěźÍįÄ Žß§žöį ŽďúŽ¨ľŽč§[11]. 2008ŽÖĄ ŽĆÄŪēúž∑ĆŽčīŽŹĄŪēôŪöƞ󟞥ú žčúŪĖČŪēėžėÄŽćė ÍĶ≠Žāī ŽßĆžĄĪž∑Ćžě•žóľ ŪôėžěźŽď§žĚĄ ŽĆÄžÉĀžúľŽ°ú Ūēú ž°įžā¨žóźžĄúŽŹĄ ž†Ąž≤ī 650Ž™ÖžĚė Ūôėžěź ž§Ď žßÄŽį©Ž≥Ğ̥ ŽŹôŽįėŪēėžėÄŽćė ŪôėžěźŽäĒ 13.2%žóź Ž∂ąÍ≥ľŪēėžėÄŽč§. Žč§ŽßĆ žßÄŽį©Ž≥ÄžĚė ž†ēŽŹĄ ŽďĪžóź ŽĆÄŪēīžĄúŽäĒ žěźžĄłŪěą ž°įžā¨ŽźėžßÄ žēäžēĄ ž§Ďž¶ĚžĚė žßÄŽį©Ž≥Ğ̥ ŽŹôŽįėŪēú ŪôėžěźžĚė ŪÜĶÍ≥ĄŽäĒ žēĆÍłį žĖīŽ†§žõ†Žč§[31].
ž∑Ćžě• žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚė žßĄŽč®
ž∑Ćžě• žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚė žĻėŽ£ĆŽ•ľ žúĄŪēīžĄúŽäĒ Ž®ľž†Ä ž∑Ćžě•žĚė žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚĄ žßĄŽč®ŪēėŽäĒ Í≤ÉžĚī ž§ĎžöĒŪēėŽč§. žßÄŽį© ŪĚ°žąė žě•žē†Ž•ľ žßĄŽč®ŪēėŽäĒ ŪĎúž§Ä Í≤Äžā¨ŽäĒ Í≥†ž†Ąž†ĀžĚł Van de Famer testžóź žĚėŪēėžó¨ ŽĆÄŽ≥ÄžĚė žßÄŽį©žĚĄ žł°ž†ēŪēú ŪõĄ žßÄŽį© ŪĚ°žąėžú®(coefficient of fat absorption, CFA)Ž•ľ ž†ēŽüČŪôĒŪēėŽäĒ Í≤ÉžĚīŽč§. Í∑łŽü¨Žāė žĚī Í≤Äžā¨ŽäĒ Ž™á ÍįÄžßÄ Žč®ž†źžúľŽ°ú žĚłŪēėžó¨ žěĄžÉĀžóźžĄú ž†Āžö©ŪēėŽäĒ Žćį žĖīŽ†§žõÄžĚī žěąŽč§. ŪôėžěźŽäĒ žßÄŽį© 100 gžĚĄ Ūē®žú†Ūēú ŪĎúž§ÄžčĚžā¨Ž•ľ žóįžÜć 5žĚľÍįĄ žĄ≠ž∑®ŪēėÍ≥† ŽßąžßÄŽßČ 3žĚľ ŽŹôžēą Ž≥īŽäĒ Ž™®Žď† žĖĎžĚė ŽĆÄŽ≥Ğ̥ Ž™®žēĄžēľ ŪēúŽč§. Í≤Äžā¨žÉĀžĚė žė§Ž•ėžôÄ Ž≥ÄŽŹôžĄĪžĚĄ ž§ĄžĚīÍłį žúĄŪēīžĄúŽäĒ ž∂©Ž∂ĄŪēú ÍłįÍįĄžĚī ŪēĄžöĒŪēėÍłį ŽēĆŽ¨łžóź 3žĚľ ŽŹôžēą ŽĆÄŽ≥Ğ̥ Ž™®žēĄžēľ ŪēúŽč§[32]. žčĚžĚīžĚė žßÄŽį© žĄ≠ž∑®žóź ŽĒįŽĚľžĄú ŽĆÄŽ≥ÄžĚė žßÄŽį© Ūē®ŽüȞ󟎏Ą Ž≥ÄŽŹôžĚī žěąÍłį ŽēĆŽ¨łžóź Ūēú žį®Ž°ÄžĚė ŽĆÄŽ≥Ä Í≤Äž≤īžóź ŽĆÄŪēú ž†ēŽüČ Í≤Äžā¨ŽäĒ žú†žö©ŪēėžßÄ žēäŽč§[33]. ŽĆÄŽ≥Ä žßÄŽį© ž†ēŽüČ Í≤Äžā¨žóź žěąžĖīžĄúŽäĒ ŪôėžěźžĚė žąúžĚĎŽŹĄŽŅźŽßĆžĚī žēĄŽčąÍ≥† Í≤Äžā¨žč§žóźžĄú ŽĆÄŽ≥Ä Í≤Äž≤īŽ•ľ Žč§Ž£®ŽäĒ Žćį žěąžĖīžĄúŽŹĄ ŪĀį ž†úŪēúž†źžĚī žěąŽč§. 3žĚľ ŽŹôžēą Ž™®žēĄžßĄ ŽĆÄŽ≥Ä Í≤Äž≤īŽ•ľ ž≤ėžĚĆžóź Í∑†žĚľŪēėÍ≤Ć žĄěžĖīž£ľÍ≥† žĚīŪõĄžóźŽäĒ žąėžěĎžóÖžúľŽ°ú žßĀž†Ď ž≤ėŽ¶¨Ž•ľ Ūēīžēľ ŪēėŽĮÄŽ°ú žĚīŽüį Í≤Ɏ吏Ěī Í≤Äžā¨Ž•ľ Ž∂ąžĺĆŪēėÍ≥† žĖīŽ†ĶÍ≤Ć ŽßƎč§[32].
Mixed 13C-triglyceride (13C-MTG) breath testŽäĒ žěĄžÉĀžóźžĄú ž∑Ćžě• žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚĄ žßĄŽč®ŪēėŽäĒ Žćį žěąžĖīžĄú CFAŽ•ľ ŽĆÄž≤īŪē† žąė žěąŽäĒ Í≤Äžā¨Ž°ú ŽŹĄžěÖŽźėžóąŽč§. 13C-MTG breath testŽäĒ ŽŹôžúĄžõźžÜĆÍįÄ Ž∂Äžį©Žźú ÍłįžßąžĚī Í≤Äžā¨žö© žčĚžā¨žôÄ Ūē®ÍĽė Ūą¨žó¨ŽźúŽč§. žĚī ÍłįžßąžĚī žč≠žĚīžßÄžě•ŽāīžóźžĄú ŪäĻž†ē ž∑Ćžě• Ūö®žÜĆžóź žĚėŪēėžó¨ ÍįÄžąėŽ∂ĄŪēīŽźėŽ©ī 13CÍįÄ Ž∂Äžį©Žźú ŽĆÄžā¨žāįŽ¨ľžĚī Žį©ž∂úŽźėÍ≥† žĚīŽäĒ žě•žóźžĄú ŪĚ°žąėŽźú žĚīŪõĄžóź ÍįĄžóźžĄú ŽĆÄžā¨ÍįÄ ŽźúŽč§. ÍįĄ ŽĆÄžā¨žĚė Í≤įÍ≥ľŽ°ú 13CO2ÍįÄ Žįįž∂úŽźėŽäĒŽćį žĚīÍ≤ÉžĚÄ žĚīŪõĄžóź ŪėłŪĚ°žĚĄ ŪÜĶŪēėžó¨ ž†úÍĪįŽźėÍ≤Ć ŽźúŽč§. ŪėłÍłįŽ°ú Žįįž∂úŽźú 13CO2žĚė žĖĎžĚÄ ÍįĄž†Ďž†ĀžúľŽ°ú ž∑Ćžě•žĚė žôłŽ∂ĄŽĻĄ ÍłįŽä•žĚĄ ŽįėžėĀŪēėŽäĒŽćį žĚīŽ•ľ žßąŽüČŽ∂ĄžĄĚŽ≤ē(mass spectrometry)žĚīŽāė ž†ĀžôłžĄ† Ž∂ĄžĄĚ(infrared analysis)žúľŽ°ú žł°ž†ēŪēúŽč§. Í≤Äžā¨ Žį©Ž≤ēžĚÄ 250 mgžĚė 13C-MTGŽ•ľ 16 gžĚė žßÄŽį©žĚĄ Ūē®žú†ŪēėŽäĒ Í≥†ŪėēžĚė Í≤Äžā¨žö© žčĚžā¨žóź ŪėľŪē©ŪēúŽč§. ŪėłÍłį Í≤Äž≤īŽäĒ žčĚž†Ąžóź žĪĄž∑®Ūēú Í≤ɞ̥ Íłįž†ÄžĻėŽ°ú ŪēėÍ≥†, žĚīŪõĄ žčĚŪõĄ 6žčúÍįĄ ŽŹôžēą 30Ž∂Ą ÍįĄÍ≤©žúľŽ°ú ÍįĀÍįĀ 10 mL ŪäúŽłĆžóź žĪĄž∑®ŪēúŽč§. žúĄ Žįįž∂úÍ≥ľ ÍīÄŽ†®Žź† žąė žěąŽäĒ Ž¨łž†úŽ•ľ ŪĒľŪēėÍłį žúĄŪēėžó¨ žčĚž†Ą 20-30Ž∂Ąžóź metoclopramide ŽďĪžĚė žě• žöīŽŹô žīȞߥž†úŽ•ľ Ūēú žį®Ž°Ä Ūą¨žó¨ŪēúŽč§. Í≤Äžā¨žĚė Í≤įÍ≥ľŽäĒ 6žčúÍįĄ ŽŹôžēąžĚė žīĚ 13CO2žĚė žĖĎžúľŽ°ú ŪĎúŪėĄŽźúŽč§. žßÄŽį© žÜĆŪôĒ žě•žē†Ž•ľ žßĄŽč®ŪēėŽäĒ Žćį žěąžĖīžĄú 13C-MTG ŪėłÍłį Í≤Äžā¨žĚė ŽĮľÍįźŽŹĄŽäĒ 90% žĚīžÉĀžĚīŽč§. žĚī Í≤Äžā¨ŽäĒ Í≤Ĺž¶Ě ŪėĻžĚÄ ž§Ďž¶ĚŽŹĄžĚė ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú žßÄŽį©Ž≥Ğ̥ žßĄŽč®ŪēėŽäĒ Í≤ÉŽŅźŽßĆ žēĄŽčąŽĚľ Ūö®žÜĆ ŽĆÄž≤īžöĒŽ≤ēžĚė Ūö®Í≥ľŽ•ľ ŪŹČÍįÄŪēėŽäĒ ŽćįžóźŽŹĄ žĚīžö©Ūē† žąė žěąŽč§[34].
Í∑ł žôłžóź ŪėĄžě¨ ž∑Ćžě• žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚĄ ŪŹČÍįÄŪēėŽäĒ Žćį ÍįÄžě• ŽßéžĚī žĚīžö©ŽźėŽäĒ Í≤Äžā¨ ž§ĎžĚė ŪēėŽāėŽäĒ ŽĆÄŽ≥Ä elastase Í≤Äžā¨(fecal elastase test, FET)Ž°ú[28], ŽĆÄŽ≥ÄŽāīžĚė human elastase-1žĚė žÉĚžĄĪžĚĄ žł°ž†ēŪēúŽč§(ž†ēžÉĀžĻė > 200 őľg/g). žĚī Í≤Äžā¨ŽäĒ Ūēú žį®Ž°ÄžĚė ŽĆÄŽ≥Ä Í≤Äž≤īŽßĆ ŪēĄžöĒŪēėÍ≥†, ŽĆÄŽ≥Ä Í≤Äž≤īŽŹĄ žÉĀžė®žóźžĄú 5žĚľÍįĄ Ž≥īÍīÄžĚī ÍįÄŽä•ŪēėŽ©į, Ūö®žÜĆ ŽĆÄž≤ī žĻėŽ£ĆŽ•ľ žßÄžÜćŪēīŽŹĄ ŽźėÍłį ŽēĆŽ¨łžóź žČĹÍ≤Ć žčúŪĖČŪē† žąė žěąŽäĒ žě•ž†źžĚī žěąŽč§. ž§Ďž¶ĚžĚė žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžóźžĄúŽäĒ žēĹ 100%žĚė ŽÜížĚÄ ŽĮľÍįźŽŹĄŽ•ľ Ž≥īžĚīžßÄŽßĆ, ž§ĎŽďĪŽŹĄžóźžĄúŽäĒ 77-100%, Í≤Ĺž¶ĚžóźžĄúŽäĒ 0-63%Ž°ú ŽĮľÍįźŽŹĄÍįÄ ŽāģžēĄžßĄŽč§[35]. ŪäĻžĚīŽŹĄŽäĒ 93% ž†ēŽŹĄžĚīŽč§[36].
ž∑Ćžě• žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚė žĻėŽ£Ć
ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚė žĻėŽ£ĆŽäĒ ž∑Ćžě• Ūö®žÜĆžĚė Ž≥ĶŪē©ž†úŽ•ľ Í≤ĹÍĶ¨ Ūą¨žó¨ŪēėŽäĒ ž∑Ćžě• Ūö®žÜĆ ŽĆÄž≤ī žĻėŽ£ĆÍįÄ Í∑ľÍįĄžĚī ŽźúŽč§[1,28,32]. Ūö®žÜĆ ŽĆÄž≤ī žĻėŽ£ĆžĚė Ž™©ž†ĀžĚÄ ž∂©Ž∂ĄŪēú žĖĎžĚė Ž¶¨ŪĆĆž†úŽ•ľ žÜĆŪôĒžóź ž†Āž†ąŪēú žě•žÜƞ̳ žč≠žĚīžßÄžě•žĚīŽāė Í≥Ķžě•žóź, Í∑łŽ¶¨Í≥† ž†Āž†ąŪēú žčúÍįĄ, ž¶Č žėĀžĖĎŽ∂ĄžĚė žúĄŽįįž∂ú(gastric emptying)žóź Žßěž∂ĒžĖī ž†ĄŽč¨ŪēėŽäĒ Í≤ÉžĚīŽč§[37].
ŪėĄžě¨ žā¨žö©ŽźėŽäĒ ž∑Ćžě• Ūö®žÜĆ ž†úž†úžĚė ŽĆÄŽ∂ÄŽ∂ĄžĚÄ ŽŹľžßÄžĚė žõźŽ£ĆŽ°úŽ∂ÄŪĄį ž∂Ēž∂úŪēú ž†úž†úŽď§žĚīŽč§. žĚīŽü¨Ūēú ž†úž†úŽď§žĚÄ pancrelipase ŽėźŽäĒ pancreatinžúľŽ°ú Ž∂ąŽ¶¨ŽäĒŽćį, ÍįĀ ž†úŪíąžóź ŽĒįŽĚľ Žč®ŽįĪžßą Ž∂ĄŪēī Ūö®žÜĆ, Ž¶¨ŪĆĆž†ú, žēĄŽįÄŽĚľž†úÍįÄ Žč§žĖĎŪēėÍ≤Ć ŪėľŪē©ŽźėžĖī žěąŽč§. ŪēúŪéł 2 mm žĚīŪēėžĚė ŪĀ¨ÍłįŽ•ľ ÍįĞߥ mini-microsphere, pellet ŽėźŽäĒ micro-tabletsŽ•ľ ŪŹ¨Ūē®ŪēėŽäĒ žļ°žäź ž†úž†úŽď§ŽŹĄ žčúŪĆźŽźėÍ≥† žěąŽč§. žĚīŽüį ž†úž†úŽď§žĚÄ Ūą¨žó¨Ūēú Ūö®žÜĆ ž†úž†úÍįÄ žúĄ žēąžóźžĄú ŽĮłž¶ô(chyme)Í≥ľ ž†Āž†ąŪēú ŪėľŪē©Ž¨ľžĚĄ ŪėēžĄĪŪēėŽäĒ Í≤ɞ̥ žīȞߥŪēėŽŹĄŽ°Ě ž†úž°įŽźėžĖī žěąŽč§. pHžóź ŽĮľÍįźŪēú ŽßąžĚīŪĀ¨Ž°úžä§ŪĒľžĖīŽď§žĚÄ žāįžóź ÍįēŪēú ž§ĎŪē©ž≤īŽ°ú Žćģžó¨ žěąžĖīžĄú žúĄ žēąžóźžĄú žúĄžāįžóź žĚėŪēėžó¨ ž∑Ćžě• Ūö®žÜĆÍįÄ Ž≥ÄžĄĪŽźėŽäĒ Í≤ɞ̥ Žį©žßÄŪēėŽ©į pH 5.0-5.5 ž†ēŽŹĄžĚė žēąž†ĄŪēú pH žĚīžÉĀžĚī ŽźėŽ©ī Ūö®žÜĆŽ•ľ Žį©ž∂úŪēúŽč§[38].
ž¶ĚžÉĀÍ≥ľ ŽćĒŽ∂ąžĖī ž∑Ćžě•žĚė žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†Ąžóź žĚėŪēú žÜĆŪôĒ žě•žē†žĚė ž§ĎžöĒŪēú Ūē©Ž≥Ďž¶ĚžĚÄ žėĀžĖĎ žě•žē†žĚīŽč§. žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†Ą ŪôėžěźžóźžĄú ŽĮłŽüČžėĀžĖĎžÜĆ(micronutrients), žßÄžö©žĄĪ ŽĻĄŪÉÄŽĮľ, žßÄžßąŽč®ŽįĪžßą ŽďĪžĚė Ūėąž§Ď ŽÜ掏ĄÍįÄ ŽāģžĚÄ Í≤ÉžĚÄ žėĀžĖĎ žě•žē†žôÄ žóįÍīÄŽźú Ūē©Ž≥Ďž¶ĚžĚīŽāė žč¨ŪėąÍīÄÍ≥Ą Ūē©Ž≥Ďž¶ĚžĚė žúĄŪóėžĄĪžĚĄ ŽÜížěĄžúľŽ°úžć® ŽÜížĚÄ žā¨ŽßĚŽ•†Í≥ľŽŹĄ žóįÍīÄžĚī ŽźėŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§[37]. Í∑łŽü¨ŽĮÄŽ°ú ž∑Ćžě• Ūö®žÜĆ ŽĆÄž≤ī žĻėŽ£ĆŽäĒ ž≤īž§Ď ÍįźžÜĆ, žßÄŽį©Ž≥ÄÍ≥ľ ÍįôžĚÄ ž¶ĚžÉĀžĚĄ Ūėłž†ĄžčúŪā§ŽäĒ Í≤É ŽŅźŽßĆ žēĄŽčąŽĚľ žėĀžĖĎ žÉĀŪÉúŽ•ľ ž†ēžÉĀžúľŽ°ú ŪöĆŽ≥ĶžčúŪā¨ žąė žěąŽŹĄŽ°Ě ŪēėŽäĒŽćį žīąž†źžĚĄ Žßěž∂ĒžĖīžēľ ŪēúŽč§[34].
ž∑Ćžě• Ūö®žÜĆ žĻėŽ£ĆžĚė ž†ĀžĚĎž¶Ě
ž≤īž§Ď ÍįźžÜĆÍįÄ žěąÍĪįŽāė, ŪēėŽ£® 100 gžĚė žßÄŽį©žĚĄ Ūē®žú†ŪēėŽäĒ žčĚžā¨Ž°ú ŪēėŽ£® 15 g žĚīžÉĀ ŽĆÄŽ≥Ä žßÄŽį©žĚė ŽįįžĄ§žĚī žěąÍĪįŽāė, žßÄŽį©Ž≥ÄÍ≥ľ žóįÍīÄŽźú ž¶ĚžÉĀžĚĄ ŽŹôŽįėŪēėŽäĒ ž∑Ćžě• žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†Ą ŪôėžěźŽäĒ ž†ĄŪÜĶž†ĀžúľŽ°ú ž∑Ćžě• Ūö®žÜĆ ŽĆÄž≤ī žĻėŽ£ĆžĚė ž†Āž†ąŪēú ŽĆÄžÉĀžĚī ŽźúŽč§. žßÄŽį©Ž≥ÄžĚī ŪēėŽ£® 7.5-15 gžĚīŽ©īžĄú ž¶ĚžÉĀžĚĄ ŽŹôŽįėŪēėžßÄ žēäŽäĒ Í≤Ĺžöįžóź ž∑Ćžě• Ūö®žÜĆ žĻėŽ£ĆŽ•ľ Ūē† Í≤ɞ̳žßÄžóź ŽĆÄŪēīžĄúŽäĒ ŽÖľŽěÄžĚī žěąŽč§[32,37]. Í∑łŽü¨Žāė žĚľŽ∂Ğ󟞥úŽäĒ žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄÍ≥ľ žÜĆŪôĒ žě•žē†Ž•ľ ÍįÄžßÄÍ≥† žěąŽäĒ ŪôėžěźŽäĒ žßÄŽį©Ž≥ÄžĚė ž†ēŽŹĄŽāė ŽŹôŽįė ž¶ĚžÉĀžĚė žú†Ž¨īžôÄ ÍīÄÍ≥ĄžóÜžĚī Ž™®ŽĎź ž∑Ćžě• Ūö®žÜĆ ŽĆÄž≤ī žĻėŽ£ĆŽ•ľ žčúŪĖČŪēīžēľ ŪēúŽč§ŽäĒ ž£ľžě•ŽŹĄ žěąŽč§[28,39].
žčĚžā¨žĚė ž°įž†ą
ž†ĄŪÜĶž†ĀžúľŽ°ú ž∑Ćžě•žĚė žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚė žīąÍłį žĻėŽ£ĆŽäĒ žßÄŽį©Ž≥Ğ̥ ž§ĄžĚīÍłį žúĄŪēėžó¨ žßÄŽį©žĚė žĄ≠ž∑®Ž•ľ ž†úŪēúŪēėŽŹĄŽ°Ě ŪēėžėÄÍ≥†, žĚīŽüį ÍīÄž†źžóźžĄú žėąž†ĄŽ∂ÄŪĄį žĚľŽįėž†ĀžúľŽ°ú ŪēėŽ£® 20 g ŽĮłŽßĆžĚė žßÄŽį©žĚĄ ŪŹ¨Ūē®Ūēú žčĚžā¨ÍįÄ Í∂Ćžě•ŽźėžĖī žôĒŽč§. Í∑łŽü¨Žāė žßÄŽį© žĄ≠ž∑®Ž•ľ ž†úŪēúŪēėŽäĒÍ≤ÉžĚÄ ž∑Ćžě• žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†Ą ŪôėžěźžóźžĄú žĚīŽĮł ŪĚ°žąėžě•žē†ÍįÄ žěąŽäĒ žßÄžö©žĄĪ ŽĻĄŪÉÄŽĮľžĚė žĄ≠ž∑®Ž•ľ ŽćĒžöĪ Ž∂Äž°ĪŪēėÍ≤Ć Ūē† žąė žěąŽč§[37]. ŪēúŪéł Ūö®žÜĆ ŪôúžĄĪžĚė ŽįėÍįźÍłįŽäĒ ÍįĀ Ūö®žÜĆžĚė ÍłįžßąžĚī ž°īžě¨Ūē®žúľŽ°úžć® ŪĖ•žÉĀ ŽźėŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§[40]. ŽĒįŽĚľžĄú žě•žĚĄ ŪÜĶÍ≥ľŪēėŽäĒ ŽŹôžēą Ž¶¨ŪĆĆž†ú ŪôúžĄĪžĚī žú†žßÄŽźėÍłį žúĄŪēīžĄúŽäĒ žĚĆžčĚŽ¨ľžĚė ž§ĎžĄĪžßÄŽį©žĚĄ ŪēĄžöĒŽ°ú ŪēúŽč§. Í≤įŽ°†ž†ĀžúľŽ°ú ž∑Ćžě•žĚė žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚĄ žĻėŽ£ĆŪēėŽäĒ Žćį žěąžĖīžĄú žßÄŽį© žĄ≠ž∑®Ž•ľ ž†úŪēúŪēėŽäĒ Í≤ÉžĚÄ ŽćĒžĚīžÉĀ Í≥†Ž†§ŪēėžßÄ žēäžēĄžēľ ŪēúŽč§[37].
žě•žóźžĄú žßĀž†Ď ŪĚ°žąėÍįÄ ŽźėŽäĒ ž§ĎÍįĄžā¨žä¨ ž§ĎžĄĪžßÄŽį©(medium-chain triglyceride)žĚÄ ž≤īž§Ď ÍįźžÜĆÍįÄ žěąŽäĒ ŪôėžěźžóźžĄú žó¨Ž∂ĄžĚė žóīŽüȞ̥ ž†úÍ≥ĶŪēėÍĪįŽāė, Í≤ĹÍĶ¨ ž∑Ćžě• Ūö®žÜĆ ž†úž†úžóź ž†Āž†ąŪěą ŽįėžĚĎŪēėžßÄ žēäŽäĒ ŪôėžěźžóźžĄú žßÄŽį©Ž≥Ğ̥ ž§ĄžĚīŽäĒ Žćį žú†žö©Ūē† žąė žěąŽč§[32]. žÜĆŽüČžĚė žčĚžā¨Ž•ľ žěźž£ľŪēėÍ≥† žĹ© ŽďĪÍ≥ľ ÍįôžĚī žÜĆŪôĒŪēėÍłį žĖīŽ†§žöī žčĚŪíąžĚĄ ŪĒľŪēėŽäĒ Í≤ÉžĚÄ žĚľŽįėž†ĀžúľŽ°ú ž∂Ēž≤úŽźúŽč§. žĄ¨žú†žÜĆÍįÄ ŪíćŽ∂ÄŪēú žčĚžā¨ÍįÄ ž∑Ćžě•žĚė Ž¶¨ŪĆĆž†ú Ž∂ĄŽĻĄŽ•ľ ž¶ĚÍįÄžčúŪā§ŽäĒ Í≤Éž≤ėŽüľ Ž≥īžĚīžßÄŽßĆ ž∑Ćžě•žĚė Ž¶¨ŪĆĆž†ú ŪôúžĄĪŽŹĄŽ•ľ 50% žĚīžÉĀ žĖĶž†úŪēėÍłį ŽēĆŽ¨łžóź žĚīžóź ŽĆÄŪēīžĄúŽäĒ ŽÖľžĚėÍįÄ ŽćĒ ŪēĄžöĒŪēėŽč§. žßÄžö©žĄĪ ŽĻĄŪÉÄŽĮľ(A, D, E, K)Í≥ľ ŽĻĄŪÉÄŽĮľ B12, Ūē≠žāįŪôĒž†úŽ•ľ ŪŹ¨Ūē®ŪēėŽäĒ ŽĮłŽüČžėĀžĖĎžÜĆŽäĒ žěĄžÉĀž†ĀžúľŽ°ú ŪēĄžöĒŪēėŽ©ī Ūą¨žó¨Ūēėžó¨žēľ ŪēúŽč§. ŽĻĄŪÉÄŽĮľ D Í≤įŪēćžĚī žěąŽäĒ ŪôėžěźžóźžĄúŽäĒ žĻľžäėÍ≥ľ ŽĻĄŪÉÄŽĮľ DŽŹĄ ž∑Ćžě•žĚė žĄĚŪöĆŪôĒÍįÄ žěąŽč§Í≥† ŪēėŽćĒŽĚľŽŹĄ Ūą¨žó¨Ūēīžēľ ŪēúŽč§[1].
ž∑Ćžě• Ūö®žÜĆ ž†úž†ú
ž∑Ćžě• Ūö®žÜĆžĚė Ž∂ĄŽĻĄŽäĒ žčĚžā¨žóź ŽįėžĚĎŪēėžó¨ ŽĻ†Ž•īÍ≤Ć ž¶ĚÍįÄŪēėžó¨ Í≥ĶŽ≥ĶžĚė žąėž§ÄŽ≥īŽč§ 6ŽįįÍĻĆžßÄ žÉĀžäĻŪēėÍ≤Ć ŽźėÍ≥† žčĚŪõĄ 20-60Ž∂ĄŽāīžóź žĶúŽĆÄžĻėžóź žĚīŽ•īÍ≤Ć ŽźúŽč§. žĚīŪõĄŽ°úŽäĒ Ūö®žÜĆ Ž∂ĄŽĻĄÍįÄ ÍįźžÜĆŪēėžó¨ 3-4Žįį žąėž§ÄžúľŽ°ú 3-4žčúÍįĄ žßÄžÜ掟ėŽč§ÍįÄ Žč§žčú Í≥ĶŽ≥Ķ žąėž§ÄžúľŽ°ú ŪöĆŽ≥ĶŽźúŽč§. žĚīŽü¨Ūēú žčĚŪõĄ Ūö®žÜĆžĚė Ž∂ĄŽĻĄŽäĒ ÍĪīÍįēŪēú žā¨Žěƞ󟞥ú ž†ēžÉĀ žčĚžā¨Ž•ľŪēú ŪõĄ žĶúŽĆÄ 3,000-6,000 IU/minžĚė Ž¶¨ŪĆĆž†úžôÄ ŪŹČÍ∑† 2,000-4,000 IU/minžĚė Ž¶¨ŪĆĆž†úÍįÄ Ž∂ĄŽĻĄŽźėŽäĒ Í≤ɞ̥ žĚėŽĮłŪēúŽč§[41]. Ūö®žÜĆ ŽĆÄž≤ī žĻėŽ£ĆŽäĒ Í∑ł Ž∂ĄŽĻĄ ŪėēŪÉúŽāė žĖĎžóź žěąžĖīžĄú ž∑Ćžě• Ūö®žÜĆžĚė žĚīŽü¨Ūēú žÉĚŽ¶¨ž†ĀžĚł Ž∂ĄŽĻĄ žĖĎžÉĀÍ≥ľ žĶúŽĆÄŪēú ŽĻĄžä∑Ūēīžēľ ŪēúŽč§. žčúŪĆźŽźėŽäĒ Ūö®žÜĆ ž†úž†úŽäĒ žÉĚŽ¶¨ž†ĀžĚł žÉĀŪÉúžóźžĄú žčĚŪõĄžóź ž∑ƞ앞󟞥ú Ž∂ĄŽĻĄŪēėŽäĒ Í≤ÉÍ≥ľ ÍįôžĚī 360,000 IUžĚė ŪôúžĄĪŪôĒŽźú Ž¶¨ŪĆĆž†úŽ•ľ žč≠žĚīžßÄžě• ŽāīÍįēžúľŽ°ú ž†ĄŽč¨ŪēėžßÄ Ž™ĽŪēúŽč§[37].
žßÄŽį©Ž≥Ğ̥ žėąŽį©ŪēėÍłį žúĄŪēīžĄúŽäĒ Ūö®žÜĆ ž†úž†úÍįÄ ž†ĀžĖīŽŹĄ 30,000 IU, ŽįĒŽěĆžßĀŪēėÍ≤ĆŽäĒ 48,000 IUžĚė Ž¶¨ŪĆĆž†úÍįÄ žčĚžā¨žôÄ Ūē®ÍĽė žč≠žĚīžßÄžě•žóź ž†ĄŽč¨ŽźėžĖīžēľ ŪēúŽč§. Í∑łŽü¨Žāė žúĄžāįžĚė Ž∂ĄŽĻĄ, žėĀžĖĎŽ∂ĄÍ≥ľ Ūö®žÜĆ ž†úž†úÍįÄ ŽŹôžčúžóź žúĄžóźžĄú žč≠žĚīžßÄžě•žúľŽ°ú Žįįž∂úŽźėžßÄ Ž™ĽŪēėÍĪįŽāė, žú†Ž¶¨Žźú Ž¶¨ŪĆĆž†úÍįÄ Žč®ŽįĪ Ž∂ĄŪēīŽ°ú Ž∂ąŪôúžĄĪŪôĒ ŽźėŽäĒ ŽďĪžĚė žó¨Žü¨ žöĒžĚłŽď§Ž°ú žĚłŪēėžó¨ žĚīŽü¨Ūēú Ž™©ŪĎúžóź ŽŹĄŽč¨ŪēėÍłįŽäĒ žĖīŽ†ĶŽč§[42]. Ūö®žÜĆžĚė žĖĎÍ≥ľ Ž∂ĄŽĻĄ ŪėēŪÉúžóź žěąžĖīžĄú žčĚŪõĄžĚė žÉĚŽ¶¨ž†ĀžĚł ž∑Ćžě• Ūö®žÜĆ Ž∂ĄŽĻĄžôÄ ŽĻĄžä∑ŪēėÍłį žúĄŪēīžĄúŽäĒ žĶúžÜĆŪēú žčĚžā¨ŽčĻ 40,000-50,000 UžĚė Ž¶¨ŪĆĆž†úÍįÄ ŪēĄžöĒŪēėŽč§[37].
ž†ēž†úŽāė žļ°žäźžóź ŽĄ£žĖīžßĄ Ž∂ĄŽßź ž†úž†úŽ°ú žĚīŽ£®žĖīžßĄ žīąÍłįžĚė ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽäĒ žúĄ žēąžóźžĄú žúĄžāįžóź žĚėŪēīžĄú Ž¶¨ŪĆĆž†úÍįÄ Ž∂ąŪôúžĄĪŪôĒŽźėŽäĒ Í≤ÉžúľŽ°úŽ∂ÄŪĄį Ž≥īŪėłŪē† žąėÍįÄ žóÜžóąÍłį ŽēĆŽ¨łžóź, žĄ≠ž∑®Ūēú Ž¶¨ŪĆĆž†úžĚė Žč®žßÄ 8%ŽßĆžĚī žÜĆžě•ŽāīžóźžĄú žĚīžö©Žź† žąė žěąžóąŽč§. Í∑łŽü¨ŽĮÄŽ°ú žÜĆŪôĒÍīÄŽāīžóźžĄú žÜĆŪôĒŽ•ľ ŪēėŽäĒ Žćį ŪēĄžöĒŪēú Ž¶¨ŪĆĆž†ú žĖĎžĚė 5-10ŽįįžĚė žĖϞ̥ Í≤ĹÍĶ¨Ž°ú Ūą¨žó¨ŪēīžēľŽßĆ ŪĖąŽč§. žúĄžóź žĖłÍłČŪēú žó¨Žü¨ Ž¨łž†úž†źŽď§žĚĄ ŪĒľŪē† žąė žěąŽäĒ ÍįÄžě• žĘčžĚÄ Žį©Ž≤ēžĚÄ ŽĮłŽčąŽßąžĚīŪĀ¨Ž°úžä§ŪĒľžĖī(minimicrosphere)Ūėē Ūö®žÜĆžĚė žě•žö©ž†úŪĒľ(enteric-coated) ž†úž†úŽ•ľ žā¨žö©ŪēėŽäĒ Í≤ÉžĚīŽč§[37].
ŽėźŪēú ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽ•ľ Ūą¨žó¨ŪēėŽäĒ žčúÍįĄŽŹĄ žĻėŽ£Ć Ūö®Í≥ľŽ•ľ ŽÜížĚīÍłį žúĄŪēėžó¨ Žß§žöį ž§ĎžöĒŪēėŽč§. žôłŽ∂Ğ󟞥ú Ūą¨žó¨Žźú Ūö®žÜĆ ž†úž†úÍįÄ žÜĆŪôĒŽźú žĚĆžčĚžóź žěĎžö©Ūēīžēľ ŪēėÍ≥†, Žėź žÜĆŪôĒžôÄ ŪĚ°žąėŽ•ľ Í∑ĻŽĆÄŪôĒŪēėÍłį žúĄŪēīžĄúŽäĒ Ūö®žÜĆ ž†úž†úžĚė žúĄ Žįįž∂úžĚī žėĀžĖĎŽ∂ĄÍ≥ľ ŽŹôžčúžóź žĚīŽ£®žĖīž†łžēľ ŪēėÍłį ŽēĆŽ¨łžóź ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽäĒ žčĚžā¨Žāė ÍįĄžčĚÍ≥ľ ÍįôžĚī Ūą¨žó¨Ūēīžēľ ŪēúŽč§[32]. ž†Ąž≤ī žö©ŽüČžĚė ŽįėžĚÄ žčĚžā¨Ž•ľ žčúžěĎŪē† ŽēĆ Ūą¨žó¨ŪēėÍ≥† ŽāėŽ®łžßÄ ŽįėžĚÄ žčĚžā¨ ž§ĎÍįĄžóź Ūą¨žó¨ŪēėŽäĒ Í≤ÉžĚī žĘčŽč§[28,43]. žĚīŽü¨Ūēú Ūą¨žó¨ Žį©Ž≤ēžĚÄ Ūö®žÜĆ ž†úž†úÍįÄ žúĄ žēąžóźžĄú ŽĮłž¶ôÍ≥ľ ŪėľŪē©Ž¨ľžĚĄ ŪėēžĄĪŪēėŽäĒ Í≤ɞ̥ ŪĖ•žÉĀžčúžľú Í≤įÍĶ≠ žúĄžóźžĄú žč≠žĚīžßÄžě•žúľŽ°ú žĚĆžčĚŽ¨ľÍ≥ľ Ūē®ÍĽė ŽŹôžčúžóź Žįįž∂úŽź† žąė žěąŽŹĄŽ°Ě Ūēīž§ÄŽč§[43,44].
Í≤ĹÍĶ¨ Ūö®žÜĆ ž†úž†úžĚė ž†Āž†ąŪēú žö©ŽüČžĚė Í≤įž†ēžĚÄ žČĹÍ≤Ć ž†Āžö©Ūē† žąė žěąŽäĒ ÍįĚÍīÄž†ĀžĚł Žį©Ž≤ēžĚī žóÜÍ≥†, ž†Āž†ąŪēú Íłįž§Ä Ūē≠Ž™©žóź ŽĆÄŪēīžĄúŽŹĄ Í∑ł Í∑ľÍĪįÍįÄ Ž∂Äž°ĪŪēėŽč§[37]. žĚľŽįėž†ĀžúľŽ°úŽäĒ ŪôėžěźžĚė žßÄŽį© žĄ≠ž∑® ž†ēŽŹĄžóź Žßěž∂ĒžĖī ž°įž†ąŪēúŽč§. Ž≥īŪÜĶ ž†ēÍ∑ú žčĚžā¨(žēĄžĻ®, ž†źžč¨, ž†ÄŽÖĀ)žóź ŽĆÄŪēú Í∂ĆÍ≥† žö©ŽüČžĚÄ 25,000-75,000 UžĚė Ž¶¨ŪĆĆž†úŽ•ľ, ÍįĄŽč®Ūēú žä§ŽāĶŽďĪžóź ŽĆÄŪēīžĄúŽäĒ 10,000-25,000 U ž†ēŽŹĄžĚė Ž¶¨ŪĆĆž†úŽ•ľ ÍįĀ žčĚžā¨žĚė žßÄŽį© Ūē®žú† ž†ēŽŹĄžóź ŽĒįŽĚľ Í∂ĆÍ≥†ŪēúŽč§. žĶúÍ∑ľžóźŽäĒ žēĹ 25,000 U ž†ēŽŹĄžĚė Ž¶¨ŪĆĆž†úŽ•ľ Ūē®žú†ŪēėŽäĒ Í≥†žö©ŽüČ ž†úž†úžôÄ 6,000-10,000 U ž†ēŽŹĄžĚė Ž¶¨ŪĆĆž†úŽ•ľ Ūē®žú†ŪēėŽäĒ ž†Äžö©ŽüČ ž†úž†úÍįÄ Ž™®ŽĎź žčúŪĆźŽźėÍ≥† žěąŽč§[28].
ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽď§žĚÄ 50žó¨ ŽÖĄ ž†ĄŽ∂ÄŪĄį žė§Žěꎏôžēą žā¨žö©ŽźėžĖīžôĒžúľŽāė ž†ĄŪÜĶž†ĀžúľŽ°ú ž†úž†úÍįÄ Ūē®žú†ŪēėŽäĒ Ž¶¨ŪĆĆž†úžĚė žö©ŽüČžóź ŽĒįŽĚľ žĄĪŽ∂Ą ŽįŹ žö©ŽüČ ŪĎúžčúÍįÄ ŽźėžĖī žôĒŽč§. Í∑łŽü¨Žāė ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽď§žĚÄ Ž¶¨ŪĆĆž†ú žôłžóźŽŹĄ Žč®ŽįĪ Ž∂ĄŪēī Ūö®žÜĆŽāė žēĄŽįÄŽĚľž†úŽŹĄ ÍįôžĚī Ūē®žú†ŪēėÍ≥†žěąÍ≥†, ÍįôžĚÄ Ž¶¨ŪĆĆž†ú Ūē®ŽüȞ̥ ÍįÄžßÄÍ≥† žěąŽč§Í≥† ŪēėŽćĒŽĚľŽŹĄ Žč®ŽįĪ Ž∂ĄŪēī Ūö®žÜĆŽāė žēĄŽįÄŽĚľž†úžĚė Ūē®ŽüČžĚÄ Žč§Ž•ł Í≤ĹžöįÍįÄ ŽßéŽč§[45]. ŽėźŪēú ÍįĀÍįĀžĚė ž†úž†úžóź ŽĆÄŪēīžĄúŽŹĄ ŪĎúžčúŽźú žö©ŽüČÍ≥ľ ŽĻĄÍĶźŪēėžó¨ žó≠ÍįÄÍįÄ Žč§žĖĎŪēėÍ≥† žĚīŽ°ú žĚłŪēėžó¨ žÉĚŽ¨ľŪēôž†Ā žĚīžö©Ž•†žóź žěąžĖīžĄúŽŹĄ žį®žĚīŽ•ľ Ž≥īžĚľ žąė žěąŽč§ŽäĒ Ž¨łž†úÍįÄ ž†úÍłįŽźėžĖī, 2004ŽÖĄ ŽĮłÍĶ≠ FDAŽäĒ ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽď§žóź ŽĆÄŪēėžó¨ žĚīŽü¨Ūēú Íłįž§Äžóź ŽßěÍ≤Ć ž†úž°įŪēėžó¨ žÉąŽ°ú žäĻžĚłžĚĄ žĖĽŽŹĄŽ°Ě ŪēėžėÄŽč§. žĚīŪõĄ ŪėĄžě¨ÍĻĆžßÄ žÉąŽ°ú FDA žäĻžĚłžĚĄ ŽįõžĚÄ ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽäĒ Creon¬ģ (Abbott Laboratories, North Chicago, IL, USA), Zenpep¬ģ (Eurand S.p.A., Milan, Italy), Pancreaze¬ģ (Nordmark Arzneimittel GmbH & Co. KG, Uetersen, Germany)ŽďĪžĚłŽćį[45], žĚīŽď§ ž†úž†úŽď§ ž§Ď Creon¬ģžĚÄ ÍĶ≠Žāīžóź Í≥ß žčúŪĆźŽź† žėąž†ēžĚīŽč§. žĚīŽď§ Ūö®žÜĆ ž†úž†úŽď§žĚÄ žÉąŽ°ú FDA žäĻžĚłžĚĄ žĖĽžĚÄ ŪõĄžóź ŽßĆžĄĪž∑Ćžě•žóľžóźžĄú žĻėŽ£Ć Ūö®Í≥ľžóź ŽĆÄŪēú žóįÍĶ¨Ž•ľ Žč§žčú žßĄŪĖČŪēėžėÄŽč§. žĚī ž§Ď Creon¬ģžĚÄ žĶúÍ∑ľ žčúŪĖČŽźú Ž¨īžěĎžúĄ žĚīž§Ď ŽßĻÍ≤Ä ŽĆÄž°į žóįÍĶ¨žóźžĄú ŽßĆžĄĪž∑Ćžě•žóľ ŪôėžěźžóźÍ≤Ć žßÄŽį© 100 g žĚīžÉĀžĚĄ ŪŹ¨Ūē®Ūēú žčĚžā¨Ž•ľ ŪēėÍ≤Ć ŪēėÍ≥† žßÄžóį Žį©ž∂úŪėēžĚė Creon¬ģžĚĄ žčĚžā¨žóźŽäĒ 72,000 U, ÍįĄžčĚžóźŽäĒ 36,000 UŽ•ľ 1ž£ľÍįĄ Ūą¨žó¨ŪēėžėĞ̥ ŽēĆ ŽĆÄž°įÍĶįÍ≥ľ ŽĻĄÍĶźŪēėžó¨ žßÄŽį©Í≥ľ žßąžÜĆ ŪĚ°žąėžú® ŽįŹ ŽĆÄŽ≥ÄžĚė ŪöüžąėŽāė ÍĶ≥Íłį, Ž≥ĶŪÜĶ ŽďĪžĚė ž¶ĚžÉĀžĚī žú†žĚėŪēėÍ≤Ć Ūėłž†ĄŽźėžóąÍ≥†[46], žĚīŪõĄ ÍįôžĚÄ žóįÍĶ¨žßĄžóź žĚėŪēī žčúŪĖČŽźú ŪõĄžÜć žóįÍĶ¨žóźžĄúŽŹĄ Creon¬ģ 24,000 UžĚĄ 6ÍįúžõĒÍįĄ Ūą¨žó¨ŪēėžėĞ̥ ŽēĆ ŽĆÄž°įÍĶįÍ≥ľ ŽĻĄÍĶźŪēėžó¨ žú†žĚėŪēėÍ≤Ć ž≤īž§ĎžĚī ž¶ĚÍįÄŪēėÍ≥† ŽįįŽ≥Ä ŪöüžąėÍįÄ ÍįźžÜĆŪēėžėÄžĚƞ̥ Ž≥īÍ≥†ŪēėžėÄŽč§[47]. ŪėĄžě¨ ÍĶ≠ŽāīžóźžĄú žčúŪĆźŽźėÍ≥† žěąŽäĒ ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽď§žĚÄ ŪĎú 2žôÄ ÍįôŽč§.
žĻėŽ£Ć Ūö®Í≥ľžĚė ŪŹČÍįÄ
žĻėŽ£Ć Ūö®Í≥ľŽäĒ žĚľŽįėž†ĀžúľŽ°ú ž≤īž§Ď ž¶ĚÍįÄ, ž≤īž§Ď ÍįźžÜĆžĚė Ūėłž†Ą, žßÄŽį©Ž≥ÄÍ≥ľ žóįÍīÄŽźú ž¶ĚžÉĀžĚė Ūėłž†ĄÍ≥ľ ÍįôžĚÄ žěĄžÉĀž†ĀžĚł žßÄŪĎúžóź Í∑ľÍĪįŪēėžó¨ ŪŹČÍįÄŪēúŽč§. Í∑łŽü¨Žāė žĚīŽü¨Ūēú žěĄžÉĀž†ĀžĚł ŪŹČÍįÄŽäĒ žĶúÍ∑ľžóźŽäĒ ž†Āž†ąžĻė žēäžĚÄ Í≤ÉžúľŽ°ú ŽįõžēĄŽď§žó¨žßÄÍ≥† žěąžúľŽ©į, CFA, 13C-MTG breath test, ŽėźŽäĒ ŪäĻž†ē žėĀžĖĎ ŪŹČÍįÄ žĚłžěź ŽďĪžĚė ÍįĚÍīÄž†ĀžĚł Žį©Ž≤ēžúľŽ°ú žßÄŽį©žĚī ž†ēžÉĀž†ĀžúľŽ°ú žÜĆŪôĒŽźėÍ≥† žěąŽč§ŽäĒ Í≤ɞ̥ ŪôēžĚłŪēėŽäĒ Í≤ÉžĚī ž†ēžÉĀžĚė žėĀžĖĎ žÉĀŪÉúŽ•ľ ŪôēžĚłŪē† žąė žěąŽäĒ ž†Āž†ąŪēú Žį©Ž≤ēžĚīŽč§[34,48].
ž∑Ćžě• Ūö®žÜĆ ž†úž†úžĚė Ūą¨žó¨ÍįÄ žßÄŽį©žĚė žÜĆŪôĒŽ•ľ ž†ēžÉĀŪôĒžčúžľúžēľ ŪēúŽč§ŽäĒ žĚīŽ°†ž†ĀžĚł žõźžĻôžóź Í∑ľÍĪįŪēúŽč§Ž©ī, CFAžĚė ž†ēžÉĀŪôĒÍįÄ ÍįĚÍīÄž†ĀžĚł Íłįž§Ä Ūē≠Ž™©žúľŽ°ú žĚīžö©ŽźėžĖīžēľ ŪēúŽč§. ŪēúŪéł 13C-MTG ŪėłÍłį Í≤Äžā¨ Í≤įÍ≥ľŽ•ľ žčúŪĖČŪē† žąė žěąžúľŽ©ī ÍįôžĚÄ žõźŽ¶¨Ž°ú žĚī Í≤Äžā¨Ž•ľ CFAŽ•ľ ŽĆÄžč†ŪēėŽäĒ Í≤Äžā¨Ž°ú žĚīžö©Ūē† žąė žěąŽč§. žĚīŽüį ž†ĎÍ∑ľžóź ŽĒįŽ•īŽ©ī ž†Āž†ąŪēú Ūö®žÜĆ žö©ŽüČžĚÄ ÍįĀÍįĀžĚė ŪôėžěźžóźžĄú CFA ŪėĻžĚÄ 13C-MTG ŪėłÍłį Í≤Äžā¨ Í≤įÍ≥ľŽ•ľ ž†ēžÉĀŪôĒžčúŪā¨ žąė žěąŽäĒ žö©ŽüČžĚī ŽźėžĖīžēľ ŪēúŽč§. žčúžěĎ žö©ŽüȞ̥ ÍįĀ žčĚžā¨ŽčĻ Ž¶¨ŪĆĆž†ú 40,000-50,000 USP (United States Pharmacopeia) unit ž†ēŽŹĄŽ°ú žčúžěĎŪēėÍ≥†, CFA ž†ēŽüČ Í≤Äžā¨Žāė 13C-MTG ŪėłÍłį Í≤Äžā¨Ž•ľ ŽįėŽ≥ĶŪēėžó¨ Í≤įÍ≥ľžĻėÍįÄ ž†ēžÉĀžĻėžóź žĚīŽ•ľ ŽēĆÍĻĆžßÄ Ūö®žÜĆžĚė žö©ŽüȞ̥ ž¶ĚŽüČŪēúŽč§. žĚīŽü¨Ūēú Žį©Ž≤ēžĚÄ ŪôėžěźžĚė ž≤īžßąŽüČ žßÄžąėžôÄ žėĀžĖĎ žÉĀŪÉúŽ•ľ ž†ēžÉĀŪôĒŪēėŽäĒ ŽćįžóźŽŹĄ ŽŹĄžõÄžĚī ŽźėŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†łžěąŽč§[34,37].
Í∑łŽü¨Žāė CFA ž†ēŽüČ Í≤Äžā¨ÍįÄ Ž≥Ķžě°Ūēėžó¨ žčúŪĖČŪēėÍłį žĖīŽ†ĶÍĪįŽāė 13C-MTG ŪėłÍłį Í≤Äžā¨ŽŹĄ žö©žĚīŪēėžßÄ žēäžĚÄ Í≤ĹžöįžóźŽäĒ, ž∑Ćžě• Ūö®žÜĆ žĻėŽ£ĆžĚė Ž™©ž†ĀžĚł žėĀžĖĎ žÉĀŪÉúžĚė ž†ēžÉĀŪôĒŽ•ľ ŪôēžĚłŪēėÍłį žúĄŪēėžó¨ žúĄžóź žĖłÍłČŪēú ÍłįŽä• Í≤Äžā¨Žď§žĚĄ ŽĆÄžč†Ūēėžó¨ žėĀžĖĎ ŪŹČÍįÄžóź Í∑ľÍĪįŪēėžó¨ žĻėŽ£ĆžĚė ž†ĀžĚĎž¶ĚžĚīŽāė Ūö®žÜĆ ž†úž†úžĚė žö©ŽüȞ̥ Í≤įž†ēŪēėÍ≥† žĻėŽ£Ć Ūö®Í≥ľŽ•ľ ŪŹČÍįÄŪē† žąėŽŹĄ žěąŽč§[37]. 2010ŽÖĄ ŽįúŪĎúŽźú žĚīŪÉąŽ¶¨žēĄ ÍįÄžĚīŽďúŽĚľžĚłžóźžĄúŽŹĄ ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽ•ľ žčúžěĎŪēėÍłį ž†Ąžóź ŽĆÄŽ≥Ä žßÄŽį© ž†ēŽüČ Í≤Äžā¨ÍįÄ ŽįėŽďúžčú ŪēĄžöĒŪēėžßÄŽäĒ žēäžúľŽ©į, Ūö®žÜĆ ž†úž†úžĚė Ūö®Í≥ľŽ•ľ ŪŹČÍįÄŪēėŽäĒŽćį žěąžĖīžĄúŽŹĄ žěĄžÉĀž†ĀžĚł žėĀžĖĎ žßÄŪĎúžĚė ŪĖ•žÉĀÍ≥ľ žÜĆŪôĒÍłį ž¶ĚžÉĀžĚė Ūėłž†ĄŽßĆžúľŽ°úŽŹĄ ž∂©Ž∂ĄŪēú Íłįž§ÄžĚī Žź† žąė žěąŽč§Í≥† ŪēėžėÄŽč§[49].
žĻėŽ£Ć Ūö®Í≥ľžóź žėĀŪĖ•žĚĄ ž£ľŽäĒ žöĒžĚł
žĶúžč†žĚė ŽĮłŽčąŽßąžĚīŪĀ¨Ž°úžä§ŪĒľžĖī žě•žö©ž†úŪĒľ ž†úŪėēžĚė Ūö®žÜĆ ž†úž†úŽ•ľ Ūą¨žó¨ŪēúŽč§Í≥† Ūēėžó¨ŽŹĄ Žįė ž†ēŽŹĄžĚė ŪôėžěźžóźžĄúŽäĒ žßÄŽį©žĚė žÜĆŪôĒÍįÄ ž†ēžÉĀžúľŽ°ú ŪöĆŽ≥ĶŽźėžßÄ žēäŽäĒŽč§[50]. žěĄžÉĀžóźžĄú žßÄŽį©Ž≥ÄžĚė žôĄž†ĄŪēú žÜƞ觞̥ ž†ÄŪēīŪēėŽäĒ žöĒžĚłžĚÄ ŪôėžěźžĚė ŽāģžĚÄ žąúžĚĎŽŹĄ, ž†Äžö©ŽüČžĚė Ūö®žÜĆ, žāįžĄĪžĚė žě•Žāī pHžôÄ žĄłÍ∑†žĚė Í≥ľž¶ĚžčĚ ŽďĪžĚīŽč§.
ŪôėžěźžĚė žąúžĚĎŽŹĄŽäĒ Í≤ĹÍĶ¨ Ūö®žÜĆ žĻėŽ£ĆžóźžĄú Žß§žöį ž§ĎžöĒŪēėÍłį ŽēĆŽ¨łžóź ŪôėžěźŽäĒ žĻėŽ£ĆžĚė ž§ĎžöĒžĄĪÍ≥ľ ž†ēŪôēŪēú Ūą¨žó¨ žä§žľÄž§ĄžĚĄ žěė žĚīŪēīŪēėÍ≥† žěąžĖīžēľ ŪēúŽč§[43]. Ūö®žÜĆžĚė ž≤ėŽį© žö©ŽüČžĚÄ ž∂©Ž∂ĄŪēīžēľ ŪēėŽäĒ Žćį žē장ú žĖłÍłČŪēú ŽĆÄŽ°ú žčĚžā¨ŽčĻ žĶúžÜĆ 40,000-50,000 USP UžĚė žö©ŽüČžĚī ŪēĄžöĒŪēėŽč§. ŪēúŪéł ž∑Ćžě• žôłŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†Ą ŪôėžěźžóźžĄúŽäĒ ž∑Ćžě•žĚė ž§ĎŪÉĄžāį(bicarbonate) Ž∂ĄŽĻĄÍįÄ ÍįźžÜĆŽźėžĖī žĚīžį®ž†ĀžúľŽ°ú žč≠žĚīžßÄžě•žĚė pHÍįÄ žāįžĄĪžĚī ŽźúŽč§. žč≠žĚīžßÄžě• ŽāīžĚė pHÍįÄ ŽāģžēĄžßÄŽ©ī Ž™łžóźžĄú ŽßƎ吏ĖīžßĄ Ž¶¨ŪĆĆž†úŽāė ŽĻĄ žě•žö©ž†úŪĒľ ž†úž†úžĚė Ž¶¨ŪĆĆž†ú Ž™®ŽĎź ŽĻĄÍįÄžó≠ž†ĀžúľŽ°ú Ž∂ąŪôúžĄĪŪôĒŽźėžĖī Ž≤ĄŽ¶¨Í≥†, žě•žö©ž†úŪĒľ Ūö®žÜĆ Í≥ľŽ¶ĹžĚī ŪôúžĄĪŪôĒŽźú Ž¶¨ŪĆĆž†úŽ•ľ žě•žĚė Í∑ľžúĄŽ∂Ğ󟞥ú ž†Āž†ąŪěą Žį©ž∂úŪēėŽäĒ Í≤ɞ̥ Žį©ŪēīŪēėŽ©į, Žčīž¶ôžóľžĚė žĻ®ž†ĄžĚĄ žĚľžúľŪā§Í≤Ć ŽźúŽč§. Í∑łŽü¨Žāė žúĄžāį Ž∂ĄŽĻĄŽ•ľ žĖĶž†úŪēėŽ©ī žúĄŽāīžĚė pHŽ•ľ žÉĀžäĻžčúŪā§Í≥† ŽĒįŽĚľžĄú žč≠žĚīžßÄžě•ŽāīžóźžĄú žāįžĚė Ž∂ÄŽčīžĚĄ ž§Ąžó¨ž£ľÍ≤Ć ŽźėžĖī ž∑Ćžě• Ūö®žÜĆ ž†úž†úžĚė Ūö®Í≥ľŽ•ľ žÉĀžäĻžčúžľú ž§ÄŽč§. žĻėŽ£Ć ŽįėžĚĎžĚī Ž∂ąž∂©Ž∂ĄŪēú Í≤ĹžöįžóźŽäĒ žě•žö©ž†úŪĒľ ŽßąžĚīŪĀ¨Ž°úžä§ŪĒľžĖī ž†úŪėēžĚė ž∑Ćžě• Ūö®žÜĆ ž†úž†úžôÄ Ūē®ÍĽė ŪĒĄŽ°úŪܧ ŪéĆŪĒĄ žį®Žč®ž†úŽ•ľ Ž≥Ďžö© Ūą¨žó¨Ūēėžó¨ žúĄžāį Ž∂ĄŽĻĄŽ•ľ žĖĶž†úŪē† Í≤ɞ̥ Í≥†Ž†§Ūēīžēľ ŪēúŽč§[1,50]. Í∑łŽü¨Žāė žĚīŽüį Ž≥Ďžö© žöĒŽ≤ēžĚÄ ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽßƞ̥ Ūą¨žó¨Ūēėžó¨ŽŹĄ ž†Āž†ąŪēú ŽįėžĚϞ̥ Ž≥īžĚīŽäĒ ŪôėžěźžóźžĄúŽäĒ ŪēĄžöĒŪēėžßÄ žēäŽč§.
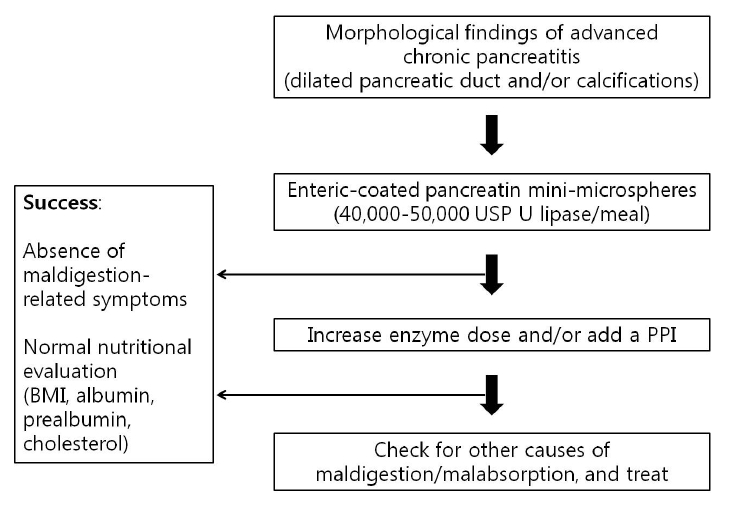
Í∑łŽü¨ŽĮÄŽ°ú ž∑Ćžě• Ūö®žÜĆ ž†úž†úžĚė Ūö®Í≥ľŽ•ľ ŽÜížĚīÍłį žúĄŪēīžĄúŽäĒ Ž®ľž†Ä ŪôėžěźÍįÄ Ūö®žÜĆ ž†úž†úŽ•ľ ž†Āž†ąŪěą žā¨žö©ŪēėŽäĒžßÄ ŪôēžĚłŪēėÍ≥†, žčĚžā¨žóź ŽĆÄŪēīžĄúŽäĒ žĶúžÜĆŪēú 40,000-50,000 U, ÍįĄžčĚžĚÄ 20,000-25,000 U Ž¶¨ŪĆĆž†ú žĚīžÉĀžúľŽ°ú ž∂©Ž∂ĄŪēú žö©ŽüČžĚė Ūö®žÜĆ ž†úž†úŽ•ľ Ūą¨žó¨ŪēúŽč§. žĻėŽ£Ć Ūö®Í≥ľÍįÄ Ž∂ąž∂©Ž∂ĄŪēėŽ©ī Žč§žĚĆžúľŽ°ú žúĄžāį Ž∂ĄŽĻĄžĚė žĖĶž†úŽ•ľ žčúŽŹĄŪēīŽ≥łŽč§. Í∑łŽüľžóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† žĻėŽ£Ć ŽįėžĚĎžĚī žóÜŽäĒ ŪôėžěźŽäĒ žĄłÍ∑†žĚė Í≥ľž¶ĚžčĚÍ≥ľ ÍįôžĚÄ Žč§Ž•ł žõźžĚł žßąŪôėžĚī žěąŽäĒžßÄ ŪôēžĚłŪēėÍ≥† žĻėŽ£ĆŪēúŽč§(Fig. 1) [28,32].
ž∑Ćžě• ŽāīŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚė žĻėŽ£Ć
ŽßĆžĄĪž∑Ćžě•žóľžóź žĚėŪēú ŽčĻŽá®ŽäĒ ž§Ďž¶ĚŽŹĄžóź žěąžĖīžĄú Í≤Ĺž¶ĚžúľŽ°úŽ∂ÄŪĄį ž§Ďž¶Ěžóź žĚīŽ•īÍłįÍĻĆžßÄ Žß§žöį Žč§žĖĎŪēėŽč§. Í∑ľŽ≥łž†ĀžĚł žõźžĚłžĚī žĚłžäźŽ¶įžĚė žÉĀŽĆÄž†Ā ŪėĻžĚÄ ž†ąŽĆÄž†Ā Í≤įŪēćžóź žĚėŪēú Í≤ÉžĚīžßÄŽßĆ Žč§Ž•ł ŪėłŽ•īŽ™¨žĚė Í≤įŪē掏Ą žĚīŽü¨Ūēú ŽčĻŽá®žóź Íłįžó¨Ūē† žąė žěąŽč§. ŽßĆžĄĪž∑Ćžě•žóľžóź žĚėŪēú ž∑Ćžě• ŽāīŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†ĄžĚÄ Í≥†ŪėąŽčĻÍ≥ľ ž†ÄŪėąŽčĻžĚė Ž≥ÄŽŹôžĚī Ž∂ąžēąž†ēŪēėžó¨ ž°įž†ąžĚī žĖīŽ†ĶŽč§[51].
ŽčĻŽá® žĻėŽ£ĆžóźŽäĒ žĄ§ŪŹįžöĒžÜĆž†ú, Ž©ĒŪäłŪŹ¨ŽĮľ, žĚłžäźŽ¶į ŽďĪžĚė Žč§žĖĎŪēú ž†úž†úÍįÄ žā¨žö©ŽźúŽč§. ž≤ėžĚĆ žēĹž†úžĚė žĄ†ŪÉĚžĚÄ ŪôėžěźžĚė žěĄžÉĀ ž¶ĚžÉĀžóź ŽĒįŽĚľ žĄ†ŪÉĚŪēúŽč§. žč¨Ūēú Í≥†ŪėąŽčĻžĚīŽāė žĚīŪôĒ ž¶ĚžÉĀžĚī žěąŽäĒ ŪôėžěźžóźžĄúŽäĒ žīąÍłį žĻėŽ£ĆŽ°ú žĚłžäźŽ¶įžĚī žĄ†ŪėłŽźúŽč§. ŽįėŽ©īžóź Í≥†ŪėąŽčĻžĚī Í≤ĹŽĮłŪēėÍ≥† ž¶ĚžÉĀžĚī žóÜŽäĒ Í≤ĹžöįžóźŽäĒ Ž©ĒŪäłŪŹ¨ŽĮľžúľŽ°ú žĻėŽ£ĆŽ•ľ žčúžěĎŪē† žąė žěąŽč§[51]. Ž©ĒŪäłŪŹ¨ŽĮľžĚÄ ŽčĻ ŽĆÄžā¨žóźžĄú žĚłžäźŽ¶įžĚĄ Žāģž∂ĒŽäĒ Ūö®Í≥ľžôÄ žĄłŪŹ¨ ž¶ĚžčĚÍ≥ľ Žč®ŽįĪžßą Ūē©žĄĪžóź ÍīÄžó¨ŪēėŽäĒ žĄłŪŹ¨ Žß§Íįú Ž¨ľžßą Žď§žóź ŽĆÄŪēú Ūē≠žĘÖžĖĎ žěĎžö© ŽēĆŽ¨łžóź Í≤ĹÍĶ¨ žĻėŽ£ĆÍįÄ ŪēĄžöĒŪēú Í≤ĹžöįžóźŽäĒ žīąÍłį žĻėŽ£ĆŽ°ú žöįžĄ†ž†ĀžúľŽ°ú žĄ†ŪÉĚŪē† žąė žěąŽč§[52]. Í≥†ŪėąŽčĻžĚī žßÄžÜ掟ėŽäĒ ŪôėžěźžóźžĄúŽäĒ Žč§Ž•ł Í≥ĄžóīžĚė žēĹŽ¨ľžĚł thiazolidinedionžĚīŽāė alpha-glucosidase inhibitor ŽďĪžĚĄ ž≤ėžĚĆžóź Ūą¨žó¨Ūē† žąėŽŹĄ žěąŽč§. Í≤ĹÍĶ¨ žēĹž†úŽ•ľ žĶúŽĆÄŪēú Ūą¨žó¨Ūē®žóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† ŪėąŽčĻ ž°įž†ąžĚī ŽźėžßÄ žēäŽäĒ ŪôėžěźŽäĒ ž∂ĒÍįÄŽ°ú žĚłžäźŽ¶įžĚė Ūą¨žó¨ÍįÄ ŪēĄžöĒŪēėŽč§[1].
Í≤į Ž°†
ŽßĆžĄĪž∑Ćžě•žóľžĚÄ žßÄžÜ枆ĀžĚł žóľž¶ĚÍ≥ľ žĄ¨žú†ŪôĒ Í≥ľž†ēžúľŽ°ú ž∑Ćžě• žč§žßąžĚė žÜźžÉĀžĚĄ ÍįÄž†łžė§ŽäĒ ŽßĆžĄĪ žßąŪôėžúľŽ°ú žĚīŽüį žÜźžÉĀžĚė Í≤įÍ≥ľŽ°ú ŪÜĶž¶ĚÍ≥ľ Ūē®ÍĽė ÍłįŽä•ž†ĀžúľŽ°úŽäĒ žôłŽ∂ĄŽĻĄ ŽįŹ ŽāīŽ∂ĄŽĻĄ ÍłįŽä•žĚė Ž∂Äž†ĄžĚĄ žīąŽěėŪēėÍ≤Ć ŽźúŽč§. Í∑łŽü¨Žāė žĻėŽ£Ćžóź žěąžĖīžĄúŽäĒ žĚīŽü¨Ūēú žóľž¶Ě ŽįŹ žĄ¨žú†ŪôĒ Í≥ľž†ēžóź žßĀž†Ď žěĎžö©Ūēėžó¨ Í≤ĹÍ≥ľŽ•ľ Ūėłž†ĄžčúŪā§ŽäĒ Ūö®Í≥ľž†ĀžĚł žĻėŽ£Ć Žį©Ž≤ēžĚÄ žēĄžßĀÍĻĆžßÄ žóÜÍ≥† ž£ľŽ°ú ŪÜĶž¶ĚžĚė ž°įž†ąžĚīŽāė žôłŽ∂ĄŽĻĄ ŪėĻžĚÄ ŽāīŽ∂ĄŽĻĄ ÍłįŽä•Ž∂Äž†Ąžóź ŽĆÄŪēú žĻėŽ£Ćžóź Í∑łžĻėÍ≥† žěąŽč§. žĚīŽßąž†ÄŽŹĄ Žč§žĖĎŪēú žěĄžÉĀ žÜĆÍ≤¨Í≥ľ Žč§žĖĎŪēú Í≤ĹÍ≥ľŽ•ľ Ž≥īžĚīÍłį ŽēĆŽ¨łžóź ŪĎúž§ÄŪôĒŽźú žĻėŽ£Ć žßÄžĻ®žĚĄ ŽßĆŽď§Íłį žĖīŽ†ĶŽč§. žßĄŪÜĶž†ú, Ūē≠žöįžöłž†ú ŽďĪžĚė Ž≥īž°į žēĹŽ¨ľÍ≥ľ ž∑Ćžě• Ūö®žÜĆ ž†úž†úŽäĒ ŪÜĶž¶ĚžĚĄ žôĄŪôĒžčúŪā§ŽäĒ Žćį ŽŹĄžõĞ̥ ž£ľŽ©į, žôłŽ∂ĄŽĻĄ ÍłįŽä• Ž∂Äž†Ąžóź žěąžĖīžĄúŽäĒ Íłįž°ī ž†úž†úžĚė Ž¨łž†úž†źžĚĄ ŪēīÍ≤įŪē† žąė žěąŽäĒ ŽĮłŽčąŽßąžĚīŪĀ¨Ž°úžä§ŪĒľžĖī žě•žö©ž†úŪĒľ ž†úŪėē Ūö®žÜĆ ž†úž†úžĚė ŽŹĄžěÖžúľŽ°ú žßÄŽį©Ž≥ÄžĚīŽāė ž≤īž§Ď ÍįźžÜĆ ŽďĪ ž¶ĚžÉĀŽŅź žēĄŽčąŽĚľ žėĀžĖĎ žÉĀŪÉúžóź žěąžĖīžĄúŽŹĄ Ž≥īŽč§ ŽāėžĚÄ Ūö®Í≥ľŽ•ľ ÍłįŽĆÄŪē† žąė žěąÍ≤Ć ŽźėžóąŽč§. žēěžúľŽ°ú ŽßĆžĄĪž∑Ćžě•žóľžĚė ŽįúŽ≥Ď ŽįŹ žßĄŪĖČ Íłįž†Ąžóź ŽĆÄŪēú Íłįžīą žóįÍĶ¨ Í≤įÍ≥ľŽ•ľ Ū܆ŽĆÄŽ°ú Ž≥īŽč§ žßĀž†Ďž†ĀžĚł žÉąŽ°úžöī žĻėŽ£Ć žėĀžó≠žĚĄ žįĺžēĄ ž†ĎÍ∑ľŪēī ŽāėÍįÄŽ†§ŽäĒ ŽÖłŽ†•žĚī ž†ąžč§ŪēėŽč§.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






