ýä£ Ùíá
Û▓░ÝòÁýØÇ ýáä ýä©Û│äýáüý£╝Ùí£ Ùï¿ýØ╝ Û░Éýù╝ ýºêÝÖÿý£╝Ùí£Ùèö Û░Çý×Ñ ÙåÆýØÇ ý£áÙ│æÙÑáÛ│╝ ýé¼ÙºØÙÑáýØä Ù│┤ýØ┤Ùèö ýºêÝÖÿý£╝Ùí£ Û│╝Û▒░Ùèö Ù¼╝ÙíáýØ┤Û│á Ýÿäý×¼Û╣îýºÇÙÅä ýù¼ýáäÝ×ê Û│ÁÛ│ÁÙ│┤Û▒┤ýØÿ Û░Çý×Ñ ýñæýÜöÝò£ Ù¼©ýá£Û░Ç ÙÉÿÛ│á ý×êÙïñ. ýòäýºüÛ╣îýºÇ Û▓░ÝòÁýùÉ ÙîÇÝò£ ÝÜ¿Û│╝ýáüýØ© ýÿêÙ░®ý▒àýØ┤ ýùåÛ©░ ÙòîÙ¼©ýùÉ Û▓░ÝòÁ Û┤ÇÙª¼ÙÑ╝ ý£äÝò┤ Û░Çý×Ñ ýñæýÜöÝò£ Û▓âýØÇ ÝÖ£ÙÅÖýä▒ Û▓░ÝòÁ ÝÖÿý×ÉÙÑ╝ ýïáýåìÝ×ê ýºäÙï¿ÝòÿÛ│á ýáüýáêÝò£ ý╣ÿÙúîÙÑ╝ ýï£ÝûëÝòÿýù¼ Û▓░ÝòÁÛÀá ýáäÝîîýùÉ ýØÿÝò£ ýâêÙí£ýÜ┤ ÝÖÿý×ÉýØÿ Ù░£ýâØýØä ÙºëÙèö Û▓âýØ┤Ùïñ. Ù¼©ýá£Ùèö Û▓░ÝòÁýØÿ ýªØýâüýØ┤ Ù╣äÝè╣ýØ┤ýáüýØ┤Ù®░ ÝØëÙÂÇ Ù░®ýé¼ýäá Û▓Çýé¼Ùºîý£╝Ùí£Ùèö ýºäÙï¿ÝòÿÛ©░ ýû┤ÙáñýÜ┤ Û▓¢ýÜ░Û░Ç ÙºÄÛ│á, Û▓Çý▓┤ÙÑ╝ ýû╗ýØä ýêÿ ýùåÙèö Û▓¢ýÜ░ÙÅä Ùô£Ù¼╝ýºÇ ýòèýòäýä£ ýºäÙï¿ýØ┤ Ùèªýû┤ýºÇÙèö Û▓¢ýÜ░Û░Ç ÙºÄÙïñÙèö ýáÉýØ┤Ùïñ.
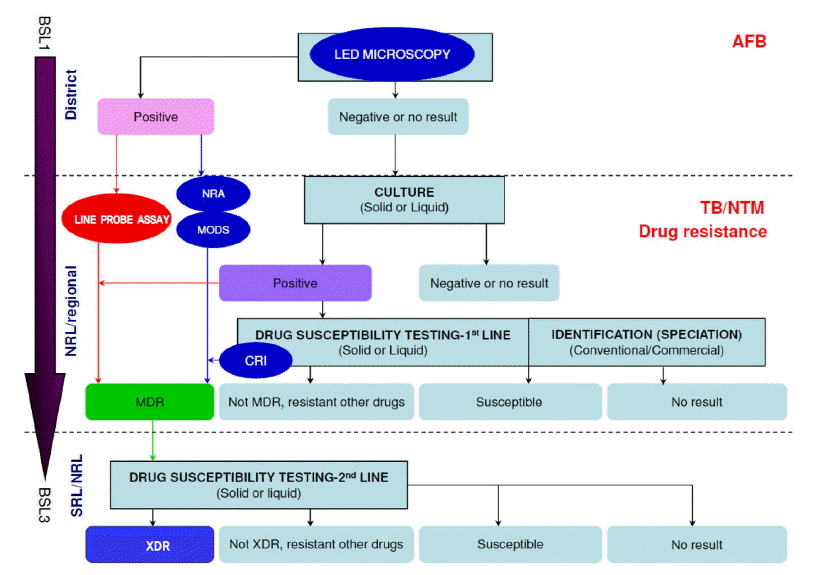
Û▓░ÝòÁýØ┤ ýØÿýï¼ÙÉÿÙèö Û▓¢ýÜ░ýùÉÙèö ÝØëÙÂÇ X-ýäá Û▓Çýé¼ÙÑ╝ ýï£ÝûëÝòÿÛ│á Û░ØÙï┤ ÙÅäÙºÉ Ù░Å Ù░░ýûæ Û▓Çýé¼ÙÑ╝ ýï£ÝûëÝòÿÛ│á, Ù░░ýûæ Û▓Çýé¼ýùÉýä£ Û▓░ÝòÁÛÀáýØ┤ ÙÅÖýáòÙÉÿýùêýØä Ùòî ÝÖòýºäÝò£Ùïñ. Ýò¡ýé░ÛÀá ÙÅäÙºÉ Û▓Çýé¼Ùèö ýáäýù╝ÙáÑýØ┤ ÙåÆýØÇ ÝÖÿý×ÉÙÑ╝ ýïáýåìÝòÿÛ▓î ýäáÙ│äÝòá ýêÿ ý×êÙïñÙèö ý×ÑýáÉýØ┤ ý×êýºÇÙºî, Ù»╝Û░ÉÙÅäÙèö Ù░░ýûæÛ│╝ Ù╣äÛÁÉ ýï£ 25-80% ýáòÙÅäÙí£ Ùé«ýØÇ ÝÄ©ýØ┤Ùïñ[1-3]. ÙÿÉÝò£ ÛÁ¡Ùé┤ýùÉýä£ÙÅä Ù╣äÛ▓░ÝòÁÝò¡ýé░ÛÀáýØÿ ÙÂäÙª¼ Ù╣êÙÅäÛ░Ç ýªØÛ░ÇÝòÿÙèö ýÂöýä©Ùí£, Û░ØÙï┤ ÙÅäÙºÉ Û▓Çýé¼ Û▓░Û│╝Ùºîý£╝Ùí£Ùèö ÝÖ£ÙÅÖýä▒ Û▓░ÝòÁý£╝Ùí£ ýºäÙï¿ÝòÿÛ©░ ÙÂêý®ÙÂäÝòÿÙïñ[4,5]. Û▓░ÝòÁ ÝÖòýºä Û▓Çýé¼ýØ© Ù░░ýûæ Û▓Çýé¼ýùÉýä£Ùèö Û▓░ÝòÁÛÀáýØ┤ ý×ÉÙØ╝Û©░Û╣îýºÇ 2-6ýú╝ ýáòÙÅä ýåîýÜöÙÉÿÛ©░ ÙòîÙ¼©ýùÉ Ýò¡ýé░ÛÀá ÙÅäÙºÉ Û▓Çýé¼ýùÉýä£ ýØîýä▒ýØ┤ Ùéÿýÿ¿ Û▓¢ýÜ░ýùÉÙèö ý×äýâüýáüý£╝Ùí£ ýºäÙï¿ýØä Ýò┤ýä£ ý╣ÿÙúî ýï£ý×æ ýù¼ÙÂÇÙÑ╝ Û▓░ýáòÝò┤ýò╝ Ýò£Ùïñ. ýÁ£ÛÀ╝ýùÉ Ýò¡ýé░ÛÀá ÙÅäÙºÉ Û▓Çýé¼Ù│┤Ùïñ ÙåÆýØÇ Ù»╝Û░ÉÙÅäÙÑ╝ Ù│┤ýØ┤Ù®┤ýä£ Û©░ýí┤ýØÿ Ù░░ýûæ Û▓Çýé¼Ù│┤Ùïñ ýïáýåìÝòÿÛ▓î Û▓░ÝòÁýØä ýºäÙï¿Ýòá ýêÿ ý×êý£╝Ù®░, ýò¢ýᣠÙé┤ýä▒ ýù¼ÙÂÇÙÑ╝ Ýò¿Û╗ÿ ÝÅëÛ░ÇÝòá ýêÿ ý×êÙèö ÙïñýûæÝò£ Û▓Çýé¼Ù▓òýØ┤ Û░£Ù░£ÙÉÿýû┤ ýºäÙï¿ýáü ý£áýÜ®ýä▒ýùÉ ÙîÇÝò£ ÝÅëÛ░ÇÛ░Ç ýØ┤Ùú¿ýû┤ýºÇÛ│á ý×êÙïñ. ýÁ£ÛÀ╝ Ù░£Ýæ£ÙÉ£ ýù¼Ùƒ¼ ýù░ÛÁ¼ Û▓░Û│╝ÙôñýØä Ù░öÝâòý£╝Ùí£ Û▓░ÝòÁýØÿ ýâêÙí£ýÜ┤ ýºäÙï¿Ù▓òýùÉ ÙîÇÝò┤ýä£ ýòîýòäÙ│┤Û│áý×É Ýò£Ùïñ(Fig. 1).
Ù│© Ùíá
Acid Fast bacilli smear microscopy
Ýò¡ýé░ÛÀá ýù╝ýâëý£╝Ùí£Ùèö carbolfuchsinýØä ýØ┤ýÜ®Ýò£ ýù╝ýâëÛ│╝ ÝÿòÛ┤æýù╝ýâëýØ┤ ý×êÙïñ. CarbolfuchsinýØä ýØ┤ýÜ®Ýò£ Û▓Çýé¼Ùèö ýÜ░Ùª¼Û░Ç ÝØöÝòÿÛ▓î ýòîÛ│á ý×êÙèö Ziehl-Neelsen (ZN) ýù╝ýâëÛ│╝ kinyoun ýù╝ýâëýØ┤ ý×êý£╝Ù®░ Û┤æÝòÖ ÝÿäÙ»©Û▓¢ýØä ýé¼ýÜ®Ýòÿýù¼ 1,000Ù░░ýØÿ Ù░░ý£¿Ùí£ Û┤Çý░░Ýò£Ùïñ. ZN ýù╝ýâë Ýøä Û┤æÝòÖ ÝÿäÙ»©Û▓¢ýùÉýä£ Û┤Çý░░ÝòÿÙèö Û▓âýØÿ Ýò£Û│äÙÑ╝ ÛÀ╣Ù│ÁÝòÿÛ©░ ý£äÝò┤ ÝÿòÛ┤æ Ù¼╝ýºê ýù╝ýâëýØ┤ ýï£ÙÅäÙÉÿýùêÙèöÙì░, ÝÿòÛ┤æýù╝ýâëýØÇ auramine OÙéÿ rhodamineýØä ýØ┤ýÜ®Ýò£ ýù╝ýâëÙ▓òý£╝Ùí£ ÝÿòÛ┤æ ÝÿäÙ»©Û▓¢ýØä ýØ┤ýÜ®Ýò┤ 250Ù░░ Ýÿ╣ýØÇ 450Ù░░ýùÉýä£ Û┤Çý░░Ýò£Ùïñ. ýù╝ýâëýùÉ ÝòäýÜöÝò£ ýï£Û░äýØ┤ ýººÛ│á ZN ýù╝ýâëýùÉ Ù╣äÝò┤ 10% ýáòÙÅä Ù»╝Û░ÉÙÅäÛ░Ç ÙåÆý£╝Ù®░, Ù│┤Ùïñ ýáÇÙ░░ý£¿ýùÉýä£ Û┤Çý░░ Û░ÇÙèÑÝòÿÙ®░, Û▓Çýé¼ý×ÉýØÿ ýùàÙ¼┤ÙƒëýØ┤ ýáüýØÇ ý×ÑýáÉýØ┤ ý×êýû┤ýä£ ýäáýºäÛÁ¡ýùÉýä£ Ýè╣Ý×ê Û▓Çýé¼ÙƒëýØ┤ ÙºÄýØÇ Û©░Û┤ÇýùÉýä£ ýé¼ýÜ®ýØä ÛÂîÛ│áÝòÿýÿÇÙïñ. ÛÀ©Ùƒ¼Ùéÿ ýºäÙï¿ýØä ý£äÝò┤ýä£ ÝÿòÛ┤æ ÝÿäÙ»©Û▓¢Û│╝ Û│áÛ░ÇýØÿ Û┤æýøÉ, ýû┤ÙæÉýÜ┤ Ù░® Ùô▒ýØ┤ ÝòäýÜöÝòÿÛ©░ ÙòîÙ¼©ýùÉ ýïñýá£Ùí£ ýäñÙ╣äÛ░Ç ý×ÿ Û░ûýÂ░ýºÇýºÇ ýòèýØÇ ÙºÄýØÇ ÛÁ¡Û░ÇÙôñýùÉýä£Ùèö ÙäÉÙª¼ ýï£ÝûëÙÉÿýºÇ Ù¬╗ÝòÿýÿÇÙïñ[6]. ýÁ£ÛÀ╝ýùÉ ÝÿòÛ┤æ ÝÿäÙ»©Û▓¢ýØÿ ý×ÑýáÉýØÇ ýºÇÙïêÙ®┤ýä£ Û┤æýøÉý£╝Ùí£ Ùìö ýáÇÙá┤ÝòÿÛ│á, ýáäÛ©░ ýåîÙ¬¿Û░Ç ýáüýØÇ Ù░£Û┤æ ÙïñýØ┤ýÿñÙô£ ÝÿäÙ»©Û▓¢ýØ┤ Û░£Ù░£ÙÉÿýû┤ Û▓░ÝòÁ ýºäÙï¿ýùÉ ýé¼ýÜ®ÙÉÿÛ│á ý×êÙïñ. Ù░£Û┤æ ÙïñýØ┤ýÿñÙô£ ÝÿäÙ»©Û▓¢ýØÇ ÝÿòÛ┤æ Ù¼╝ýºêýØä ýù╝ýâëýùÉ ýØ┤ýÜ®ÝòÿýºÇÙºî, Û┤æýøÉý£╝Ùí£Ùèö LED (light-emitting diode) Û©░ýêáýØä ýØ┤ýÜ®ÝòÿÙèö Û▓Çýé¼Ù▓òý£╝Ùí£ Û©░ýí┤ýØÿ Û┤æÝòÖ ÝÿäÙ»©Û▓¢ ÙÿÉÙèö ÝÿòÛ┤æ ÝÿäÙ»©Û▓¢ýùÉ Ù╣äÝò┤ ÙåÆýØÇ Ù»╝Û░ÉÙÅäÙÑ╝ Ù│┤ýØ┤Ù®┤ýä£ ÙÅÖÙô▒Ýò£ Ýè╣ýØ┤ÙÅäÙÑ╝ Ù│┤ý×äýØ┤ ýòîÙáñýíîÙïñ[7-9]. ýØ┤ÙÑ╝ Ù░öÝâòý£╝Ùí£ 2010ÙàäÙÂÇÝä░ WHOýùÉýä£Ùèö ÝÿòÛ┤æ ÝÿäÙ»©Û▓¢ÙîÇýïá Ù░£Û┤æ ÙïñýØ┤ýÿñÙô£ ÝÿäÙ»©Û▓¢ýØä ýé¼ýÜ®Ýòá Û▓âýØä ÛÂîÛ│áÝòÿÛ│á ý×êýºÇÙºî, ýòäýºü ZN Û▓Çýé¼ÙÑ╝ ÙîÇý▓┤ÝòÿýºÇÙèö Ù¬╗Ýò£Ùïñ[10]. ýòäýºü ÛÁ¡Ùé┤ýØÿ Û▓░ÝòÁ ýºäÙúîýºÇý╣¿ýùÉýä£Ùèö ýØ┤Ùƒ¼Ýò£ ýâêÙí£ýÜ┤ ÝÿäÙ»©Û▓¢ ýé¼ýÜ®ýùÉ ÙîÇÝò£ ýû©Û©ëýØ┤ ýùåÙèö ýïñýáòýØ┤Ùïñ[11].
Ýò¡ýé░ÛÀá Ù░░ýûæ Û▓Çýé¼
Ýò¡ýé░ÛÀá Ù░░ýûæ Û▓Çýé¼Ùèö Û▓░ÝòÁýØä ÝÖòýºäÝòá ýêÿ ý×êÙèö Û▓Çýé¼ýØ┤Ùïñ. Ù░░ýûæ Û▓Çýé¼ýùÉ ýé¼ýÜ®ÙÉÿÙèö Ù░░ýºÇýØÿ ýóàÙÑÿÙèö Ýü¼Û▓î Û│áý▓┤Ù░░ýºÇýÖÇ ýòíý▓┤Ù░░ýºÇÙí£ ÙéÿÙêî ýêÿ ý×êÙèöÙì░, Û│áý▓┤Ù░░ýºÇÙèö Û│äÙ×Ç ýä▒ÙÂäýØÿ Ù░░ýºÇýØ© L├Âwenstein-Jensen Ù░░ýºÇÛ░Ç Ýæ£ýñÇÙ░░ýºÇýØ┤Ù®░, Ýò£ý▓£ Û│áý▓┤Ù░░ýºÇýØ© Middlebrook 7H10/11ýØ┤ ý×êÙïñ. Û│áý▓┤Ù░░ýºÇÙèö ýÿñÙ×ÿ ýáäÙÂÇÝä░ ýé¼ýÜ®ÙÉÿýû┤ ýÿ¿ Ù░®Ù▓òý£╝Ùí£ ýòêýáòýáüýØ┤ýºÇÙºî, Ù░░ýûæ ýù¼ÙÂÇÙÑ╝ ÝÖòýØ©ÝòÿÙèöÙì░ 3-8ýú╝ýØÿ ýï£Û░äýØ┤ ýåîýÜöÙÉÿÙèö Ýò£Û│äÛ░Ç ý×êýùêÙïñ. ýÁ£ÛÀ╝ ýòíý▓┤Ù░░ýºÇýØÿ Û░£Ù░£Ùí£ Ù░░ýûæ ýûæýä▒ Ù│┤Û│áýùÉ ýåîÙ¬¿ÙÉÿÙèö ýï£Û░äýØä ýñäýØ╝ ýêÿ ý×êÛ▓î ÙÉÿýùêÙèöÙì░, Û©░ýí┤ ýòíý▓┤Ù░░ýºÇ(Middlebrook 7H12)Ù┐ÉÙºî ýòäÙïêÙØ╝ ÙïñýûæÝò£ ý×ÉÙÅÖÝÖöÙÉ£ ýòíý▓┤Ù░░ýºÇ(BACTEC460, MGIT, Septi-Check, Myco-ESP culture System II, BacT/ALERT MB Susceptibility Kit)ÙôñýØ┤ Û░£Ù░£ÙÉÿýùêÙïñ. ýØ┤Ùôñ ýòíý▓┤Ù░░ýºÇýØÿ Û▓¢ýÜ░, ÙÅäÙºÉ ýûæýä▒ýØ© Û▓¢ýÜ░ 2ýú╝, ÙÅäÙºÉ ýØîýä▒ýØ© Û▓Çý▓┤ýØÿ Û▓¢ýÜ░ ýò¢ 3ýú╝Ù®┤ Ù░░ýûæ ýûæýä▒ýØ┤ Ù│┤Û│áÙÉ£Ùïñ[12,13]. ýòíý▓┤Ù░░ýºÇÙèö Ù╣äýï©Û│á, ýä©ÛÀáýØ┤Ùéÿ Ù╣äÛ▓░ÝòÁÝò¡ýé░ÛÀáýùÉ ýØÿÝò£ ÛÁÉý░¿Û░Éýù╝ýØÿ Ù╣äý£¿ýØ┤ ÙåÆýØÇ Ùï¿ýáÉýØ┤ ý×êÛ©┤ ÝòÿýºÇÙºî, Ù╣áÙÑ© Û▓░Û│╝Ù│┤Û│áýÖÇ ÙåÆýØÇ ýûæýä▒ÙÑá ÙòîÙ¼©ýùÉ ÛÁ¡Ùé┤ ýù¼Ùƒ¼ Û©░Û┤ÇýùÉýä£ÙÅä ÙäÉÙª¼ ÙÅäý×àÙÉÿÛ│á ý×êý£╝Ù®░, 2011Ùàä Û▓░ÝòÁ ýºäÙúîýºÇý╣¿ýùÉÙÅä Û│áý▓┤Ù░░ýºÇýÖÇ ýòíý▓┤Ù░░ýºÇýùÉ Û░üÛ░ü ýáæýóàÝòá Û▓âýØä ÛÂîÛ│áÝòÿÛ│á ý×êÙïñ[11]. ÙïñýûæÝò£ ýóàÙÑÿýØÿ ý×ÉÙÅÖÝÖöÙÉ£ ýòíýá£Ù░░ýºÇÙèö Û▓░ÝòÁýØÿ ýºäÙï¿Ù┐É ýòäÙïêÙØ╝ ýò¢ýᣠÙé┤ýä▒ Û▓░ÝòÁýØÿ ýïáýåìÝò£ ýºäÙï¿ýùÉÙÅä ýØ┤ýÜ®ÙÉÿÛ│á ý×êÙïñ.
Mycobacteria growth indicator tube (MGIT)
MGIT systemýØÇ Ù│ÇÝÿòÙÉ£ ýòíý▓┤Ù░░ýºÇýØ© Middlebrook 7H9 brothÛ░Ç Ùôñýû┤ý×êÙèö ý£áÙª¼ Ýè£Ù©îÙí£ýä£ Ù░öÙïÑýùÉ ÝÿòÛ┤æÙ¼╝ýºêýØä Ù¼╗ýØÇ ýïñÙª¼ý¢ÿýØ┤ ý×êÙïñ. ÝÿòÛ┤æÙ¼╝ýºêýØÇ ýé░ýåîýùÉ Ù»╝Û░ÉÝòÿýù¼ ý▓ÿýØîýùÉÙèö Ù░░ýºÇ Ùé┤ýØÿ ÝÆìÙÂÇÝò£ ýé░ýåîýùÉ ýØÿÝò┤ Ù░£Û┤æýØ┤ ýûÁýá£ÙÉÿýû┤ ý×êÙïñÛ░Ç Û░ØÙï┤ýØä ýáæýóàÝûêýØä Ùòî Û▓░ÝòÁÛÀáýØ┤ ý×ÉÙØ╝Ùéÿ ýé░ýåîÙÑ╝ ýåîÙ¬¿Ýòá Û▓¢ýÜ░ ÝÿòÛ┤æÙ¼╝ýºêýØ┤ Ù░£Û┤æÝòÿýù¼ UV Ù׿ÝöäÝòÿýùÉýä£ ýÿñÙáîýºÇýâëý£╝Ùí£ Ù│┤ýØ┤ÙÅäÙíØ Û│áýòêÙÉÿýùêý£╝Ù®░, ýÁ£ÛÀ╝ýùÉÙèö ýáä ý×ÉÙÅÖÝÖöÙÉ£ ýï£ýèñÝà£ýØ© BACTEC MGIT 960ýØ┤ Û░£Ù░£ÙÉÿýùêÙïñ.
ýò¢ýᣠÙé┤ýä▒ ýù¼ÙÂÇÙÑ╝ ýºäÙï¿ÝòÿÙèö Ùì░ýùÉÙÅä ýé¼ýÜ®Ýòá ýêÿ ý×êÙèöÙì░, ýØ┤Ùèö Ù░░ýûæÙÉ£ Û▓░ÝòÁÛÀáýØä ýò¢ýá£Û░Ç Ùôñýû┤ý×êÙèö Ù░░ýºÇýùÉ ýáæýóàÝò£ Ýøä ýâëÛ╣öýØÿ Ù│ÇÝÖöÙÑ╝ ÝÖòýØ©Ýò£Ùïñ. ýÁ£ÛÀ╝ Ù®öÝâÇÙÂäýäØýùÉ ýØÿÝòÿÙ®┤ Ýò¡Û▓░ÝòÁýò¢ýᣠýØ╝ý░¿ ýò¢ýá£ýùÉ ÙîÇÝò┤ýä£ BACTEC MGIT 960 systemýØÿ ýáòÝÖòÙÅäýÖÇ ýÿêý©íÙÅäÛ░Ç Ù¬¿ÙæÉ ýÜ░ýêÿÝòÿýÿÇÙïñ[14-16]. Ùé┤ýä▒ Û▓Çýé¼ÙÑ╝ ýû╗ýØä ÙòîÛ╣îýºÇ Û▒©Ùª¼Ùèö ýï£Û░äýØÇ ýººÛ▓îÙèö 5-8.2ýØ╝ ýáòÙÅäýØ┤Ùïñ.
Microscopic observation drug susceptibility (MODS) assay
MODSÙèö Û▓░ÝòÁÛÀáýØ┤ Û│áý▓┤Ù░░ýºÇÙ│┤Ùïñ ýòíý▓┤Ù░░ýºÇýùÉýä£ Ù╣áÙÑ┤Û▓î ý×ÉÙØ╝Ù®░, Ýè╣ýºòýáüý£╝Ùí£ Ýÿòýä▒ÝòÿÙèö cord Ù¬¿ýûæýØä ýòíý▓┤Ù░░ýºÇýùÉýä£ ýí░Û©░ýùÉ ÝÿäÙ»©Û▓¢ýáüý£╝Ùí£ Û┤Çý░░ Û░ÇÙèÑÝò£ ýáÉýØä Û▓░ÝòÁ ýºäÙï¿ Ù░Å ýò¢ýá£Ùé┤ýä▒Û▓░ÝòÁýØÿ ýºäÙï¿ýùÉ ýØ┤ýÜ®ÝòÿÙèö Û▓Çýé¼Ù▓òýØ┤Ùïñ[17]. Middlebrook 7H9 ýòíý▓┤Ù░░ýºÇ, ýä▒ý×Ñ Ù│┤ý®ýá£, ýÿñýù╝ ÛÀáýØÿ Û│╝ýä▒ý×ÑýØä ÙºëÛ©░ ý£äÝò£ Û░üýóà Ýò¡ÛÀáýá£Û░Ç ý▒äýøîýºä 24 well plateýùÉ Û▓Çý▓┤ÙÑ╝ ÙäúÛ│á, ýÿñýù╝ÙÉÿýºÇ ýòèÙÅäÙíØ Ù┤ëÝò£ ÙÆñ ÙºñýØ╝ inverted light microscopyÙÑ╝ ýØ┤ýÜ®Ýòÿýù¼ Û▓░ÝòÁÛÀáýØÿ Ýè╣ýºòýáüýØ© Ù¬¿ýûæýØ© cordÛ░Ç Ýÿòýä▒ýØ┤ ÙÉÿýùêÙèöýºÇ ÝÖòýØ©Ýòÿýù¼ Û▓░ÝòÁÛÀáýØä ýí░Û©░ýùÉ ýºäÙï¿Ýò£Ùïñ. ÛÀá Ù░░ýûæÛ╣îýºÇ ýåîýÜöÙÉÿÙèö ýï£Û░äÙÅä ýò¢ 7ýØ╝ ýáòÙÅäýùÉ ÙÂêÛ│╝ÝòÿÙ®░, 24Û░£ýØÿ well ýñæ ýØ╝ÙÂÇýùÉ ÙïñýûæÝò£ ÙåìÙÅäýØÿ Ýò¡Û▓░ÝòÁýò¢ýá£ÙÑ╝ ÙäúýØÇ ÙÆñ Û▓Çý▓┤ÙÑ╝ ýáæýóàÝòÿýù¼, isoniazidýÖÇ rifampinýùÉ ÙîÇÝò£ Ùé┤ýä▒ Û▓Çýé¼ÙÑ╝ Ù╣áÙÑ┤Û▓î ýï£ÝûëÝòá ýêÿ ý×êÙïñÙèö ý×ÑýáÉýØ┤ ý×êÙïñ. Û░ÇÛ▓®ýØ┤ Ù╣äýï©ýºÇ ýòèÛ│á, Û░äÝÄ©ÝòÿÙïñÙèö ý×ÑýáÉýØ┤ ý×êý£╝Ùéÿ ÙºñýØ╝ ýºüýáæ Û┤Çý░░Ýò┤ýò╝ ÝòÿÛ│á ýêÖÙá¿ÙÉ£ ýØ©ÙáÑýØ┤ ÝòäýÜöÝòÿÙ®░, biosafety Level 3 ýØ┤ýâüýØÿ ýïñÝùÿýïñýØ┤ Û░ûýÂ░ýá©ýò╝ ÝòÿÛ©░ ÙòîÙ¼©ýùÉ ýØ┤Ù»© Û▓░ÝòÁ ýºäÙï¿ýùÉ ÝòäýÜöÝò£ ýÜöÛ▒┤ÙôñýØä Û░ûýÂÿ Ù╣äÛÁÉýáü Ýü░ Û▓Çýé¼ýïñýØ┤ ýáüÙï╣ÝòÿÙ®░, ýØ┤ ÙòîÙ¼©ýùÉ ýòäýºü Ù░®Ù▓òýáüý£╝Ùí£ Ýæ£ýñÇÝÖöÙÉÿýºÇ Ù¬╗ÝòÿýÿÇÙïñ. ÛÀá Ù░░ýûæ Ù»╝Û░ÉÙÅäÙèö 87.4-97.8% ýØ┤Û│á[18] isoniazid Ùé┤ýä▒ýùÉ ÙîÇÝò£ Ù»╝Û░ÉÙÅäÙèö 90.3% , Ýè╣ýØ┤ÙÅäÙèö 98.6% , rifampin Ùé┤ýä▒ýùÉ ÙîÇÝò£ Ù»╝Û░ÉÙÅäÙèö 98% , Ýè╣ýØ┤ÙÅäÙèö 99.4% ýÿÇÙïñ[17,19].
Nitrate reductase assay (NRA)
Û│áý▓┤Ù░░ýºÇÙÑ╝ ýé¼ýÜ®Ýò£ Û▓Çýé¼Ù▓òý£╝Ùí£ Û▓░ÝòÁÛÀáýØ┤ nitrateÙÑ╝ nitriteÙí£ ÝÖÿýøÉýï£ÝéñÙèö Û▓âýùÉ Ù░öÝâòýØä Ùæö Û▓Çýé¼Ùí£, LJ Ù░░ýºÇýùÉ nitrateÙÑ╝ ÙäúýØÇ ÙÆñ, Û▓░ÝòÁÛÀáýØ┤ ý×ÉÙ×ä Û▓¢ýÜ░ Griess Ù░ÿýØæýùÉ ýØÿÝò┤ Ù░░ýºÇýØÿ ýâëýØ┤ ÙÂëýØÇ Ù╣øý£╝Ùí£ Ù│ÇÝòÿÙèö Û▓âý£╝Ùí£ ýºäÙï¿Ýò£Ùïñ. ýò¢ýᣠÙé┤ýä▒ýØä ÝÅëÛ░ÇÝòÿÙèö Ùì░ýùÉÙÅä ýé¼ýÜ®ÙÉá ýêÿ ý×êÙèöÙì░ Ýò¡ÛÀáýᣠý▓ÿÙª¼Ýò£ ÙÆñ Û▓░ÝòÁÛÀáýØä ýáæýóàÝò£ ÙÆñ, ýáæýóàÝò£ýºÇ 10ýØ╝ýº© ÙÉÿÙèö Ùéá nirateÙÑ╝ ÝÖÿýøÉýï£ÝéñÙèö ÙèÑÙáÑýØä ý©íýáòÝò£Ùïñ. Ùé┤ýä▒ÛÀáýú╝Ùèö nitrateÙÑ╝ nitriteÙí£ ÝÖÿýøÉýï£ý╝£ Ù░░ýºÇýØÿ ýâëýØ┤ pink-red colorÙí£ Ù│ÇÝòÿÙ®░, Û░Éýêÿýä▒ ý×êÙèö ÛÀáýØ┤ ý×ÉÙ×Ç Ù░░ýºÇÙèö Ù¼┤ýâëý£╝Ùí£ Ùé¿ÙèöÙïñ. NRAÙèö rifampin Ùé┤ýä▒ýùÉ ÙîÇÝò£ Ù»╝Û░ÉÙÅäýÖÇ Ýè╣ýØ┤ÙÅäÛ░Ç Û░üÛ░ü 99% , 100% , isoniazidýùÉ ÙîÇÝò£ Ù»╝Û░ÉÙÅäýÖÇ Ýè╣ýØ┤ÙÅäÙèö 94% , 100% ýØ╝ ýáòÙÅäÙí£ ÙºñýÜ░ ýÜ░ýêÿÝòÿÙïñ[20,21]. Û▓Çýé¼Û░Ç ýë¢Û│á ýáÇÙá┤ÝòÿÙ®░ ýêÖÙï¼ÙÉ£ ýØ©ÙáÑýØ┤Ùéÿ Û│áÛ©ëý×ÑÙ╣äÛ░Ç ÝòäýÜö ýùåÙèö Ùô▒ Ùº╣ ý£áýÜ®ÝòÿÙ®░ ý×ÑýáÉýØ┤ ÙºÄý£╝Ùéÿ ýòäýºüÛ╣îýºÇÙèö Ù░░ýûæÙÉ£ Û▓░ÝòÁÛÀáýØÿ 1ý░¿ ýò¢ýᣠÙé┤ýä▒ Û▓Çýé¼ýùÉÙºî ýØ┤ýÜ®ÙÉÿÛ│á ý×êý£╝Ù®░ ýù░ÛÁ¼Û░Ç Ùìö ÝòäýÜöÝòÿÙïñ.
Û▓░ÝòÁÛÀá ÝòÁýé░ ýªØÝÅ¡ Û▓Çýé¼(nucleic acid amplification, NAA testing)
Û▓░ÝòÁÛÀá ÝòÁýé░ ýªØÝÅ¡Û▓Çýé¼Ùèö Û▓░ÝòÁÛÀáýùÉÙºî Ýè╣ýØ┤ÝòÿÛ▓î ýí┤ý×¼ÝòÿÙèö DNAÙéÿ RNAÙÑ╝ ýñæÝò®ÝÜ¿ýåîýù░ýçäÙ░ÿýØæ(polymerase chain reaction, PCR)ýØä ýØ┤ýÜ®Ýòÿýù¼ ý©íýáòÝòÿÙèö Û▓âý£╝Ùí£ 24-48ýï£Û░ä Ùé┤ýùÉ Û▓░Û│╝ÙÑ╝ ýòî ýêÿ ý×êÙïñ. ýØ╝Ù░ÿýáüý£╝Ùí£ ÙºñýÜ░ ÙåÆýØÇ Ýè╣ýØ┤ÙÅäÙÑ╝ Û░ÇýºÇÛ│á ý×êý£╝Ùéÿ ýâüÙîÇýáüý£╝Ùí£ Ùé«ýØÇ Ù»╝Û░ÉÙÅäÙÑ╝ Û░ÇýºÇÛ│á ý×êÙèöÙì░ Ýò¡ýé░ÛÀá ÙÅäÙºÉ Û▓Çýé¼ýÖÇ Ù╣äÛÁÉÝòÿýÿÇýØä Ùòî Ù╣äÛ▓░ÝòÁÝò¡ýé░ÛÀáýØ┤ ÝØöÝò£ ÝÖÿÛ▓¢ýùÉýä£ ÙÅäÙºÉ ýûæýä▒ Û▓Çý▓┤ýùÉýä£Ùèö ÙåÆýØÇ ýûæýä▒ ýÿêý©íÙÑá(> 95% )ýØä Ù│┤ýØ┤Ùéÿ, ÙÅäÙºÉ ýØîýä▒ Ù░░ýûæ ýûæýä▒ýØ© Û▓Çý▓┤ýØÿ Û▓¢ýÜ░ 50-80% ýùÉýä£ ýûæýä▒ÙÑáýØä Ù│┤ýØ©Ùïñ. Amplified mycobacterium tuberculosis direct (MTD) test (Gen- Probe, San diego, CA)ýÖÇ Amplicor M. tuberculosis test (Roche Diagnostics, Basel, Switzerland) Ùô▒ýØ┤ ý×äýâüýáüý£╝Ùí£ Û▓░ÝòÁýØ┤ ýØÿýï¼ÙÉÿÙèö ÝÖÿý×ÉýØÿ ÙÅäÙºÉ ýûæýä▒ Ýÿ©ÝØíÛ©░Û│ä Û▓Çý▓┤ýùÉýä£ ýé¼ýÜ®ýØ┤ FDAýùÉýä£ Û│ÁýØ©ÙÉÿýùêý£╝Ù®░, ýØ┤ýÖ©ýùÉÙÅä In- house PCR method Ùô▒ ÙïñýûæÝò£ ÝÿòÝâ£ýØÿ NAA assayÛ░Ç Û▓░ÝòÁ ýºäÙï¿ýùÉ ýØ┤ýÜ®ÙÉÿÛ│á ý×êÙïñ. CDCÙèö Û▓░ÝòÁýØ┤ ýØÿýï¼ÙÉÿýºÇÙºî ÝÖòýºäÙÉÿýºÇ ýòèýØÇ ÝÖÿý×ÉýùÉýä£ Ýÿ©ÝØíÛ©░Û│ä Û▓Çý▓┤ýùÉýä£ NAAÙÑ╝ ýï£ÝûëÝòá Û▓âýØä ýÂöý▓£ÝòÿÛ│á ý×êý£╝Ù®░[22], Û░£ýáòÙÉ£ ÛÁ¡Ùé┤ Û▓░ÝòÁýºÇý╣¿ýùÉýä£ÙÅä Û▓░ÝòÁÛÀá ÝòÁýé░ ýªØÝÅ¡Û▓Çýé¼ÙÑ╝ 1) ÝÅÉÛ▓░ÝòÁýØ┤ ýØÿýï¼ÙÉÿÙéÿ ÙÅäÙºÉ Û▓Çýé¼Û░Ç ýØîýä▒ýØ╝ Ùòî Ýÿ╣ýØÇ 2) Ýò¡ýé░ÛÀá ÙÅäÙºÉ Û▓Çýé¼Û░Ç ýûæýä▒ýØ┤ýºÇÙºî Ù╣äÛ▓░ÝòÁ Ýò¡ýé░ÛÀáýØÿ Û░ÇÙèÑýä▒ýØ┤ ý×êýØä Ùòî ýïñýï£Ýòá Û▓âýØä ýÂöý▓£ÝòÿýÿÇÛ│á, 3) ÝÅÉýÖ©Û▓░ÝòÁýØ© Û▓¢ýÜ░ýùÉÙÅä ÙÅäýøÇýØ┤ ÙÉ£ÙïñÛ│á Û©░ýêáÝòÿýÿÇÙïñ. ýÁ£ÛÀ╝ýùÉÙèö ýØ┤Ùƒ¼Ýò£ ÙÂäý×ÉÝòÖýáü Û©░ýêáýØÿ Ù░£Ùï¼Ùí£ ýºäÙï¿Û│╝ ýò¢ýᣠÛ░Éýêÿýä▒ Û▓Çýé¼ÙÑ╝ ÙÅÖýï£ýùÉ ýï£ÝûëÝòÿÛ▓î ÙÉÿýùêÙïñ.
Line probe assay (LPA)
Reverse hybridization Û▓Çýé¼Ùí£ýä£ Û▓░ÝòÁÛÀá ÙÿÉÙèö Û▓Çý▓┤ýùÉýä£ ýºüýáæ DNAÙÑ╝ ýÂöý£Ýòÿýù¼ ýØ┤ÙÑ╝ PCRÙí£ ýªØÝÅ¡Ýòÿýù¼ oligonucleotide probeÙÑ╝ ýØ┤ýÜ®Ýòÿýù¼ labelingýØä Ýòÿýù¼ stripýùÉ ÙéÿÝâÇÙéÿÙèö ýâëÛ╣öýØÿ Ù│ÇÝÖöÙÑ╝ ÝÖòýØ©ÝòÿÙèö Û▓Çýé¼Ù▓òý£╝Ùí£ Û▓░ÝòÁýØÿ ýºäÙï¿Û│╝ ýò¢ýᣠÙé┤ýä▒ ýù¼ÙÂÇÙÑ╝ ÝÖòýØ©ÝòÿÙèöÙì░ ýé¼ýÜ®Ýò£Ùïñ[18]. ýÁ£ý┤êÙí£ ýé¼ýÜ®ÙÉ£ LPAÙèö INNO-LiPA Rif TB (Innogenetics NV)ýÿÇý£╝Ù®░, 2005ÙàäýùÉ Ù░£Ýæ£ÙÉ£ Ù®öÝâÇÙÂäýäØ Û▓░Û│╝ýùÉ Ùö░ÙÑ┤Ù®┤ Û▓░ÝòÁýØÿ ýºäÙï¿ýùÉ Ù»╝Û░ÉÙÅäÙèö 95% ýØ┤ýâü, Ýè╣ýØ┤ÙÅäÙèö 100% ýÿÇý£╝Ù®░, ý×äýâü Û▓Çý▓┤ýùÉýä£Ùèö Ù»╝Û░ÉÙÅäÛ░Ç 80-100% Û╣îýºÇ ÙïñýûæÝòÿÛ▓î Ù│┤Û│áÙÉ£ Ù░ö ý×êÙïñ[23]. GenoType MTBDR (Hain Lifescience)Û░Ç ÙæÉÙ▓êýº© Û░£Ù░£ÙÉ£ LPAýÿÇÙèöÙì░, rifampin Ù░Å isoniazid Ùé┤ýä▒ýØä ýºäÙï¿ÝòÿÙèöÙì░ Ùºîýí▒ÙÅäÛ░Ç Ùé«ýòä, Ùìö ÙºÄýØÇ rpoB, inhA mutationýØä ý░¥ýòäÙé┤Ùèö GenoType MTBDR plusÙí£ Ù│┤ýÖäÙÉÿýùêý£╝Ù®░, isoniazid Ùé┤ýä▒ ýºäÙï¿ýùÉ Ùìö ÙåÆýØÇ Ù»╝Û░ÉÙÅäÙÑ╝ Ù│┤ý×äýØ┤ ýªØÙ¬àÙÉÿýùêÙïñ[24,25]. ÙÿÉÝò£ ýÁ£ÛÀ╝ýùÉÙèö fluoroquinolone, ethambutol, kanamycin, amikacin Ùô▒ýùÉ ÙîÇÝò£ Ùé┤ýä▒ýØä ýºäÙï¿ÝòÿÙèö Û▓Çýé¼ýØ© GenoType MTBDRslýØ┤ Û░£Ù░£ÙÉÿýû┤ 2ý░¿ ýò¢ýá£ýùÉ ÙîÇÝò£ Ùé┤ýä▒ ýºäÙï¿ýùÉ Û│áÙ¼┤ýáüýØ© Û▓░Û│╝ÙÑ╝ Ù│┤ýù¼ýú╝Û│á ý×êÙïñ[26]. Ýÿäý×¼Û╣îýºÇ ýù¼Ùƒ¼ ýù░ÛÁ¼ Û▓░Û│╝ÙÑ╝ ÝåáÙîÇÙí£ Ýòá Ùòî ÙÅäÙºÉ ýØîýä▒ Û▓Çý▓┤ýùÉýä£Ùèö ýºäÙï¿ýùÉ ýá£Ýò£ýØ┤ ý×êÛ│á, rifampin Ùé┤ýä▒ýØä ÝÖòýØ©ÝòÿÙèö Ùì░Ùèö ý£áýÜ®ÝòÿÙéÿ INH Ùé┤ýä▒ýùÉ ÙîÇÝò┤ýä£Ùèö ýºäÙï¿ýØÿ Ù│ÇÝÖöÝÅ¡ýØ┤ ý╗ñýä£ LPAÙèö rifampin Ùé┤ýä▒ýùÉ ÙîÇÝò£ Û▓Çýé¼Ùí£ ýÂöý▓£ÙÉ£Ùïñ.
Xpert MTB/RIF (cepheid)
ý×ÉÙÅÖÝÖöÙÉ£ ÙÂäý×ÉÝòÖýáü Û▓Çýé¼Ùí£ ÝöîÙØ╝ýèñÝï▒ ý╣┤Ýè©Ùª¼ýºÇ Ùé┤ýùÉ ýä©Ýż ýÜ®Ýò┤, ÝòÁýé░ ýÂöý£ Ù░Å ýªØÝÅ¡, ýªØÝÅ¡ ÝâÉýºÇýùÉ ÝòäýÜöÝò£ Ù¬¿Ùôá Ù░ÿýØæ ýÜ®ýá£Û░Ç Ùôñýû┤ý×êýû┤ Û░ØÙï┤ýØä ýáä ý▓ÿý╣ÿÝòÿýù¼ MTB/RIF ý╣┤Ýè©Ùª¼ýºÇýùÉ ÙäúÛ│á ýØ┤ÙÑ╝ GeneXpert Û©░Û©░ýùÉ ÙäúÛ©░Ùºî ÝòÿÙ®┤ ý×ÉÙÅÖýáüý£╝Ùí£ PCRýØä ýïñÝûëýï£ý╝£ Û▓░ÝòÁÛÀá ÝÖòýØ©Û│╝ rifampin Ùé┤ýä▒ ýù¼ÙÂÇÙÑ╝ 2ýï£Û░ä Ùé┤ýùÉ ýòî ýêÿ ý×êÛ▓î ÙÉ£Ùïñ[27]. ÙÅäÙºÉ ýûæýä▒ ÝÖÿý×ÉýùÉýä£Ùèö 98.2-100% Ù»╝Û░ÉÙÅäÙÑ╝ ÙÅäÙºÉ ýØîýä▒/Ù░░ýûæ ýûæýä▒ ÝÖÿý×ÉýùÉýä£Ùèö 71.7-72.5% ýØÿ Ù»╝Û░ÉÙÅäÙÑ╝ Ù│┤ýÿÇÙïñ. 2Ù▓êýº© Û░ØÙï┤ý£╝Ùí£ 12.6% , ýä© Ù▓êýº© Û░ØÙï┤ý£╝Ùí£Ùèö 5.1% ýØÿ Ù»╝Û░ÉÙÅäÙÑ╝ ýªØÛ░Çýï£Ýé¼ ýêÿ ý×êýû┤ 3Û░£ýØÿ Û░ØÙï┤ Û▓Çý▓┤ÙÑ╝ ýØ┤ýÜ®ÝòÿÙèö Û▓¢ýÜ░ýùÉÙèö 90.2% ýØÿ Ù»╝Û░ÉÙÅäÙÑ╝ ÙéÿÝâÇÙé┤Ù®░, Ýè╣ýØ┤ÙÅäÙèö 99.2% ýùÉ ýØ┤ÙÑ©Ùïñ. Rifampin Ùé┤ýä▒ýùÉ ÙîÇÝò£ Ù»╝Û░ÉÙÅä, Ýè╣ýØ┤ÙÅäÙèö Û░üÛ░ü 97.6% , 100% Ùí£ ÙåÆýòÿý£╝Ùéÿ Û░ÇÛ▓®ýØ┤ Ù╣äýï©Û│á, isoniazid Ùé┤ýä▒ýØä ÝÖòýØ©Ýòá ýêÿ ýùåÙïñÙèö Ùï¿ýáÉýØ┤ ý×êÙïñ[27]. 2011Ùàä WHOÙèö MDR TB Û┤ÇÙª¼ÙÑ╝ ý£äÝò┤ýä£ ýáüÛÀ╣ýáüý£╝Ùí£ ýé¼ýÜ®Ýòá Û▓âýØä ÛÂîÛ│áÝòÿÛ│á ý×êÙïñ.
ýØ©Ýä░ÝÄÿÙíá Û░ÉÙºê ÙÂäÙ╣äÙèÑ Û▓Çýé¼
Û│╝Û▒░ Û▓░ÝòÁÛÀáýùÉ Û░Éý×æÙÉ£ T Ùª╝ÝöäÛÁ¼ýùÉ Û▓░ÝòÁÛÀá Ýè╣ýØ┤ Ýò¡ýøÉýØä ý×ÉÛÀ╣Ýòÿýù¼ ÙÂäÙ╣äÙÉÿÙèö ýØ©Ýä░ÝÄÿÙíáÛ░ÉÙºêÙÑ╝ ý©íýáòÝòÿÙèö Û▓Çýé¼Ùí£ Ýÿäý×¼ ýé¼ýÜ®ÙÉÿÛ│á ý×êÙèö Û▓Çýé¼Ù▓òýØÇ Quantiferon-TB Gold In-Tube┬« (Cellestis)ýÖÇ T-SPOT.TB┬« (oxford immunotec)Û░Ç ý×êÙïñ. Quantiferon-TB Gold In-Tube┬« Ù░®Ù▓òýØÇ ÝÖÿý×ÉýØÿ ÙºÉý┤êÝÿêýòíýØä ý▒äýÀ¿Ýò┤ýä£ Û▓░ÝòÁÛÀáÝò¡ýøÉ(ESAT-6, CFP-10, TB7.7)ýØ┤ Ùôñýû┤ ý×êÙèö Ýè£Ù©î, ýØîýä▒ÙîÇýí░Ýè£Ù©î(Nil), ýûæýä▒ÙîÇýí░Ýè£Ù©î(Mitogen)ýùÉ Û░üÛ░ü ý▓¿Û░ÇÝòÿýù¼ 16-24ýï£Û░ä ÙÅÖýòê ý×ÉÛÀ╣Ýòÿýù¼ ÙÂäÙ╣äÙÉ£ ýØ©Ýä░ÝÄÿÙíáÛ░ÉÙºêÙÑ╝ ELISAÙÑ╝ ÝåÁÝòÿýù¼ ý©íýáòÝò£Ùïñ. T-SPOT.TB┬«ýØÿ Û▓¢ýÜ░ýùÉÙèö ý▒äýÀ¿Ýò£ ýáäÝÿêýùÉýä£ ÙºÉý┤ê Ùï¿ÝòÁÛÁ¼ÙÑ╝ ýÂöý£Ýòÿýù¼ ESAT-6ýÖÇ CFP-10 Ýò¡ýøÉý£╝Ùí£ ý×ÉÛÀ╣Ýò£ Ýøä ELISPOT Ù░®Ù▓òý£╝Ùí£ spotýØÿ ýê½ý×ÉÙÑ╝ ýä©ýû┤ýä£ ýºäÙï¿Ýò£Ùïñ. Û▓░ÝòÁ Û░Éýù╝ ýù¼ÙÂÇÙÑ╝ ýºäÙï¿ÝòÿÙèö Û▓âý£╝Ùí£, Û▓░ÝòÁ Û░Éýù╝ÙÑáýØ┤ 1% Ù»©ÙºîýØ© ÛÁ¡Û░ÇýùÉýä£Ùèö ý×äýâüýáüý£╝Ùí£ Û▓░ÝòÁýØ┤ ýØÿýï¼ÙÉÿýû┤ ýï£ÝûëÝò£ Û▓¢ýÜ░ ýûæýä▒ýØ╝ Û▓¢ýÜ░ Û▓░ÝòÁ Û░ÇÙèÑýä▒ýØ┤ ÙåÆýºÇÙºî, ýÜ░Ùª¼ÙéÿÙØ╝ýÖÇ Û░ÖýØ┤ Û▓░ÝòÁ Û░Éýù╝ÙÑáýØ┤ ÙåÆýØÇ ÛÁ¡Û░ÇýùÉýä£Ùèö ÝÖ£ÙÅÖýä▒ Û▓░ÝòÁýØÿ ýºäÙï¿ýùÉ ÙîÇÝò£ ý£áýÜ®ýä▒ýØÇ Ùû¿ýû┤ýºäÙïñ.
Û▓░ Ùíá
ýÁ£ÛÀ╝ Û░£Ù░£ÙÉ£ ýù¼Ùƒ¼ ÙÂäý×ÉÝòÖýáü ÙÿÉÙèö Ù╣äÙÂäý×ÉÝòÖýáü Û▓Çýé¼ÙôñýØä ÝåÁÝò┤ Û▓░ÝòÁýØä ýóÇÙìö ýïáýåìÝòÿÛ│á Û░äÙï¿ÝòÿÛ▓î ýºäÙï¿ÝòÿÙèö Û▓âýØ┤ Û░ÇÙèÑÝò┤ýíîÙïñ. Û©░ýí┤ýØÿ Ù░░ýûæ Û▓Çýé¼ýùÉ Û▒©Ùª¼Ùìÿ ýï£Û░äýØä Û░Éýåîýï£Ýé¼ ýêÿ ý×êýØä Ù┐ÉÙºî ýòäÙïêÙØ╝ ýÁ£ÛÀ╝ Û▓░ÝòÁÛ┤ÇÙª¼ýùÉýä£ Û░Çý×Ñ ýñæýÜöÝò£ Ù¼©ýá£ýØ© Ùé┤ýä▒Û▓░ÝòÁýØÿ ýºäÙï¿ ýù¡ýï£ Û©░ýí┤ýØÿ ýò¢ýá£Û░Éýêÿýä▒ Û▓░Û│╝ýùÉ Ù╣äÝò┤ Ù╣áÙÑ┤Û▓î ýºäÙï¿Ýòá ýêÿ ý×êýû┤ Û▓░ÝòÁ Û┤ÇÙª¼ýùÉ Û©ìýáòýáüýØ© Û©░ýù¼ÙÑ╝ Ýòá Û▓âý£╝Ùí£ Û©░ÙîÇÙÉ£Ùïñ. ÛÀ©Ùƒ¼Ùéÿ ýØ┤Ùƒ¼Ýò£ ýâêÙí£ýÜ┤ Û▓Çýé¼Ù▓òýØÇ ýù¼ýáäÝ×ê Û▓░ÝòÁÛÀá Ù░░ýûæ Û▓Çýé¼ÙÑ╝ ÙîÇý▓┤Ýòá ýêÿÙèö ýùåý£╝Ù®░, Û©░ýí┤ýØÿ ýò¢ýᣠÛ░Éýêÿýä▒ Û▓Çýé¼ ýù¡ýï£ ÙîÇý▓┤Ýòá ýêÿ ýùåÙïñ. ýØ┤Ùôñ ýâêÙí£ýÜ┤ Û▓Çýé¼ÙôñýØÇ ÙÅäÙºÉ ýØîýä▒ Û▓░ÝòÁ ÙÿÉÙèö ÝÅÉýÖ© Û▓░ÝòÁ Ùô▒ Ýè╣ýêÿÝò£ ýâüÝÖ®ýùÉýä£ýØÿ Û▓░ÝòÁýùÉýä£ ýºäÙï¿ýáü ý£áýÜ®ýä▒ýùÉ ý░¿ýØ┤Û░Ç ý×êý£╝Ù®░, ýù¼Û▒┤Û│╝ ýØ©ÙáÑýØ┤ Û░ûýÂöýû┤ýºä ýïñÝùÿýïñýØ┤ ÝòäýÜöÝòÿÙ®░ Û┤æÙ▓öý£äÙé┤ýä▒Û▓░ÝòÁýØÿ ýºäÙï¿ýØä ý£äÝò┤ýä£Ùèö ýù¼ýáäÝ×ê Ýÿäý×¼ýØÿ ýò¢ýᣠÛ░Éýêÿýä▒ Û▓░Û│╝Û░Ç ÝòäýÜöÝòÿÛ©░ ÙòîÙ¼©ýØ┤Ùïñ. ÙÿÉÝò£ ýØ┤Ùƒ¼Ýò£ Û▓Çýé¼ Û©░ýêáýØÿ Ù░£Ùï¼ýØ┤ Û│º ÝÜ¿Û│╝ýáüýØ© Û▓░ÝòÁ Û┤ÇÙª¼Ùí£ ýØ┤ýû┤ýºÇÙèö Û▓âýØÇ ýòäÙïêÛ©░ ÙòîÙ¼©ýùÉ Û▓░ÝòÁýØÿ ýïáýåìÝòÿÛ│á ýáòÝÖòÝò£ ýºäÙï¿Ù▓òýùÉ ÙîÇÝò£ ýù░ÛÁ¼ýÖÇ Ýò¿Û╗ÿ Û▓░ÝòÁ ÝÖÿý×ÉýØÿ Û┤ÇÙª¼ Ùô▒ ýáäÙ░ÿýáüýØ© Û▓░ÝòÁ Û┤ÇÙª¼ ýé¼ýùàýùÉÙÅä Ýò¿Û╗ÿ Ùà©ÙáÑýØä Û©░ýÜ©ýù¼ýò╝ ÝòÿÛ▓áÙïñ.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






